Lektsia_3.ppt
- Количество слайдов: 55
 Лекция 3. Ферменты, часть 2. Витамины
Лекция 3. Ферменты, часть 2. Витамины
 Активность фермента – это скорость превращения субстрата в продукт За единицу активности фермента принимается такое количество фермента, которое катализирует превращение 1 мкмоля субстрата в продукт (1 мкмоль = 10– 3 моля) в 1 мин при 25°С в оптимальных условиях действия фермента. Удельной активностью называется число единиц ферментативной активности в расчете на 1 мг белка. 2
Активность фермента – это скорость превращения субстрата в продукт За единицу активности фермента принимается такое количество фермента, которое катализирует превращение 1 мкмоля субстрата в продукт (1 мкмоль = 10– 3 моля) в 1 мин при 25°С в оптимальных условиях действия фермента. Удельной активностью называется число единиц ферментативной активности в расчете на 1 мг белка. 2
 Кинетика ферментативных реакций k 1 k 3 E + S E + P k 2 Уравнение Михаэлиса-Ментен v скорость при концентрации субстрата [S], Vmax – максимальная скорость, Км – константа Михаэлиса Ментен, k 1, k 2, k 3 константы скоростей
Кинетика ферментативных реакций k 1 k 3 E + S E + P k 2 Уравнение Михаэлиса-Ментен v скорость при концентрации субстрата [S], Vmax – максимальная скорость, Км – константа Михаэлиса Ментен, k 1, k 2, k 3 константы скоростей
 Влияние концентрации субстрата на начальную скорость катализируемой ферментом реакции Из такого графика можно определить величину V только путем аппроксимирования. Точное определение этой величины в данном случае невозможно, так как по мере повышения концентрации субстрата начальная скорость реакции лишь приближаете к V, но никогда ее не достигает. Концентрация субстрата, при которой скорость реакции составляет половину максимальной, численно 4 равна К'м константе Михаэлиса - Ментен.
Влияние концентрации субстрата на начальную скорость катализируемой ферментом реакции Из такого графика можно определить величину V только путем аппроксимирования. Точное определение этой величины в данном случае невозможно, так как по мере повышения концентрации субстрата начальная скорость реакции лишь приближаете к V, но никогда ее не достигает. Концентрация субстрата, при которой скорость реакции составляет половину максимальной, численно 4 равна К'м константе Михаэлиса - Ментен.
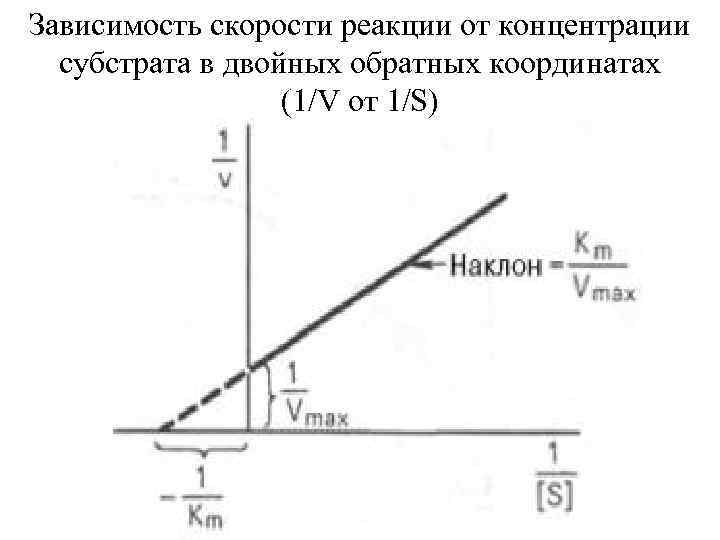 Зависимость скорости реакции от концентрации субстрата в двойных обратных координатах (1/V от 1/S)
Зависимость скорости реакции от концентрации субстрата в двойных обратных координатах (1/V от 1/S)
 Влияние кооперативности в ферментативных комплексах Зависимость степени насыщения фермента субстратом от концентрации субстрата при положительной (I) и отрицательной (II) кооперативности, а также в ее отсутствии (III).
Влияние кооперативности в ферментативных комплексах Зависимость степени насыщения фермента субстратом от концентрации субстрата при положительной (I) и отрицательной (II) кооперативности, а также в ее отсутствии (III).
 Уравнение Хилла где К' – константа ассоциации; n – число субстрат связывающих центров Положительная кооперативность при связывании кислорода молекулой гемоглобина
Уравнение Хилла где К' – константа ассоциации; n – число субстрат связывающих центров Положительная кооперативность при связывании кислорода молекулой гемоглобина
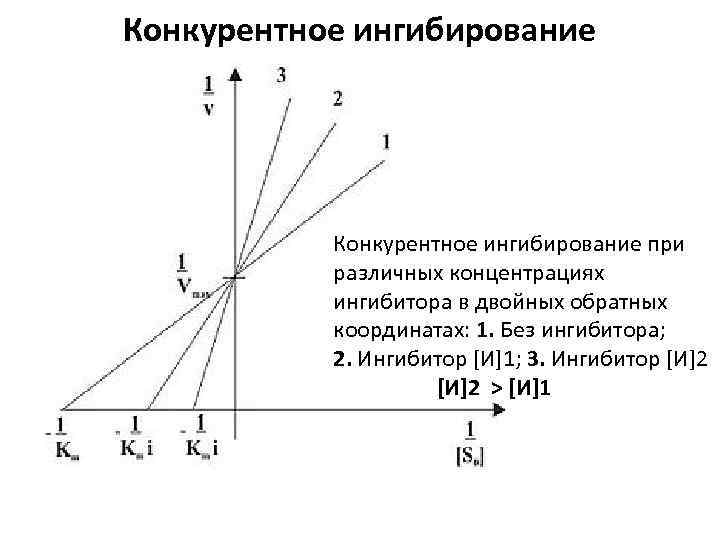 Конкурентное ингибирование при различных концентрациях ингибитора в двойных обратных координатах: 1. Без ингибитора; 2. Ингибитор [И]1; 3. Ингибитор [И]2 > [И]1
Конкурентное ингибирование при различных концентрациях ингибитора в двойных обратных координатах: 1. Без ингибитора; 2. Ингибитор [И]1; 3. Ингибитор [И]2 > [И]1
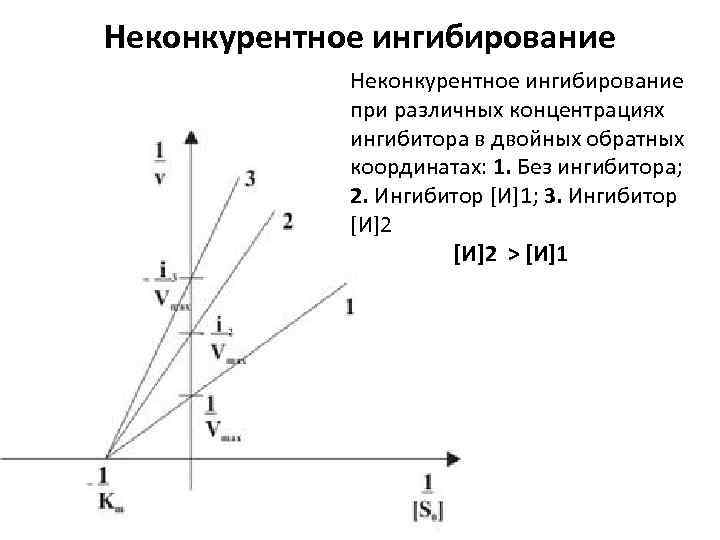 Неконкурентное ингибирование при различных концентрациях ингибитора в двойных обратных координатах: 1. Без ингибитора; 2. Ингибитор [И]1; 3. Ингибитор [И]2 > [И]1
Неконкурентное ингибирование при различных концентрациях ингибитора в двойных обратных координатах: 1. Без ингибитора; 2. Ингибитор [И]1; 3. Ингибитор [И]2 > [И]1
 Классификация ферментов КФ или ЕС (Enzyme Classification) Как найти код фермента: На главной странице сайта IUPAC (lnternational Union of Pure and Applied Chemistry) выбираем раздел, посвященный химической номенклатуре. Далее по ссылке - на страницу совместной комиссии IUBMB-IUPAC по биохимической номенклатуре (JCBN). На открывшейся странице выбираем раздел по номенклатуре ферментов.
Классификация ферментов КФ или ЕС (Enzyme Classification) Как найти код фермента: На главной странице сайта IUPAC (lnternational Union of Pure and Applied Chemistry) выбираем раздел, посвященный химической номенклатуре. Далее по ссылке - на страницу совместной комиссии IUBMB-IUPAC по биохимической номенклатуре (JCBN). На открывшейся странице выбираем раздел по номенклатуре ферментов.
 Классификация ферментов (КФ) Е. С. (Enzyme Classification) • ЕС. 1. – оксидоредуктазы (oxidoreductases). • ЕС. 2. – трансферазы (transferases). • ЕС. 3. – гидролазы (hydrolases). • ЕС. 4. – лиазы (lyases). • ЕС. 5. – изомеразы (isomerases) • ЕС. 6. – лигазы (ligases). 11
Классификация ферментов (КФ) Е. С. (Enzyme Classification) • ЕС. 1. – оксидоредуктазы (oxidoreductases). • ЕС. 2. – трансферазы (transferases). • ЕС. 3. – гидролазы (hydrolases). • ЕС. 4. – лиазы (lyases). • ЕС. 5. – изомеразы (isomerases) • ЕС. 6. – лигазы (ligases). 11
 Оксидоредуктазы Катализаторы окислительновосстановительных реакций 1. 1. Дегидрогеназы (редуктазы) 1. 2. Оксидазы 1. 3. Монооксидазы 1. 4. Пероксидазы и каталазы 1. 5. Оксигеназы …………………. . 1. 14. Гидроксилазы 12
Оксидоредуктазы Катализаторы окислительновосстановительных реакций 1. 1. Дегидрогеназы (редуктазы) 1. 2. Оксидазы 1. 3. Монооксидазы 1. 4. Пероксидазы и каталазы 1. 5. Оксигеназы …………………. . 1. 14. Гидроксилазы 12
 Примеры дегидрогеназ Е. С. 1. 1. – алкоголь дегидрогеназа NAD+ Е. С. 1. 1. 1. 2. – алкоголь дегидрогеназа NADP+ …………………………. Е. С. 1. 1. 1. 27 – L-лактат дегидрогеназа ………………………… Е. С. 1. 1. 1. 62 – эстрадиол 17 -β-дегидрогеназа 13
Примеры дегидрогеназ Е. С. 1. 1. – алкоголь дегидрогеназа NAD+ Е. С. 1. 1. 1. 2. – алкоголь дегидрогеназа NADP+ …………………………. Е. С. 1. 1. 1. 27 – L-лактат дегидрогеназа ………………………… Е. С. 1. 1. 1. 62 – эстрадиол 17 -β-дегидрогеназа 13
 Трансферазы Катализируют реакции переноса групп атомов с одной молекулы на другую • • • Е. С. 2. 1. – переносчики одно-углеродной группы Е. С. 2. 2. – переносчики карбонильных функций Е. С. 2. 3. – ацетилтрансферазы Е. С. 2. 4. – гликозилтрансферазы Е. С. 2. 5. – переносчики алкильных (кроме метильных) и арильных групп Е. С. 2. 6. – переносчики азотистых функций Е. С. 2. 7. – переносчики фосфор-содержащих групп Е. С. 2. 8. – переносчики серу-содержащих функций Е. С. 2. 9. – переносчики селен-содержащих групп
Трансферазы Катализируют реакции переноса групп атомов с одной молекулы на другую • • • Е. С. 2. 1. – переносчики одно-углеродной группы Е. С. 2. 2. – переносчики карбонильных функций Е. С. 2. 3. – ацетилтрансферазы Е. С. 2. 4. – гликозилтрансферазы Е. С. 2. 5. – переносчики алкильных (кроме метильных) и арильных групп Е. С. 2. 6. – переносчики азотистых функций Е. С. 2. 7. – переносчики фосфор-содержащих групп Е. С. 2. 8. – переносчики серу-содержащих функций Е. С. 2. 9. – переносчики селен-содержащих групп
 Гидролазы Осуществляют разрыв ковалентных связей с присоединением по месту разрыва воды. • Протеазы – гидролизуют белки • Нуклеазы – гидролизуют нуклеиновые кислоты • Специфические эндонуклеазы (так называемые рестриктазы) – разрывают полинуклеотиды по строго определенным последовательностям
Гидролазы Осуществляют разрыв ковалентных связей с присоединением по месту разрыва воды. • Протеазы – гидролизуют белки • Нуклеазы – гидролизуют нуклеиновые кислоты • Специфические эндонуклеазы (так называемые рестриктазы) – разрывают полинуклеотиды по строго определенным последовательностям
 Гидролазы Е. С. 3. 1. – действуют на сложноэфирные связи, эстеразы Е. С. 3. 2. – гликозилазы Е. С. 3. 3. – действуют на простоэфирные связи Е. С. 3. 4. – действуют на пептидные связи (пептидазы) Е. С. 3. 5. – действуют на C – N связи, кроме пептидных Е. С. 3. 6. – действуют на ангидриды кислот Е. С. 3. 7. – действуют на углерод-углеродные связи Е. С. 3. 8. – действуют на связи с галогеном Е. С. 3. 9. – действуют на связи P – N Е. С. 3. 10. – действуют на S – N связи Е. С. 3. 11. – действуют на C – P связи Е. С. 3. 12. – действуют на S – S связи Е. С. 3. 13. – действуют на C – S связи. 16
Гидролазы Е. С. 3. 1. – действуют на сложноэфирные связи, эстеразы Е. С. 3. 2. – гликозилазы Е. С. 3. 3. – действуют на простоэфирные связи Е. С. 3. 4. – действуют на пептидные связи (пептидазы) Е. С. 3. 5. – действуют на C – N связи, кроме пептидных Е. С. 3. 6. – действуют на ангидриды кислот Е. С. 3. 7. – действуют на углерод-углеродные связи Е. С. 3. 8. – действуют на связи с галогеном Е. С. 3. 9. – действуют на связи P – N Е. С. 3. 10. – действуют на S – N связи Е. С. 3. 11. – действуют на C – P связи Е. С. 3. 12. – действуют на S – S связи Е. С. 3. 13. – действуют на C – S связи. 16
 Лиазы Катализ реакций разрыва связей в субстрате без присоединения воды или окисления. • Е. С. 4. 1. – углерод-углеродные лиазы • Е. С. 4. 2. – углерод-кислородные лиазы • Е. С. 4. 3. – углерод-азотные лиазы • Е. С. 4. 4. – углерод-серы лиазы • Е. С. 4. 5. – углерод-галоген лиазы • Е. С. 4. 6. – фосфор-кислородные лиазы • Е. С. 4. 99. – другие лиазы.
Лиазы Катализ реакций разрыва связей в субстрате без присоединения воды или окисления. • Е. С. 4. 1. – углерод-углеродные лиазы • Е. С. 4. 2. – углерод-кислородные лиазы • Е. С. 4. 3. – углерод-азотные лиазы • Е. С. 4. 4. – углерод-серы лиазы • Е. С. 4. 5. – углерод-галоген лиазы • Е. С. 4. 6. – фосфор-кислородные лиазы • Е. С. 4. 99. – другие лиазы.
 Изомеразы Осуществляют внутримолекулярные перестройки. Е. С. 5. 1. – рацемазы и эпимеразы Е. С. 5. 2. – цис-трас-изомеразы Е. С. 5. 3. – внутримолекулярные оксидоредуктазы Е. С. 5. 4. – внутримолекулярные трансферазы (мутазы) • Е. С. 5. 5. – внутримолекулярные лиазы • Е. С. 5. 99. – другие изомеразы. • •
Изомеразы Осуществляют внутримолекулярные перестройки. Е. С. 5. 1. – рацемазы и эпимеразы Е. С. 5. 2. – цис-трас-изомеразы Е. С. 5. 3. – внутримолекулярные оксидоредуктазы Е. С. 5. 4. – внутримолекулярные трансферазы (мутазы) • Е. С. 5. 5. – внутримолекулярные лиазы • Е. С. 5. 99. – другие изомеразы. • •
 Лигазы или синтетазы Соединяют 2 части с использованием энергии АТФ. Реакции ферментов этого класса, как правило, необратимы. • Е. С. 6. 1. – образуют углерод-кислородные связи • Е. С. 6. 2. – образуют углерод-сера связи • Е. С. 6. 3. – образуют углерод-азотные связи • Е. С. 6. 4. – образуют углерод-углеродные связи • Е. С. 6. 5. – образуют фосфат эфирные связи.
Лигазы или синтетазы Соединяют 2 части с использованием энергии АТФ. Реакции ферментов этого класса, как правило, необратимы. • Е. С. 6. 1. – образуют углерод-кислородные связи • Е. С. 6. 2. – образуют углерод-сера связи • Е. С. 6. 3. – образуют углерод-азотные связи • Е. С. 6. 4. – образуют углерод-углеродные связи • Е. С. 6. 5. – образуют фосфат эфирные связи.
 Ферменты в клинической диагностике Функциональные ферменты плазмы: липопротеинлипаза, псевдохолинэстераза, а также проферменты компонентов систем свертывания крови и растворения кровяного сгустка. Они синтезируются в печени, и их концентрация в крови либо такая же, как в тканях, либо более высокая. Нефункциональные ферменты плазмы не выполняют в крови никаких известных физиологических функций. Их субстраты в плаз ме обычно не обнаруживаются, и в норме их концентрация в крови человека почти в миллион раз ниже, чем в тканях. Появление этих белков в плазме в по вышенных концентрациях указывает на повышенную скорость деструкции тканей.
Ферменты в клинической диагностике Функциональные ферменты плазмы: липопротеинлипаза, псевдохолинэстераза, а также проферменты компонентов систем свертывания крови и растворения кровяного сгустка. Они синтезируются в печени, и их концентрация в крови либо такая же, как в тканях, либо более высокая. Нефункциональные ферменты плазмы не выполняют в крови никаких известных физиологических функций. Их субстраты в плаз ме обычно не обнаруживаются, и в норме их концентрация в крови человека почти в миллион раз ниже, чем в тканях. Появление этих белков в плазме в по вышенных концентрациях указывает на повышенную скорость деструкции тканей.
 Фермент Заболевание Аспартатаминотрансфераза Инфаркт миокарда Аланинаминотрансфераза Вирусный гепатит Амилаза Острый панкреатит Церулоплазмин Гепатолентикулярная дегенерация Креатинфосфокиназа Заболевание мышц и инфаркт миокарда γ Глутамилтранспептидаза Различные заболевания печени Лактатдегидрогеназа Инфаркт миокарда Липаза Острый панкреатит Кислая фосфатаза Метастазирующая карци нома предстательной железы Щелочная фосфатаза Различные заболевания костей, закупорка прото ков печени
Фермент Заболевание Аспартатаминотрансфераза Инфаркт миокарда Аланинаминотрансфераза Вирусный гепатит Амилаза Острый панкреатит Церулоплазмин Гепатолентикулярная дегенерация Креатинфосфокиназа Заболевание мышц и инфаркт миокарда γ Глутамилтранспептидаза Различные заболевания печени Лактатдегидрогеназа Инфаркт миокарда Липаза Острый панкреатит Кислая фосфатаза Метастазирующая карци нома предстательной железы Щелочная фосфатаза Различные заболевания костей, закупорка прото ков печени
 Витамины • Сегодня известно 13 витаминов. Это водорастворимые витамины: B 1, B 2, В 3, В 5, B 6, В 9, B 12, C, Н • и жирорастворимые витамины: A, D, E, K. • К ним надо добавить несколько соединений, получивших название витаминоподобных: липоевую кислоту, холин, инозит, биофлавоноиды.
Витамины • Сегодня известно 13 витаминов. Это водорастворимые витамины: B 1, B 2, В 3, В 5, B 6, В 9, B 12, C, Н • и жирорастворимые витамины: A, D, E, K. • К ним надо добавить несколько соединений, получивших название витаминоподобных: липоевую кислоту, холин, инозит, биофлавоноиды.
 • Витаминами называют группу низкомолекулярных органических соединений различной химической природы, необходимых для осуществления жизненно важных биохимических процессов in vivo. • Природные соединения, не являющиеся витаминами, но легко превращающиеся в них в организме человека, называются провитаминами.
• Витаминами называют группу низкомолекулярных органических соединений различной химической природы, необходимых для осуществления жизненно важных биохимических процессов in vivo. • Природные соединения, не являющиеся витаминами, но легко превращающиеся в них в организме человека, называются провитаминами.
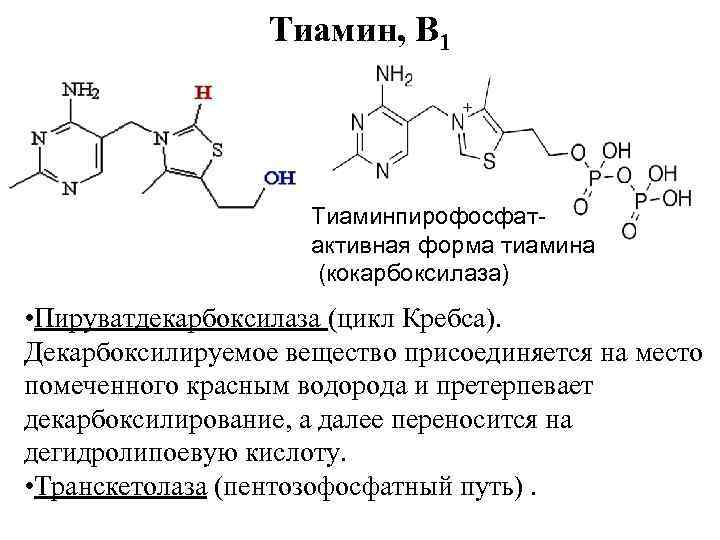 Тиамин, B 1 Тиаминпирофосфатактивная форма тиамина (кокарбоксилаза) • Пируватдекарбоксилаза (цикл Кребса). Декарбоксилируемое вещество присоединяется на место помеченного красным водорода и претерпевает декарбоксилирование, а далее переносится на дегидролипоевую кислоту. • Транскетолаза (пентозофосфатный путь).
Тиамин, B 1 Тиаминпирофосфатактивная форма тиамина (кокарбоксилаза) • Пируватдекарбоксилаза (цикл Кребса). Декарбоксилируемое вещество присоединяется на место помеченного красным водорода и претерпевает декарбоксилирование, а далее переносится на дегидролипоевую кислоту. • Транскетолаза (пентозофосфатный путь).
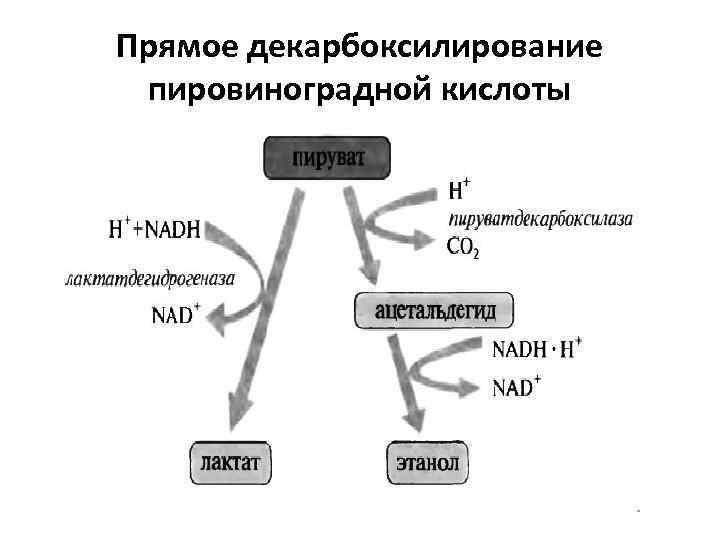 Прямое декарбоксилирование пировиноградной кислоты
Прямое декарбоксилирование пировиноградной кислоты
 Рибофлавин, B 2 В состав молекулы входит спирт рибитол и гетероциклический флавин.
Рибофлавин, B 2 В состав молекулы входит спирт рибитол и гетероциклический флавин.
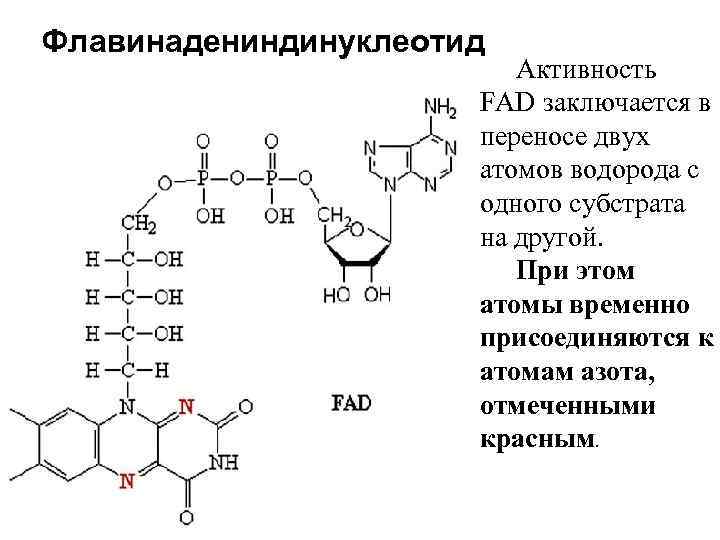 Флавинадениндинуклеотид Активность FAD заключается в переносе двух атомов водорода с одного субстрата на другой. При этом атомы временно присоединяются к атомам азота, отмеченными красным.
Флавинадениндинуклеотид Активность FAD заключается в переносе двух атомов водорода с одного субстрата на другой. При этом атомы временно присоединяются к атомам азота, отмеченными красным.
 Флавинмононуклеотид
Флавинмононуклеотид
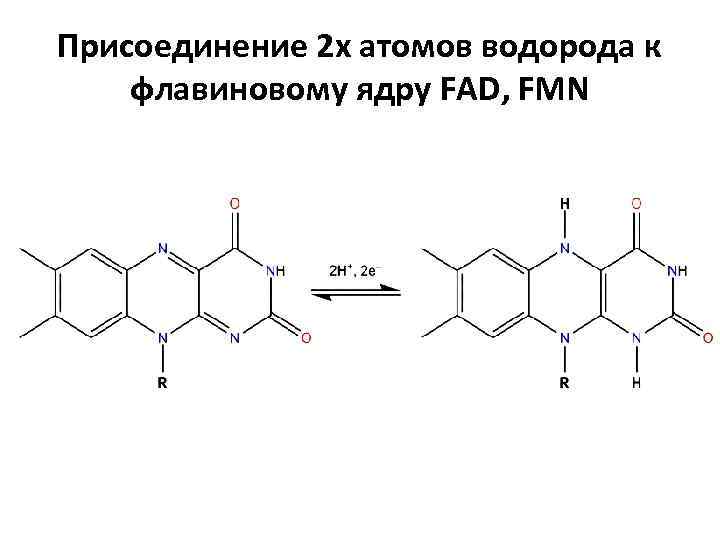 Присоединение 2 х атомов водорода к флавиновому ядру FAD, FMN
Присоединение 2 х атомов водорода к флавиновому ядру FAD, FMN
 • • Зависимые ферменты: Аэробные дегидрогеназы или флавопротеины (образуют H 2 O 2 ) – оксидаза L-аминокислот (FMN) – альдегидрогеназа (FAD) (ацетальдегид, метаболизм спирта) – глюкозооксидаза (FAD) (получается из грибов, используется для определения глюкозы) Анаэробные дегидрогеназы – NADH-дегидрогеназа (FMN) (комплекс I дыхательной цепи на внутренней мембране митохондрий) – сукцинатдегидрогеназа (FAD) (комплекс II дыхательной цепи на внутренней мембране митохондрий) – Ацил-Со. А-дегидрогеназа (FAD) (β-окисление жирных кислот) – глицерол-3 -фосфатдегидрогеназа (FMN) (глицеролфосфатный NADH-переносящий челнок, глюконеогенез из глицерина, синтез глицерина) – дигидролипоилдегидрогеназа (FAD) (пируват/акетоглутаратдегидрогеназный комплекс) – сфинганинредуктаза (FMN) (синтез сфингозина из пальмитоил-Ко. А и серина) – тиоредоксинредуктаза (FMN) (синтез дезоксирибонуклеотидов) – скваленэпоксидаза (FAD) (синтез холестерина)
• • Зависимые ферменты: Аэробные дегидрогеназы или флавопротеины (образуют H 2 O 2 ) – оксидаза L-аминокислот (FMN) – альдегидрогеназа (FAD) (ацетальдегид, метаболизм спирта) – глюкозооксидаза (FAD) (получается из грибов, используется для определения глюкозы) Анаэробные дегидрогеназы – NADH-дегидрогеназа (FMN) (комплекс I дыхательной цепи на внутренней мембране митохондрий) – сукцинатдегидрогеназа (FAD) (комплекс II дыхательной цепи на внутренней мембране митохондрий) – Ацил-Со. А-дегидрогеназа (FAD) (β-окисление жирных кислот) – глицерол-3 -фосфатдегидрогеназа (FMN) (глицеролфосфатный NADH-переносящий челнок, глюконеогенез из глицерина, синтез глицерина) – дигидролипоилдегидрогеназа (FAD) (пируват/акетоглутаратдегидрогеназный комплекс) – сфинганинредуктаза (FMN) (синтез сфингозина из пальмитоил-Ко. А и серина) – тиоредоксинредуктаза (FMN) (синтез дезоксирибонуклеотидов) – скваленэпоксидаза (FAD) (синтез холестерина)
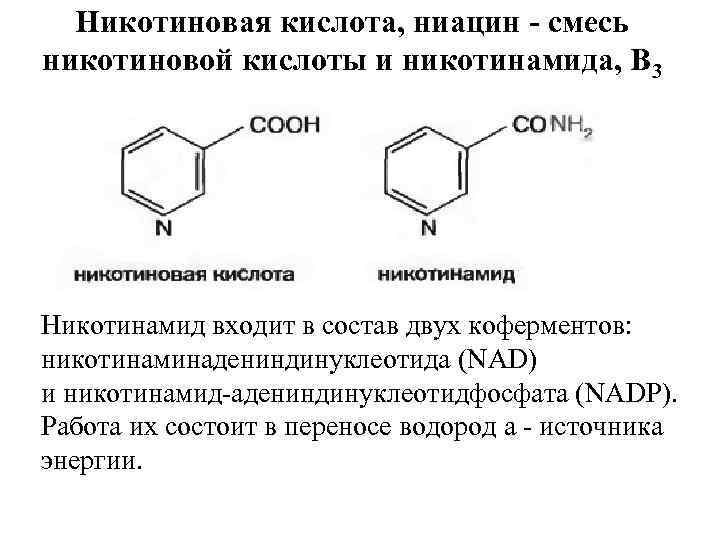 Никотиновая кислота, ниацин - смесь никотиновой кислоты и никотинамида, B 3 Никотинамид входит в состав двух коферментов: никотинаминадениндинуклеотида (NAD) и никотинамид адениндинуклеотидфосфата (NADP). Работа их состоит в переносе водород а источника энергии.
Никотиновая кислота, ниацин - смесь никотиновой кислоты и никотинамида, B 3 Никотинамид входит в состав двух коферментов: никотинаминадениндинуклеотида (NAD) и никотинамид адениндинуклеотидфосфата (NADP). Работа их состоит в переносе водород а источника энергии.
 Никотинамидадениндинуклеотид NAD Сюда присоединяется фосфат в молекуле NADP
Никотинамидадениндинуклеотид NAD Сюда присоединяется фосфат в молекуле NADP
 Обратимый перенос протона и двух электронов на молекулу NAD+ с субстрата А
Обратимый перенос протона и двух электронов на молекулу NAD+ с субстрата А
 Некоторые NAD+ - зависимые ферменты : – лактатдегидрогеназа (цикл Кори) – дигидролипоатдегидрогеназа (пируват/акетоглутаратдегидрогеназный комплекс) – изоцитратдегидрогеназа, малатдегидрогеназа (цикл Кребса) – НАДН-оксидаза (образование Н 2 О 2 в лейкоцитах) – НАДН-дегидрогеназа (комплекс I дыхательной цепи на внутренней мембране митохондрий) – β-оксиацил-Ко. Адегидрогеназа (β-окисление ЖК) – глутаматдегидрогеназа (прямое и непрямое дезаминирование - после трансаминиования) – (метаболизм этилового спирта) Алкогольдегидрогеназа
Некоторые NAD+ - зависимые ферменты : – лактатдегидрогеназа (цикл Кори) – дигидролипоатдегидрогеназа (пируват/акетоглутаратдегидрогеназный комплекс) – изоцитратдегидрогеназа, малатдегидрогеназа (цикл Кребса) – НАДН-оксидаза (образование Н 2 О 2 в лейкоцитах) – НАДН-дегидрогеназа (комплекс I дыхательной цепи на внутренней мембране митохондрий) – β-оксиацил-Ко. Адегидрогеназа (β-окисление ЖК) – глутаматдегидрогеназа (прямое и непрямое дезаминирование - после трансаминиования) – (метаболизм этилового спирта) Алкогольдегидрогеназа
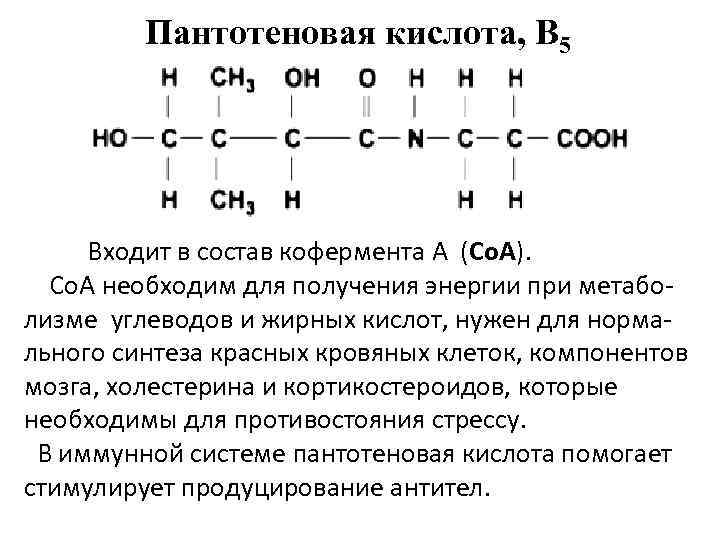 Пантотеновая кислота, B 5 Входит в состав кофермента А (Со. А). Со. А необходим для получения энергии при метаболизме углеводов и жирных кислот, нужен для нормального синтеза красных кровяных клеток, компонентов мозга, холестерина и кортикостероидов, которые необходимы для противостояния стрессу. В иммунной системе пантотеновая кислота помогает стимулирует продуцирование антител.
Пантотеновая кислота, B 5 Входит в состав кофермента А (Со. А). Со. А необходим для получения энергии при метаболизме углеводов и жирных кислот, нужен для нормального синтеза красных кровяных клеток, компонентов мозга, холестерина и кортикостероидов, которые необходимы для противостояния стрессу. В иммунной системе пантотеновая кислота помогает стимулирует продуцирование антител.
 Кофермент А, Co. A
Кофермент А, Co. A
 Основные зависимые ферменты: • пальмитилсинтетаза (синтез жирных кислот. Пантотеновая кислота входит в состав фермента, а также кофермента Ко. А) • дигидролипоилтрансфераза (обмен пирувата и а-кетоглутарата) • ацил-Ко. Адегидрогеназа, д 2 -еноил-Ко. А-гидратаза, • б-оксиацил-Ко. Адегидрогеназа, тиолаза (б-окисление жирных кислот) • цитратсинтетаза, сукцинаттиокиназа (цикл Кребса) • цитратлиаза (транспорт Ацетил-Ко. А в цитоплазму для синтеза жирных кислот) • ацетаттиокиназа (метаболизм этилового спирта и треонина) • пропионал-Ко. Акарбоксилаза, метилмалонил-Ко. Арацемаза, метилмалонил-Ко. Амутаза (метаболизм жирных кислот с нечетным числом атомов углерода, метионина, изолейцина и валина) • ацетил-Ко. Акарбоксилаза (синтез жирных кислот) • ацил-Ко. Асинтетаза (мобилизация жирных кислот и синтез жиров) • гидроксиметилглутарилсинтетаза, гидроксиметилглутариллиаза (синтез кетоновых) • ацетоацетил-Ко. Асинтетаза или сукцинил-Ко. А-ацетоацетат-Ко. Атрансфераза (мобилизация кетоновых тел)
Основные зависимые ферменты: • пальмитилсинтетаза (синтез жирных кислот. Пантотеновая кислота входит в состав фермента, а также кофермента Ко. А) • дигидролипоилтрансфераза (обмен пирувата и а-кетоглутарата) • ацил-Ко. Адегидрогеназа, д 2 -еноил-Ко. А-гидратаза, • б-оксиацил-Ко. Адегидрогеназа, тиолаза (б-окисление жирных кислот) • цитратсинтетаза, сукцинаттиокиназа (цикл Кребса) • цитратлиаза (транспорт Ацетил-Ко. А в цитоплазму для синтеза жирных кислот) • ацетаттиокиназа (метаболизм этилового спирта и треонина) • пропионал-Ко. Акарбоксилаза, метилмалонил-Ко. Арацемаза, метилмалонил-Ко. Амутаза (метаболизм жирных кислот с нечетным числом атомов углерода, метионина, изолейцина и валина) • ацетил-Ко. Акарбоксилаза (синтез жирных кислот) • ацил-Ко. Асинтетаза (мобилизация жирных кислот и синтез жиров) • гидроксиметилглутарилсинтетаза, гидроксиметилглутариллиаза (синтез кетоновых) • ацетоацетил-Ко. Асинтетаза или сукцинил-Ко. А-ацетоацетат-Ко. Атрансфераза (мобилизация кетоновых тел)
 Витамин B 6 Пиридоксин
Витамин B 6 Пиридоксин
 Основные зависимые ферменты: • аминотрансферазы • синтез сфингозина (активация серина для взаимодействия с пальмитиновой кислотой) • кинурениназа (катаболизм триптофана) • ДОФА декарбоксилаза (синтез дофамина и далее других катехоломинов) • аминолевулинатсинтетаза (синтез гема)
Основные зависимые ферменты: • аминотрансферазы • синтез сфингозина (активация серина для взаимодействия с пальмитиновой кислотой) • кинурениназа (катаболизм триптофана) • ДОФА декарбоксилаза (синтез дофамина и далее других катехоломинов) • аминолевулинатсинтетаза (синтез гема)
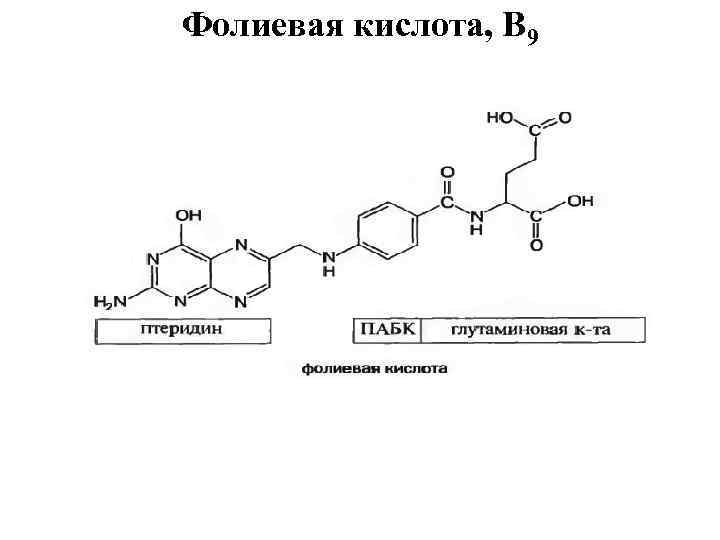 Фолиевая кислота, B 9
Фолиевая кислота, B 9
 Основные зависимые ферменты: • серингидроксиметилтрансфераза (перенос метиленового фрагмента с серина с образованием глицина) • глицинсинтаза (перенос метиленового фрагмента с глицина) • формилтрансфераза (синтез пуринов) • тимидилатсинтетаза (синтез тимидина)
Основные зависимые ферменты: • серингидроксиметилтрансфераза (перенос метиленового фрагмента с серина с образованием глицина) • глицинсинтаза (перенос метиленового фрагмента с глицина) • формилтрансфераза (синтез пуринов) • тимидилатсинтетаза (синтез тимидина)
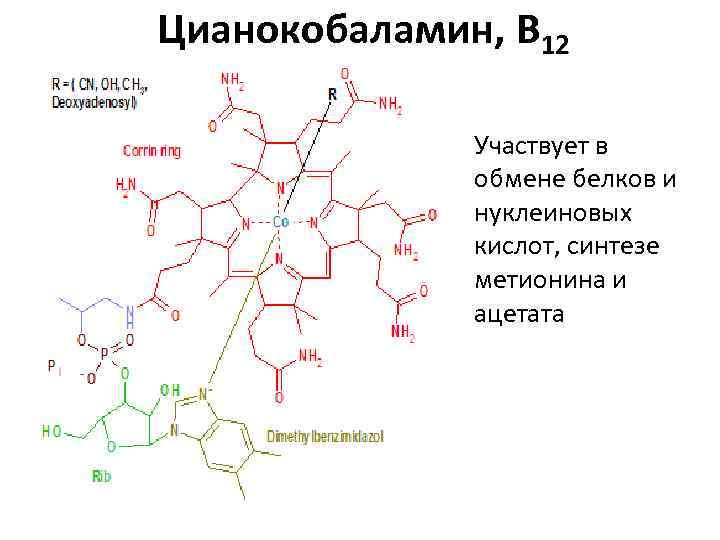 Цианокобаламин, B 12 Участвует в обмене белков и нуклеиновых кислот, синтезе метионина и ацетата
Цианокобаламин, B 12 Участвует в обмене белков и нуклеиновых кислот, синтезе метионина и ацетата
 Основные зависимые ферменты: • метилмалонил-Ко. А-мутаза (дезоксиаденозилкобаламин) (метаболизм жирных кислот с нечетным числом атомов углерода, метионина, изолейцина и валина) • синтез метионина из гомоцистеина (метилкобаламин) (восстановление аденозилметионина)
Основные зависимые ферменты: • метилмалонил-Ко. А-мутаза (дезоксиаденозилкобаламин) (метаболизм жирных кислот с нечетным числом атомов углерода, метионина, изолейцина и валина) • синтез метионина из гомоцистеина (метилкобаламин) (восстановление аденозилметионина)
 Аскорбиновая кислота, С Основные эффекты аскорбиновой кислоты связаны с ее участием в окислительно восстановительных процессах. Последнее осуществляется в результате окисления кислоты аскорбиновой в дегидроаскорбиновую кислоту с потерей двух атомов водорода. Процесс обратимый.
Аскорбиновая кислота, С Основные эффекты аскорбиновой кислоты связаны с ее участием в окислительно восстановительных процессах. Последнее осуществляется в результате окисления кислоты аскорбиновой в дегидроаскорбиновую кислоту с потерей двух атомов водорода. Процесс обратимый.
 • Основные зависимые ферменты: • микросомальное гидроксилирование пролина и лизина в составе коллагена • гидроксилирование холестерина • п-гидроксифенилпируватгидроксилаза (катаболизм тирозина до фумарата и ацетоацетата) • фолатредуктаза (образование тетрагидрофолиевой кислоты в печени)
• Основные зависимые ферменты: • микросомальное гидроксилирование пролина и лизина в составе коллагена • гидроксилирование холестерина • п-гидроксифенилпируватгидроксилаза (катаболизм тирозина до фумарата и ацетоацетата) • фолатредуктаза (образование тетрагидрофолиевой кислоты в печени)
 Биотин, Н Биотин функционирует как компонент специфических мультисубъединичных ферментов, катализирующих реакции карбоксилирования. Растворим в спирте, в воде плохо
Биотин, Н Биотин функционирует как компонент специфических мультисубъединичных ферментов, катализирующих реакции карбоксилирования. Растворим в спирте, в воде плохо
 • Основные зависимые ферменты: • пируваткарбоксилаза (первый фермент глюконеогенеза из пирувата) • ацетил-Ко. А-карбоксилаза (синтез жирных кислот) • пропионил-Ко. А-карбоксилаза (метаболизм жирных кислот с нечетным числом атомов углерода, метионина, изолейцина и валина) • б-метилкротонил-Ко. А-карбоксилаза (катаболизм лейцина и некоторых изопреноидных соединений)
• Основные зависимые ферменты: • пируваткарбоксилаза (первый фермент глюконеогенеза из пирувата) • ацетил-Ко. А-карбоксилаза (синтез жирных кислот) • пропионил-Ко. А-карбоксилаза (метаболизм жирных кислот с нечетным числом атомов углерода, метионина, изолейцина и валина) • б-метилкротонил-Ко. А-карбоксилаза (катаболизм лейцина и некоторых изопреноидных соединений)
 Ретинол, А Играет важную роль в окислительновосстановительных процессах (за счет большого количества ненасыщенных связей). Имеются данные, что витамин А участвует в синтезе мукополисахаридов, белков, липидов.
Ретинол, А Играет важную роль в окислительновосстановительных процессах (за счет большого количества ненасыщенных связей). Имеются данные, что витамин А участвует в синтезе мукополисахаридов, белков, липидов.
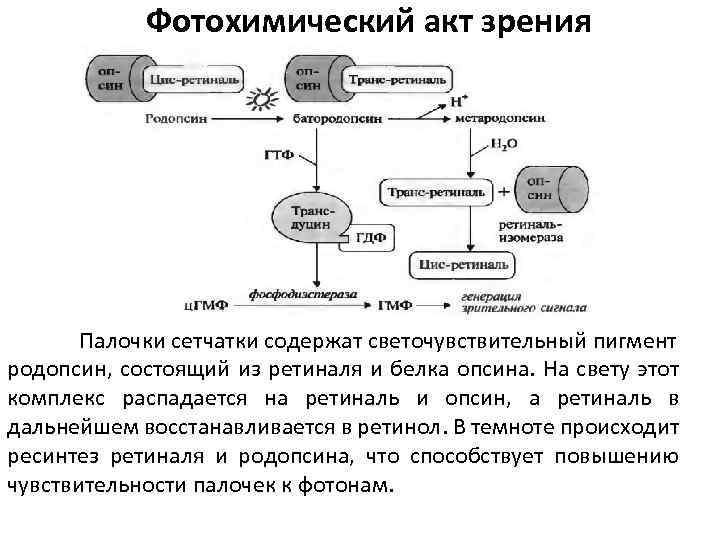 Фотохимический акт зрения Палочки сетчатки содержат светочувствительный пигмент родопсин, состоящий из ретиналя и белка опсина. На свету этот комплекс распадается на ретиналь и опсин, а ретиналь в дальнейшем восстанавливается в ретинол. В темноте происходит ресинтез ретиналя и родопсина, что способствует повышению чувствительности палочек к фотонам.
Фотохимический акт зрения Палочки сетчатки содержат светочувствительный пигмент родопсин, состоящий из ретиналя и белка опсина. На свету этот комплекс распадается на ретиналь и опсин, а ретиналь в дальнейшем восстанавливается в ретинол. В темноте происходит ресинтез ретиналя и родопсина, что способствует повышению чувствительности палочек к фотонам.
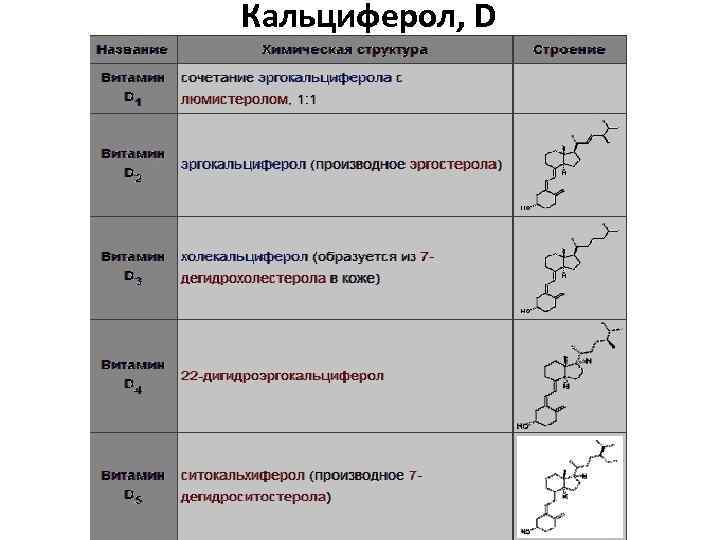 Кальциферол, D
Кальциферол, D
 Роль веществ группы D (прогормонов) однотипна и проявляется в основном в отношении метаболизма Ca 2+ и фосфатов: • Повышает проницаемость эпителия кишечника для кальция и фосфатов, что способствует их всасыванию. • Модулирует действие паратгормона на реабсорбцию кальция в почках • Стимулирует активность остеобластов
Роль веществ группы D (прогормонов) однотипна и проявляется в основном в отношении метаболизма Ca 2+ и фосфатов: • Повышает проницаемость эпителия кишечника для кальция и фосфатов, что способствует их всасыванию. • Модулирует действие паратгормона на реабсорбцию кальция в почках • Стимулирует активность остеобластов
 Токоферол, Е ("toko - потомство и лат. "ferre – приносить) Витамин Е – это 7 токоферолов, обозначаемые греческими буквами. В пищевых продуктах обнаружены α, β, γ-токоферолы. Наиболее активен α-токоферол. Витамин Е необходим для репродукции, он, также, участвует в регуляции окислительно-восстановительных процессов. Основная функция - антиоксидантная. Витамин Е тормозит перикисное окисление ненасыщенных жирных кислот.
Токоферол, Е ("toko - потомство и лат. "ferre – приносить) Витамин Е – это 7 токоферолов, обозначаемые греческими буквами. В пищевых продуктах обнаружены α, β, γ-токоферолы. Наиболее активен α-токоферол. Витамин Е необходим для репродукции, он, также, участвует в регуляции окислительно-восстановительных процессов. Основная функция - антиоксидантная. Витамин Е тормозит перикисное окисление ненасыщенных жирных кислот.
 Филлохинон, менахинон, К Активность витаминов данной группы заключается в антигемморагическом действии (повышение свертываемости крови). Благоприятствует синтезу АТФ, креатинфосфата, ряда ферментов.
Филлохинон, менахинон, К Активность витаминов данной группы заключается в антигемморагическом действии (повышение свертываемости крови). Благоприятствует синтезу АТФ, креатинфосфата, ряда ферментов.
 Механизм действия витамина К Активация витамин-зависимой карбоксилазы глутаминовых остатков в следующих факторах свертывания крови: • II - протромбин • VII - проконвертин • IX - фактор Кристмаса • X - фактор Стюарта-Провера
Механизм действия витамина К Активация витамин-зависимой карбоксилазы глутаминовых остатков в следующих факторах свертывания крови: • II - протромбин • VII - проконвертин • IX - фактор Кристмаса • X - фактор Стюарта-Провера
 Таблица «Витамины» Название, буквенное и тривиальное Структурная формула, растворимость, мол. масса Основные биохимически е процессы и/или зависимые ферменты Источник получения (с пищей и/или иной), необходимое количество человеку, собаке, кошке, КРС, птицам Проблемы при недостатке и избытке Метод количественного определения
Таблица «Витамины» Название, буквенное и тривиальное Структурная формула, растворимость, мол. масса Основные биохимически е процессы и/или зависимые ферменты Источник получения (с пищей и/или иной), необходимое количество человеку, собаке, кошке, КРС, птицам Проблемы при недостатке и избытке Метод количественного определения


