chromatography-3-2012.ppt
- Количество слайдов: 40
 Лекция № 3 Аффинная хроматография: Принципы и методы
Лекция № 3 Аффинная хроматография: Принципы и методы
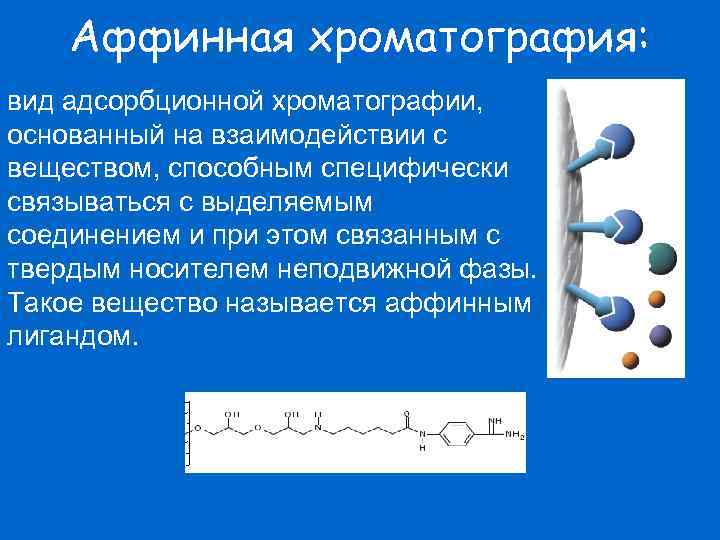 Аффинная хроматография: вид адсорбционной хроматографии, основанный на взаимодействии с веществом, способным специфически связываться с выделяемым соединением и при этом связанным с твердым носителем неподвижной фазы. Такое вещество называется аффинным лигандом.
Аффинная хроматография: вид адсорбционной хроматографии, основанный на взаимодействии с веществом, способным специфически связываться с выделяемым соединением и при этом связанным с твердым носителем неподвижной фазы. Такое вещество называется аффинным лигандом.
 Аффинная хроматография в терминах кинетики L + LS S Стандартное определение равновесной константы диссоциации KD [L][S] KD = [LS] Конц. связ. вещества ~ L 0 ~ Общая конц. вещества KD + L 0 При связывании KD 10 -6 – 10 -4 M При элюции KD 10 -1 – 10 -2 M KD равновесная константа диссоциации комплекса [L] концентрация несвязанного лиганда [S] концентрация несвязанного вещества [LS] концентрация комплекса лиганд/вещество L 0 концентрация лиганда, обычно 10 -4 – 10 -2 M L+S LS LS L+S Изменение условий связывания и элюции меняет KD!
Аффинная хроматография в терминах кинетики L + LS S Стандартное определение равновесной константы диссоциации KD [L][S] KD = [LS] Конц. связ. вещества ~ L 0 ~ Общая конц. вещества KD + L 0 При связывании KD 10 -6 – 10 -4 M При элюции KD 10 -1 – 10 -2 M KD равновесная константа диссоциации комплекса [L] концентрация несвязанного лиганда [S] концентрация несвязанного вещества [LS] концентрация комплекса лиганд/вещество L 0 концентрация лиганда, обычно 10 -4 – 10 -2 M L+S LS LS L+S Изменение условий связывания и элюции меняет KD!
![Аффинная хроматография в терминах кинетики L + S LS C+S KDComp = [C][S] [CS] Аффинная хроматография в терминах кинетики L + S LS C+S KDComp = [C][S] [CS]](https://present5.com/presentation/51975572_51657705/image-4.jpg) Аффинная хроматография в терминах кинетики L + S LS C+S KDComp = [C][S] [CS] CS KDComp равновесная константа диссоциации [C] концентрация несвязанного конкурентного лиганда [S] концентрация несвязанного вещества [CS] концентрация комплекса конкурентный лиганд/вещество Концентрация элюированного вещества Суммарная концентрация вещества ~ ~ ( r r+1 ) r. C 0 KDComp. L 0 r. C 0 + KD r : соотношение между объемом раствора конкур. лиганда и объемом пор матрицы, обычно находится в диапазоне 1– 10 KD : константа диссоциации вещества, связанного с лигандом на матрице C 0 : концентрация конкурирующего лиганда, обычно 10 -2 – 10 -1 M L 0 : концентрация лиганда на матрице, обычно 10 -4 – 10 -2
Аффинная хроматография в терминах кинетики L + S LS C+S KDComp = [C][S] [CS] CS KDComp равновесная константа диссоциации [C] концентрация несвязанного конкурентного лиганда [S] концентрация несвязанного вещества [CS] концентрация комплекса конкурентный лиганд/вещество Концентрация элюированного вещества Суммарная концентрация вещества ~ ~ ( r r+1 ) r. C 0 KDComp. L 0 r. C 0 + KD r : соотношение между объемом раствора конкур. лиганда и объемом пор матрицы, обычно находится в диапазоне 1– 10 KD : константа диссоциации вещества, связанного с лигандом на матрице C 0 : концентрация конкурирующего лиганда, обычно 10 -2 – 10 -1 M L 0 : концентрация лиганда на матрице, обычно 10 -4 – 10 -2
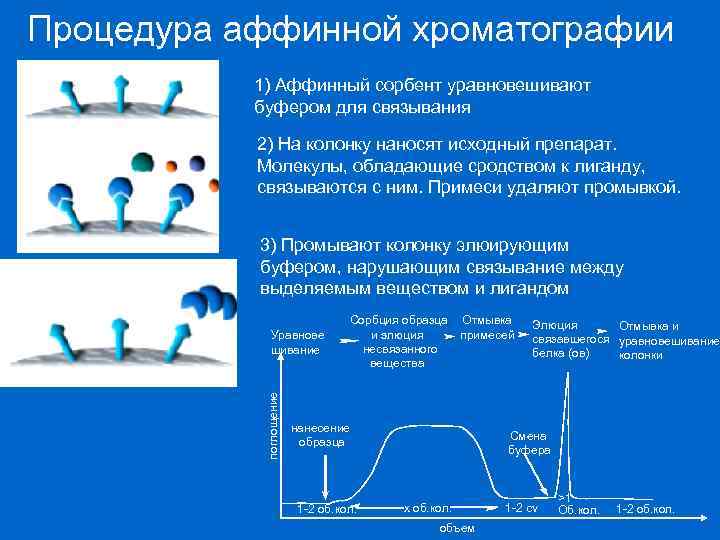 Процедура аффинной хроматографии 1) Аффинный сорбент уравновешивают буфером для связывания 2) На колонку наносят исходный препарат. Молекулы, обладающие сродством к лиганду, связываются с ним. Примеси удаляют промывкой. 3) Промывают колонку элюирующим буфером, нарушающим связывание между выделяемым веществом и лигандом поглощение Уравнове шивание Сорбция образца и элюция несвязанного вещества Отмывка примесей нанесение образца 1 -2 об. кол. Элюция Отмывка и связавшегося уравновешивание белка (ов) колонки Смена буфера x об. кол. объем 1 -2 cv >1 Об. кол. 1 -2 об. кол.
Процедура аффинной хроматографии 1) Аффинный сорбент уравновешивают буфером для связывания 2) На колонку наносят исходный препарат. Молекулы, обладающие сродством к лиганду, связываются с ним. Примеси удаляют промывкой. 3) Промывают колонку элюирующим буфером, нарушающим связывание между выделяемым веществом и лигандом поглощение Уравнове шивание Сорбция образца и элюция несвязанного вещества Отмывка примесей нанесение образца 1 -2 об. кол. Элюция Отмывка и связавшегося уравновешивание белка (ов) колонки Смена буфера x об. кол. объем 1 -2 cv >1 Об. кол. 1 -2 об. кол.
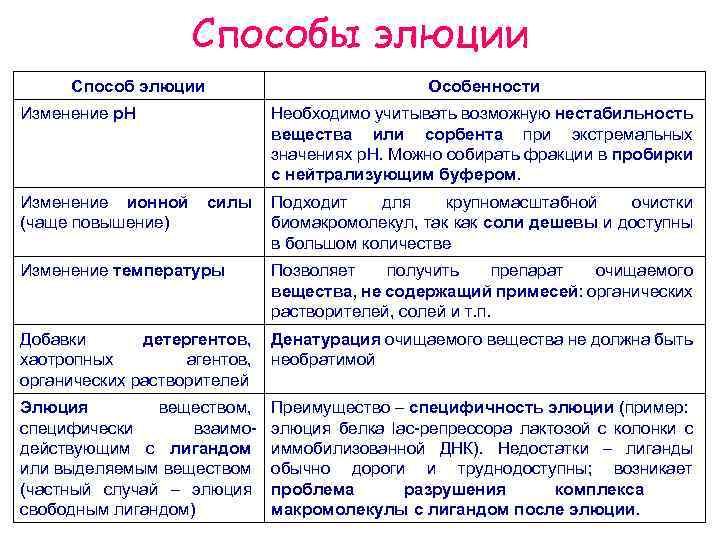 Способы элюции Способ элюции Особенности Изменение р. Н Изменение ионной (чаще повышение) Необходимо учитывать возможную нестабильность вещества или сорбента при экстремальных значениях р. Н. Можно собирать фракции в пробирки с нейтрализующим буфером. силы Подходит для крупномасштабной очистки биомакромолекул, так как соли дешевы и доступны в большом количестве Изменение температуры Позволяет получить препарат очищаемого вещества, не содержащий примесей: органических растворителей, солей и т. п. Добавки детергентов, хаотропных агентов, органических растворителей Денатурация очищаемого вещества не должна быть необратимой Элюция веществом, специфически взаимодействующим с лигандом или выделяемым веществом (частный случай – элюция свободным лигандом) Преимущество – специфичность элюции (пример: элюция белка lac-репрессора лактозой с колонки с иммобилизованной ДНК). Недостатки – лиганды обычно дороги и труднодоступны; возникает проблема разрушения комплекса макромолекулы с лигандом после элюции.
Способы элюции Способ элюции Особенности Изменение р. Н Изменение ионной (чаще повышение) Необходимо учитывать возможную нестабильность вещества или сорбента при экстремальных значениях р. Н. Можно собирать фракции в пробирки с нейтрализующим буфером. силы Подходит для крупномасштабной очистки биомакромолекул, так как соли дешевы и доступны в большом количестве Изменение температуры Позволяет получить препарат очищаемого вещества, не содержащий примесей: органических растворителей, солей и т. п. Добавки детергентов, хаотропных агентов, органических растворителей Денатурация очищаемого вещества не должна быть необратимой Элюция веществом, специфически взаимодействующим с лигандом или выделяемым веществом (частный случай – элюция свободным лигандом) Преимущество – специфичность элюции (пример: элюция белка lac-репрессора лактозой с колонки с иммобилизованной ДНК). Недостатки – лиганды обычно дороги и труднодоступны; возникает проблема разрушения комплекса макромолекулы с лигандом после элюции.
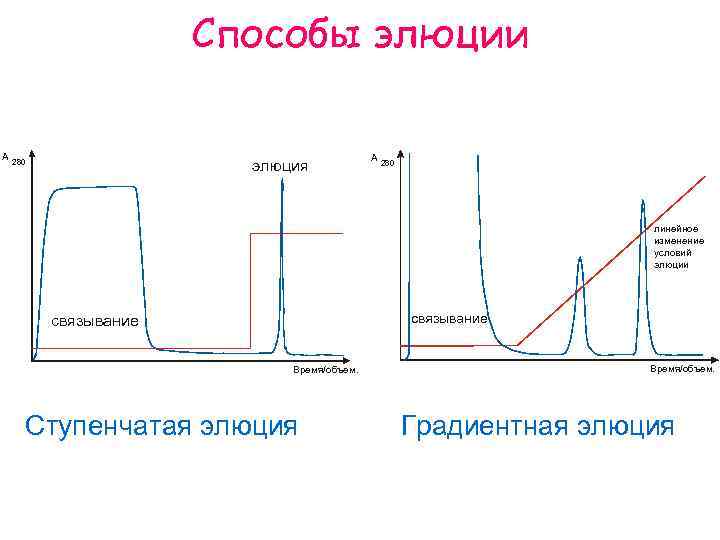 Способы элюции A элюция 280 A 280 линейное изменение условий элюции связывание Время/объем. Ступенчатая элюция Время/объем. Градиентная элюция
Способы элюции A элюция 280 A 280 линейное изменение условий элюции связывание Время/объем. Ступенчатая элюция Время/объем. Градиентная элюция
 Носители для аффинной хроматографии Матрица: подходящая для присоединения лиганда. Должна быть физически и химически инертна. Спейсер: используется для улучшения связывания между лигандом и выделяемым веществом, для снятия стерических ограничений. Лиганд: молекула, которая обратимо связывается с выделяемым веществом или с группой веществ.
Носители для аффинной хроматографии Матрица: подходящая для присоединения лиганда. Должна быть физически и химически инертна. Спейсер: используется для улучшения связывания между лигандом и выделяемым веществом, для снятия стерических ограничений. Лиганд: молекула, которая обратимо связывается с выделяемым веществом или с группой веществ.
 Требования к матрице • • 1) гидрофильность 2) крупнопористость 3) жесткость 4) устойчивость к физическим и химическим воздействиям • 5) наличие функциональных групп для иммобилизации лиганда • 6) отсутствие неспецифической сорбции разделяемых веществ на матрице Желательно, чтобы матрицу можно было получить в виде однородных по размеру сферических частиц
Требования к матрице • • 1) гидрофильность 2) крупнопористость 3) жесткость 4) устойчивость к физическим и химическим воздействиям • 5) наличие функциональных групп для иммобилизации лиганда • 6) отсутствие неспецифической сорбции разделяемых веществ на матрице Желательно, чтобы матрицу можно было получить в виде однородных по размеру сферических частиц
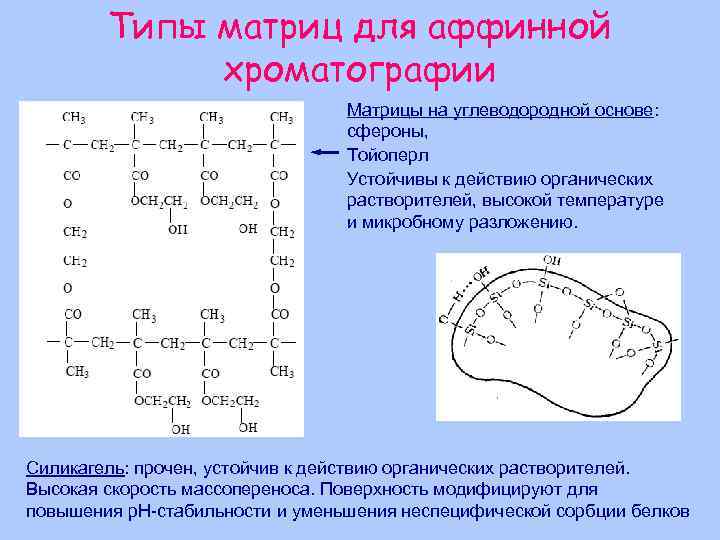 Типы матриц для аффинной хроматографии Матрицы на углеводородной основе: сфероны, Тойоперл Устойчивы к действию органических растворителей, высокой температуре и микробному разложению. Силикагель: прочен, устойчив к действию органических растворителей. Высокая скорость массопереноса. Поверхность модифицируют для повышения р. Н-стабильности и уменьшения неспецифической сорбции белков
Типы матриц для аффинной хроматографии Матрицы на углеводородной основе: сфероны, Тойоперл Устойчивы к действию органических растворителей, высокой температуре и микробному разложению. Силикагель: прочен, устойчив к действию органических растворителей. Высокая скорость массопереноса. Поверхность модифицируют для повышения р. Н-стабильности и уменьшения неспецифической сорбции белков
 Типы матриц для аффинной хроматографии Агароза (Sepharose): крупнопористая, достаточно жесткая и биологически инертная. р. Н-стабильность: 4 -9. Введение химических сшивок повышает устойчивость к мочевине и органическим растворителям ПААГ: непопулярен из-за недостаточной механической прочности. Прилипает к стеклу. Химическая модификация ПААГ H 2 N-(CH 2)2 -NH 2, 90°C -CONH 2 H 2 N-NH 2 -CO-NH-(CH 2)2 -NH 2 -CONH-NH 2 HNO 2 -CON 3 Ultrogel Ас. А: 2 – 4% ПААГ, укрепленный сеткой агарозы. Крупнопористый, жесткий, содержит два вида функциональных групп. Близок к агарозе по химической и термической стойкости.
Типы матриц для аффинной хроматографии Агароза (Sepharose): крупнопористая, достаточно жесткая и биологически инертная. р. Н-стабильность: 4 -9. Введение химических сшивок повышает устойчивость к мочевине и органическим растворителям ПААГ: непопулярен из-за недостаточной механической прочности. Прилипает к стеклу. Химическая модификация ПААГ H 2 N-(CH 2)2 -NH 2, 90°C -CONH 2 H 2 N-NH 2 -CO-NH-(CH 2)2 -NH 2 -CONH-NH 2 HNO 2 -CON 3 Ultrogel Ас. А: 2 – 4% ПААГ, укрепленный сеткой агарозы. Крупнопористый, жесткий, содержит два вида функциональных групп. Близок к агарозе по химической и термической стойкости.
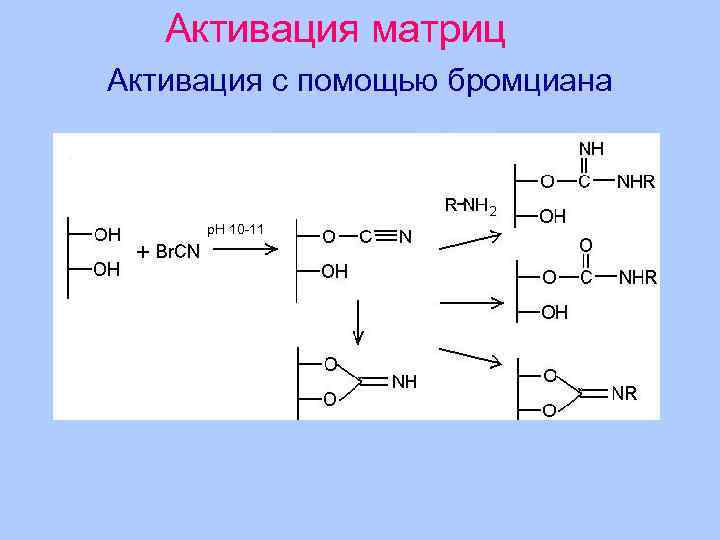 Активация матриц Активация с помощью бромциана р. Н 10 -11
Активация матриц Активация с помощью бромциана р. Н 10 -11
 Активация матриц Активация с помощью карбонилдиимидазола
Активация матриц Активация с помощью карбонилдиимидазола
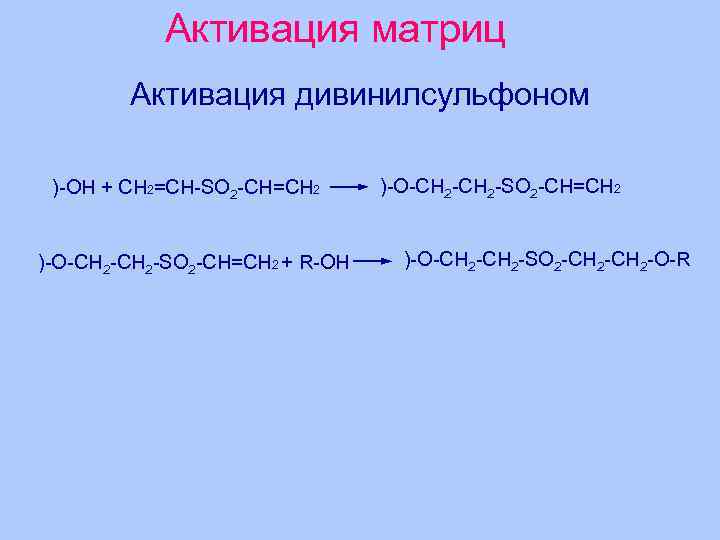 Активация матриц Активация дивинилсульфоном )-OH + CH 2=CH-SO 2 -CH=CH 2 )-O-CH 2 -SO 2 -CH=CH 2 + R-OH )-O-CH 2 -SO 2 -CH=CH 2 )-O-CH 2 -SO 2 -CH 2 -O-R
Активация матриц Активация дивинилсульфоном )-OH + CH 2=CH-SO 2 -CH=CH 2 )-O-CH 2 -SO 2 -CH=CH 2 + R-OH )-O-CH 2 -SO 2 -CH=CH 2 )-O-CH 2 -SO 2 -CH 2 -O-R
 Активация матриц Активация с помощью бензохинона Активация с помощью трихлортриазина белок Реакция идет в мягких условиях, между лигандом и матрицей образуется прочная связь, но полученные сорбенты неспецифически связывают вещества, содержащие ароматические группы
Активация матриц Активация с помощью бензохинона Активация с помощью трихлортриазина белок Реакция идет в мягких условиях, между лигандом и матрицей образуется прочная связь, но полученные сорбенты неспецифически связывают вещества, содержащие ароматические группы
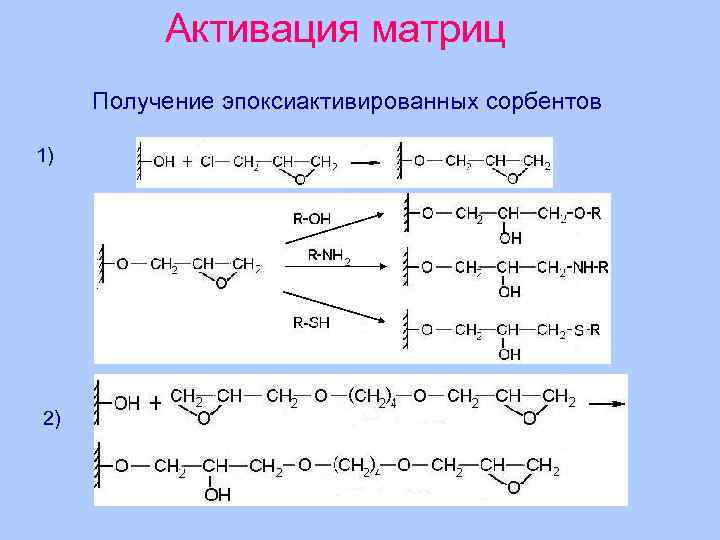 Активация матриц Получение эпоксиактивированных сорбентов 1) 2)
Активация матриц Получение эпоксиактивированных сорбентов 1) 2)
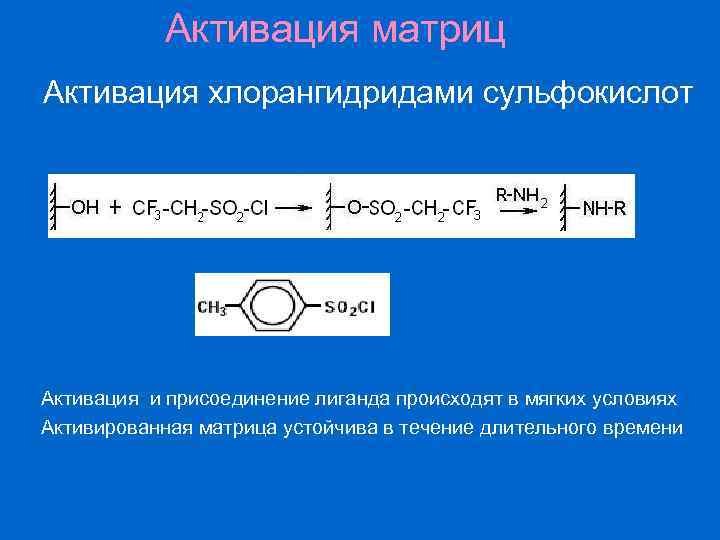 Активация матриц Активация хлорангидридами сульфокислот Активация и присоединение лиганда происходят в мягких условиях Активированная матрица устойчива в течение длительного времени
Активация матриц Активация хлорангидридами сульфокислот Активация и присоединение лиганда происходят в мягких условиях Активированная матрица устойчива в течение длительного времени
 Введение спейсера между лигандом и матрицей
Введение спейсера между лигандом и матрицей
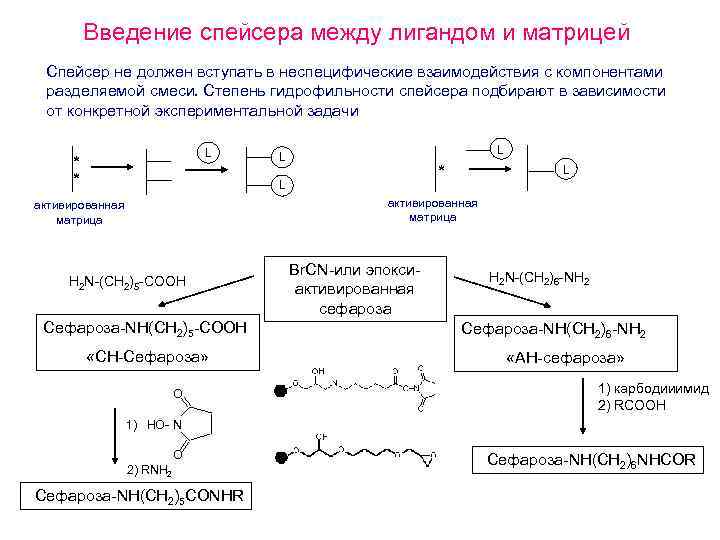 Введение спейсера между лигандом и матрицей Спейсер не должен вступать в неспецифические взаимодействия с компонентами разделяемой смеси. Степень гидрофильности спейсера подбирают в зависимости от конкретной экспериментальной задачи L * * L L активированная матрица H 2 N-(CH 2)5 -COOH Сефароза-NH(CH 2)5 -COOH «CH-Сефароза» O Br. CN-или эпоксиактивированная сефароза H 2 N-(CH 2)6 -NH 2 Сефароза-NH(CH 2)6 -NH 2 «АН-сефароза» 1) карбодииимид 2) RCOOH 1) HO- N O 2) RNH 2 Сефароза-NH(CH 2)5 CONHR Сефароза-NH(CH 2)6 NHCOR
Введение спейсера между лигандом и матрицей Спейсер не должен вступать в неспецифические взаимодействия с компонентами разделяемой смеси. Степень гидрофильности спейсера подбирают в зависимости от конкретной экспериментальной задачи L * * L L активированная матрица H 2 N-(CH 2)5 -COOH Сефароза-NH(CH 2)5 -COOH «CH-Сефароза» O Br. CN-или эпоксиактивированная сефароза H 2 N-(CH 2)6 -NH 2 Сефароза-NH(CH 2)6 -NH 2 «АН-сефароза» 1) карбодииимид 2) RCOOH 1) HO- N O 2) RNH 2 Сефароза-NH(CH 2)5 CONHR Сефароза-NH(CH 2)6 NHCOR
 Условия присоединения лиганда Условия эксперимента Рекомендованные концентрации для иммобилизации лиганда Легко доступные лиганды 10– 100 кратный молярный избыток лиганда по отношению к группам на матрице Небольшие лиганды 1– 20 µмоль/мл матрицы (обычно 2 µмоль/мл смолы) Белковые лиганды 5– 10 мг белка/мл смолы Антитела 5 мг белка/мл матрицы Лиганды с низкой аффиностью Максимально возможная концентрация лиганда для улучшения связывания
Условия присоединения лиганда Условия эксперимента Рекомендованные концентрации для иммобилизации лиганда Легко доступные лиганды 10– 100 кратный молярный избыток лиганда по отношению к группам на матрице Небольшие лиганды 1– 20 µмоль/мл матрицы (обычно 2 µмоль/мл смолы) Белковые лиганды 5– 10 мг белка/мл смолы Антитела 5 мг белка/мл матрицы Лиганды с низкой аффиностью Максимально возможная концентрация лиганда для улучшения связывания
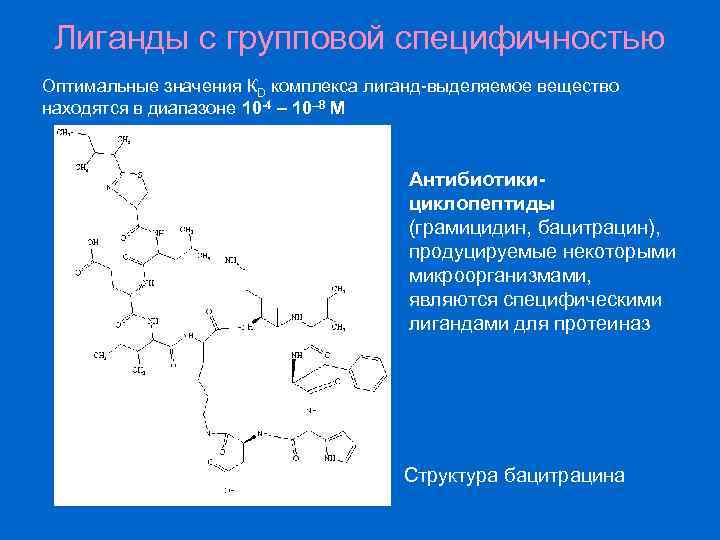 Лиганды с групповой специфичностью Оптимальные значения КD комплекса лиганд-выделяемое вещество находятся в диапазоне 10 -4 – 10– 8 М Антибиотикициклопептиды (грамицидин, бацитрацин), продуцируемые некоторыми микроорганизмами, являются специфическими лигандами для протеиназ Структура бацитрацина
Лиганды с групповой специфичностью Оптимальные значения КD комплекса лиганд-выделяемое вещество находятся в диапазоне 10 -4 – 10– 8 М Антибиотикициклопептиды (грамицидин, бацитрацин), продуцируемые некоторыми микроорганизмами, являются специфическими лигандами для протеиназ Структура бацитрацина
 Лиганды с групповой специфичностью Освобождение от/очистка сериновых протеиназ OH OH Sepharose O O H N O NH N H Бензамидин-сефароза NH 2
Лиганды с групповой специфичностью Освобождение от/очистка сериновых протеиназ OH OH Sepharose O O H N O NH N H Бензамидин-сефароза NH 2
 Лиганды с групповой специфичностью Лиганды, содержащие остаток фенилборной кислоты, взаимодействуют с веществами, содержащими цис-диольные группировки
Лиганды с групповой специфичностью Лиганды, содержащие остаток фенилборной кислоты, взаимодействуют с веществами, содержащими цис-диольные группировки
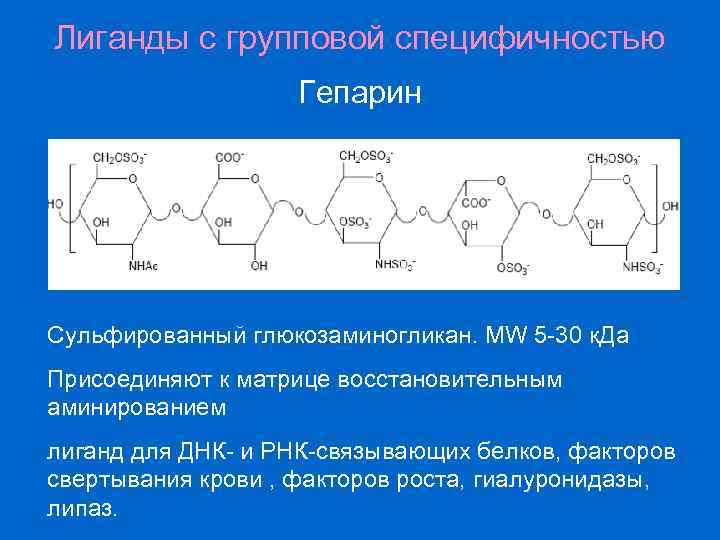 Лиганды с групповой специфичностью Гепарин Сульфированный глюкозаминогликан. MW 5 -30 к. Да Присоединяют к матрице восстановительным аминированием лиганд для ДНК- и РНК-связывающих белков, факторов свертывания крови , факторов роста, гиалуронидазы, липаз.
Лиганды с групповой специфичностью Гепарин Сульфированный глюкозаминогликан. MW 5 -30 к. Да Присоединяют к матрице восстановительным аминированием лиганд для ДНК- и РНК-связывающих белков, факторов свертывания крови , факторов роста, гиалуронидазы, липаз.
 Хроматография на красителях Наиболее широко используется для NADзависимых ферментов, но можно очищать протеазы и другие белки, а также нуклеиновые кислоты Cibacron Blue (присоединяют триазиновым методом) – для промышленного получения сывороточного альбумина и интерферонаальфа Краситель Cibacron Blue Аденозинмонофосфат (через аминогруппу аденина) Red (Procion Red )Sepharose
Хроматография на красителях Наиболее широко используется для NADзависимых ферментов, но можно очищать протеазы и другие белки, а также нуклеиновые кислоты Cibacron Blue (присоединяют триазиновым методом) – для промышленного получения сывороточного альбумина и интерферонаальфа Краситель Cibacron Blue Аденозинмонофосфат (через аминогруппу аденина) Red (Procion Red )Sepharose
 Примеры белковых лигандов: 1) Белок А (из стафилококка) и белок G (из стрептококка) взаимодействуют с константной частью (тяжелыми цепями) иммуноглобулинов, а белок L-с легкими цепями каппа-типа. Эти белки применяют для очистки и нековалентной иммобилизации иммуноглобулинов Белки Gи. А Белок L Желтым цветом на рисунке показаны тяжелые цепи Ig, красным - легкие 2) Антитела – высокоселективные лиганды, но условия элюции в этом случае обычно жесткие.
Примеры белковых лигандов: 1) Белок А (из стафилококка) и белок G (из стрептококка) взаимодействуют с константной частью (тяжелыми цепями) иммуноглобулинов, а белок L-с легкими цепями каппа-типа. Эти белки применяют для очистки и нековалентной иммобилизации иммуноглобулинов Белки Gи. А Белок L Желтым цветом на рисунке показаны тяжелые цепи Ig, красным - легкие 2) Антитела – высокоселективные лиганды, но условия элюции в этом случае обычно жесткие.
 3) Лектины – белки, специфически связывающие сахара и олигосахариды. Применяются для очистки полисахаридов, гликопротеинов и гликолипидов. Лектины Специфичность Лектины, связывающие маннозу/глюкозу Конкавалин А, Con A, Canavalia ensiformis Разветвленная манноза, другие углеводы с концевой маннозой или глюкозой (a. Man > a. Glc > Glc. NAc). Лентил Lectin, Lens culinaris Разветвленная манноза с остатками фукозы, связанной a (1, 6) связью с N-ацетил-глюкозамином, (a. Man >a. Glc > Glc. NAc). Лектины, связывающие N-ацетил-глюкозамин Лектин зародышей пшеницы, Triticum vulgare Хитобиозная основа из олигосахаридов, связанных через аминогруппы [Glc. NAc(b 1, 4 Glc. NAc)1– 2 >b. Glc. Nac]. Лиганды присоединяются бромциановым методом
3) Лектины – белки, специфически связывающие сахара и олигосахариды. Применяются для очистки полисахаридов, гликопротеинов и гликолипидов. Лектины Специфичность Лектины, связывающие маннозу/глюкозу Конкавалин А, Con A, Canavalia ensiformis Разветвленная манноза, другие углеводы с концевой маннозой или глюкозой (a. Man > a. Glc > Glc. NAc). Лентил Lectin, Lens culinaris Разветвленная манноза с остатками фукозы, связанной a (1, 6) связью с N-ацетил-глюкозамином, (a. Man >a. Glc > Glc. NAc). Лектины, связывающие N-ацетил-глюкозамин Лектин зародышей пшеницы, Triticum vulgare Хитобиозная основа из олигосахаридов, связанных через аминогруппы [Glc. NAc(b 1, 4 Glc. NAc)1– 2 >b. Glc. Nac]. Лиганды присоединяются бромциановым методом
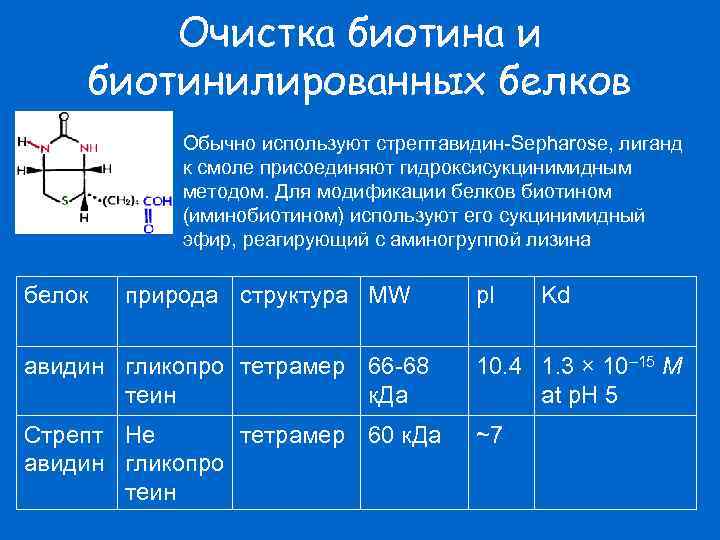 Очистка биотина и биотинилированных белков Обычно используют стрептавидин-Sepharose, лиганд к смоле присоединяют гидроксисукцинимидным методом. Для модификации белков биотином (иминобиотином) используют его сукцинимидный эфир, реагирующий с аминогруппой лизина белок природа структура MW p. I Kd авидин гликопро тетрамер 66 -68 теин к. Да 10. 4 1. 3 × 10– 15 M at p. H 5 Стрепт Не тетрамер 60 к. Да авидин гликопро теин ~7
Очистка биотина и биотинилированных белков Обычно используют стрептавидин-Sepharose, лиганд к смоле присоединяют гидроксисукцинимидным методом. Для модификации белков биотином (иминобиотином) используют его сукцинимидный эфир, реагирующий с аминогруппой лизина белок природа структура MW p. I Kd авидин гликопро тетрамер 66 -68 теин к. Да 10. 4 1. 3 × 10– 15 M at p. H 5 Стрепт Не тетрамер 60 к. Да авидин гликопро теин ~7
 Метод «молекулярных отпечатков» Функционализованные мономеры Пороген Сшивающий агент полимеризация Молекулу- «шаблон» удаляют промывкой Молекулы «шаблоны» «отпечаток» используют для хроматографии
Метод «молекулярных отпечатков» Функционализованные мономеры Пороген Сшивающий агент полимеризация Молекулу- «шаблон» удаляют промывкой Молекулы «шаблоны» «отпечаток» используют для хроматографии
 Аффинная хроматография рекомбинантных белков “tag” (англ. ) – ярлычок, бирка Аффинные тэги: Пептиды: His 4 -10 Кальмодулин-связывающий пептид FLAG-пептид (Asp-Tyr-Lys-(Asp)4 -Lys) Белки: GST (глутатион–Sтрансфераза) МВР (белок, связывающий мальтозу) Критерии выбора аффинного тэга: специфичность связывания тэга с аффинным лигандом, условия элюции с аффинного сорбента, влияние тэга на растворимость гибридного белка, величина нагрузки на метаболический аппарат клетки-хозяина, стабильность и цена аффинного сорбента
Аффинная хроматография рекомбинантных белков “tag” (англ. ) – ярлычок, бирка Аффинные тэги: Пептиды: His 4 -10 Кальмодулин-связывающий пептид FLAG-пептид (Asp-Tyr-Lys-(Asp)4 -Lys) Белки: GST (глутатион–Sтрансфераза) МВР (белок, связывающий мальтозу) Критерии выбора аффинного тэга: специфичность связывания тэга с аффинным лигандом, условия элюции с аффинного сорбента, влияние тэга на растворимость гибридного белка, величина нагрузки на метаболический аппарат клетки-хозяина, стабильность и цена аффинного сорбента
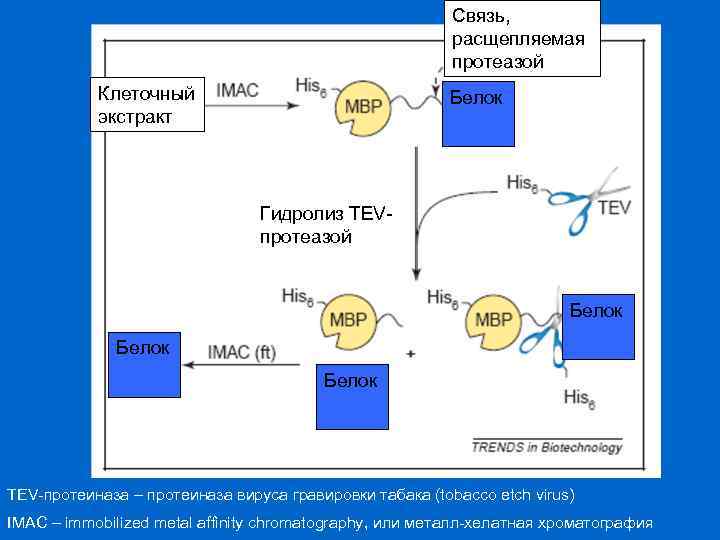 Связь, расщепляемая протеазой Клеточный экстракт Белок Гидролиз TEVпротеазой Белок TEV-протеиназа – протеиназа вируса гравировки табака (tobacco etch virus) IMAC – immobilized metal affinity chromatography, или металл-хелатная хроматография
Связь, расщепляемая протеазой Клеточный экстракт Белок Гидролиз TEVпротеазой Белок TEV-протеиназа – протеиназа вируса гравировки табака (tobacco etch virus) IMAC – immobilized metal affinity chromatography, или металл-хелатная хроматография
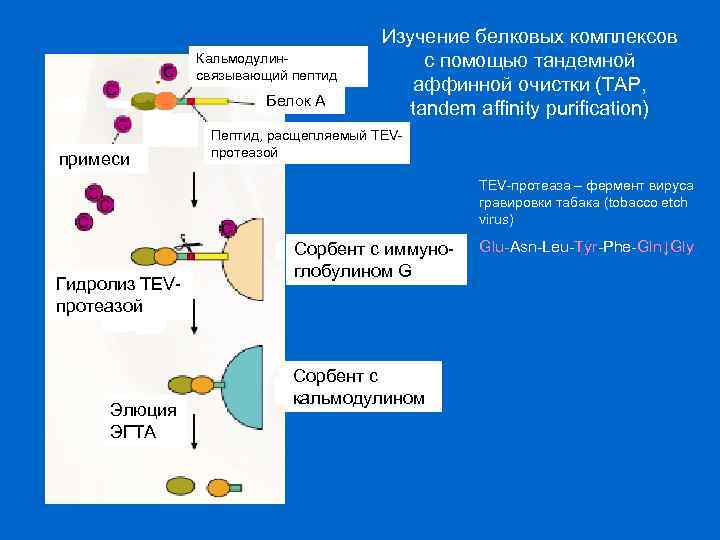 Кальмодулинсвязывающий пептид Белок А примеси Изучение белковых комплексов с помощью тандемной аффинной очистки (TAP, tandem affinity purification) Пептид, расщепляемый TEVпротеазой TEV-протеаза – фермент вируса гравировки табака (tobacco etch virus) Гидролиз TEVпротеазой Элюция ЭГТА Сорбент с иммуноглобулином G Сорбент с кальмодулином Glu-Asn-Leu-Tyr-Phe-Gln↓Gly
Кальмодулинсвязывающий пептид Белок А примеси Изучение белковых комплексов с помощью тандемной аффинной очистки (TAP, tandem affinity purification) Пептид, расщепляемый TEVпротеазой TEV-протеаза – фермент вируса гравировки табака (tobacco etch virus) Гидролиз TEVпротеазой Элюция ЭГТА Сорбент с иммуноглобулином G Сорбент с кальмодулином Glu-Asn-Leu-Tyr-Phe-Gln↓Gly
 Преимущества аффинной хроматографии • 1) высокая избирательность, обеспечивающая возможность одностадийной очистки вещества в 100 и более раз • 2) связывание вещества с сорбентом происходит в мягких условиях, не угрожающих структуре (нативности) вещества • 3) высокий выход очищаемых веществ, обусловленный отделением гидролитических ферментов на первой стадии • 4) можно использовать большие объемы исходных препаратов; в ходе ступенчатой элюции происходит концентрирование
Преимущества аффинной хроматографии • 1) высокая избирательность, обеспечивающая возможность одностадийной очистки вещества в 100 и более раз • 2) связывание вещества с сорбентом происходит в мягких условиях, не угрожающих структуре (нативности) вещества • 3) высокий выход очищаемых веществ, обусловленный отделением гидролитических ферментов на первой стадии • 4) можно использовать большие объемы исходных препаратов; в ходе ступенчатой элюции происходит концентрирование
 Металл-хелатная хроматография Меt: Cu, Zn, Ni, Со Иминодиуксусную кислоту присоединяют как через диэпоксиды, так и через эфиры. Для выделения фосфопротеинов используют Ga 3+ и Fe 3+ Преимущества: Разнообразие методов элюции Возможность работы как с нативными, так и с денатурированными белками Высокая емкость сорбента
Металл-хелатная хроматография Меt: Cu, Zn, Ni, Со Иминодиуксусную кислоту присоединяют как через диэпоксиды, так и через эфиры. Для выделения фосфопротеинов используют Ga 3+ и Fe 3+ Преимущества: Разнообразие методов элюции Возможность работы как с нативными, так и с денатурированными белками Высокая емкость сорбента
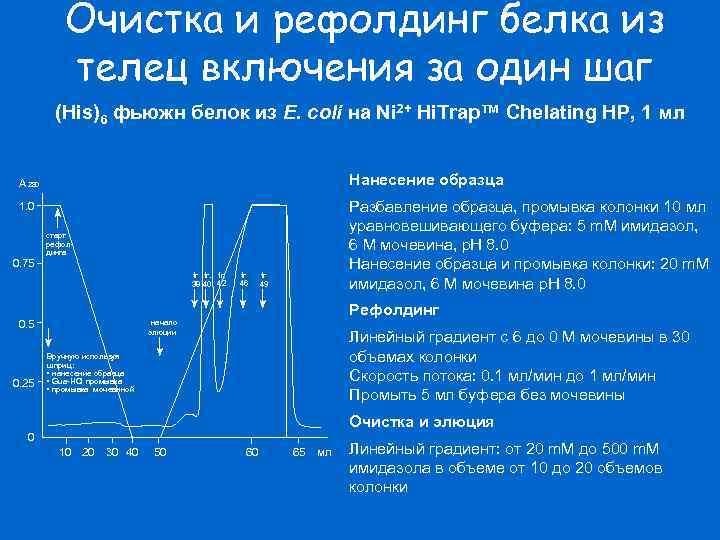 Очистка и рефолдинг белка из телец включения за один шаг (His)6 фьюжн белок из E. coli на Ni 2+ Hi. Trap™ Chelating HP, 1 мл Нанесение образца A 280 Разбавление образца, промывка колонки 10 мл уравновешивающего буфера: 5 m. M имидазол, 6 M мочевина, p. H 8. 0 Нанесение образца и промывка колонки: 20 m. M имидазол, 6 M мочевина p. H 8. 0 1. 0 старт рефолдинга 0. 75 fr. fr. 38 40 42 0. 5 0. 25 fr. 46 fr. 49 Рефолдинг начало элюции Линейный градиент с 6 до 0 M мочевины в 30 объемах колонки Скорость потока: 0. 1 мл/мин до 1 мл/мин Промыть 5 мл буфера без мочевины Вручную используя шприц: • нанесение образца • Gua-HCl промывка • промывка мочевиной Очистка и элюция 0 10 20 30 40 50 60 65 мл Линейный градиент: от 20 m. M до 500 m. M имидазола в объеме от 10 до 20 объемов колонки
Очистка и рефолдинг белка из телец включения за один шаг (His)6 фьюжн белок из E. coli на Ni 2+ Hi. Trap™ Chelating HP, 1 мл Нанесение образца A 280 Разбавление образца, промывка колонки 10 мл уравновешивающего буфера: 5 m. M имидазол, 6 M мочевина, p. H 8. 0 Нанесение образца и промывка колонки: 20 m. M имидазол, 6 M мочевина p. H 8. 0 1. 0 старт рефолдинга 0. 75 fr. fr. 38 40 42 0. 5 0. 25 fr. 46 fr. 49 Рефолдинг начало элюции Линейный градиент с 6 до 0 M мочевины в 30 объемах колонки Скорость потока: 0. 1 мл/мин до 1 мл/мин Промыть 5 мл буфера без мочевины Вручную используя шприц: • нанесение образца • Gua-HCl промывка • промывка мочевиной Очистка и элюция 0 10 20 30 40 50 60 65 мл Линейный градиент: от 20 m. M до 500 m. M имидазола в объеме от 10 до 20 объемов колонки
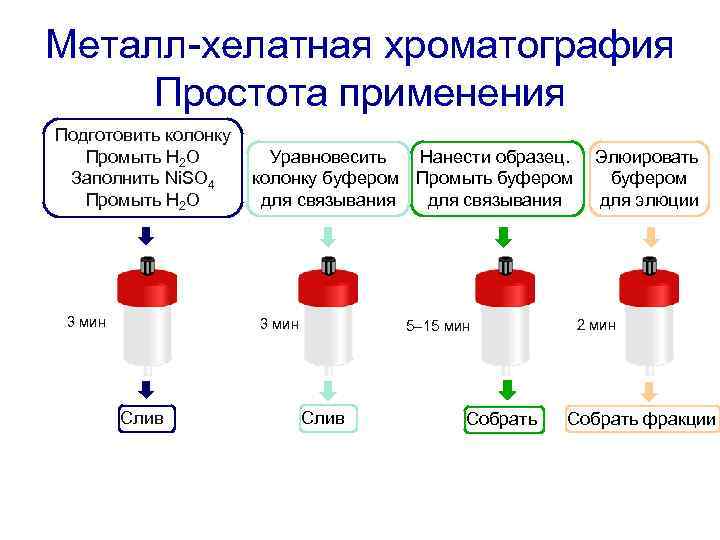 Металл-хелатная хроматография Простота применения Подготовить колонку Промыть H 2 O Заполнить Ni. SO 4 Промыть H 2 O 3 мин Уравновесить Нанести образец. колонку буфером Промыть буфером для связывания 3 мин Слив 5– 15 мин Слив Собрать Элюировать буфером для элюции 2 мин Собрать фракции
Металл-хелатная хроматография Простота применения Подготовить колонку Промыть H 2 O Заполнить Ni. SO 4 Промыть H 2 O 3 мин Уравновесить Нанести образец. колонку буфером Промыть буфером для связывания 3 мин Слив 5– 15 мин Слив Собрать Элюировать буфером для элюции 2 мин Собрать фракции
 Ковалентная хроматография Выделение биомолекул со свободной SH-группой Sepharose N CH (CH 2)2 C NH CH CH 2 S S COOH O CO NHCH COOH O CH 2 CH CH 2 S S OH Sepharose N N 2 Активированная Тиол-Sepharose S S +RSH Активированная Тиопропил-Sepharose S S R+S N N H Восстан. агент Sepharose S S R Sepharose SH+R’ S S R’ Восстанавл. агент : низкомолекулярный тиол, напр. дитиотреитол RSH: вещество с SH-группой
Ковалентная хроматография Выделение биомолекул со свободной SH-группой Sepharose N CH (CH 2)2 C NH CH CH 2 S S COOH O CO NHCH COOH O CH 2 CH CH 2 S S OH Sepharose N N 2 Активированная Тиол-Sepharose S S +RSH Активированная Тиопропил-Sepharose S S R+S N N H Восстан. агент Sepharose S S R Sepharose SH+R’ S S R’ Восстанавл. агент : низкомолекулярный тиол, напр. дитиотреитол RSH: вещество с SH-группой
 Гидрофобная хроматография лизоцим химотрипсин Концентрация соли Желтым показаны гидрофобные остатки Рибонуклеаза А поглощение Цитохром с
Гидрофобная хроматография лизоцим химотрипсин Концентрация соли Желтым показаны гидрофобные остатки Рибонуклеаза А поглощение Цитохром с
 Вот такие бывают колонки…
Вот такие бывают колонки…
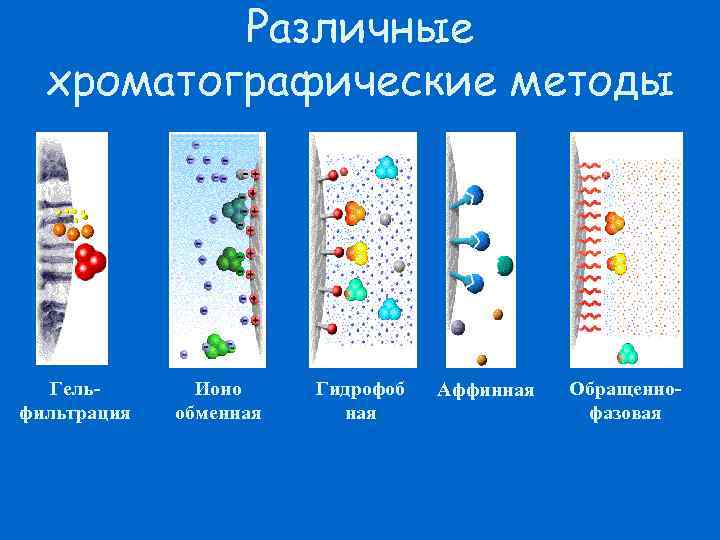 Различные хроматографические методы Гельфильтрация Ионо обменная Гидрофоб ная Аффинная Обращеннофазовая
Различные хроматографические методы Гельфильтрация Ионо обменная Гидрофоб ная Аффинная Обращеннофазовая


