лекция2фарм -ферменты рус.ppt
- Количество слайдов: 38
 ЛЕКЦІЯ№ 2 ТЕМА: Ферменты; строение, свойства и классификация. Механизм действия и регуляция активности ферментов. Кинетика ферментативных реакций.
ЛЕКЦІЯ№ 2 ТЕМА: Ферменты; строение, свойства и классификация. Механизм действия и регуляция активности ферментов. Кинетика ферментативных реакций.
 Ферменты (энзимы) – это биокатализаторы белковой природы, которые ускоряют химические реакции в организме Энзимология (ферментология) – наука про ферменты 2
Ферменты (энзимы) – это биокатализаторы белковой природы, которые ускоряют химические реакции в организме Энзимология (ферментология) – наука про ферменты 2
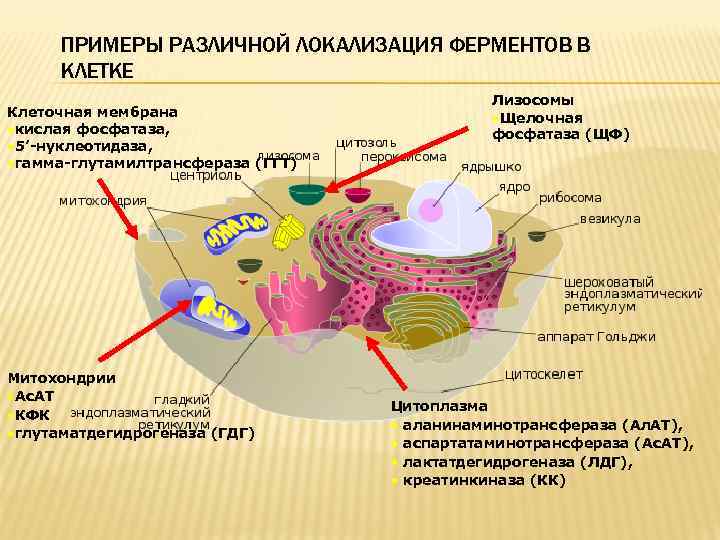 ПРИМЕРЫ РАЗЛИЧНОЙ ЛОКАЛИЗАЦИЯ ФЕРМЕНТОВ В КЛЕТКЕ Клеточная мембрана • кислая фосфатаза, • 5’-нуклеотидаза, • гамма-глутамилтрансфераза (ГГТ) Митохондрии • Ас. АТ • КФК • глутаматдегидрогеназа (ГДГ) Лизосомы • Щелочная фосфатаза (ЩФ) Цитоплазма • аланинаминотрансфераза (Ал. АТ), • аспартатаминотрансфераза (Ас. АТ), • лактатдегидрогеназа (ЛДГ), • креатинкиназа (КК)
ПРИМЕРЫ РАЗЛИЧНОЙ ЛОКАЛИЗАЦИЯ ФЕРМЕНТОВ В КЛЕТКЕ Клеточная мембрана • кислая фосфатаза, • 5’-нуклеотидаза, • гамма-глутамилтрансфераза (ГГТ) Митохондрии • Ас. АТ • КФК • глутаматдегидрогеназа (ГДГ) Лизосомы • Щелочная фосфатаза (ЩФ) Цитоплазма • аланинаминотрансфераза (Ал. АТ), • аспартатаминотрансфераза (Ас. АТ), • лактатдегидрогеназа (ЛДГ), • креатинкиназа (КК)
 ИНДИВИДУАЛЬНЫЕ СВОЙСТВА ФЕРМЕНТОВ 1. Ферменты обладают высокой специфичностью действия 2. Ферменты обладают высокой каталитической активностью (ускоряют скорость реакции в 106 – 1011 раз). 3. Ферменты для своего действия требуют строго определенного значения р. Н 4. Ферменты для своего действия требуют строго определенного значения температуры 5. Ферменты могут регулироваться
ИНДИВИДУАЛЬНЫЕ СВОЙСТВА ФЕРМЕНТОВ 1. Ферменты обладают высокой специфичностью действия 2. Ферменты обладают высокой каталитической активностью (ускоряют скорость реакции в 106 – 1011 раз). 3. Ферменты для своего действия требуют строго определенного значения р. Н 4. Ферменты для своего действия требуют строго определенного значения температуры 5. Ферменты могут регулироваться
 НОМЕНКЛАТУРА ФЕРМЕНТОВ 1. Рабочая (удобная) Рабочее название фермента Ш = название S + «-аза» мальтоза + «-аза» = мальтаза Ш = название S + тип реакции + «-аза» лактат + дегидрогенизация + «-аза» = лактатдегидрогеназа (ЛДГ) Ш историческое (тривиальное) название пепсин, тромбин, ренин
НОМЕНКЛАТУРА ФЕРМЕНТОВ 1. Рабочая (удобная) Рабочее название фермента Ш = название S + «-аза» мальтоза + «-аза» = мальтаза Ш = название S + тип реакции + «-аза» лактат + дегидрогенизация + «-аза» = лактатдегидрогеназа (ЛДГ) Ш историческое (тривиальное) название пепсин, тромбин, ренин
 2. Систематическая номенклатура основана на классификации ферментов (КФ) по типу хим. реакции !!! Систематическое название фермента = субстрат 1: субстрат 2 – тип хим. р-ции по КФ + «-аза» L-Лактат: НАД+ - оксидоредуктаза (систематическое название ЛДГ)
2. Систематическая номенклатура основана на классификации ферментов (КФ) по типу хим. реакции !!! Систематическое название фермента = субстрат 1: субстрат 2 – тип хим. р-ции по КФ + «-аза» L-Лактат: НАД+ - оксидоредуктаза (систематическое название ЛДГ)
 Классы подразделяются на: подклассы, подподкласы и порядковый номер в подподклассе. Шифр фермента - четырехзначный код, в котором первая цифра - класс, втораяподкласс, третьяподподкласс, четвертая - порядковый номер в подподклассе. Например: 1. 1. - алкогольдегидрогеназа 3. 1. 1. 3. - липаза
Классы подразделяются на: подклассы, подподкласы и порядковый номер в подподклассе. Шифр фермента - четырехзначный код, в котором первая цифра - класс, втораяподкласс, третьяподподкласс, четвертая - порядковый номер в подподклассе. Например: 1. 1. - алкогольдегидрогеназа 3. 1. 1. 3. - липаза
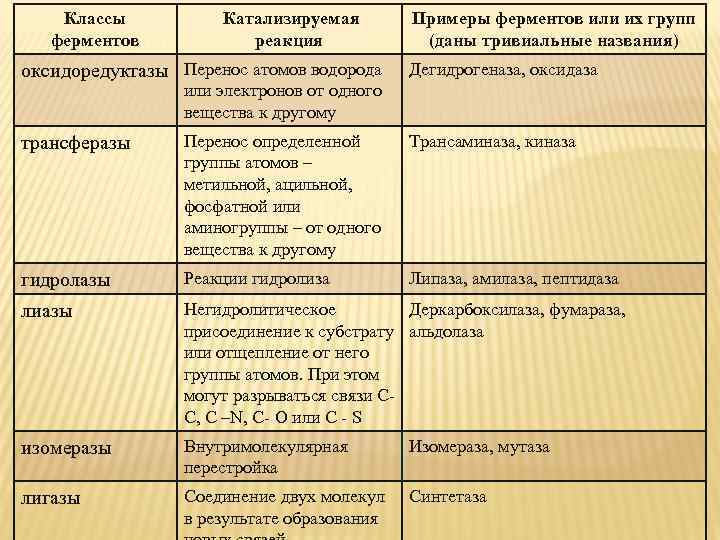 Классы ферментов Катализируемая реакция оксидоредуктазы Перенос атомов водорода Примеры ферментов или их групп (даны тривиальные названия) Дегидрогеназа, оксидаза или электронов от одного вещества к другому трансферазы Перенос определенной группы атомов – метильной, ацильной, фосфатной или аминогруппы – от одного вещества к другому Трансаминаза, киназа гидролазы Реакции гидролиза Липаза, амилаза, пептидаза лиазы Негидролитическое Деркарбоксилаза, фумараза, присоединение к субстрату альдолаза или отщепление от него группы атомов. При этом могут разрываться связи СС, С –N, C- O или C - S изомеразы Внутримолекулярная перестройка Изомераза, мутаза лигазы Соединение двух молекул в результате образования Синтетаза
Классы ферментов Катализируемая реакция оксидоредуктазы Перенос атомов водорода Примеры ферментов или их групп (даны тривиальные названия) Дегидрогеназа, оксидаза или электронов от одного вещества к другому трансферазы Перенос определенной группы атомов – метильной, ацильной, фосфатной или аминогруппы – от одного вещества к другому Трансаминаза, киназа гидролазы Реакции гидролиза Липаза, амилаза, пептидаза лиазы Негидролитическое Деркарбоксилаза, фумараза, присоединение к субстрату альдолаза или отщепление от него группы атомов. При этом могут разрываться связи СС, С –N, C- O или C - S изомеразы Внутримолекулярная перестройка Изомераза, мутаза лигазы Соединение двух молекул в результате образования Синтетаза
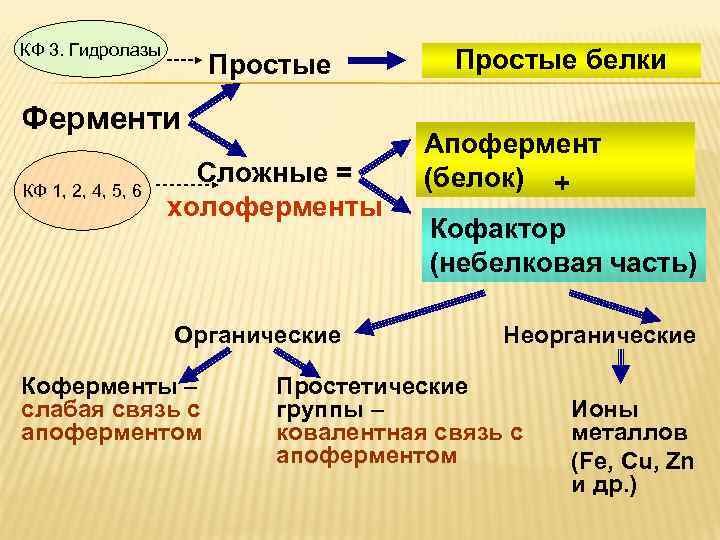 КФ 3. Гидролазы Простые Ферменти КФ 1, 2, 4, 5, 6 Сложные = холоферменты Органические Коферменты – слабая связь с апоферментом Простые белки Апофермент (белок) + Кофактор (небелковая часть) Неорганические Простетические группы – ковалентная связь с апоферментом Ионы металлов (Fe, Cu, Zn и др. )
КФ 3. Гидролазы Простые Ферменти КФ 1, 2, 4, 5, 6 Сложные = холоферменты Органические Коферменты – слабая связь с апоферментом Простые белки Апофермент (белок) + Кофактор (небелковая часть) Неорганические Простетические группы – ковалентная связь с апоферментом Ионы металлов (Fe, Cu, Zn и др. )
 Функции коферментов: Участие в акте катализа; Осуществление контакта между ферментом и субстратом; Стабилизация апофермента Классификация коферментов I. Переносчики Н - в ферментах дегидрогеназа II. Переносчики групп атомов (-NН 2, -СН 3, Н 3 РО 4 ) III. Коферменты синтеза и расщепления С-С связи и процессов изомеризации
Функции коферментов: Участие в акте катализа; Осуществление контакта между ферментом и субстратом; Стабилизация апофермента Классификация коферментов I. Переносчики Н - в ферментах дегидрогеназа II. Переносчики групп атомов (-NН 2, -СН 3, Н 3 РО 4 ) III. Коферменты синтеза и расщепления С-С связи и процессов изомеризации
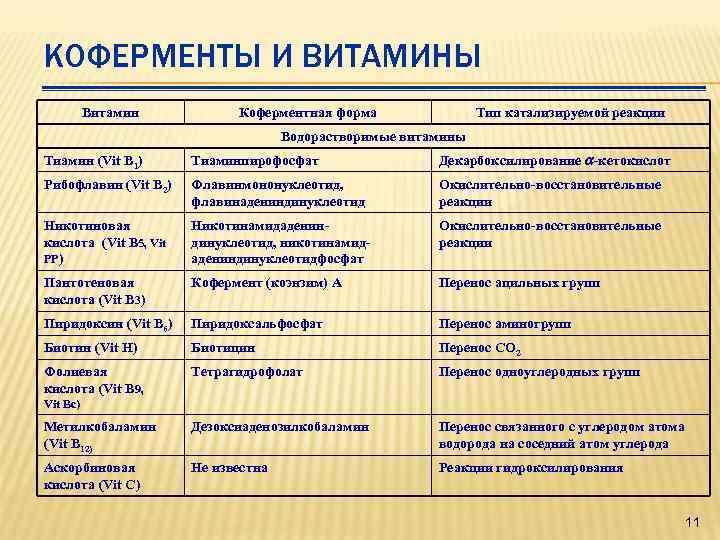 КОФЕРМЕНТЫ И ВИТАМИНЫ Витамин Коферментная форма Тип катализируемой реакции Водорастворимые витамины Тиамин (Vit В 1) Тиаминпирофосфат Декарбоксилирование a-кетокислот Рибофлавин (Vit В 2) Флавинмононуклеотид, флавинадениндинуклеотид Окислительно-восстановительные реакции Никотиновая кислота (Vit B 5, Vit PP) Никотинамидадениндинуклеотид, никотинамидадениндинуклеотидфосфат Окислительно-восстановительные реакции Пантотеновая кислота (Vit В 3) Кофермент (коэнзим) А Перенос ацильных групп Пиридоксин (Vit В 6) Пиридоксальфосфат Перенос аминогрупп Биотин (Vit H) Биотицин Перенос СО 2 Фолиевая кислота (Vit B 9, Тетрагидрофолат Перенос одноуглеродных групп Метилкобаламин (Vit В 12) Дезоксиаденозилкобаламин Перенос связанного с углеродом атома водорода на соседний атом углерода Аскорбиновая кислота (Vit С) Не известна Реакции гидроксилирования Vit Вс) 11
КОФЕРМЕНТЫ И ВИТАМИНЫ Витамин Коферментная форма Тип катализируемой реакции Водорастворимые витамины Тиамин (Vit В 1) Тиаминпирофосфат Декарбоксилирование a-кетокислот Рибофлавин (Vit В 2) Флавинмононуклеотид, флавинадениндинуклеотид Окислительно-восстановительные реакции Никотиновая кислота (Vit B 5, Vit PP) Никотинамидадениндинуклеотид, никотинамидадениндинуклеотидфосфат Окислительно-восстановительные реакции Пантотеновая кислота (Vit В 3) Кофермент (коэнзим) А Перенос ацильных групп Пиридоксин (Vit В 6) Пиридоксальфосфат Перенос аминогрупп Биотин (Vit H) Биотицин Перенос СО 2 Фолиевая кислота (Vit B 9, Тетрагидрофолат Перенос одноуглеродных групп Метилкобаламин (Vit В 12) Дезоксиаденозилкобаламин Перенос связанного с углеродом атома водорода на соседний атом углерода Аскорбиновая кислота (Vit С) Не известна Реакции гидроксилирования Vit Вс) 11
 АКТИВНЫЙ ЦЕНТР – УЧАСТОК МОЛЕКУЛЫ ФЕРМЕНТА, В КОТОРОМ ПРОИСХОДИТ СВЯЗЫВАНИЕ И ПРЕВРАЩЕНИЕ СУБСТРАТА. ь комплементарный по строению субстрату ь 7 -15 аминокислот ОН (сер, тре, тир) - SН (цис) - NН (гис) - СООН (глу, асп) - NН 2 (арг, лиз) Строение активного центра фермента
АКТИВНЫЙ ЦЕНТР – УЧАСТОК МОЛЕКУЛЫ ФЕРМЕНТА, В КОТОРОМ ПРОИСХОДИТ СВЯЗЫВАНИЕ И ПРЕВРАЩЕНИЕ СУБСТРАТА. ь комплементарный по строению субстрату ь 7 -15 аминокислот ОН (сер, тре, тир) - SН (цис) - NН (гис) - СООН (глу, асп) - NН 2 (арг, лиз) Строение активного центра фермента
 СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ Абсолютная специфичность проявляется тогда, когда фермент действует лишь на одноединственное вещество и катализирует лишь определенное превращение данного вещества. Относительная специфичность наблюдается, когда фермент катализирует реакции одного типа с более чем одним структуроподобным субстратом. Такие ферменты действуют на определенный тип химической связи. Стереоспецифичность - фермент катализирует превращение определенного стереоизомера. В организме человека наблюдают специфичность ферментов к следующим стереоизомерам: • D- сахара; • L-аминокислот; • цис-транс-изомерам; • ɑ-, β-гликозидным связям.
СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ Абсолютная специфичность проявляется тогда, когда фермент действует лишь на одноединственное вещество и катализирует лишь определенное превращение данного вещества. Относительная специфичность наблюдается, когда фермент катализирует реакции одного типа с более чем одним структуроподобным субстратом. Такие ферменты действуют на определенный тип химической связи. Стереоспецифичность - фермент катализирует превращение определенного стереоизомера. В организме человека наблюдают специфичность ферментов к следующим стереоизомерам: • D- сахара; • L-аминокислот; • цис-транс-изомерам; • ɑ-, β-гликозидным связям.
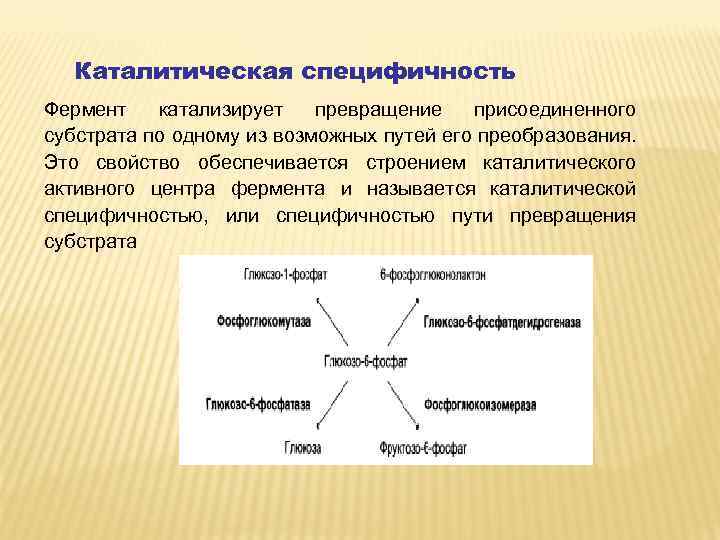 Каталитическая специфичность Фермент катализирует превращение присоединенного субстрата по одному из возможных путей его преобразования. Это свойство обеспечивается строением каталитического активного центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата
Каталитическая специфичность Фермент катализирует превращение присоединенного субстрата по одному из возможных путей его преобразования. Это свойство обеспечивается строением каталитического активного центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата
 УСЛОВНЫЕ ОБОЗНАЧЕНИЯ В ЭНЗИМОЛОГИИ Е - фермент, энзим ("еnzуме") S - субстрат - вещество, на которую действует фермент Р - продукт реакции - вещество, которое образуется в результате ферм. реакции
УСЛОВНЫЕ ОБОЗНАЧЕНИЯ В ЭНЗИМОЛОГИИ Е - фермент, энзим ("еnzуме") S - субстрат - вещество, на которую действует фермент Р - продукт реакции - вещество, которое образуется в результате ферм. реакции
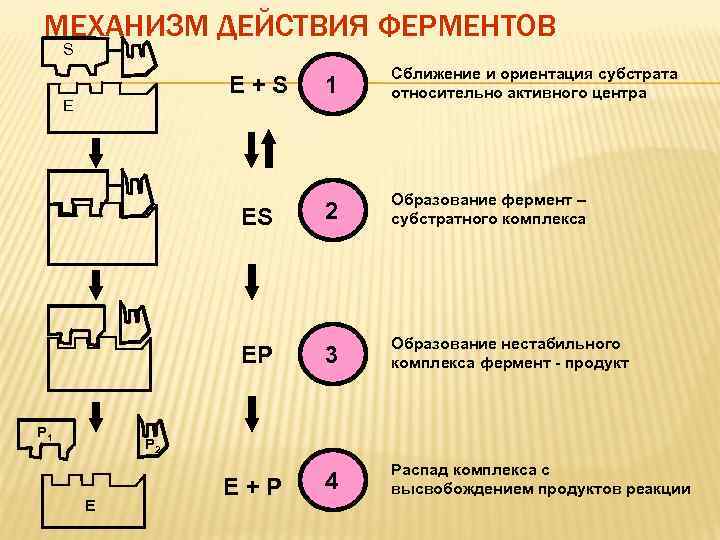 МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ S E+S ES Р 1 2 Образование фермент – субстратного комплекса EP Е 1 Сближение и ориентация субстрата относительно активного центра 3 Образование нестабильного комплекса фермент - продукт 4 Распад комплекса с высвобождением продуктов реакции Р 2 Е E+P
МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ S E+S ES Р 1 2 Образование фермент – субстратного комплекса EP Е 1 Сближение и ориентация субстрата относительно активного центра 3 Образование нестабильного комплекса фермент - продукт 4 Распад комплекса с высвобождением продуктов реакции Р 2 Е E+P
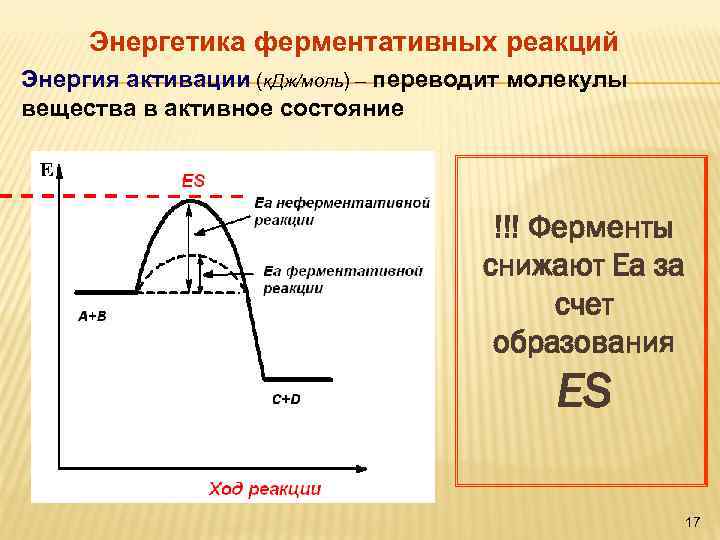 Энергетика ферментативных реакций Энергия активации (к. Дж/моль) – переводит молекулы вещества в активное состояние !!! Ферменты снижают Еа за счет образования ЕS 17
Энергетика ферментативных реакций Энергия активации (к. Дж/моль) – переводит молекулы вещества в активное состояние !!! Ферменты снижают Еа за счет образования ЕS 17
 Активность – это изменение концентрации субстрата под влиянием фермента в единицу времени. В системе СИ используют «катал» 1 катал = 1 моль / с. Международная единица активности (МЕ или U) – количество фермента, катализирующие превращение 1 мкмоля субстрата за 1 мин. 1 U равняется 16, 67 нанокатал.
Активность – это изменение концентрации субстрата под влиянием фермента в единицу времени. В системе СИ используют «катал» 1 катал = 1 моль / с. Международная единица активности (МЕ или U) – количество фермента, катализирующие превращение 1 мкмоля субстрата за 1 мин. 1 U равняется 16, 67 нанокатал.
 КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ (1913 г. – Михаэлис и Ментен) Скорость ферментативной реакции (V) зависит от: ь концентрации фермента ь концентрации субстрата ь t, р. Н 19
КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ (1913 г. – Михаэлис и Ментен) Скорость ферментативной реакции (V) зависит от: ь концентрации фермента ь концентрации субстрата ь t, р. Н 19
![Зависимость скорости ферментативной реакции от концентрации фермента V = k∙[E] от концентрации субстрата V= Зависимость скорости ферментативной реакции от концентрации фермента V = k∙[E] от концентрации субстрата V=](https://present5.com/presentation/177904927_360120571/image-20.jpg) Зависимость скорости ферментативной реакции от концентрации фермента V = k∙[E] от концентрации субстрата V= Vmax___ 1+ Km / [S] Константа Михаэлиса (Km) – концентрация S, при которой скорость ферм. р-ции = ½ V max 20
Зависимость скорости ферментативной реакции от концентрации фермента V = k∙[E] от концентрации субстрата V= Vmax___ 1+ Km / [S] Константа Михаэлиса (Km) – концентрация S, при которой скорость ферм. р-ции = ½ V max 20
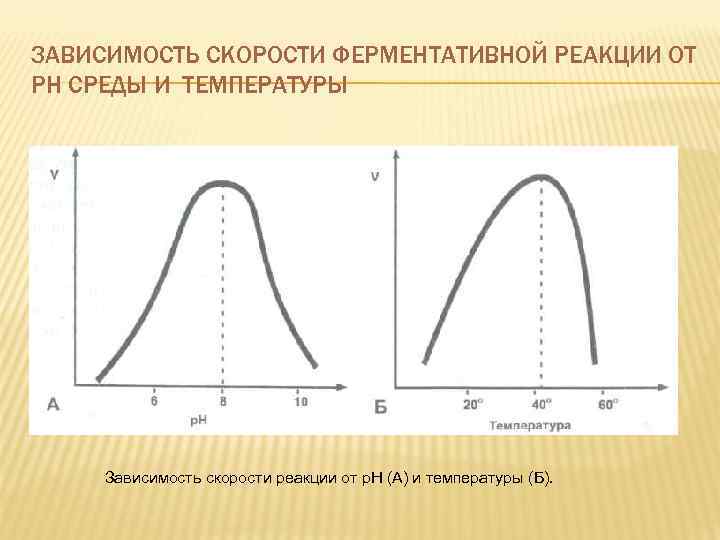 ЗАВИСИМОСТЬ СКОРОСТИ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ ОТ РН СРЕДЫ И ТЕМПЕРАТУРЫ Зависимость скорости реакции от р. Н (А) и температуры (Б).
ЗАВИСИМОСТЬ СКОРОСТИ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ ОТ РН СРЕДЫ И ТЕМПЕРАТУРЫ Зависимость скорости реакции от р. Н (А) и температуры (Б).
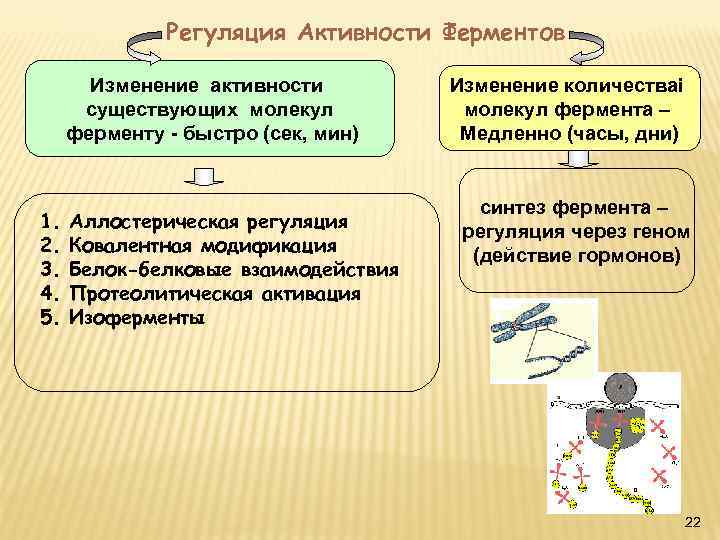 Регуляция Активности Ферментов Изменение активности существующих молекул ферменту - быстро (сек, мин) 1. 2. 3. 4. 5. Аллостерическая регуляция Ковалентная модификация Белок-белковые взаимодействия Протеолитическая активация Изоферменты Изменение количестваі молекул фермента – Медленно (часы, дни) синтез фермента – регуляция через геном (действие гормонов) 22
Регуляция Активности Ферментов Изменение активности существующих молекул ферменту - быстро (сек, мин) 1. 2. 3. 4. 5. Аллостерическая регуляция Ковалентная модификация Белок-белковые взаимодействия Протеолитическая активация Изоферменты Изменение количестваі молекул фермента – Медленно (часы, дни) синтез фермента – регуляция через геном (действие гормонов) 22
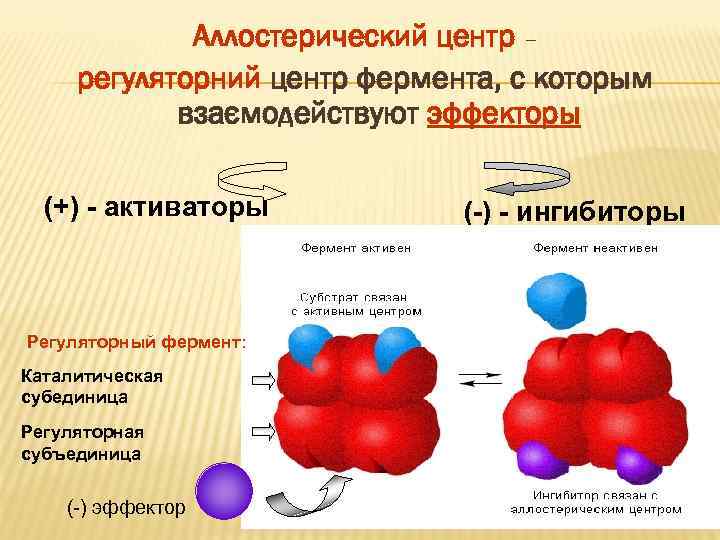 Аллостерический центр – регуляторний центр фермента, с которым взаємодействуют эффекторы (+) - активаторы (-) - ингибиторы Регуляторный фермент: Каталитическая субединица Регуляторная субъединица (-) эффектор 23
Аллостерический центр – регуляторний центр фермента, с которым взаємодействуют эффекторы (+) - активаторы (-) - ингибиторы Регуляторный фермент: Каталитическая субединица Регуляторная субъединица (-) эффектор 23
 АКТИВАТОРЫ ФЕРМЕНТОВ Соединения, которые приводят фермент в каталитически активное состояние Ионы двухвалентных металлов: Zn 2+, Cа 2+, Mg 2+, Cu 2+
АКТИВАТОРЫ ФЕРМЕНТОВ Соединения, которые приводят фермент в каталитически активное состояние Ионы двухвалентных металлов: Zn 2+, Cа 2+, Mg 2+, Cu 2+
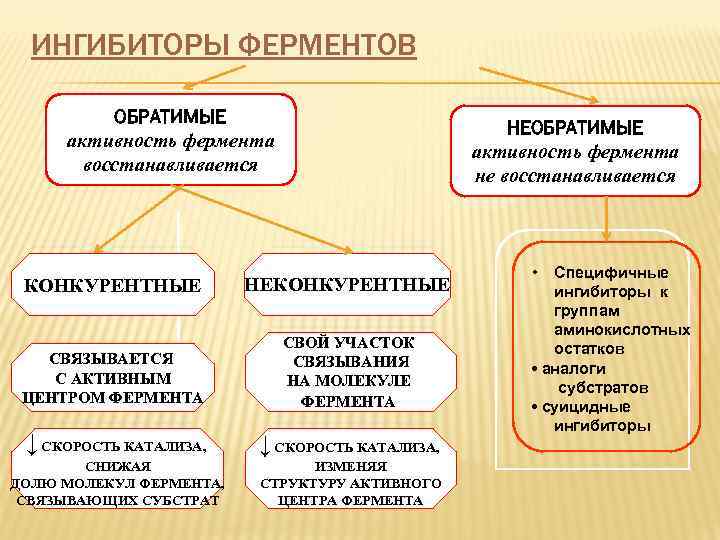 ИНГИБИТОРЫ ФЕРМЕНТОВ ОБРАТИМЫЕ активность фермента восстанавливается НЕОБРАТИМЫЕ активность фермента не восстанавливается КОНКУРЕНТНЫЕ НЕКОНКУРЕНТНЫЕ СВЯЗЫВАЕТСЯ С АКТИВНЫМ ЦЕНТРОМ ФЕРМЕНТА СВОЙ УЧАСТОК СВЯЗЫВАНИЯ НА МОЛЕКУЛЕ ФЕРМЕНТА ↓ СКОРОСТЬ КАТАЛИЗА, СНИЖАЯ ДОЛЮ МОЛЕКУЛ ФЕРМЕНТА, СВЯЗЫВАЮЩИХ СУБСТРАТ ИЗМЕНЯЯ СТРУКТУРУ АКТИВНОГО ЦЕНТРА ФЕРМЕНТА • Специфичные ингибиторы к группам аминокислотных остатков • аналоги субстратов • суицидные ингибиторы
ИНГИБИТОРЫ ФЕРМЕНТОВ ОБРАТИМЫЕ активность фермента восстанавливается НЕОБРАТИМЫЕ активность фермента не восстанавливается КОНКУРЕНТНЫЕ НЕКОНКУРЕНТНЫЕ СВЯЗЫВАЕТСЯ С АКТИВНЫМ ЦЕНТРОМ ФЕРМЕНТА СВОЙ УЧАСТОК СВЯЗЫВАНИЯ НА МОЛЕКУЛЕ ФЕРМЕНТА ↓ СКОРОСТЬ КАТАЛИЗА, СНИЖАЯ ДОЛЮ МОЛЕКУЛ ФЕРМЕНТА, СВЯЗЫВАЮЩИХ СУБСТРАТ ИЗМЕНЯЯ СТРУКТУРУ АКТИВНОГО ЦЕНТРА ФЕРМЕНТА • Специфичные ингибиторы к группам аминокислотных остатков • аналоги субстратов • суицидные ингибиторы
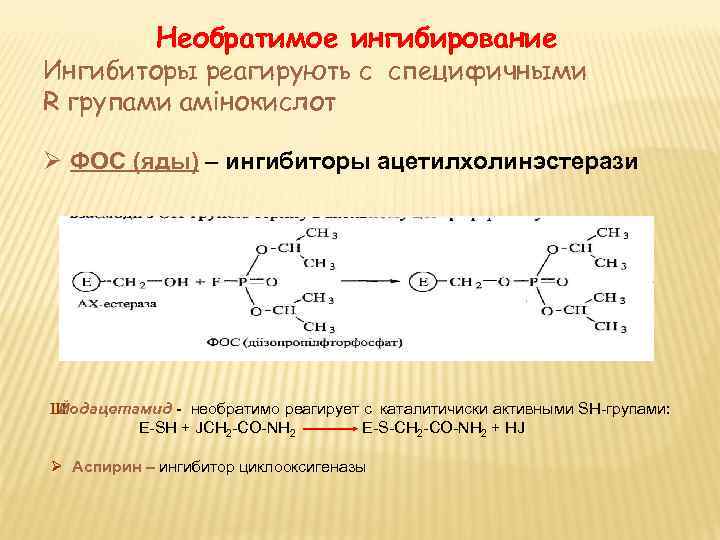 Необратимое ингибирование Ингибиторы реагирують с специфичными R групами амінокислот Ø ФОС (яды) – ингибиторы ацетилхолинэстерази Ш Йодацетамид - необратимо реагирует с каталитичиски активными SH-групами: E-SH + JCH 2 -CO-NH 2 E-S-CH 2 -CO-NH 2 + НJ Ø Аспирин – ингибитор циклооксигеназы
Необратимое ингибирование Ингибиторы реагирують с специфичными R групами амінокислот Ø ФОС (яды) – ингибиторы ацетилхолинэстерази Ш Йодацетамид - необратимо реагирует с каталитичиски активными SH-групами: E-SH + JCH 2 -CO-NH 2 E-S-CH 2 -CO-NH 2 + НJ Ø Аспирин – ингибитор циклооксигеназы
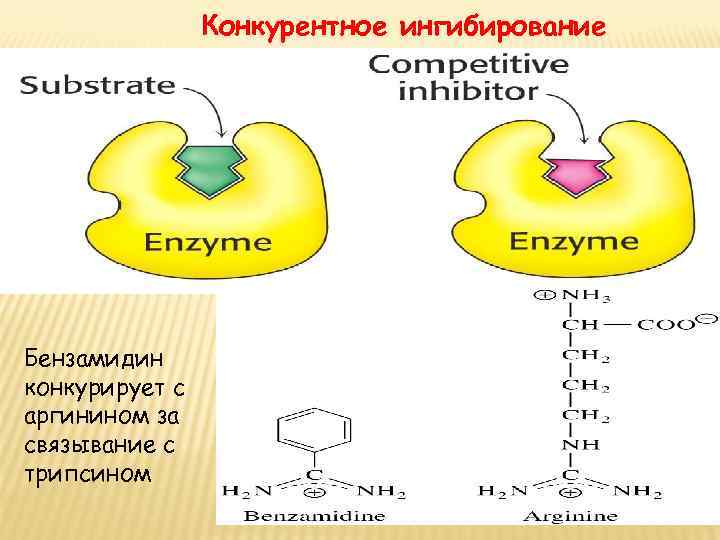 Конкурентное ингибирование Бензамидин конкурирует с аргинином за связывание с трипсином
Конкурентное ингибирование Бензамидин конкурирует с аргинином за связывание с трипсином
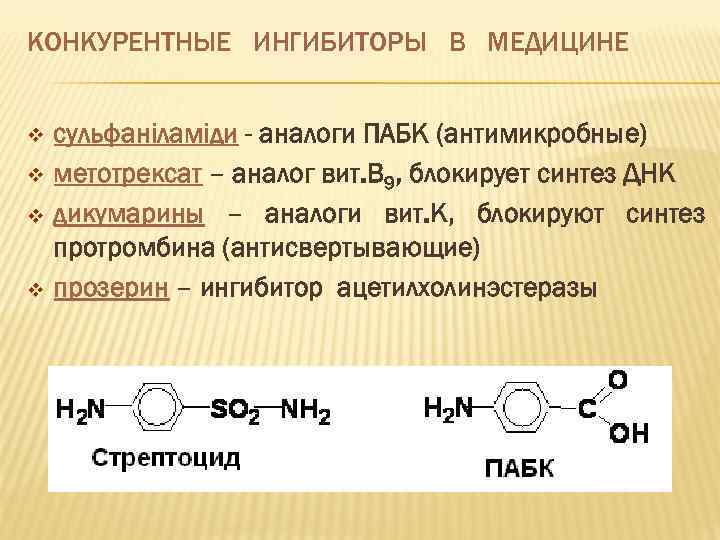 КОНКУРЕНТНЫЕ ИНГИБИТОРЫ В МЕДИЦИНЕ v v сульфаніламіди - аналоги ПАБК (антимикробные) метотрексат – аналог вит. В 9, блокирует синтез ДНК дикумарины – аналоги вит. К, блокируют синтез протромбина (антисвертывающие) прозерин – ингибитор ацетилхолинэстеразы
КОНКУРЕНТНЫЕ ИНГИБИТОРЫ В МЕДИЦИНЕ v v сульфаніламіди - аналоги ПАБК (антимикробные) метотрексат – аналог вит. В 9, блокирует синтез ДНК дикумарины – аналоги вит. К, блокируют синтез протромбина (антисвертывающие) прозерин – ингибитор ацетилхолинэстеразы
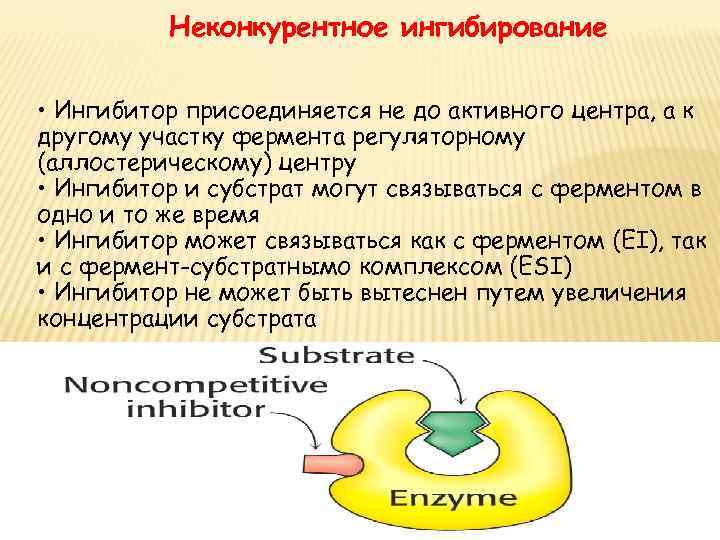 Неконкурентное ингибирование • Ингибитор присоединяется не до активного центра, а к другому участку фермента регуляторному (аллостерическому) центру • Ингибитор и субстрат могут связываться с ферментом в одно и то же время • Ингибитор может связываться как с ферментом (EI), так и с фермент-субстратнымо комплексом (ESI) • Ингибитор не может быть вытеснен путем увеличения концентрации субстрата
Неконкурентное ингибирование • Ингибитор присоединяется не до активного центра, а к другому участку фермента регуляторному (аллостерическому) центру • Ингибитор и субстрат могут связываться с ферментом в одно и то же время • Ингибитор может связываться как с ферментом (EI), так и с фермент-субстратнымо комплексом (ESI) • Ингибитор не может быть вытеснен путем увеличения концентрации субстрата
 Безконкурентное ингибирование • Ингибитор присоединяется к ES, а не к свободному E • Встречается только в мультисубстратных реакциях
Безконкурентное ингибирование • Ингибитор присоединяется к ES, а не к свободному E • Встречается только в мультисубстратных реакциях
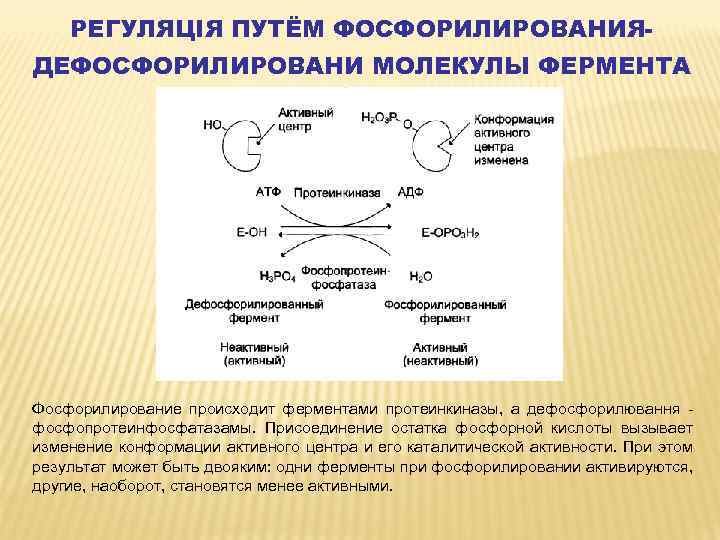 РЕГУЛЯЦІЯ ПУТЁМ ФОСФОРИЛИРОВАНИЯДЕФОСФОРИЛИРОВАНИ МОЛЕКУЛЫ ФЕРМЕНТА Фосфорилирование происходит ферментами протеинкиназы, а дефосфорилювання фосфопротеинфосфатазамы. Присоединение остатка фосфорной кислоты вызывает изменение конформации активного центра и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие, наоборот, становятся менее активными.
РЕГУЛЯЦІЯ ПУТЁМ ФОСФОРИЛИРОВАНИЯДЕФОСФОРИЛИРОВАНИ МОЛЕКУЛЫ ФЕРМЕНТА Фосфорилирование происходит ферментами протеинкиназы, а дефосфорилювання фосфопротеинфосфатазамы. Присоединение остатка фосфорной кислоты вызывает изменение конформации активного центра и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие, наоборот, становятся менее активными.
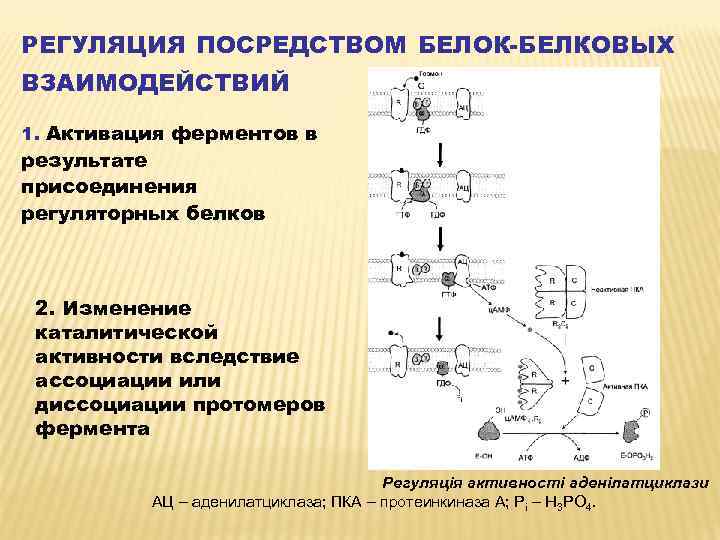 РЕГУЛЯЦИЯ ПОСРЕДСТВОМ БЕЛОК-БЕЛКОВЫХ ВЗАИМОДЕЙСТВИЙ 1. Активация ферментов в результате присоединения регуляторных белков 2. Изменение каталитической активности вследствие ассоциации или диссоциации протомеров фермента Регуляція активності аденілатциклази АЦ – аденилатциклаза; ПКА – протеинкиназа А; Рі – Н 3 РО 4.
РЕГУЛЯЦИЯ ПОСРЕДСТВОМ БЕЛОК-БЕЛКОВЫХ ВЗАИМОДЕЙСТВИЙ 1. Активация ферментов в результате присоединения регуляторных белков 2. Изменение каталитической активности вследствие ассоциации или диссоциации протомеров фермента Регуляція активності аденілатциклази АЦ – аденилатциклаза; ПКА – протеинкиназа А; Рі – Н 3 РО 4.
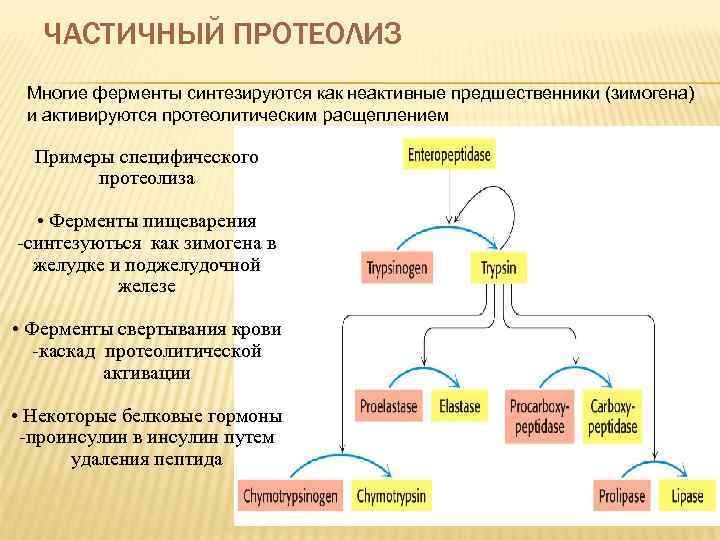 ЧАСТИЧНЫЙ ПРОТЕОЛИЗ Многие ферменты синтезируются как неактивные предшественники (зимогена) и активируются протеолитическим расщеплением Примеры специфического протеолиза • Ферменты пищеварения -синтезуються как зимогена в желудке и поджелудочной железе • Ферменты свертывания крови -каскад протеолитической активации • Некоторые белковые гормоны -проинсулин в инсулин путем удаления пептида
ЧАСТИЧНЫЙ ПРОТЕОЛИЗ Многие ферменты синтезируются как неактивные предшественники (зимогена) и активируются протеолитическим расщеплением Примеры специфического протеолиза • Ферменты пищеварения -синтезуються как зимогена в желудке и поджелудочной железе • Ферменты свертывания крови -каскад протеолитической активации • Некоторые белковые гормоны -проинсулин в инсулин путем удаления пептида
 Изоферменты – это ферменты, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по составу, свойствам, местом локализации. Лактатдегидрогеназа (ЛДГ) олигомер, состоящий из 4 протомеров одного или двух типов, обозначаемых: Н и М. ЛДГ существует в 5 изоформ *ЛДГ-1 -(4 Н), локализован в мышце сердца, почках. *ЛДГ-2 -(3 Н 1 М), эритроциты, тромбоциты, сердце, почки. *ЛДГ-3 -(2 Н 2 М), в поджелудочной железе, селезенка, надпочечник. *ЛДГ-4 -(1 Н 3 М), тромбоциты, легкие. *ЛДГ-5 -(4 М), локализован в клетках печени, скелетной мускулатуре. Изоферменты – важны для диагностики разных заболеваний: ЛДГ 1, 2 – инфаркт миокарда, ↑ ЛДГ 4, 5 – поражение печени
Изоферменты – это ферменты, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по составу, свойствам, местом локализации. Лактатдегидрогеназа (ЛДГ) олигомер, состоящий из 4 протомеров одного или двух типов, обозначаемых: Н и М. ЛДГ существует в 5 изоформ *ЛДГ-1 -(4 Н), локализован в мышце сердца, почках. *ЛДГ-2 -(3 Н 1 М), эритроциты, тромбоциты, сердце, почки. *ЛДГ-3 -(2 Н 2 М), в поджелудочной железе, селезенка, надпочечник. *ЛДГ-4 -(1 Н 3 М), тромбоциты, легкие. *ЛДГ-5 -(4 М), локализован в клетках печени, скелетной мускулатуре. Изоферменты – важны для диагностики разных заболеваний: ЛДГ 1, 2 – инфаркт миокарда, ↑ ЛДГ 4, 5 – поражение печени
 ПРИМЕНЕНИЕ ФЕРМЕНТОВ В МЕДИЦИНЕ. Энзимодиагностика — исследование ферментов в биологических средах организма с диагностической целью. Энзимотерапия — использование ферментов и метаболитов в качестве лечебных средств
ПРИМЕНЕНИЕ ФЕРМЕНТОВ В МЕДИЦИНЕ. Энзимодиагностика — исследование ферментов в биологических средах организма с диагностической целью. Энзимотерапия — использование ферментов и метаболитов в качестве лечебных средств
 ФЕРМЕНТЫ – ИНДИКАТОРЫ ЗАБОЛЕВАНИЙ Миокард • Креатинфосфокиназа (КФК-МВ) • Аспартатаминотрансфераза (АСТ) Инфаркт миокарда • Лактатдегидрогеназа (ЛДГ 1, 2) Печень Аланинаминотрансфераза (АЛТ) Лактатдегирогеназа - ЛДГ 4, 5 Поджелудочная • Альфа-амилаза железа • Трипсин Гепатит Панкреатит 36
ФЕРМЕНТЫ – ИНДИКАТОРЫ ЗАБОЛЕВАНИЙ Миокард • Креатинфосфокиназа (КФК-МВ) • Аспартатаминотрансфераза (АСТ) Инфаркт миокарда • Лактатдегидрогеназа (ЛДГ 1, 2) Печень Аланинаминотрансфераза (АЛТ) Лактатдегирогеназа - ЛДГ 4, 5 Поджелудочная • Альфа-амилаза железа • Трипсин Гепатит Панкреатит 36
 МЕТОДЫ ИММОБИЛИЗАЦИИ ФЕРМЕНТОВ 37
МЕТОДЫ ИММОБИЛИЗАЦИИ ФЕРМЕНТОВ 37
 СПАСИБО ЗА ВНИМАНИЕ!
СПАСИБО ЗА ВНИМАНИЕ!


