Лекция 2. Модели атома.ppt
- Количество слайдов: 22
 Лекция 2 Развитие представлений о дискретно строении атома
Лекция 2 Развитие представлений о дискретно строении атома
 Атомистика древних греков n n n Все состоит из атомов. Атомы неделимы физически, неразрушимы и существуют вечно. Между атомами в материи существует пустое пространство. Атомы всегда находятся в движении. Существует бесконечное количество как самих атомов, так и их разновидностей – атомы различаются формой и размерами.
Атомистика древних греков n n n Все состоит из атомов. Атомы неделимы физически, неразрушимы и существуют вечно. Между атомами в материи существует пустое пространство. Атомы всегда находятся в движении. Существует бесконечное количество как самих атомов, так и их разновидностей – атомы различаются формой и размерами.
 Атомистическая теория Д. Дальтона n n n Атомы представляют собой мельчайшие частицы вещества, которые невозможно разделить на составные части, превратить друг в друга или уничтожить. При разложении соединения из него получаются исходные атомы в неизменном виде… Все атомы одного элемента совершенно одинаковы и имеют одинаковый вес. Атомы различных элементов имеют различные веса.
Атомистическая теория Д. Дальтона n n n Атомы представляют собой мельчайшие частицы вещества, которые невозможно разделить на составные части, превратить друг в друга или уничтожить. При разложении соединения из него получаются исходные атомы в неизменном виде… Все атомы одного элемента совершенно одинаковы и имеют одинаковый вес. Атомы различных элементов имеют различные веса.
 Строение атома по Томсону (модель сливового пудинга), 1904 г.
Строение атома по Томсону (модель сливового пудинга), 1904 г.
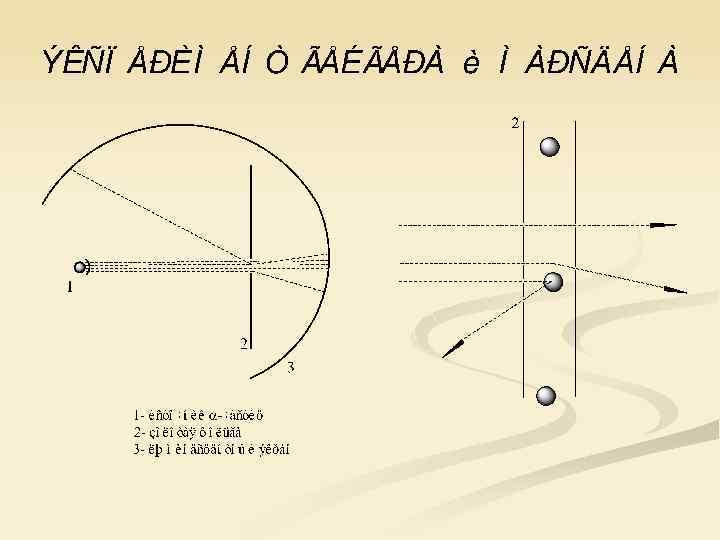
 «Это было почти столь же невероятно, как если бы вы стреляли 15 -дюймовым снарядом по куску папиросной бумаги, а снаряд рикошетом вернулся назад и попал в вас. » Эрнст Резерфорд
«Это было почти столь же невероятно, как если бы вы стреляли 15 -дюймовым снарядом по куску папиросной бумаги, а снаряд рикошетом вернулся назад и попал в вас. » Эрнст Резерфорд
 Строение атома по Резерфорду (ядерная модель), 1911 г.
Строение атома по Резерфорду (ядерная модель), 1911 г.
 Спектр(лат. “spectrum” – представление) – совокупность длин волн электромагнитного излучения, поглощаемого или испускаемого веществом
Спектр(лат. “spectrum” – представление) – совокупность длин волн электромагнитного излучения, поглощаемого или испускаемого веществом
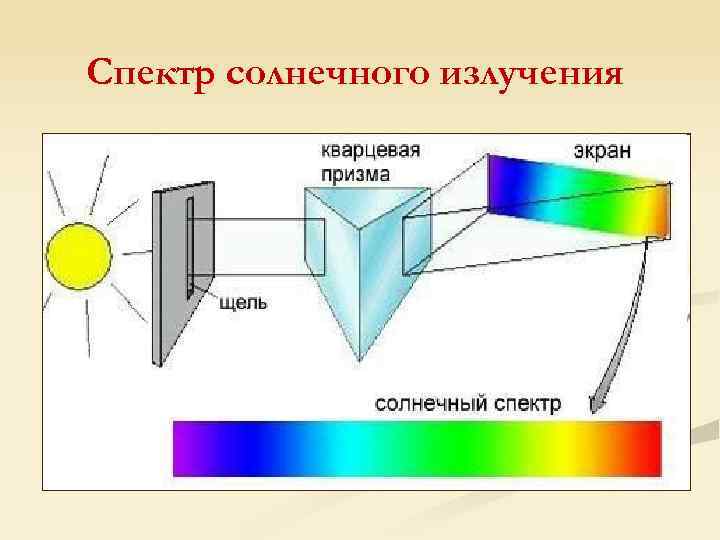 Спектр солнечного излучения
Спектр солнечного излучения
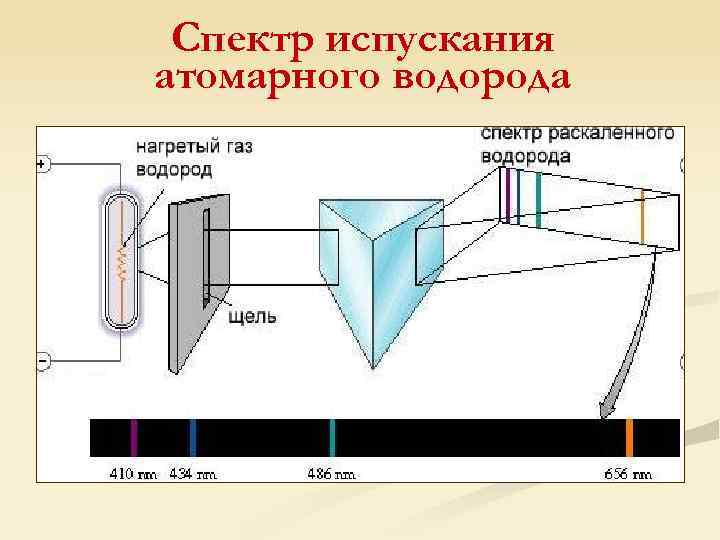 Спектр испускания атомарного водорода
Спектр испускания атомарного водорода
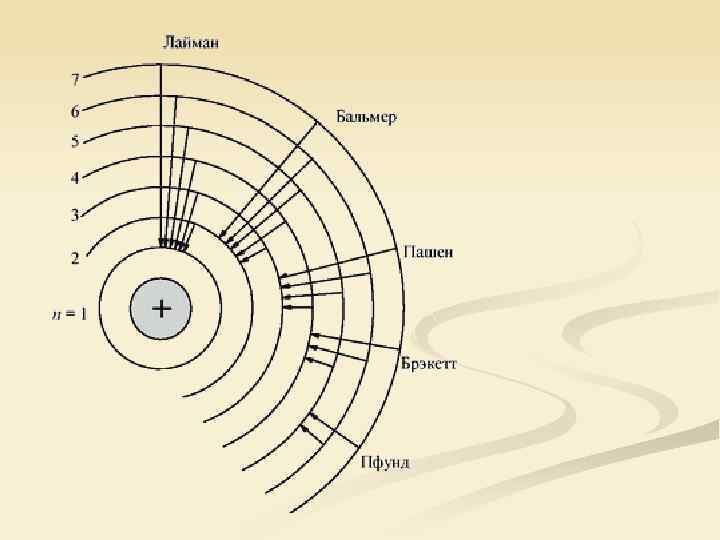
 Спектральные серии атома водорода, открытые к 1913 г. n n n Серия Бальмера в видимом диапазоне, 1885 г. Серия Лаймана в ультрафиолетовом диапазоне, 1906 г. Серия Пашена в инфракрасном диапазоне, 1908 г. Уравнение Ридберга: где R = 109 677 см− 1 Серия Лаймана: n 1 = 1; n 2 = 2, 3, 4, … Серия Бальмера: n 1 = 2; n 2 = 3, 4, 5, … Серия Пашена: n 1 = 3; n 2 = 4, 5, 6, …
Спектральные серии атома водорода, открытые к 1913 г. n n n Серия Бальмера в видимом диапазоне, 1885 г. Серия Лаймана в ультрафиолетовом диапазоне, 1906 г. Серия Пашена в инфракрасном диапазоне, 1908 г. Уравнение Ридберга: где R = 109 677 см− 1 Серия Лаймана: n 1 = 1; n 2 = 2, 3, 4, … Серия Бальмера: n 1 = 2; n 2 = 3, 4, 5, … Серия Пашена: n 1 = 3; n 2 = 4, 5, 6, …
 Теория Нильса Бора, 1913 г. 1. Постулат стационарных состояний. Существуют некоторые стационарные состояния атома, находясь в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. При движении по стационарным орбитам электрон, несмотря на наличие ускорения, не излучает электромагнитных волн (энергии).
Теория Нильса Бора, 1913 г. 1. Постулат стационарных состояний. Существуют некоторые стационарные состояния атома, находясь в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. При движении по стационарным орбитам электрон, несмотря на наличие ускорения, не излучает электромагнитных волн (энергии).
 Теория Нильса Бора, 1913 г. 2. Правило квантования орбит. В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь квантованные значения момента импульса, удовлетворяющие условию: mvr = nħ ħ – постоянная Дирака ħ = h/2π = 1, 05 • 10 -34 Дж • с
Теория Нильса Бора, 1913 г. 2. Правило квантования орбит. В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь квантованные значения момента импульса, удовлетворяющие условию: mvr = nħ ħ – постоянная Дирака ħ = h/2π = 1, 05 • 10 -34 Дж • с
 Теория Нильса Бора, 1913 г. 3. Условие частот Бора. Атом излучает (поглощает) квант электромагнитной энергии, когда электрон переходит с орбиты с большим (меньшим) n на орбиту с меньшим (большим) n. Энергия кванта равна разности энергий электрона на орбитах до и после перехода: hνab = Ea – Eb
Теория Нильса Бора, 1913 г. 3. Условие частот Бора. Атом излучает (поглощает) квант электромагнитной энергии, когда электрон переходит с орбиты с большим (меньшим) n на орбиту с меньшим (большим) n. Энергия кванта равна разности энергий электрона на орбитах до и после перехода: hνab = Ea – Eb
 Строение атома по Бору (планетарная модель), 1913 г.
Строение атома по Бору (планетарная модель), 1913 г.
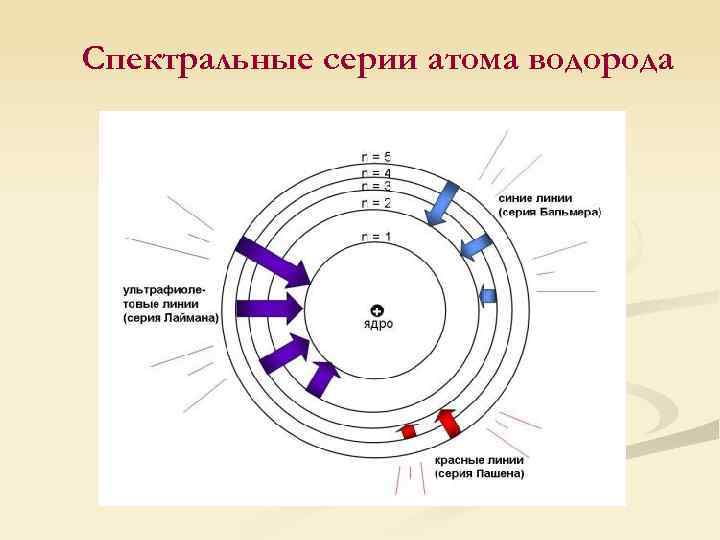 Спектральные серии атома водорода
Спектральные серии атома водорода
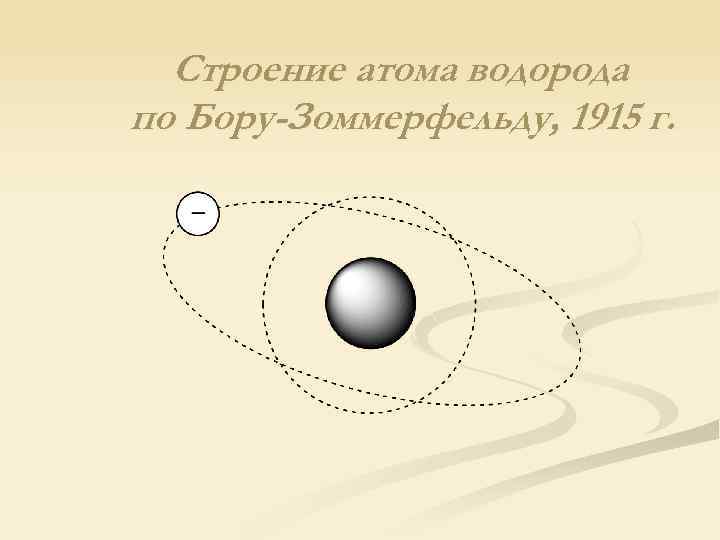 Строение атома водорода по Бору-Зоммерфельду, 1915 г.
Строение атома водорода по Бору-Зоммерфельду, 1915 г.
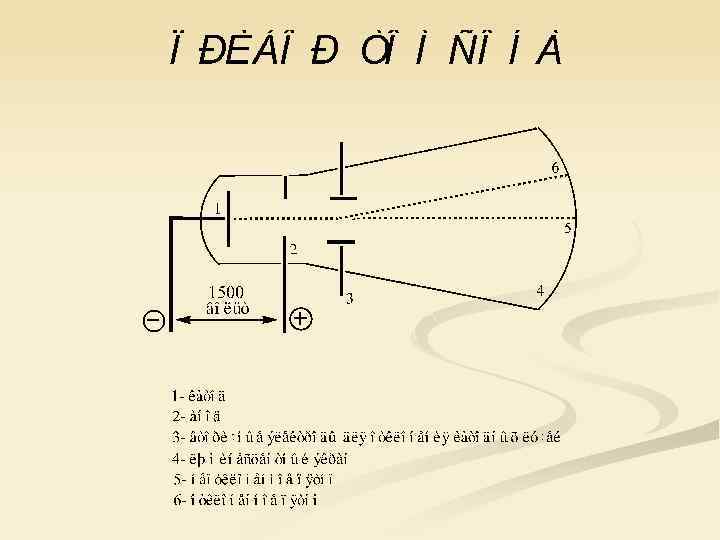
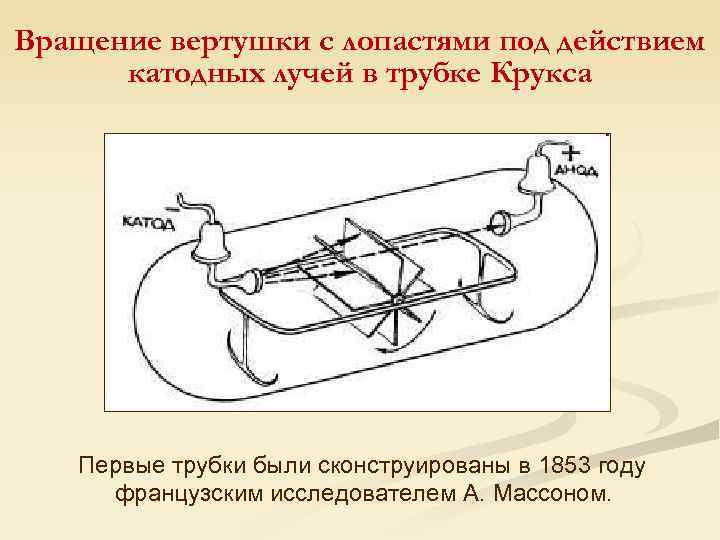 Вращение вертушки с лопастями под действием катодных лучей в трубке Крукса Первые трубки были сконструированы в 1853 году французским исследователем А. Массоном.
Вращение вертушки с лопастями под действием катодных лучей в трубке Крукса Первые трубки были сконструированы в 1853 году французским исследователем А. Массоном.
 Свойства катодных лучей, описанные Вильямом Круксом: n n вызывают свечение некоторых веществ, нанесенных на внутреннюю поверхность трубки; обладают кинетической энергией и способны передавать механическое движение вертушке с лопастями; отклоняются магнитным полем; отрицательно заряжены, потому что движутся по направлению к положительному полюсу трубки.
Свойства катодных лучей, описанные Вильямом Круксом: n n вызывают свечение некоторых веществ, нанесенных на внутреннюю поверхность трубки; обладают кинетической энергией и способны передавать механическое движение вертушке с лопастями; отклоняются магнитным полем; отрицательно заряжены, потому что движутся по направлению к положительному полюсу трубки.
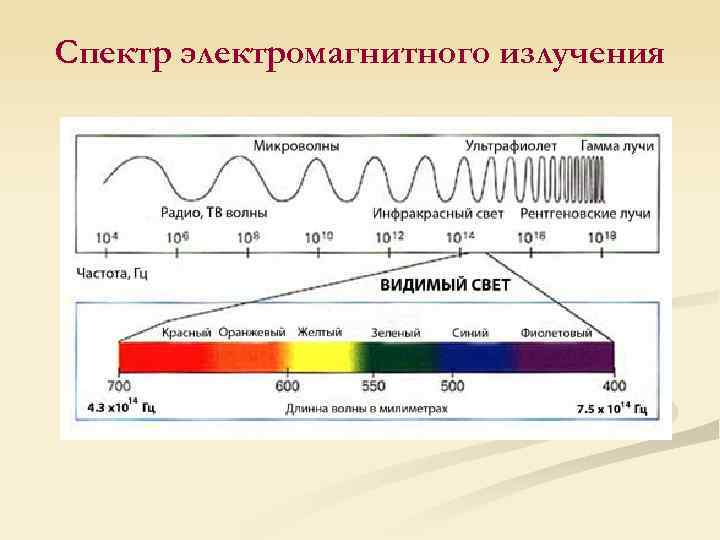 Спектр электромагнитного излучения
Спектр электромагнитного излучения


