для студентов Лекция 2. Геном человека.ppt
- Количество слайдов: 60
Лекция 2. Общая характеристика генома человека 1. 2. 3. 4. План лекции: Понятие «геном» Типы ДНК генома Тонкая структура гена Генетическое картирование

Задание на практические занятия Классификации генов в генотипе человека конспект: «Классификации генов в генотипе» Устные ответы: 1) Структурные гены, особенности строения и роль 2) Функциональные гены – особенности строения и роль Взаимодействие генов Конспект: «Виды взаимодействия генов, примеры у человека» Устные ответы: 1) взаимодействие аллельных генов 2) взаимодействие неаллельных генов

Терминология 1920 г. - Г. Винклер – термин «геном» (совокупность генов в гаплоидном наборе – характеристика целого вида организмов) “ГЕНОМ” – СОВОКУПНОСТЬ СБАЛАНСИРОВАННЫХ по БАЗОВОЙ БИОИНФОРМАЦИИ ГЕНОВ, ОПРЕДЕЛЯЮЩИХ во ВЗАИМОДЕЙСТВИИ ВИДОСПЕЦИФИЧНЫЕ ТИПЫ ОБМЕНА ВЕЩЕСТВ и ОНТОГЕНЕЗА «ГЕНОТИП» – ОПРЕДЕЛЯЕТ ИНДИВИДУАЛЬНОЕ (ВНУТРИВИДОВОЕ) РАЗНООБРАЗИЕ ОСОБЕЙ по СОДЕРЖАНИЮ и ДОЗАМ ОТДЕЛЬНЫХ “КВАНТОВ” БИОИНФОРМАЦИИ, ИНСТРУМЕНТ СОЗДАНИЯ РЕЗЕРВА НАСЛЕДСТВЕННОЙ ИЗМЕНЧИВОСТИ; “КАРИОТИП” ОТРАЖАЕТ СПОСОБ СТРУКТУРНОГО ОФОРМЛЕНИЯ ГЕНОМОВ и ГЕНОТИПОВ у ЭУКАРИОТ;
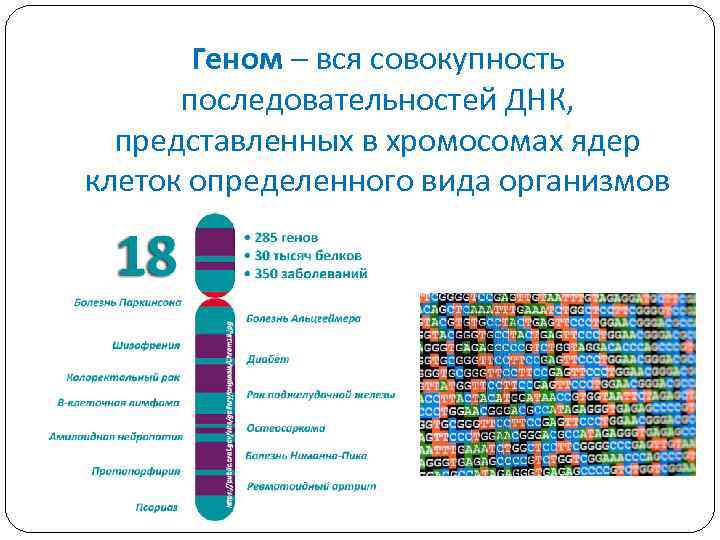
Геном – вся совокупность последовательностей ДНК, представленных в хромосомах ядер клеток определенного вида организмов

ГЕНОМЫ ЧЕЛОВЕКА и ДРУГИХ ВИДОВ ЖИВОТНЫХ (СРАВНИТЕЛЬНО-ЭВОЛЮЦИОННЫЙ АСПЕКТ) В ГЕНОМЕ ЧЕЛОВЕКА есть ГЕНЫ: = ОБЩИЕ для ПРО- и ЭУКАРИОТ – 21%; = ОБЩИЕ для ЖИВОТНЫХ и др. ЭУКАРИОТ – 32%; = ОБЩИЕ для ПОЗВОНОЧНЫХ и др. ЖИВОТНЫХ – 24%; = ОБЩИЕ для ПОЗВОНОЧНЫХ – 22%; = ОБЩИЕ для ПРИМАТОВ – 90 -99%; В ГЕНОМЕ ЧЕЛОВЕКА есть ДНК от: = РЕТРОТРАНСПОЗОНОВ (РНК ВИРУСОВ) – 8%; = ДНК ТРАНСПОЗОНОВ (БАКТЕРИАЛЬНЫХ) – 3%; = еще 220 ГЕНОВ от БАКТЕРИЙ-СИМБИОНТОВ, ВКЛЮЧАЯ ГЕН МАО; ГИПОТЕЗА – эти ГЕНЫ ИНТРОДУЦИРОВАНЫ в ГЕНОМ ГОМИНИДА ПРИШЕЛЬЦАМИ из КОСМОСА для ПРЕВРАЩЕНИЯ в РАБОЧУЮ СИЛУ; от ЧЕЛОВЕКА – ГЕНЫ ДОСТАЛИСЬ БАКТЕРИЯМ-СИМБИОНТАМ;
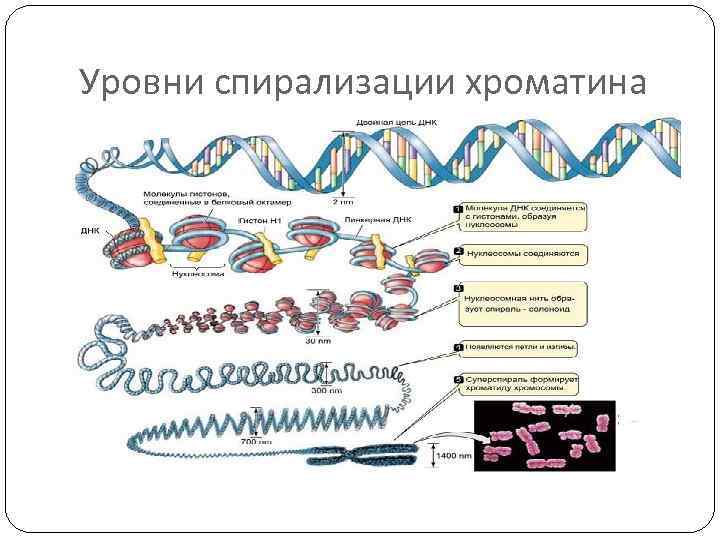
Уровни спирализации хроматина
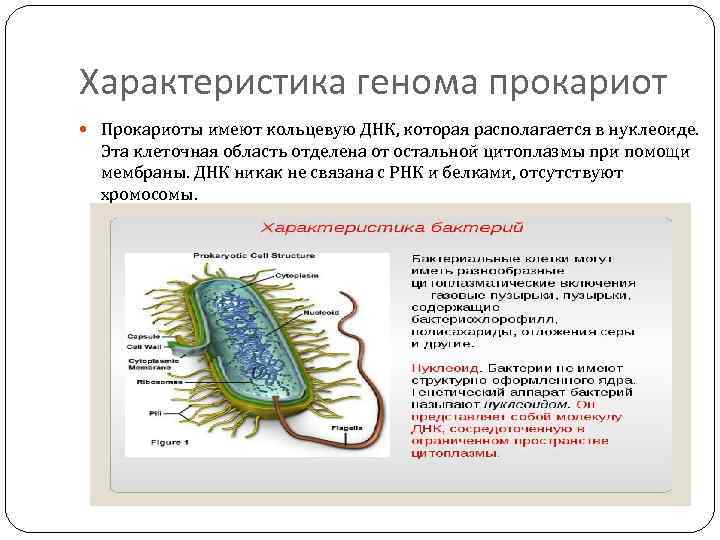
Характеристика генома прокариот Прокариоты имеют кольцевую ДНК, которая располагается в нуклеоиде. Эта клеточная область отделена от остальной цитоплазмы при помощи мембраны. ДНК никак не связана с РНК и белками, отсутствуют хромосомы.
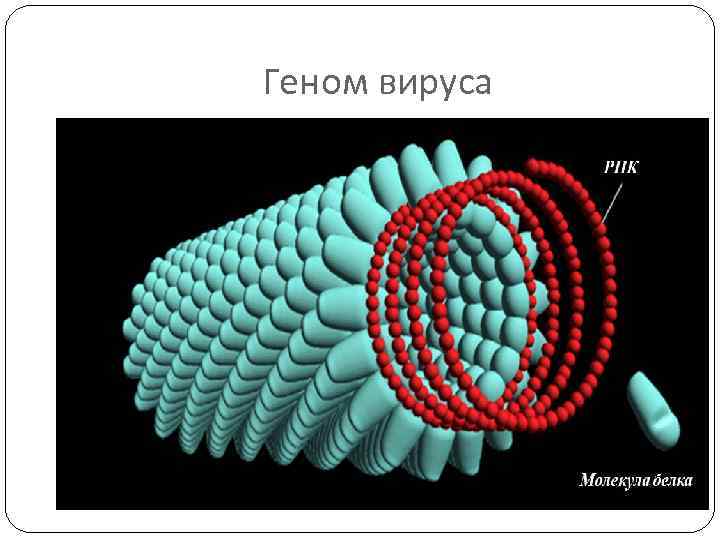
Геном вируса
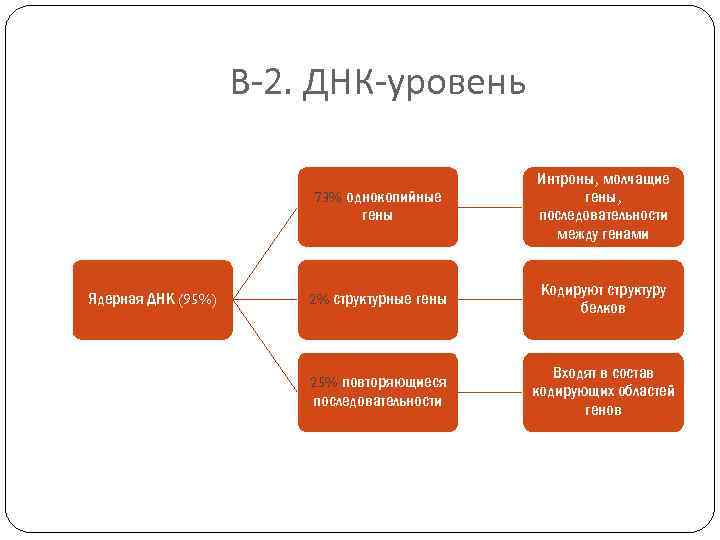
В-2. ДНК-уровень 73% однокопийные гены Ядерная ДНК (95%) Интроны, молчащие гены, последовательности между генами 2% структурные гены Кодируют структуру белков 25% повторяющиеся последовательности Входят в состав кодирующих областей генов
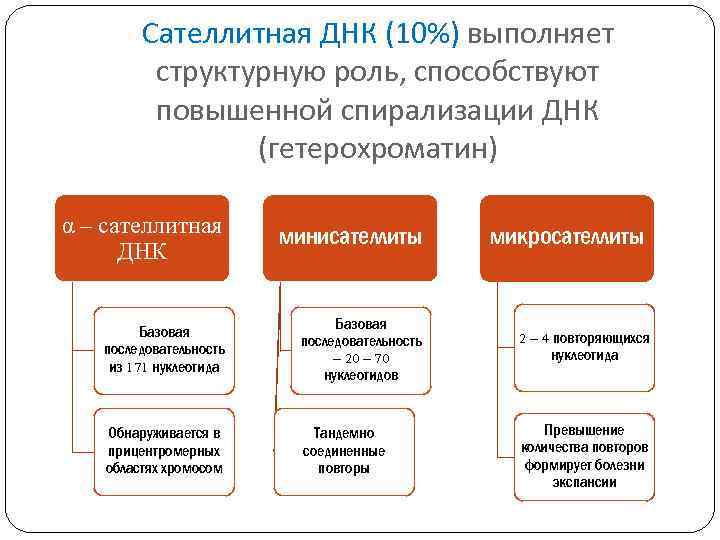
Сателлитная ДНК (10%) выполняет структурную роль, способствуют повышенной спирализации ДНК (гетерохроматин) α – сателлитная ДНК минисателлиты Базовая последовательность из 171 нуклеотида Базовая последовательность – 20 – 70 нуклеотидов 2 – 4 повторяющихся нуклеотида Обнаруживается в прицентромерных областях хромосом Тандемно соединенные повторы Превышение количества повторов формирует болезни экспансии микросателлиты

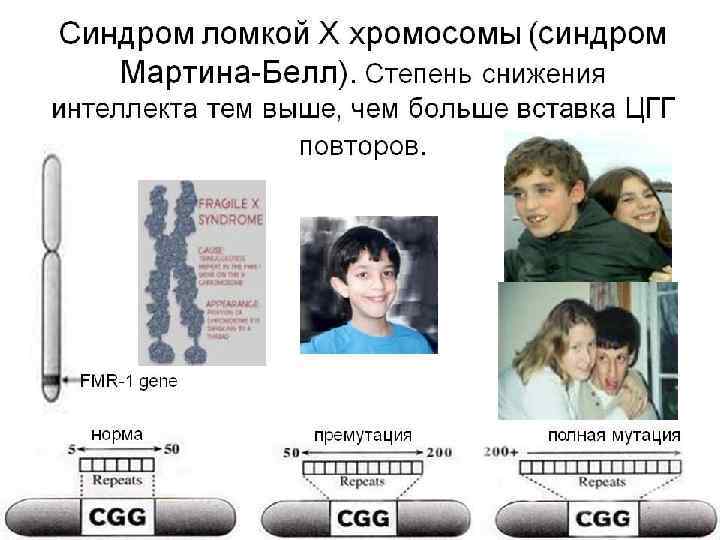
Болезни экспансии К болезням экспансии относятся наследственные заболевания, обусловленные динамическими мутациями. В основе динамических мутаций лежит нестабильность микро- и минисателлитных повторов ДНК, локализованных в значимых областях генов. При болезнях экспансии наблюдается превышение (экспансия) определенного порогового уровня числа повторяющихся элементов в месте локализации динамической мутации. Подобные экспансии сопровождаются нарушениями работы гена. В настоящее время насчитывается более 20 болезней экспансии, подавляющее большинство из них связаны с экспансией тринуклеотидных повторов. Это синдром Мартина-Белл (синдром фрагильной или ломкой Х-хромосомы), миотоническая дистрофия, атаксия Фридрейха, целая серия спиноцеребеллярных атаксий, хорея Гентингтона и ряд других. Болезни экспансии могут быть аутосомными или Х -сцепленными в зависимости от локализации мутантного гена.


Болезни экспансии У некоторых больных синдромом Ушера (Ашера) идентифицирована инсерция Aluповторов в 9 экзоне гена рецептора 2 -го фибробластного фактора роста. миодистрофией Дюшенна удалось проследить присутствие Aluповторов в точке разрыва, образованного делецией гена DMD.

Синдром Ашера (Ушера) Синдром Ашера - это сочетание врожденной нейросенсорной тугоухости, медленно прогрессирующей пигментной дегенерации сетчатки (начало на первом или втором десятилетии жизни) и вестибулярных расстройств. Также наблюдаются глаукома, катаракта, нистагм, задержка умственного развития, психозы. Встречается у 1 из 6000 детей. Выделяют три типа синдрома: I тип – врожденные глубокая тугоухость и нарушение вестибулярных функций, раннее начало пигментного ретинита; II тип – позднее начало пигментной дегенерации сетчатки и сохранность вестибулярных функций; III тип – доброкачественный, встречается редко и характеризуется медленным усугублением нарушений зрения и слуха.
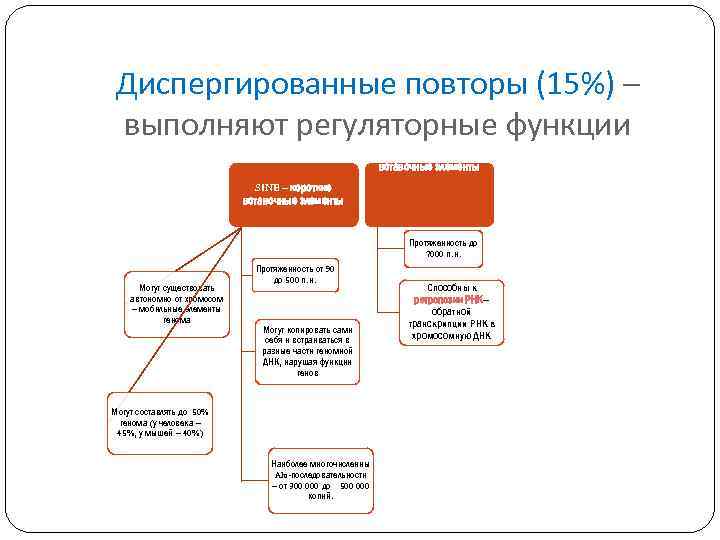
Диспергированные повторы (15%) – выполняют регуляторные функции LINE – длинные вставочные элементы SINE – короткие вставочные элементы Протяженность до 7000 п. н. Могут существовать автономно от хромосом – мобильные элементы генома Протяженность от 90 до 500 п. н. Могут копировать сами себя и встраиваться в разные части геномной ДНК, нарушая функции генов Могут составлять до 50% генома (у человека – 45%, у мышей – 40%) Наиболее многочисленны Alu-последовательности – от 300 000 до 500 000 копий. Способны к ретропозии РНК– обратной транскрипции РНК в хромосомную ДНК

Гипотезы о роли интронов 1. 2. 3. Внутри интронных областей одних генов могут располагаться экзоны других генов, «прочитывающихся» в противоположном направлении; В интронных областях есть «дополнительные» промоторы, которые способны запускать синтез РНК с разных точек гена (альтернативная транскрипция); Альтернативный сплайсинг – вырезание разных интронов из одной и той же молекулы гя. РНК – в результате образуются разные м. РНК
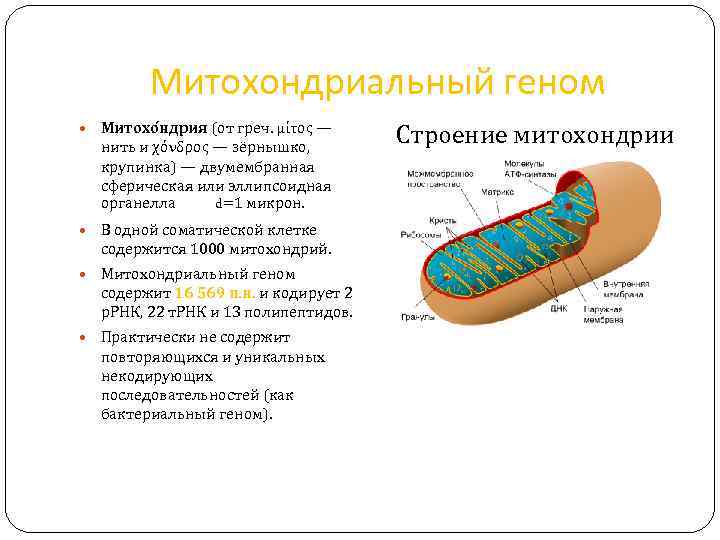
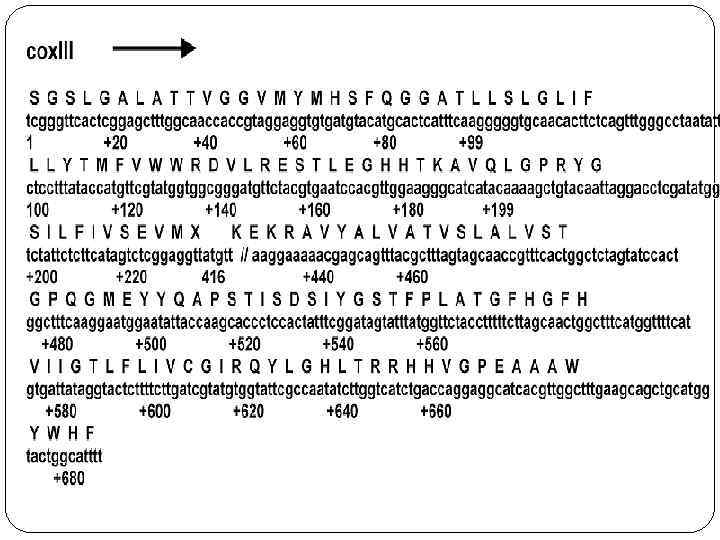
Митохондриальный геном Митохо ндрия (от греч. μίτος — нить и χόνδρος — зёрнышко, крупинка) — двумембранная сферическая или эллипсоидная органелла d=1 микрон. В одной соматической клетке содержится 1000 митохондрий. Митохондриальный геном содержит 16 569 п. н. и кодирует 2 р. РНК, 22 т. РНК и 13 полипептидов. Практически не содержит повторяющихся и уникальных некодирующих последовательностей (как бактериальный геном). Строение митохондрии
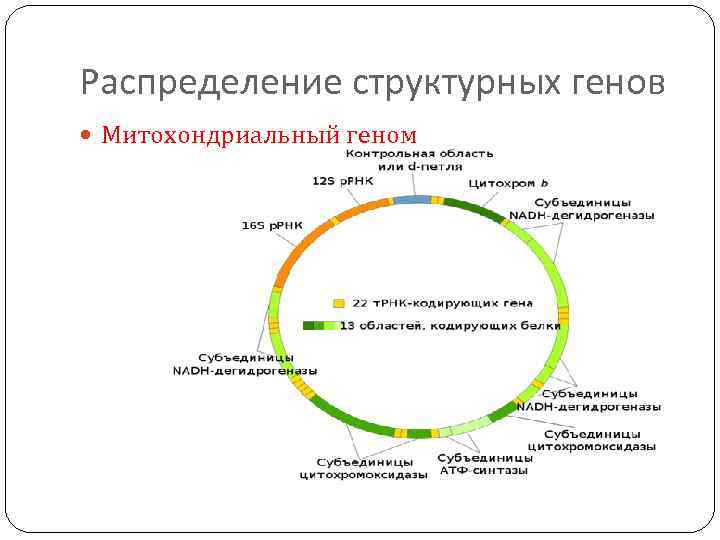
Распределение структурных генов Митохондриальный геном

Особенности митохондриального генома 1) мт. ДНК наследуется по материнскому типу (доля отцовских митохондрий в зиготе – от 0 до 4, материнских – до 2500 после оплодотворения репликация отцовских митохондрий блокируется); 2) комбинативная изменчивость (мейоз) отсутствует (мт. ДНК меняется только в результате мутаций); 3) митохондриальный геном непрерывен, он практически не содержит интронов (известен один интрон - -около 1000 нукеотидов); 4) в мт. ДНК нет гистонов и отсутствует система репарации ДНК (высокая скорость мутирования); 5) внутри одной клетки могут функционировать митохондрии с разными типами мт. ДНК – гетероплазмия; 6) в мт. ДНК транскрибируются обе цепи, причем код мт. ДНК несколько отличается от ядерного; 7) мутации мт. ДНК лежат в основе митохондриальных болезней, отличающихся от моногенных болезней не только особенностями передачи из поколения в поколения по материнской линии. Но и общими признаками клинической картины.

Митохондриальные болезни Описаны различные сочетания следующих клинических признаков: 1) повторные коматозные состояния, сопровождающиеся ацидозом крови и увеличением концентрации кетоновых тел; 2) задержка физического развития, нанизм; 3) дисфункция щитовидной железы; 4) симптомы поражения различных отделов нервной системы (судороги, атаксия, полинейропатия, изменение мышечного тонуса и др. ); 5) миопатии и кардиомиопатии; 6) витамин-D-резистентный рахит; 7) диарея, целиакие-подобный синдром; 8) печеночная недостаточность; 9) атрофия зрительных нервов; 10) панцитопения, анемия. Митохондриальные заболевания передаются только по женской линии к детям обоих полов. Патологические нарушения клеточного энергетического обмена могут проявляться в виде дефектов различных звеньев в цикле Кребса, дыхательной цепи, в процессах окисления. Не все ферменты и другие регуляторы, необходимые для эффективного функционирования митохондрий, кодируются митохондриальной ДНК. Большая часть митохондриальных функций контролируется ядерной ДНК. Можно выделить две группы митохондриальных заболеваний: Ярко выраженные наследственные синдромы, обусловленные мутациями генов, ответственных за митохондриальные белки (синдром Барта, синдром Кернса -Сейра и другие). Вторичные митохондриальные заболевания, включающие нарушение клеточного энергообмена как важное звено формирования патогенеза (болезни соединительной ткани, синдром хронической усталости, кардиомиопатия, мигрень, печеночная недостаточность и другие).

Геном как единое целое Несмотря на дискретное генетическое определение отдельных признаков, в индивидуальном развитии воссоздается единый сбалансированный комплекс признаков и свойств, соответствующий типу морфофункциональной организации конкретного биологического вида. Генные взаимодействия происходят на нескольких уровнях: 1. непосредственно в генетическом материале клеток, 2. между и. РНК и образующимися полипептидами в процессе биосинтеза белка, 3. между белками-ферментами одного метаболического цикла. Типы взаимодействия аллельных и неаллельных генов.
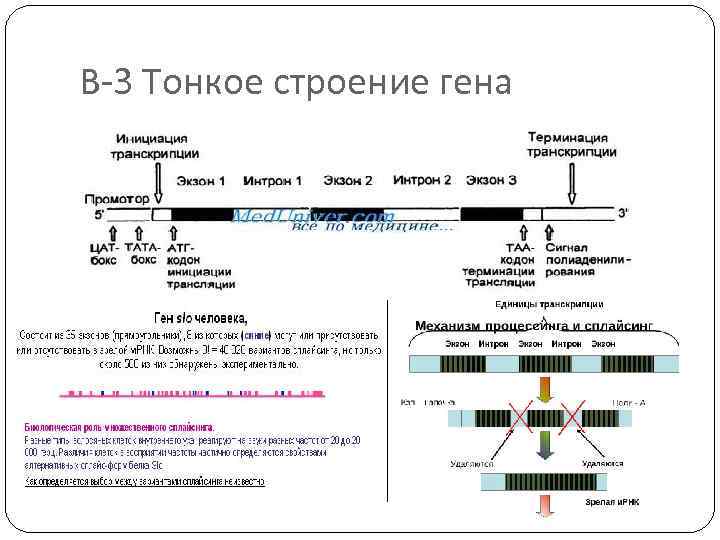
В-3 Тонкое строение гена
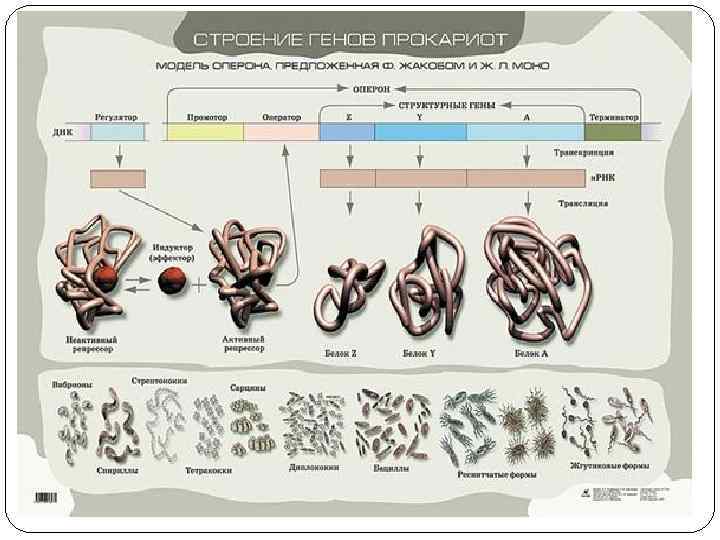
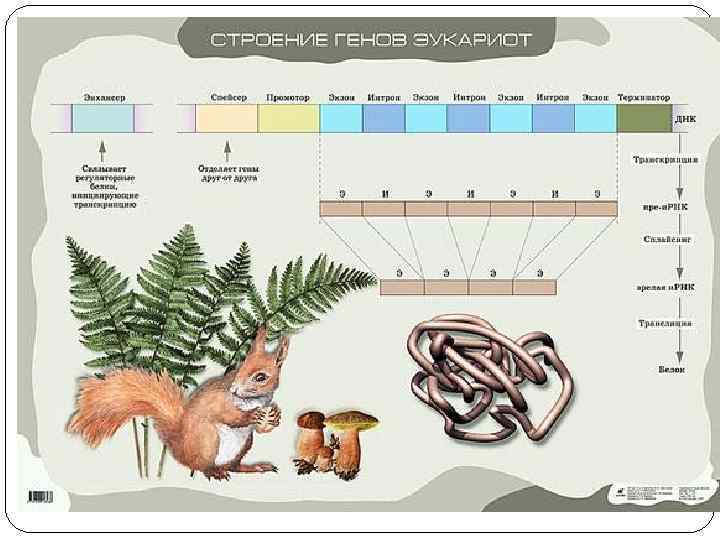

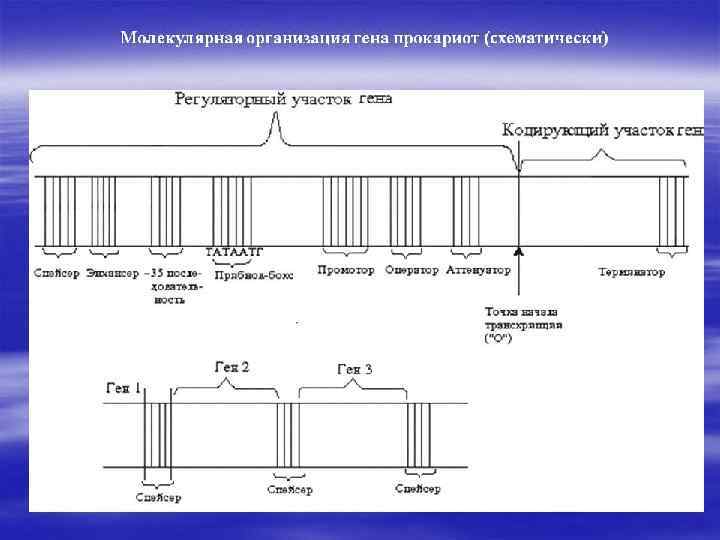

Регуляторные зоны - это участки ДНК на которых не происходит синтез РНК, но которые служат местом связывания различных белков (или РНК). Эти последовательности часто называют регуляторными зонами ( или регуляторные области, элементы, структуры, участки и др. ). Большинство учёных приходит к мнению, что наименьшей функциональной областью в ДНК является совокупность нуклеотидов, состоящая из структурного гена, регуляторных зон и регуляторных генов.

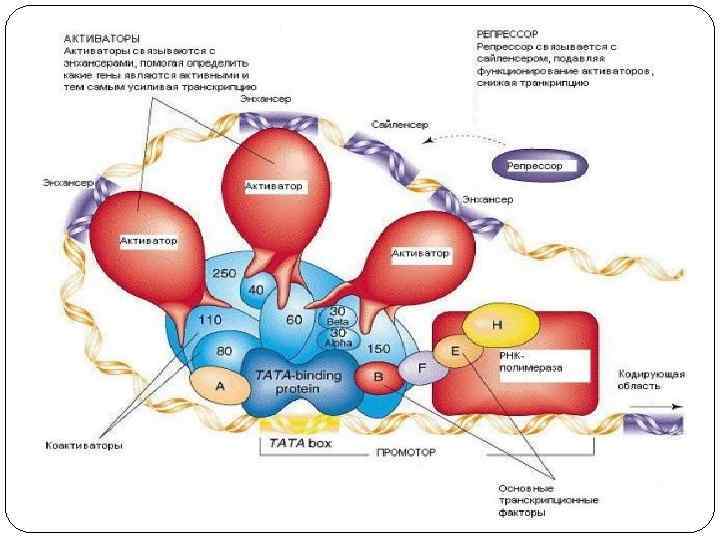
Регуляторные участки гена содержат: А. Стартовый кодон – сайт (место) начала транскрипции (распознает фермент). Б. Промотор (прикрепляется фермент) В. Контролирующие зоны располагаются вблизи от обслуживаемого гена (лидерную последовательность, трейлерную последовательность). Г. Модуляторы (энхансеры, сайленсеры) – располагаются вдали от гена. Д. Терминатор – сайт окончания транскрипции. Промотор - лидер - кодирующая последовательность – трейлер - терминатор

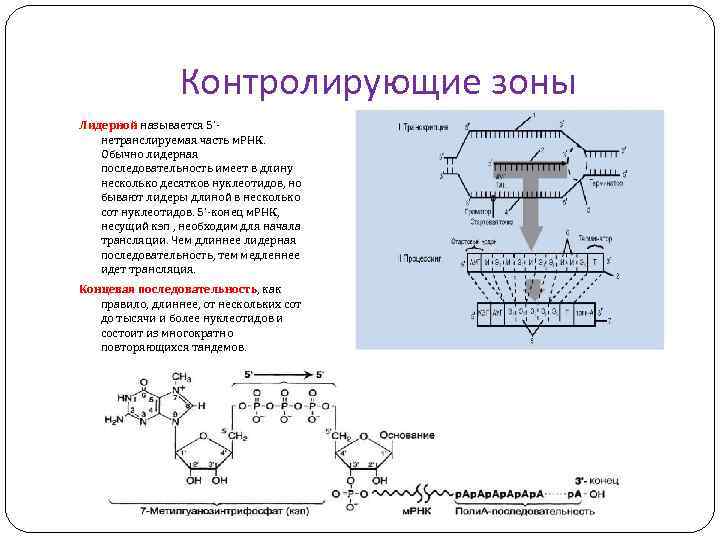
Контролирующие зоны Лидерной называется 5'нетранслируемая часть м. РНК. Обычно лидерная последовательность имеет в длину несколько десятков нуклеотидов, но бывают лидеры длиной в несколько сот нуклеотидов. 5'-конец м. РНК, несущий кэп , необходим для начала трансляции. Чем длиннее лидерная последовательность, тем медленнее идет трансляция. Концевая последовательность, как правило, длиннее, от нескольких сот до тысячи и более нуклеотидов и состоит из многократно повторяющихся тандемов.

Функции контролирующих зон Лидерная последовательность Трейлерная транскрибируется, но не транслируется, и может регулировать возможность самого процесса транскрипции. В случае необходимости «выключения» транскрипции м. РНК в области лидерной последовательности образуется «шпилька» и процесс транскрипции не идет. последовательность транскрибируется и служит сигналом формирования поли-(А) – хвостика при созревании м. РНК.
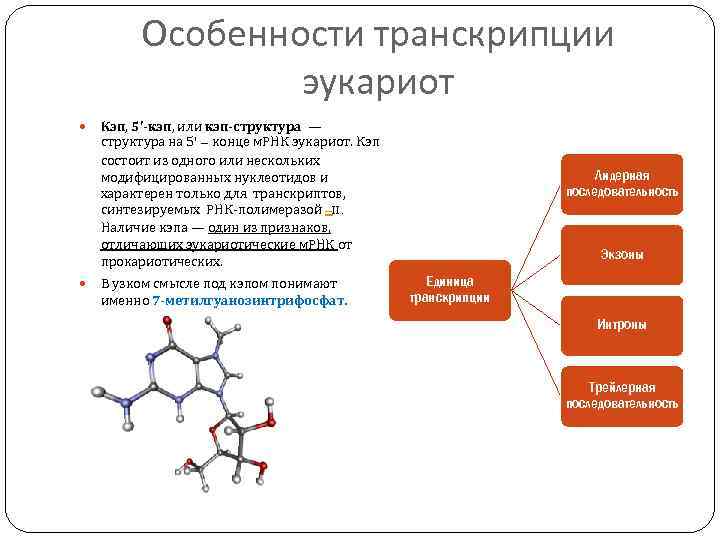
Особенности транскрипции эукариот Кэп, 5'-кэп, или кэп-структура — структура на 5’ – конце м. РНК эукариот. Кэп состоит из одного или нескольких модифицированных нуклеотидов и характерен только для транскриптов, синтезируемых РНК-полимеразой –II. Наличие кэпа — один из признаков, отличающих эукариотические м. РНК от прокариотических. В узком смысле под кэпом понимают именно 7 -метилгуанозинтрифосфат. Лидерная последовательность Экзоны Единица транскрипции Интроны Трейлерная последовательность

Роль хвоста поли-(А) Хвост поли-(А ) - полиаденильный хвост, некодируемая поли (А) последовательность эукариотических м. РНК длиной 100 -200 нуклеотидов, присоединяемая в процессе полиаденилирования. Предполагается, что полиаденильный хвост (наряду с расположенным с 5’-конца кэпом - белком-активатором катаболитных оперонов) обеспечивает более высокую стабильность м. РНК и ее защиту от действия экзонуклеаз. Полиаденилирование происходит непосредственно после терминации транскрипции. Специальный фермент - poly(A)полимераза присоединяет к 3'концу каждого РНК-транскрипта, от 100 до 200 остатков адениловой кислоты (poly(A)), что завершает процесс образования первичного РНК-транскрипта. Конкретные функции poly(A) неизвестны, но считается, что такой "хвост" способствует последующему процессингу РНК и экспорту зрелых молекул м. РНК из ядра.
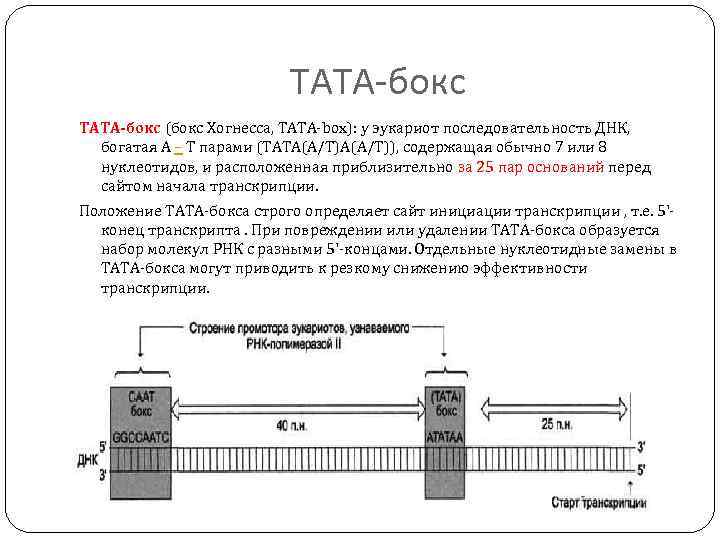
ТАТА-бокс TATA-бокс (бокс Хогнесса, TATA-box): у эукариот последовательность ДНК, богатая А – Т парами (ТAТA(A/Т)), содержащая обычно 7 или 8 нуклеотидов, и расположенная приблизительно за 25 пар оснований перед сайтом начала транскрипции. Положение TATA-бокса строго определяет сайт инициации транскрипции , т. е. 5'конец транскрипта. При повреждении или удалении TATA-бокса образуется набор молекул РНК с разными 5'-концами. Отдельные нуклеотидные замены в TATA-бокса могут приводить к резкому снижению эффективности транскрипции.
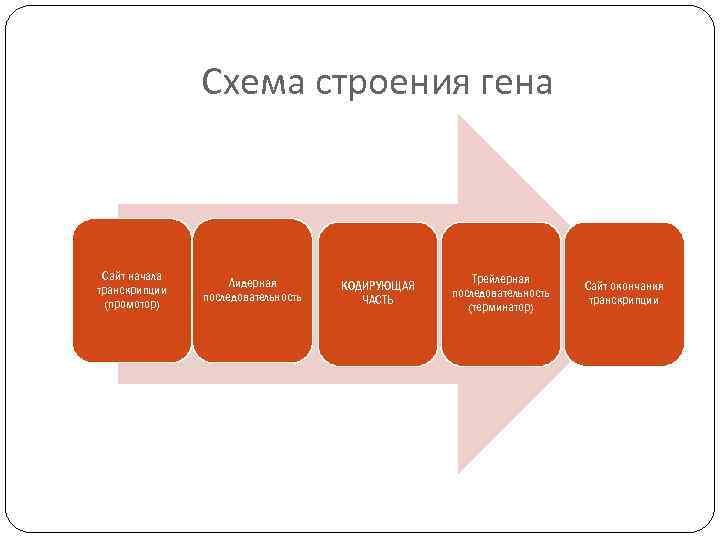
Схема строения гена Сайт начала транскрипции (промотор) Лидерная последовательность КОДИРУЮЩАЯ ЧАСТЬ Трейлерная последовательность (терминатор) Сайт окончания транскрипции

Виды регуляторных последовательностей Образование комплекса транскрипции и его активность в свою очередь контролируют ещё два типа белков-регуляторов. Первый тип белков осаждается на регуляторные (зоны) последовательности ДНК, которые располагаются, как правило, рядом с промотором. Эти белки ускоряют или тормозят образование транскрипционного комплекса. Регуляторные последовательности имеют различные названия. Чаще всего их объединяют термином – контролирующие зоны или цис-регуляторные элементы. К этой зоне относится лидерная последовательность, промотор и регуляторные зоны, располагающиеся рядом с промотором - рядом расположенные области. К контролирующим зонам присоединяются различные регуляторные белки, которые влияют на начальное связывание РНК-полимеразы с промотором. Эти белки носят специальное название –факторы транскрипции. Второй тип регуляторных последовательностей усиливает или тормозит движение транскрипционного комплекса по гену. У эукариот эти участки часто расположены далеко от контролируемого ими гена: - впереди от 5’- конца кодирующей области, но за несколько тысяч пар нуклеотидов от кодирующего участка, в самой кодирующей области или позади неё. В некоторых случаях их выявляют на других хромосомах. Как правило, на этих областях, также как и на контролирующих зонах, осаждаются регуляторные белки усиливающие или замедляющие транскрипцию. Эти регуляторные последовательности настолько разнообразны по строению, положению и функциям, что для большинства из них пока не найдено название. В последнее время некоторые учёные называют их модуляторы или транс-регуляторные элементы. К модуляторам относят энхансеры (усиливают транскрипцию с некоторых эукариотических промоторов) и сайленсеры (обладают противоположным действием по отношению к энхансерам), оказывающие дистанционное влияние на инициацию транскрипции независимо от своей ориентации относительно кодирующей области.

Факторы транскрипции РНК-полимераза эукариот не может самостоятельно инициировать транскрипцию. Для ее активации необходимо большое количество белков, называемых общими факторами транскрипции. Для РНК-полимеразы-II выделено 6 факторов транскрипции: TFIIA, TFIIB, TFIID, TFIIE, TFIIF, TFIIH. В составе TFIID содеражатся белки TBP (TATA-box binding protein). В состав транскрипционного комплекса TFIIF входит 14 полипептидов, которые помогают РНК-полимеразе разрушать нуклеосомы и декомпактизировать молекулу ДНК.

Виды РНК-полимераз • Считывает гены 18 S, 28 S, 5, 8 S рибосомных РНК PHK I • Считывает основную часть генов, кодирующих PHK II полипептиды, и гены малых РНК • Считывает гены 5 S рибосомальных РНК, гены PHK III транспортных РНК и малых РНК
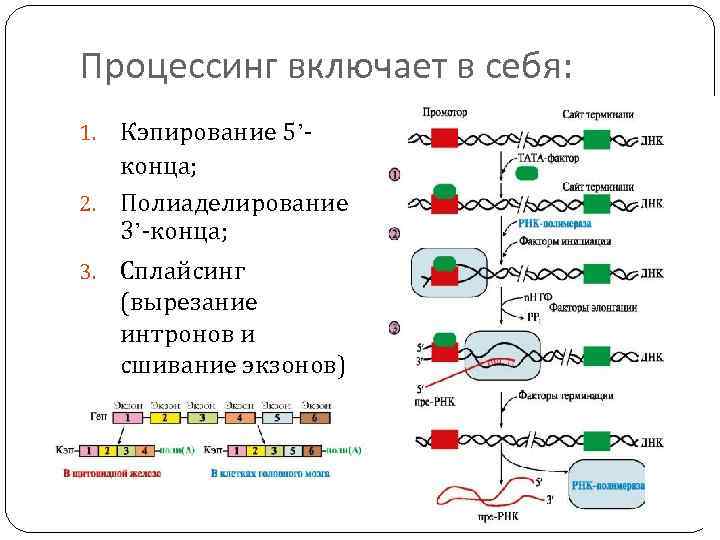
Процессинг включает в себя: Кэпирование 5’конца; 2. Полиаделирование 3’-конца; 1. 3. Сплайсинг (вырезание интронов и сшивание экзонов)
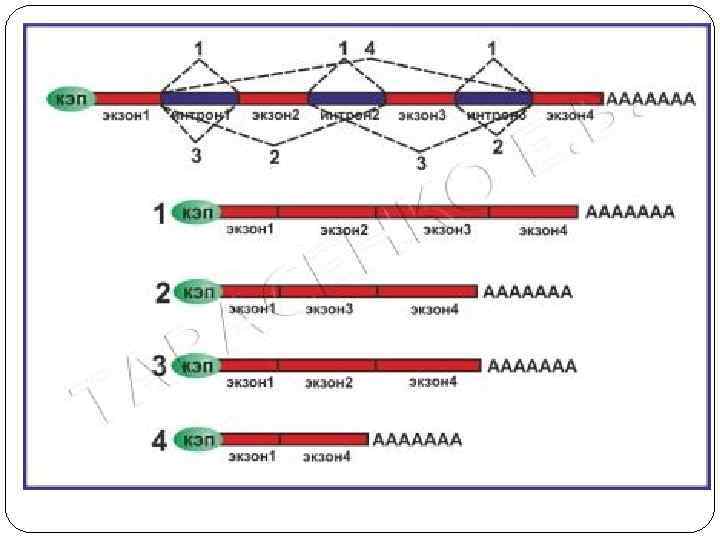

Экзон-интронная структура гена Экзоны – от 100 до 600 п. н. , их несколько десятков в гене. Термины «экзон» и «интрон» были введены У. Гилбертом в 1978 г. Интроны – имеют длину от нескольких десятков п. н. до нескольких тысяч. Составляют до 80% материала ДНК. Отделяются от экзонов парой ГТ на 5’-конце и парой АГ на 3’-конце.

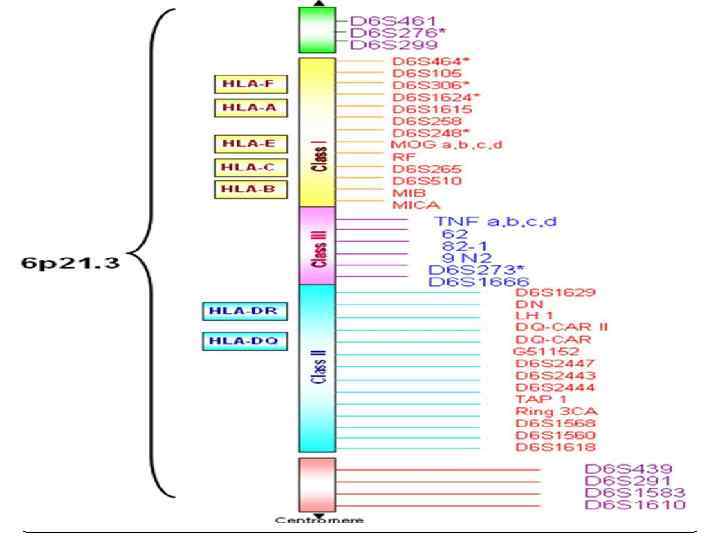
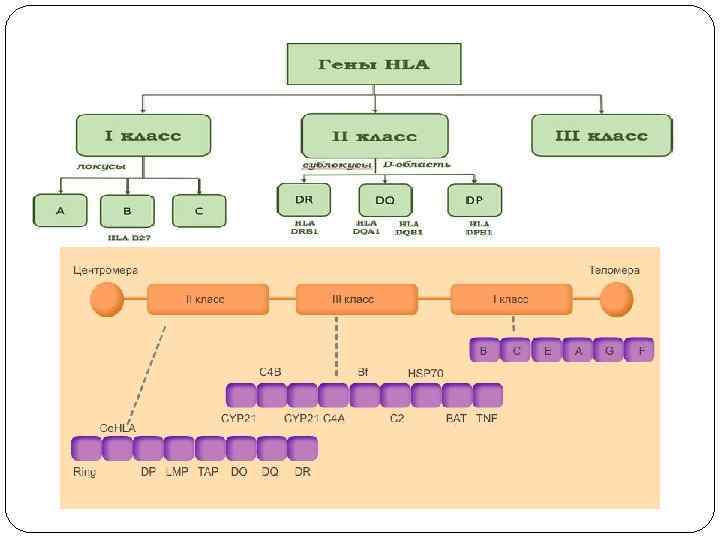
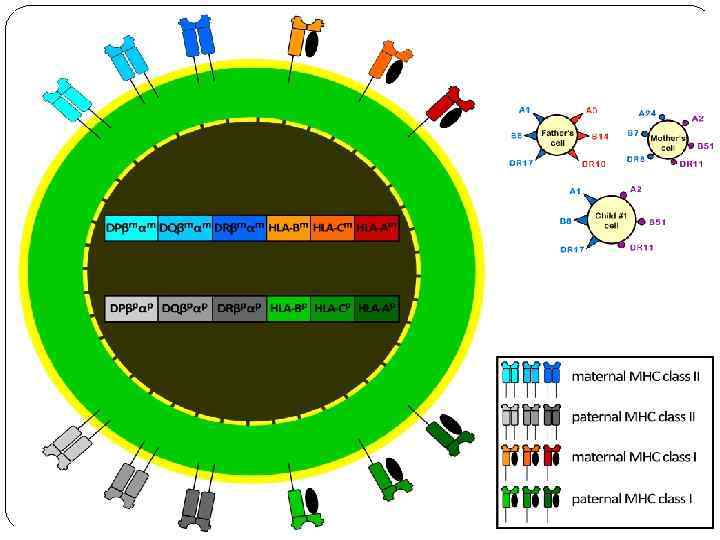
Мультигенные семейства генов Эти гены обычно сгруппированы в кластеры в определенных районах одной или нескольких хромосом и часто находятся под общим регуляторным контролем. Примерами мультигенных семейств могут служить гены рибосомальных и транспортных РНК, гены α - и β-глобинов, тубулина, миоглобина, интерферона и многих других. Особое место среди мультигенных семейств занимают супергены – очень большие кластеры из сотен функционально и структурно родственных генов. Классическим примером супергена служит HLA-комплекс, контролирующий главные антигены гистосовместимости. Он занимает район более 6000 тыс. п. н. на коротком плече хромосомы 6 и состоит из серии тесно сцепленных генов, ответственных за синтез множества белков, включающих клеточные поверхностные антигены, молекулы иммунного ответа и некоторые компоненты комплемента. К супергенам относятся три комплекса расположенных на разных хромосомах генов, контролирующих синтез тяжелых и легких цепей иммуноглобулинов.

Человеческие лейкоцитарные антигены Система генов тканевой совместимости человека ( HLA, Human Leucocyte Antigens) — группа антигенов гистосовместимости у людей. Представлены более, чем 150 антигенами. Локус, расположенный на в коротком плече 6 хромосомы, содержит большое количество генов, связанных с иммунной системой человека. Этими генами кодируются в том числе и антигенпредставляющие белки, расположенные на поверхности клетки.

Система HLA представляет собой индивидуальный набор различного типа белковых молекул, находящихся на поверхности клеток. Набор антигенов (HLA-статус) уникален для каждого человека. К первому классу МНС относятся молекулы типов HLA-A, -B и -C. Антигены первого класса системы HLA находятся на поверхности ЛЮБЫХ клеток. Для гена HLA-А известны около 60 вариантов, для HLA-B — 136, а для гена HLA-С — 38 разновидностей. Представителями МНС второго класса являются HLA-DQ, -DP и -DR. Антигены второго класса системы HLA находятся на поверхности только некоторых клеток ИМУННОЙ системы (в основном это лимфоциты и макрофаги). Для транплантации ключевое значение имеет полная совместимость по HLA-DR (по другим HLA-антигенам отсутствие совместимости менее значимо).

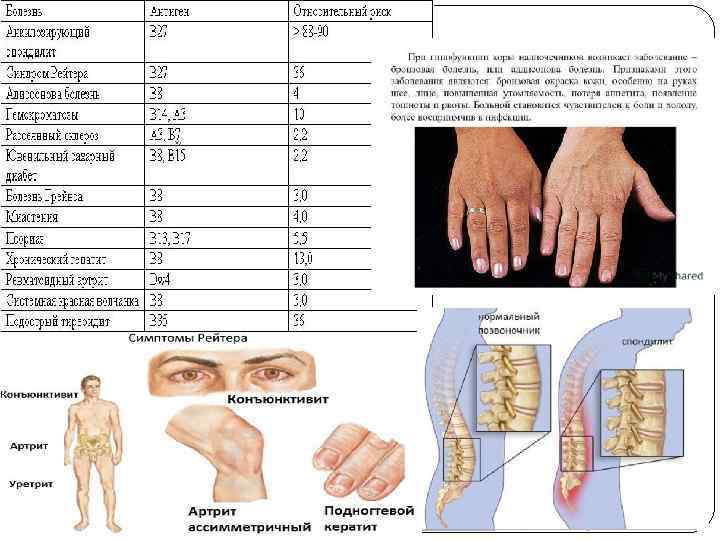
HLA-типирование – определение HLA-варианта Типирование на HLA-B 27 является, пожалуй, самым известным из всех. Этот антиген относится к MHC-I (молекулам главного комплекса гистосовместимости 1 -го класса), то есть находится на поверхности всех клеток. У здоровых европейцев антиген HLA-B 27 встречается всего в 8% случаев. Однако его наличие резко увеличивает (до 20 -30%) шансы заболеть ассиметричным олигоартритом (воспаление нескольких суставов) и (или) получить поражение крестцово-подвздошного сочленения (воспаление соединения между крестцом и тазовыми костями). Установлено, что HLA-B 27 встречается: у страдающих болезнью Бехтерева в 90 -95% случаев (это воспаление межпозвонковых суставов с последующим сращением позвонков), при реактивных (вторичных) артритах в 36 -100% (аутоиммунно-аллергическое воспаление суставов после некоторых мочеполовых и кишечных инфекций), при болезни (синдроме) Рейтера в 70 -85% (артрит + воспаление мочевыводящего канала + воспаление слизистой оболочки глаз), при псориатическом артрите в 54%, при энтеропатических артритах в 50% (артриты, связанные с поражением кишечника).

HLA-типирование для оценки риска сахарного диабета Ученые пришли к выводу, что некоторые аллели (варианты одного гена) могут обладать провоцирующим или защитным действием при сахарном диабете. Например, наличие B 8 или B 15 в генотипе по отдельности увеличивает риск диабета в 2 -3 раза, а совместно — в 10 раз. Присутствие определенных разновидностей генов может увеличивать риск заболевания сахарным диабетом 1 типа с 0, 4% до 6 -8%. Счастливые носители B 7 болеют диабетом в 14, 5 раз реже тех людей, у которых B 7 отсутствует. «Защитные» аллели в генотипе также способствуют более мягкому течению болезни в случае, если диабет всетаки разовьется. HLA-типирование позволяет установить риск развития сахарного диабета 1 типа. Наиболее информативны антигены HLA II класса: DR 3/DR 4 и DQ. У 50% больных СД I типа обнаружены HLA-антигены DR 4, DQB*0302 и/или DR 3, DQB*0201. При этом риск развития болезни возрастает многократно.

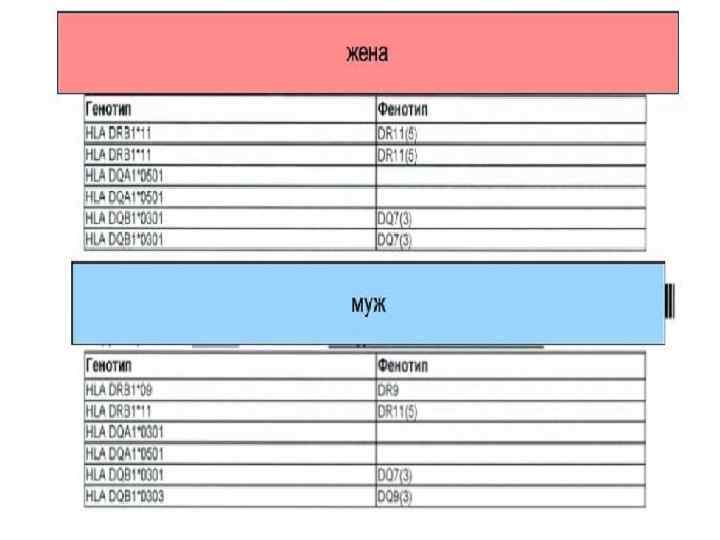
HLA-антигены и невынашивание беременности Одним из иммунологических факторов невынашивания беременности является совпадение по 3 и более общим антигенам HLA II класса. Антигены HLA II класса находятся преимущественно на клетках иммунной системы. Ребенок получает половину генов от отца и половину от матери. Для иммунной системы любые белки, кодируемые генами, являются антигенами и потенциально способны вызывать иммунный ответ. В начале беременности (первый триместр) чужеродные для организма матери отцовские антигены плода вызывают у матери выработку защитных (блокирующих) антител. Эти защитные антитела связываются с отцовскими HLA-антигенами плода, защищая их от клеток иммунной системы матери (натуральных киллеров) и способствуя нормальному протеканию беременности. Если же у родителей совпадает 4 и более антигена HLA II класса, то образование защитных антител резко снижается или не происходит. В этом случае развивающийся плод остается беззащитным от материнской иммунной системы, которая без защитных антител расценивает клетки эмбриона как скопление опухолевых клеток и старается их уничтожить (это естественный процесс, потому что в любом организме ежесуточно образуются опухолевые клетки, которые ликвидируются иммунной системой). В итоге наступает отторжение эмбриона и происходит выкидыш. Таким образом, для нормального протекания беременности нужно, чтобы супруги отличались HLAантигенами II класса. Также существует статистика, какие аллели (варианты) HLA-генов женщин и мужчин приводят к выкидышам чаще или реже.

Сроки развития наследственных болезней во многом зависят от функций вовлеченного в патологию гена: - гены, кодирующие транскриптационные факторы, могут проявиться во внутриутробном периоде (30% врожденных пороков развития); - гены, кодирующие ферменты (47% проявляется на первом году жизни; - гены, кодирующие модуляторы белковой индукции, в периоде до 50 лет. Количественное распределение генов, участвующих в основных процессах типичной клетки: синтез РНК и белков – 22%, клеточное деление – 12 %, клеточные сигналы – 12%, защита клетки – 12%, метаболизм – 17%, клеточные структуры – 8%, неизвестная функция – 17%.

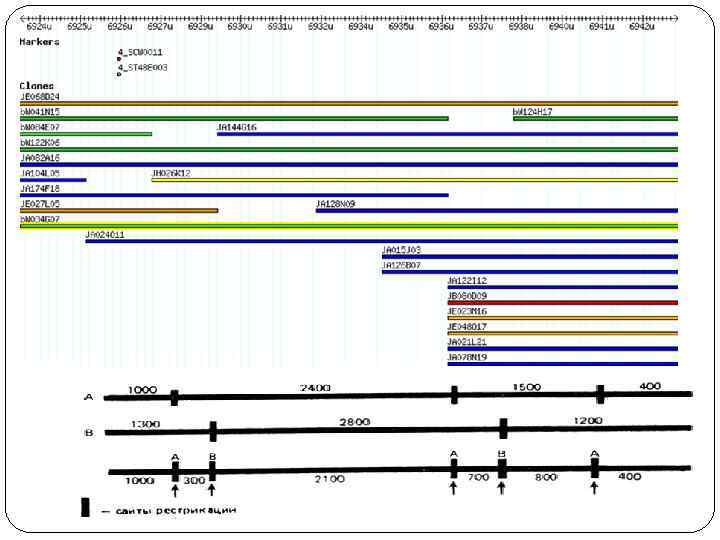
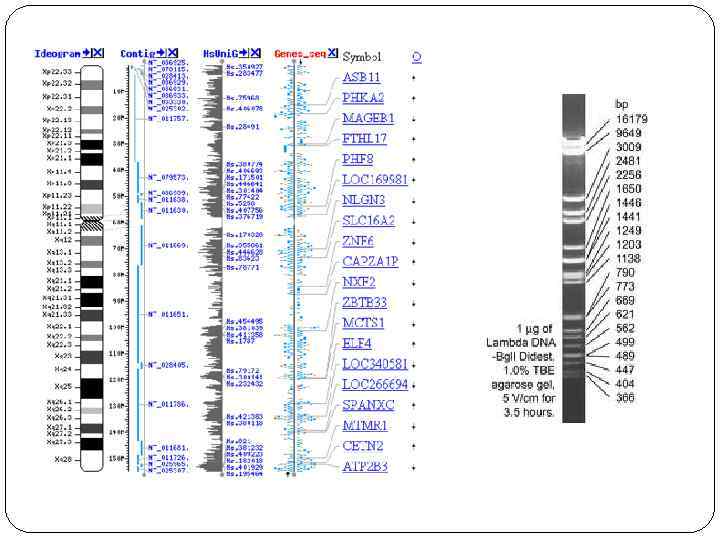
Карты хромосом Генети ческая ка рта — схема взаимного расположения структурных генов, регуляторных элементов и генетических маркеров, а также относительных расстояний между ними на хромосоме. Метод построения генетических карт называется генетическим картированием. Цитологическая карта — пространственное представление порядка взаимного расположения структурных элементов хромосом (например, их дифференциально окрашенных участков). Физическая карта — представление порядка следования физических маркеров (фрагментов молекулы ДНК), расстояние между которыми определяется в парах нуклеотидов (п. н. ). Рестрикционная карта — вид физической карты, на которой указан порядок следования и расстояния между сайтами расщепления ДНК-рестриктазами (обычно участок узнавания рестриктазы размером 4— 6 п. н. ). Маркерами этой карты являются рестрикционные фрагменты. Секвенсовые карты – вид карт, на которых указана последовательность нуклеотидов в ДНК. Конечной целью изучения генома определенного организма является интеграция его генетических, цитогенетических и физических карт , а также их привязка к полной геномной последовательности.
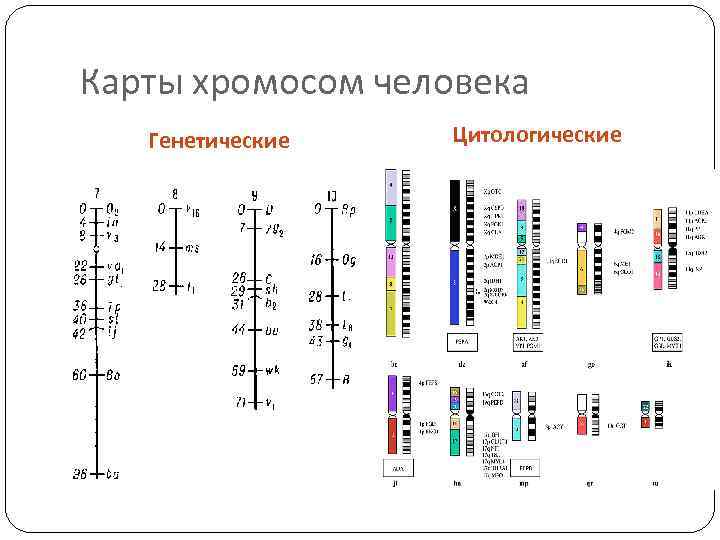
Карты хромосом человека Генетические Цитологические
для студентов Лекция 2. Геном человека.ppt