Slayd_k_l_2.ppt
- Количество слайдов: 17
 Лекция № 2 ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Лекция № 2 ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
 Термохимия - это область химической науки, изучающая тепловые эффекты реакций Термодинамика – наука о наиболее общих закономерностях протекания химических реакций (определение возмoжности или невозможности протекания реакций в определенных условиях)
Термохимия - это область химической науки, изучающая тепловые эффекты реакций Термодинамика – наука о наиболее общих закономерностях протекания химических реакций (определение возмoжности или невозможности протекания реакций в определенных условиях)
 Формы существования энергии: химическая, электрическая, механическая, ядерная, солнечная и др.
Формы существования энергии: химическая, электрическая, механическая, ядерная, солнечная и др.
 Энергия - это мера способности взаимодействия и движения материальных систем Другими словами Энергия - это мера способности совершать работу системой (или над системой) Энергия химических реакций способна превращаться в следующие виды энергии: например - электрическую, cветовую, тепловую
Энергия - это мера способности взаимодействия и движения материальных систем Другими словами Энергия - это мера способности совершать работу системой (или над системой) Энергия химических реакций способна превращаться в следующие виды энергии: например - электрическую, cветовую, тепловую
 CИСТЕМА Системой называют тело или группу тел, отделенных от окружающей среды реальной или воображаемой поверхностью раздела Типы системы: Открытая q m Изолированная q m Закрытая q m
CИСТЕМА Системой называют тело или группу тел, отделенных от окружающей среды реальной или воображаемой поверхностью раздела Типы системы: Открытая q m Изолированная q m Закрытая q m
 Параметры состояния cистемы: P, V, T, m или С (независимые термодинамические переменные) m PV = M RT Функции состояния системы: U, H, S, G … (зависят от термодинамических параметров состояния)
Параметры состояния cистемы: P, V, T, m или С (независимые термодинамические переменные) m PV = M RT Функции состояния системы: U, H, S, G … (зависят от термодинамических параметров состояния)
 Внутренняя энергия U Что такое внутренняя энергия системы ? U = Eкин. + Eпот. U = U 2 – U 1 Размерность внутренней энергии: Дж/моль или кал/моль; 1 кал = 4, 18 Дж
Внутренняя энергия U Что такое внутренняя энергия системы ? U = Eкин. + Eпот. U = U 2 – U 1 Размерность внутренней энергии: Дж/моль или кал/моль; 1 кал = 4, 18 Дж
 Переход системы из одного состояния в другое называется процессом. Различают процессы: изотермические (Т - const) изобарные (Р - const), изохорные (V - const). Передача энергии системе или от системы происходит в форме теплоты Q или в форме работы А. Теплота – это неупорядоченная форма передачи энергии Работа – это упорядоченная форма передачи энергии
Переход системы из одного состояния в другое называется процессом. Различают процессы: изотермические (Т - const) изобарные (Р - const), изохорные (V - const). Передача энергии системе или от системы происходит в форме теплоты Q или в форме работы А. Теплота – это неупорядоченная форма передачи энергии Работа – это упорядоченная форма передачи энергии
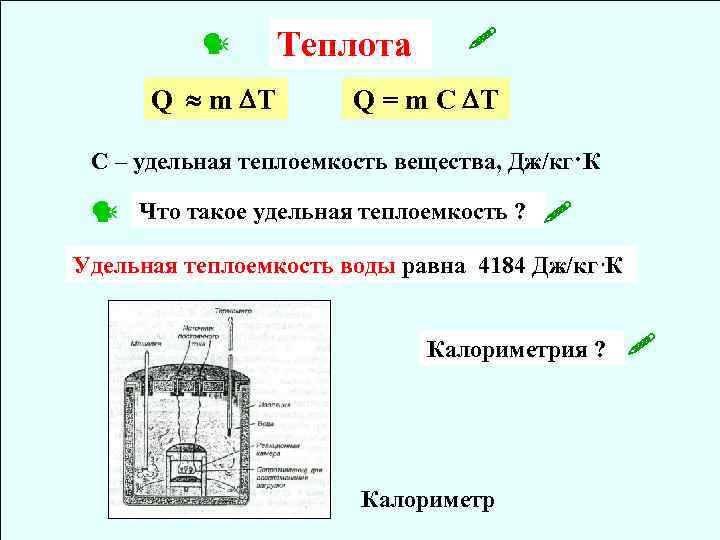 Q m T Теплота Q = m C T C – удельная теплоемкость вещества, Дж/кг·К Что такое удельная теплоемкость ? Удельная теплоемкость воды равна 4184 Дж/кг К Калориметрия ? Калориметр
Q m T Теплота Q = m C T C – удельная теплоемкость вещества, Дж/кг·К Что такое удельная теплоемкость ? Удельная теплоемкость воды равна 4184 Дж/кг К Калориметрия ? Калориметр
 Работа – мера энергии, переданная за счет перемещения масс под действием каких-либо сил. Работа, выполненная химической системой, равна: А = р(V 2 – V 1) = -р V
Работа – мера энергии, переданная за счет перемещения масс под действием каких-либо сил. Работа, выполненная химической системой, равна: А = р(V 2 – V 1) = -р V
 Тепловой эффект реакции Если к системе подводится тепло Q, оно распределяется на изменение внутренней энергии и на работу Q = U + р V Уравнение теплового эффекта реакции Изобарный процесс Изохорный процесс Qp = U + p V = (U 2 –U 1) + p (V 2 – V 1) Qv = U Qp = (U 2 + p. V 2) – (U 1 + p. V 1) Энтальпия Н (H = U + PV) Qp = H 2 – H 1 = H Энтальпия – это энергия, запасенная веществом при его образовании.
Тепловой эффект реакции Если к системе подводится тепло Q, оно распределяется на изменение внутренней энергии и на работу Q = U + р V Уравнение теплового эффекта реакции Изобарный процесс Изохорный процесс Qp = U + p V = (U 2 –U 1) + p (V 2 – V 1) Qv = U Qp = (U 2 + p. V 2) – (U 1 + p. V 1) Энтальпия Н (H = U + PV) Qp = H 2 – H 1 = H Энтальпия – это энергия, запасенная веществом при его образовании.
 Тепловой эффект реакции (Q) равен изменению внутренней энергии ( U) для изохорного процесса или изменению энтальпии ( H) для изобарного процесса. Тепловой эффект реакции (Q) – это количество теплоты, которое выделяется или поглощается в результате реакции между определенными количествами реагентов, задаваемых стехиометрическими коэффициентами Для химических реакций: Q (или Н) 50 -500 к. Дж/моль Для фазовых переходов: Q (или Н) 5 -50 к. Дж /моль
Тепловой эффект реакции (Q) равен изменению внутренней энергии ( U) для изохорного процесса или изменению энтальпии ( H) для изобарного процесса. Тепловой эффект реакции (Q) – это количество теплоты, которое выделяется или поглощается в результате реакции между определенными количествами реагентов, задаваемых стехиометрическими коэффициентами Для химических реакций: Q (или Н) 50 -500 к. Дж/моль Для фазовых переходов: Q (или Н) 5 -50 к. Дж /моль
 Экзотермические реакции Н < 0 Эндотермические реакции Н > 0 Н = – Н = Н 1 - Н 2 Н Н+ + ОН- – Н Н 2 О Стандартная энтальпия реакции: (р = 101325 Па (~105 Па), Т = 298 К (25 ºС) Н 298 или H
Экзотермические реакции Н < 0 Эндотермические реакции Н > 0 Н = – Н = Н 1 - Н 2 Н Н+ + ОН- – Н Н 2 О Стандартная энтальпия реакции: (р = 101325 Па (~105 Па), Т = 298 К (25 ºС) Н 298 или H
 Термохимические уравнения Si + O 2 = Si. O 2 уравнение химической реакции термохимическое уравнение Si(к) + O 2(г) = Si. O 2(к), H = – 860 к. Дж Si(к) + O 2(г) = Si. O 2(к) + 860 к. Дж Внимание! H – со знаком “минус”, Q - со знаком “плюс”
Термохимические уравнения Si + O 2 = Si. O 2 уравнение химической реакции термохимическое уравнение Si(к) + O 2(г) = Si. O 2(к), H = – 860 к. Дж Si(к) + O 2(г) = Si. O 2(к) + 860 к. Дж Внимание! H – со знаком “минус”, Q - со знаком “плюс”
 О стандартной энтальпии образования вещества ΔH°f (Br 2(ж)) = 0 ΔH°f (Br 2(г)) = 29 к. Дж/моль Н обр или H f Са. СО 3 Н обр = ? Cа. О(к) + СО 2(г) = Са. СО 3(к), ΔH° = – 175 к. Дж Са(к) + С(гр) + 3/2 О 2(г) = Са. СО 3(к), ΔH° = ?
О стандартной энтальпии образования вещества ΔH°f (Br 2(ж)) = 0 ΔH°f (Br 2(г)) = 29 к. Дж/моль Н обр или H f Са. СО 3 Н обр = ? Cа. О(к) + СО 2(г) = Са. СО 3(к), ΔH° = – 175 к. Дж Са(к) + С(гр) + 3/2 О 2(г) = Са. СО 3(к), ΔH° = ?
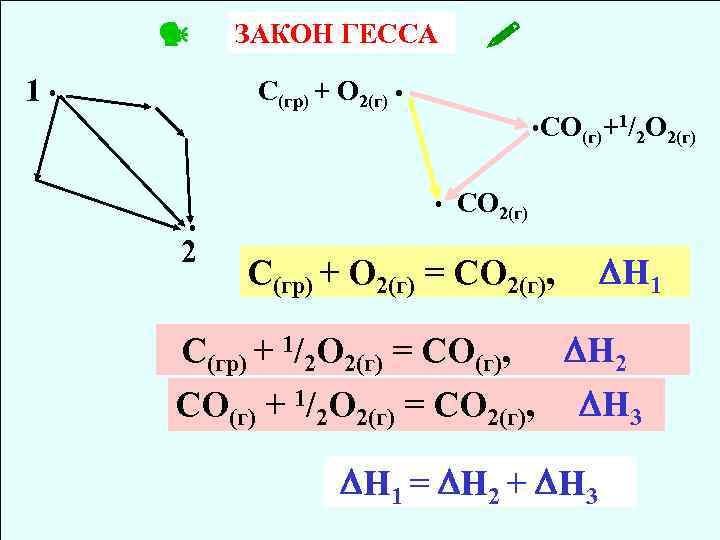 1 • ЗАКОН ГЕССА С(гр) + О 2(г) • • 2 • СO(г)+1/2 O 2(г) • СО 2(г) С(гр) + О 2(г) = СО 2(г), H 1 С(гр) + 1/2 О 2(г) = СО(г), H 2 CО(г) + 1/2 О 2(г) = СО 2(г), H 3 H 1 = H 2 + H 3
1 • ЗАКОН ГЕССА С(гр) + О 2(г) • • 2 • СO(г)+1/2 O 2(г) • СО 2(г) С(гр) + О 2(г) = СО 2(г), H 1 С(гр) + 1/2 О 2(г) = СО(г), H 2 CО(г) + 1/2 О 2(г) = СО 2(г), H 3 H 1 = H 2 + H 3
 СЛЕДСТВИЕ ИЗ ЗАКОНА ГЕССА H = ( Hобр)прод – ( Hобр)исх а. А + b. B = c. C + d. D H = c Hобр. С + d Hобр. D – а Hобр. А – b Hобр. B СН 4(г) + О 2(г) = СО 2(г) + 2 Н 2 О(г) H°обр, к. Дж/моль: – 75 0 – 393 H° = – 393 + 2(– 242) – (– 75) = – 802 к. Дж – 242
СЛЕДСТВИЕ ИЗ ЗАКОНА ГЕССА H = ( Hобр)прод – ( Hобр)исх а. А + b. B = c. C + d. D H = c Hобр. С + d Hобр. D – а Hобр. А – b Hобр. B СН 4(г) + О 2(г) = СО 2(г) + 2 Н 2 О(г) H°обр, к. Дж/моль: – 75 0 – 393 H° = – 393 + 2(– 242) – (– 75) = – 802 к. Дж – 242


