lecture_2-stud.ppt
- Количество слайдов: 64
ЛЕКЦИЯ 2 БЕЛКИ
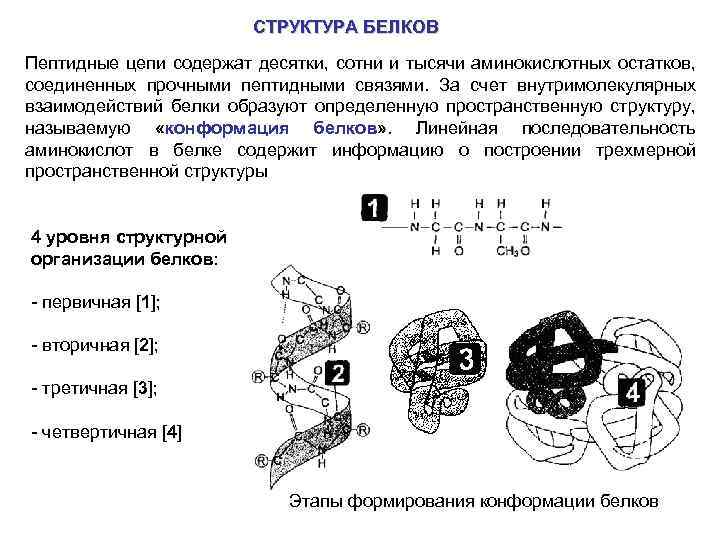
СТРУКТУРА БЕЛКОВ Пептидные цепи содержат десятки, сотни и тысячи аминокислотных остатков, соединенных прочными пептидными связями. За счет внутримолекулярных взаимодействий белки образуют определенную пространственную структуру, называемую «конформация белков» . Линейная последовательность аминокислот в белке содержит информацию о построении трехмерной пространственной структуры 4 уровня структурной организации белков: - первичная [1]; - вторичная [2]; - третичная [3]; - четвертичная [4] Этапы формирования конформации белков

ПЕРВИЧНАЯ СТРУКТУРА Аминокислотные остатки в пептидной цепи белков чередуются не случайным образом, а расположены последовательность в определённом аминокислотных остатков в порядке. Линейную полипептидной цепи называют «первичная структура белка» Первичная структура каждого индивидуального белка закодирована в участке ДНК, называемом геном. В процессе синтеза белка информация, находящаяся в гене, сначала переписывается на м. РНК, а затем, используя м. РНК в качестве матрицы, на рибосоме происходит сборка первичной структуры белка

МЕТОДЫ ИЗУЧЕНИЯ ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКА Установление первичной структуры белков включает 2 основных этапа: ►определение аминокислотного состава изучаемого белка; ►определение аминокислотной последовательности в белке Определение аминокислотного состава белка Первый этап в определении первичной структуры белков заключается в качественной и количественной оценке аминокислотного состава данного индивидуального белка Кислотный гидролиз белка Белок гидролизуют в 6 мол/л НСl при температуре около 110 °С в течение 24 ч. В результате такой обработки разрушаются пептидные связи в белке, а в гидролизате присутствуют только свободные аминокислоты. Кроме того, глутамин и аспарагин гидролизуются до глутаминовой и аспарагиновой кислот Изоэлектрическая точка белков

Разделение аминокислот с помощью ионообменной хроматографии Смесь аминокислот, полученных кислотным гидролизом белков, разделяют в колонке с катионообменной смолой. Такая синтетическая смола содержит прочно связанные с ней отрицательно заряженные группы (например, остатки сульфоновой кислоты -S 03 -), к которым присоединены ионы Na+ Обращенная распределительная ионобменная хроматография В катионообменник вносят смесь аминокислот в кислой среде (р. Н=3), где аминокислоты в основном представляют катионы, т. е. несут положительный заряд. Положительно заряженные аминокислоты присоединяются к отрицательно заряженным частицам смолы. Чем больше суммарный заряд аминокислоты, тем прочнее её связь со смолой. Лизин, аргинин и гистидин наиболее прочно связываются с катионообменником, а аспарагиновая и глутаминовая кислоты - наиболее слабо. Далее – элюирование АК буферным раствором с увеличивающейся ионной силой (т. е. с увеличением концентрации Na. Cl) и р. Н. Увеличение р. Н - элюат – фракции отдельных АК, далее реакция с нингидрином
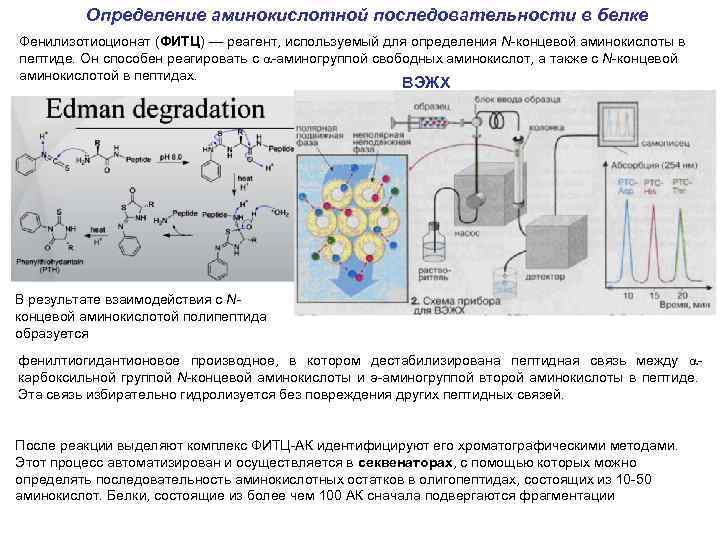
Определение аминокислотной последовательности в белке Фенилизотиоционат (ФИТЦ) — реагент, используемый для определения N-концевой аминокислоты в пептиде. Он способен реагировать с a-аминогруппой свободных аминокислот, а также с N-концевой аминокислотой в пептидах. ВЭЖХ В результате взаимодействия с Nконцевой аминокислотой полипептида образуется фенилтиогидантионовое производное, в котором дестабилизирована пептидная связь между aкарбоксильной группой N-концевой аминокислоты и а-аминогруппой второй аминокислоты в пептиде. Эта связь избирательно гидролизуется без повреждения других пептидных связей. После реакции выделяют комплекс ФИТЦ-АК идентифицируют его хроматографическими методами. Этот процесс автоматизирован и осуществляется в секвенаторах, с помощью которых можно определять последовательность аминокислотных остатков в олигопептидах, состоящих из 10 -50 аминокислот. Белки, состоящие из более чем 100 АК сначала подвергаются фрагментации

А. растворимость белков зависит от концентрации солей. В дистиллированной воде они растворяются плохо, однако по мере возрастания ИС их рас-ть возрастает. Используют обычно (NH 4)2 SO 4 Б. Диализ обычно используют для очистки белков от примесей В. Гель-фильтрация позволяет разделить молекулы по величине и форме. Размер частиц геля 10 -500 мкм. В частицах геля есть каналы определенного диаметра. Элюирование осуществляют буферным раствором. Большие молекулы не способны проникать в поры геля и выходят первыми. Г. Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (ДСНПААГ). Основан на свойстве заряженных молекул передвигаться под действием внешнего ЭМ поля. На первой стадии белки денатурируют ДСН = SDS = (С 12 H 25 OSO 3 Na), добавляют тиолы. Есть еще двумерный электрофорез Скорость перемещения частиц Уравнение Стокса Z – число единиц заряда у частицы, е – заряд электрона, Е – напряженность внешнего поля, f – коэфф. вязкого трения частиц, n – вязкость среды, r – радиус сферической частицы и известной Mw и плотностью Д. РСА, Е. Двумерный ЯМР (bio-NMR-NOESY)

Расщепление пептидов на фрагменты - используются разные расщепляющие агенты (ферменты или химические вещества) - в разных пробах очищенного полипептида, можно получить частично перекрывающие друга фрагменты с установленной аминокислотной последовательностью. С их помощью можно воссоздать правильный порядок фрагментов и получить полную последовательность аминокислот в полипептидной цепи. Ферментативное расщепление полипептида по специфическим участкам трипсин (пищеварительный/протеолитический фермент поджелудочной железы) высокая специфичность действия, расщепляет пептидные связи, в образовании которых участвует карбоксильная группа остатков лизина или аргинина Исходя из установленного количества остатков лизина и аргинина, можно предсказать количество получаемых при гидролизе трипсином фрагментов Если в полипептидной цепи имеется 6 неконцевых остатков аргинина и лизина, то при расщеплении трипсином можно получить 7 фрагментов. Затем в каждом фрагменте устанавливают аминокислотную последовательность
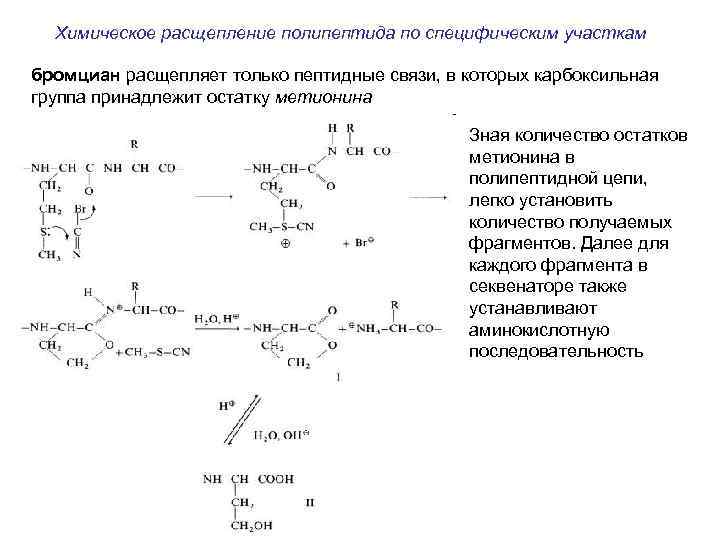
Химическое расщепление полипептида по специфическим участкам бромциан расщепляет только пептидные связи, в которых карбоксильная группа принадлежит остатку метионина Зная количество остатков метионина в полипептидной цепи, легко установить количество получаемых фрагментов. Далее для каждого фрагмента в секвенаторе также устанавливают аминокислотную последовательность

Получение аминокислотной последовательности полипептида с помощью перекрывающихся фрагментов Получение пептидов с перекрывающимися аминокислотными последовательностями: - обработка отдельных проб полипептида разными реагентами, расщепляющими белок в разных местах; - нужно провести столько расщеплений, чтобы получить набор пептидов, обеспечивающих перекрывание всех участков, необходимых для определения последовательности исходного полипептида Пептиды, полученные при гидролизе белка трипсином Пептиды, полученные при гидролизе белка бромцианом
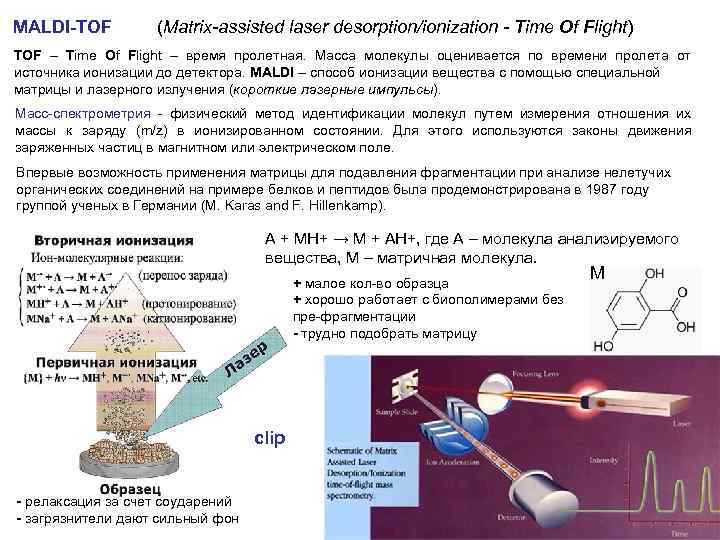
MALDI-TOF (Matrix-assisted laser desorption/ionization - Time Of Flight) TOF – Time Of Flight – время пролетная. Масса молекулы оценивается по времени пролета от источника ионизации до детектора. MALDI – способ ионизации вещества с помощью специальной матрицы и лазерного излучения (короткие лазерные импульсы). Масс-спектрометрия - физический метод идентификации молекул путем измерения отношения их массы к заряду (m/z) в ионизированном состоянии. Для этого используются законы движения заряженных частиц в магнитном или электрическом поле. Впервые возможность применения матрицы для подавления фрагментации при анализе нелетучих органических соединений на примере белков и пептидов была продемонстрирована в 1987 году группой ученых в Германии (M. Karas and F. Hillenkamp). А + МН+ → М + АН+, где А – молекула анализируемого вещества, М – матричная молекула. + малое кол-во образца + хорошо работает с биополимерами без пре-фрагментации - трудно подобрать матрицу clip - релаксация за счет соударений - загрязнители дают сильный фон М

КОНФОРМАЦИЯ БЕЛКОВ ►За счет взаимодействия функциональных групп аминокислот линейные полипептидные цепи индивидуальных белков приобретают определённую пространственную трёхмерную структуру, называемую «конформация» ►Все молекулы индивидуальных белков (т. е. имеющих одинаковую первичную структуру) образуют в растворе одинаковую конформацию ►вся информация, необходимая для формирования пространственных структур, находится в первичной структуре белков ► различают 2 основных типа конформаций полипептидных цепей: вторичную и третичную структуры Вторичная структура белков пространственная структура, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова. При этом пептидные цепи могут приобретать регулярные структуры двух основных типов: a-спираль и b-структура
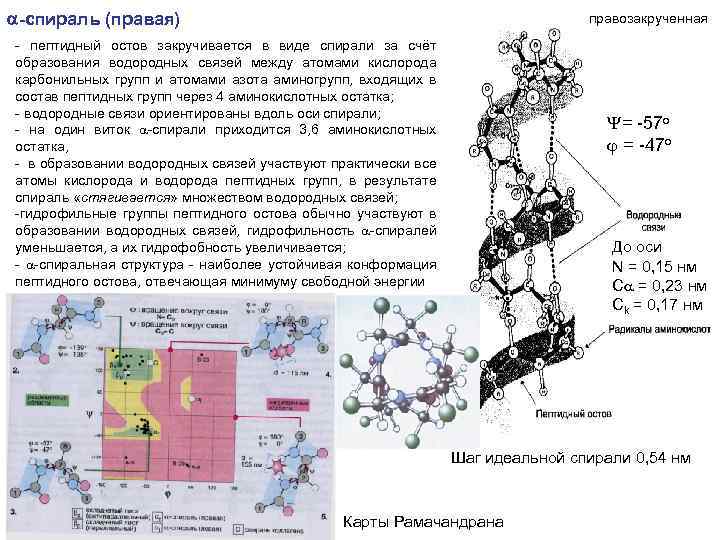
a-спираль (правая) правозакрученная - пептидный остов закручивается в виде спирали за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка; - водородные связи ориентированы вдоль оси спирали; - на один виток a-спирали приходится 3, 6 аминокислотных остатка, - в образовании водородных связей участвуют практически все атомы кислорода и водорода пептидных групп, в результате спираль «стягивается» множеством водородных связей; -гидрофильные группы пептидного остова обычно участвуют в образовании водородных связей, гидрофильность a-спиралей уменьшается, а их гидрофобность увеличивается; - a-спиральная структура - наиболее устойчивая конформация пептидного остова, отвечающая минимуму свободной энергии Y= -57 o = -47 o До оси N = 0, 15 нм Сa = 0, 23 нм Сk = 0, 17 нм Шаг идеальной спирали 0, 54 нм Карты Рамачандрана
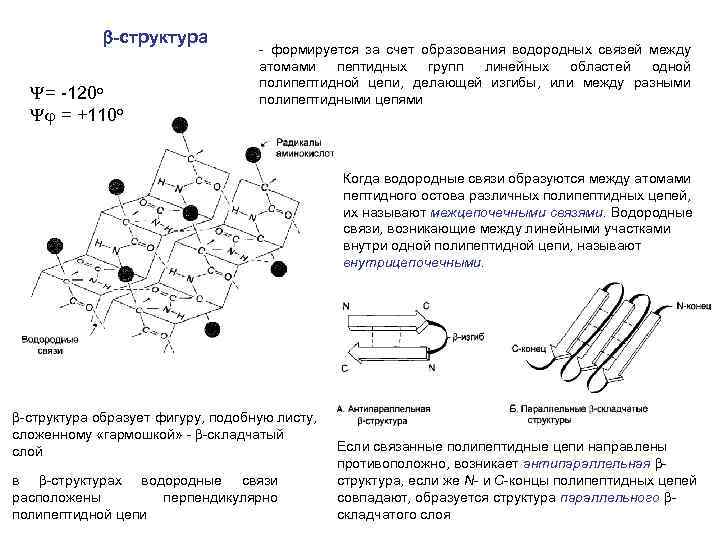
b-структура Y= -120 o Y = +110 o - формируется за счет образования водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными цепями Когда водородные связи образуются между атомами пептидного остова различных полипептидных цепей, их называют межцепочечными связями. Водородные связи, возникающие между линейными участками внутри одной полипептидной цепи, называют внутрицепочечными. b-структура образует фигуру, подобную листу, сложенному «гармошкой» - b-складчатый слой в b-структурах водородные связи расположены перпендикулярно полипептидной цепи Если связанные полипептидные цепи направлены противоположно, возникает антипараллельная bструктура, если же N- и С-концы полипептидных цепей совпадают, образуется структура параллельного bскладчатого слоя
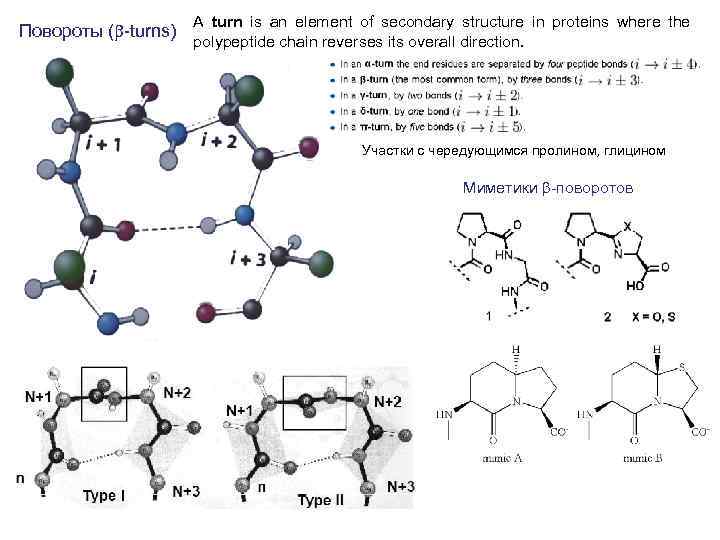
Повороты (b-turns) A turn is an element of secondary structure in proteins where the polypeptide chain reverses its overall direction. Участки с чередующимся пролином, глицином Миметики b-поворотов
![2 -azabicyclo[2. 2. 1]heptanes phenoxathiin 10, 10 -dioxide бензодиазепиноны Синтез по реакции УГИ модифицированной 2 -azabicyclo[2. 2. 1]heptanes phenoxathiin 10, 10 -dioxide бензодиазепиноны Синтез по реакции УГИ модифицированной](https://present5.com/presentation/12346603_224925379/image-16.jpg)
2 -azabicyclo[2. 2. 1]heptanes phenoxathiin 10, 10 -dioxide бензодиазепиноны Синтез по реакции УГИ модифицированной

Нерегулярные вторичные структуры - в белках отмечают области с нерегулярной вторичной структурой, которые часто называют беспорядочными клубками. Они представлены петлеобразными и кольцеобразными структурами, имеющими меньшую регулярность укладки, чем a-спирали и b-структуры, однако и они не так сильно варьируют от одной молекулы белка к другой; - в каждом индивидуальном белке они имеют свою фиксированную конформацию, определяемую аминокислотным составом данного участка цепи и окружающих его участков; Содержание разных типов вторичных структур в белках Содержание различных типов вторичных структур в разных белках неодинаково. По наличию a-спиралей и b-структур глобулярные белки можно разделить на 4 категории: 1. Только a-спирали (миоглобин (А) и гемоглобин (Б)), коллаген – фибриллярный белок (правозакрученная спираль из трех α-цепей)
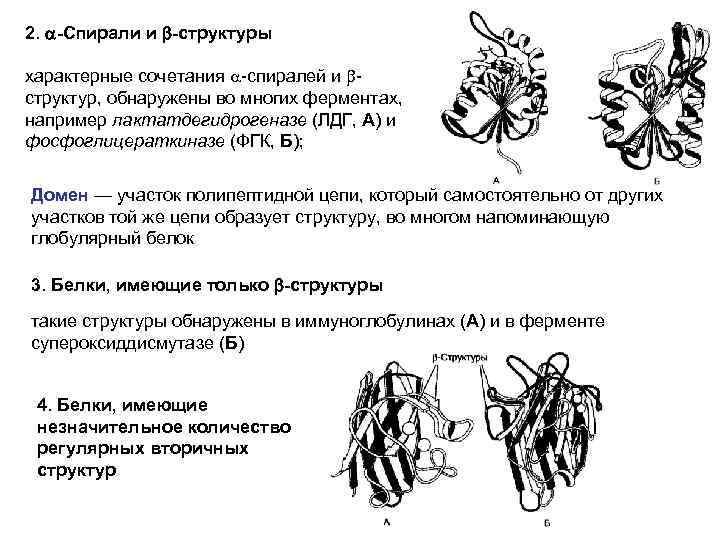
2. a-Спирали и b-структуры характерные сочетания a-спиралей и bструктур, обнаружены во многих ферментах, например лактатдегидрогеназе (ЛДГ, А) и фосфоглицераткиназе (ФГК, Б); Домен — участок полипептидной цепи, который самостоятельно от других участков той же цепи образует структуру, во многом напоминающую глобулярный белок 3. Белки, имеющие только b-структуры такие структуры обнаружены в иммуноглобулинах (А) и в ферменте супероксиддисмутазе (Б) 4. Белки, имеющие незначительное количество регулярных вторичных структур

Третичная структура белков — трёхмерная пространственная структура, образующаяся за счёт взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи Связи, участвующие в формировании третичной структуры белков 1. Гидрофобные взаимодействия - при укладке полипептидная цепь белка стремится принять энергетически выгодную форму, характеризующуюся минимумом свободной энергии. Поэтому гидрофобные радикалы аминокислот стремятся к объединению внутри глобулярной структуры растворимых в воде белков. Между ними возникают так называемые гидрофобные взаимодействия, а также силы ван дер Ваальса между близко прилегающими друг к другу атомами. В результате внутри белковой глобулы формируется гидрофобное ядро - гидрофильные группы пептидного остова при формировании вторичной структуры образуют множество водородных связей, благодаря чему исключается связывание с ними воды и разрушение внутренней, плотной структуры белка
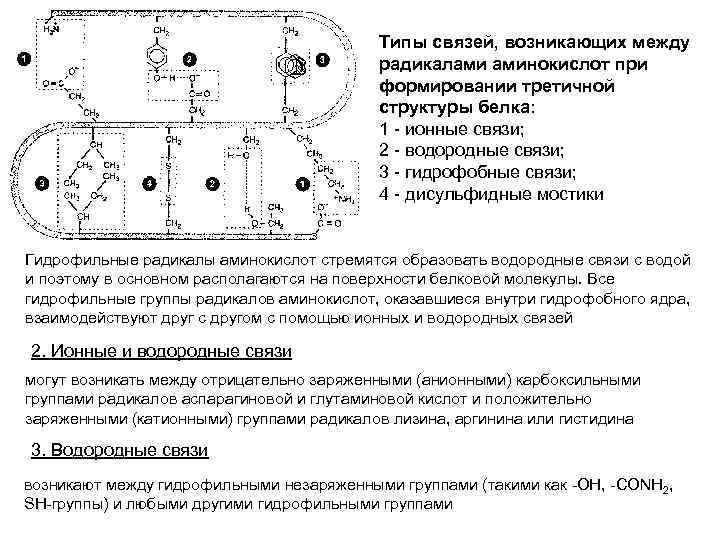
Типы связей, возникающих между радикалами аминокислот при формировании третичной структуры белка: 1 - ионные связи; 2 - водородные связи; 3 - гидрофобные связи; 4 - дисульфидные мостики Гидрофильные радикалы аминокислот стремятся образовать водородные связи с водой и поэтому в основном располагаются на поверхности белковой молекулы. Все гидрофильные группы радикалов аминокислот, оказавшиеся внутри гидрофобного ядра, взаимодействуют друг с другом с помощью ионных и водородных связей 2. Ионные и водородные связи могут возникать между отрицательно заряженными (анионными) карбоксильными группами радикалов аспарагиновой и глутаминовой кислот и положительно заряженными (катионными) группами радикалов лизина, аргинина или гистидина 3. Водородные связи возникают между гидрофильными незаряженными группами (такими как -ОН, -CONH 2, SH-группы) и любыми другими гидрофильными группами

Белки, функционирующие в неполярном (липидном) окружении, например белки мембран, имеют обратное устройство: гидрофильные радикалы аминокислот расположены внутри белка, в то время как гидрофобные аминокислоты локализованы на поверхности молекулы и контактируют с неполярным окружением. В каждом случае радикалы аминокислот занимают наиболее выгодное биоэнергетическое положение 4. Ковалентные связи Третичную структуру некоторых белков стабилизируют дисульфидные связи, образующиеся за счёт взаимодействия SH-групп двух остатков цистеина. Эти два остатка цистеина могут находиться далеко друг от друга в линейной первичной структуре белка, но при формировании третичной структуры они сближаются и образуют прочное ковалентное связывание радикалов Большинство внутриклеточных белков лишено дисульфидных связей. Однако такие связи распространены в белках, секретируемых клеткой во внеклеточное пространство. Эти связи стабилизируют конформацию белков вне клетки и предотвращают их денатурацию. К таким белкам относят гормон инсулин и иммуноглобулины
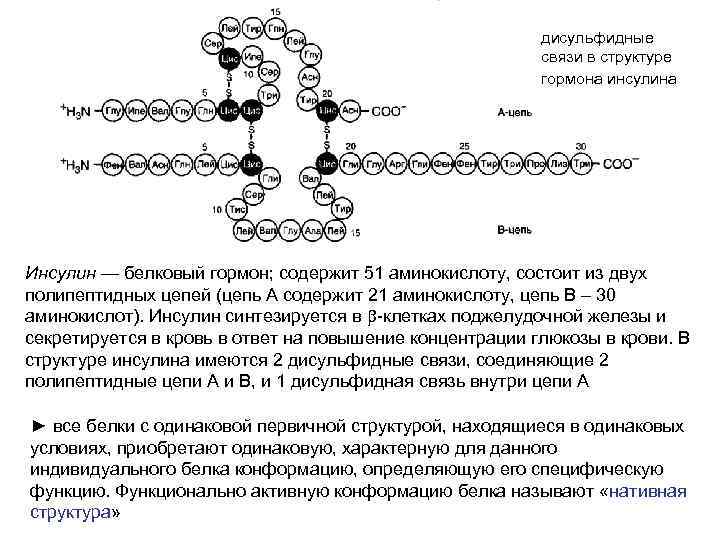
дисульфидные связи в структуре гормона инсулина Инсулин — белковый гормон; содержит 51 аминокислоту, состоит из двух полипептидных цепей (цепь А содержит 21 аминокислоту, цепь В – 30 аминокислот). Инсулин синтезируется в b-клетках поджелудочной железы и секретируется в кровь в ответ на повышение концентрации глюкозы в крови. В структуре инсулина имеются 2 дисульфидные связи, соединяющие 2 полипептидные цепи А и В, и 1 дисульфидная связь внутри цепи А ► все белки с одинаковой первичной структурой, находящиеся в одинаковых условиях, приобретают одинаковую, характерную для данного индивидуального белка конформацию, определяющую его специфическую функцию. Функционально активную конформацию белка называют «нативная структура»

Конформационная лабильность белков Гидрофобные взаимодействия, а также ионные и водородные связи относят к числу слабых, так как их энергия лишь ненамного превышает энергию теплового движения атомов при комнатной температуре (т. е. уже при данной температуре возможен разрыв таких связей). Поддержание характерной для белка конфоромации возможно благодаря возникновению множества слабых связей между различными участками полипептидной цепи Белки состоят из огромного числа атомов, находящихся в постоянном (броуновском) движении, что приводит к небольшим перемещениям отдельных участков полипептидной цепи, которые обычно не нарушают общую структуру белка и его функции. Следовательно, белки обладают конформационной лабильностью — склонностью к небольшим изменениям конформации за счёт разрыва одних и образования других слабых связей. Конформация белка может меняться при изменении химических и физических свойств среды, а также при взаимодействии белка с другими молекулами. При этом происходит изменение пространственной структуры не только участка, контактирующего с другой молекулой, но и конформации белка в целом. Конформационные изменения играют огромную роль в функционировании белков в живой клетке!

Денатурация белков Разрыв большого количества слабых связей в молекуле белка приводит к разрушению её нативной конформации. Так как разрыв связей под действием различных факторов носит случайный характер, то молекулы одного индивидуального белка приобретают в растворе форму случайно сформировавшихся беспорядочных клубков, отличающихся друг от друга трёхмерной структурой. Потеря нативной конформации сопровождается утратой специфической функции белков. Этот процесс носит название денатурации белков. При денатурации белков не происходит разрыва пептидных связей, т. е. первичная структура белка не нарушается В денатурированном белке гидрофобные радикалы, которые в нативной структуре молекулы спрятаны внутри гидрофобного ядра, оказываются на поверхности. При достаточно высокой концентрации белка и отсутствии сильного отталкивающего заряда молекулы могут объединяться друг с другом гидрофобными взаимодействиями, при этом растворимость белка снижается и происходит образование осадка. Компактная, плотная пространственная структура нативного белка при денатурации резко увеличивается в размерах и становится легко доступной для расщепления пептидных связей протеолитическими ферментами
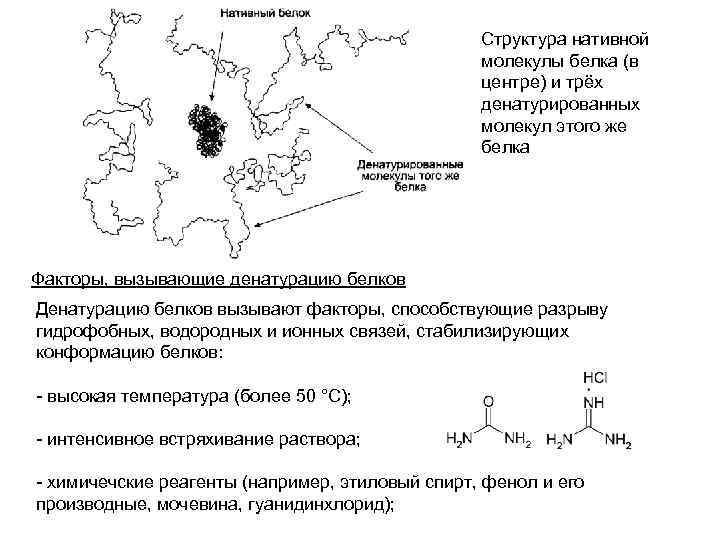
Структура нативной молекулы белка (в центре) и трёх денатурированных молекул этого же белка Факторы, вызывающие денатурацию белков Денатурацию белков вызывают факторы, способствующие разрыву гидрофобных, водородных и ионных связей, стабилизирующих конформацию белков: - высокая температура (более 50 °С); - интенсивное встряхивание раствора; - химичечские реагенты (например, этиловый спирт, фенол и его производные, мочевина, гуанидинхлорид);

мочевина или гуанидинхлорид образуют водородные связи с амино- и карбонильными группами пептидного остова и некоторыми функциональными группами радикалов аминокислот, происходит разрыв связей, участвующих в формировании вторичной и третичной структуры нативных белков, и образование новых связей с химическими реагентами - кислоты и щелочи, изменяя р. Н среды, вызывают перераспределение связей в молекуле белка; - соли тяжёлых металлов (такие как медь, ртуть, серебро, свинец и др. ) (образуют прочные связи с важными функциональными группами белков (чаще всего с -SH), изменяя их конформацию и активность); - детергенты — вещества, содержащие гидрофобный углеводородный радикал и гидрофильную функциональную группу (такие вещества называют амфифильными)

Медицинские аспекты конформационной лабильности белков Склонность большинства белков к денатурации в процессе их выделения, хранения и использования серьёзно затрудняет их получение и применение в медицине. Для правильного обращения с белковыми лекарственными препаратами к ним прикладывают инструкцию, в которой указывают условия их хранения и использования. Большинство белковых препаратов необходимо хранить в холодильнике при температуре не выше 10 °С, растворять сухие препараты охлаждённой до комнатной температуры кипячёной водой во избежание их денатурации Применение денатурирующих агентов в биологических исследованиях и медицине В биохимических исследованиях перед определением в биологическом материале низкомолекулярных соединений из раствора обычно удаляют белки. Для этой цели чаще всего используют трихлоруксусную кислоту. После её добавления в раствор денатурированные белки выпадают в осадок и легко удаляются фильтрованием. Трихлоруксусную кислоту можно также использовать для денатурации ферментов в целях прекращения ферментативной реакции
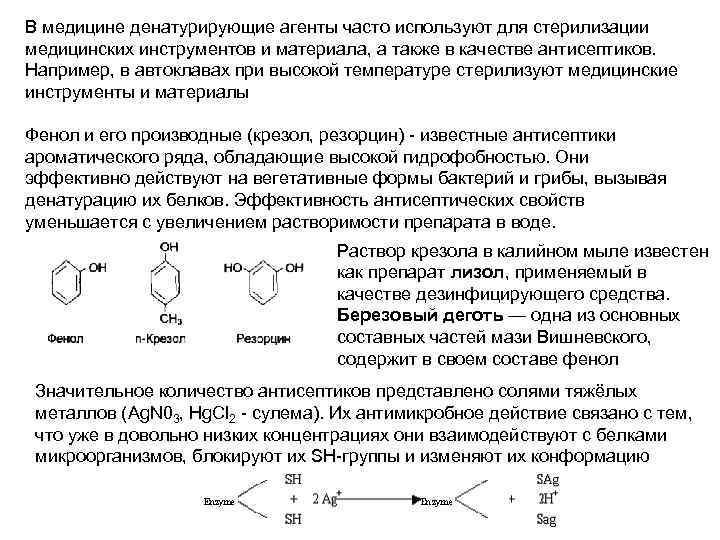
В медицине денатурирующие агенты часто используют для стерилизации медицинских инструментов и материала, а также в качестве антисептиков. Например, в автоклавах при высокой температуре стерилизуют медицинские инструменты и материалы Фенол и его производные (крезол, резорцин) - известные антисептики ароматического ряда, обладающие высокой гидрофобностью. Они эффективно действуют на вегетативные формы бактерий и грибы, вызывая денатурацию их белков. Эффективность антисептических свойств уменьшается с увеличением растворимости препарата в воде. Раствор крезола в калийном мыле известен как препарат лизол, применяемый в качестве дезинфицирующего средства. Березовый деготь — одна из основных составных частей мази Вишневского, содержит в своем составе фенол Значительное количество антисептиков представлено солями тяжёлых металлов (Ag. N 03, Hg. Cl 2 - сулема). Их антимикробное действие связано с тем, что уже в довольно низких концентрациях они взаимодействуют с белками микроорганизмов, блокируют их SH-группы и изменяют их конформацию

СУПЕРВТОРИЧНАЯ СТРУКТУРА БЕЛКОВ Пространственная структура каждого белка индивидуальна и определяется его первичной структурой. Однако сравнение конформаций разных по структуре и функциям белков выявило наличие у них похожих сочетаний элементов вторичной структуры. Такой специфический порядок формирования вторичных структур называют супервторичной структурой белков. Она формируется за счёт межрадикальных взаимодействий. Определённые характерные сочетания a-спиралей и b-структур часто обозначают как «структурные мотивы» Супервторичная структура типа a/b-бочонка Такая структура напоминает бочонок, где каждая b-структура расположена внутри и связана с a-спиральным участком полипептидной цепи, находящимся на поверхности молекулы. Супервторичную структуру в виде a/b-бочонка имеют некоторые ферменты, например триозофосфатизомераза (А) и один домен пируваткиназы (Б)
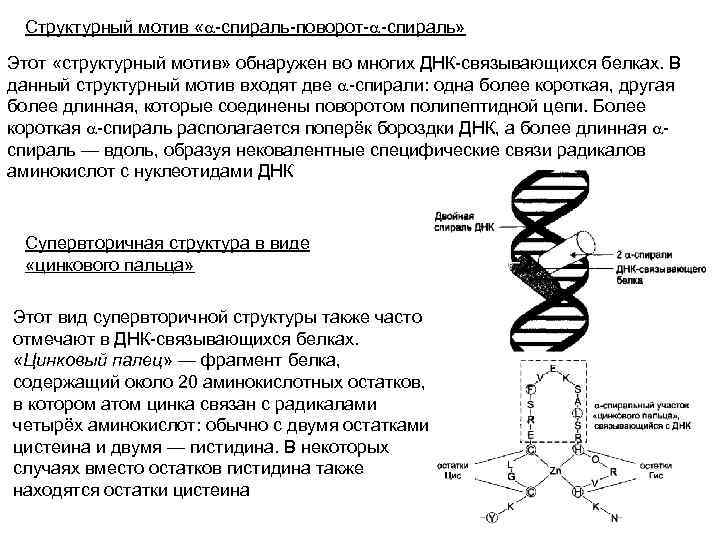
Структурный мотив «a-спираль-поворот-a-спираль» Этот «структурный мотив» обнаружен во многих ДНК-связывающихся белках. В данный структурный мотив входят две a-спирали: одна более короткая, другая более длинная, которые соединены поворотом полипептидной цепи. Более короткая a-спираль располагается поперёк бороздки ДНК, а более длинная aспираль — вдоль, образуя нековалентные специфические связи радикалов аминокислот с нуклеотидами ДНК Супервторичная структура в виде «цинкового пальца» Этот вид супервторичной структуры также часто отмечают в ДНК-связывающихся белках. «Цинковый палец» — фрагмент белка, содержащий около 20 аминокислотных остатков, в котором атом цинка связан с радикалами четырёх аминокислот: обычно с двумя остатками цистеина и двумя — гистидина. В некоторых случаях вместо остатков гистидина также находятся остатки цистеина
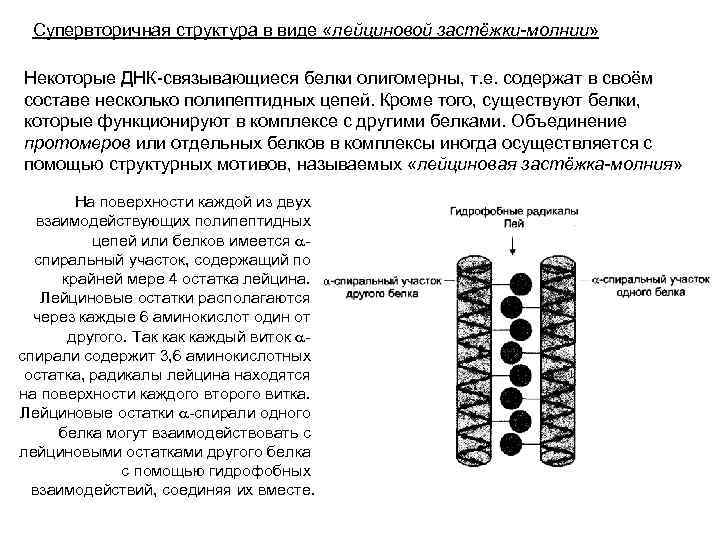
Супервторичная структура в виде «лейциновой застёжки-молнии» Некоторые ДНК-связывающиеся белки олигомерны, т. е. содержат в своём составе несколько полипептидных цепей. Кроме того, существуют белки, которые функционируют в комплексе с другими белками. Объединение протомеров или отдельных белков в комплексы иногда осуществляется с помощью структурных мотивов, называемых «лейциновая застёжка-молния» На поверхности каждой из двух взаимодействующих полипептидных цепей или белков имеется aспиральный участок, содержащий по крайней мере 4 остатка лейцина. Лейциновые остатки располагаются через каждые 6 аминокислот один от другого. Так каждый виток aспирали содержит 3, 6 аминокислотных остатка, радикалы лейцина находятся на поверхности каждого второго витка. Лейциновые остатки a-спирали одного белка могут взаимодействовать с лейциновыми остатками другого белка с помощью гидрофобных взаимодействий, соединяя их вместе.

ДОМЕННАЯ СТРУКТУРА БЕЛКОВ Если полипептидная цепь белка содержит более 150 -200 аминокислот, как правило, её пространственная структура сформирована в виде двух или более доменов. Домен — участок полипептидной цепи, который в процессе формирования пространственной структуры приобрёл независимо от других участков той же цепи конформацию глобулярного белка. Например, лёгкая цепь иммуноглобулина G состоит из двух доменов. В некоторых случаях доменами называют отдельные структурные участки полипептидной цепи. ЧЕТВЕРТИЧНАЯ СТРУКТУРА БЕЛКОВ Существуют белки, состоящие из двух и более полипептидных цепей. После формирования трёхмерной структуры каждой полипептидной цепи они объединяются с помощью тех же слабых взаимодействий, которые участвовали в образовании третичной структуры: гидрофобных, ионных, водородных. Количество и взаиморасположение полипептидных цепей в пространстве называют «четвертичная структура белков» . Отдельные полипептидные цепи в таком белке носят название протомеров, или субъединиц. Белок, содержащий в своём составе несколько протомеров, называют олигомерным.

В состав олигомерных белков может входить от двух до нескольких десятков протомеров, хотя наиболее часто встречают белки, содержащие от двух до четырёх полипептидных цепей (димерные, тетрамерные белки). Так, фермент гексокиназа содержит в своём составе 2 протомера; белок эритроцитов гемоглобин и фермент лактатдегидрогеназа - 4 протомера; фермент внутренней мембраны митохондрий цитохромоксидаза - 13 протомеров, а глутаминсинтетаза - 12 протомеров. Существуют многофункциональные комплексы, содержащие в своём составе несколько десятков полипептидных цепей, например пируватдегидрогеназный комплекс состоит из 312 протомеров!! Субъединичная структура глутаминсинтетазы Некоторые олигомерные белки содержат идентичные протомеры (например, гексокиназа), другие состоят из разных протомеров. По сравнению с индивидуальными мономерными белками олигомеры выполняют более сложные функции
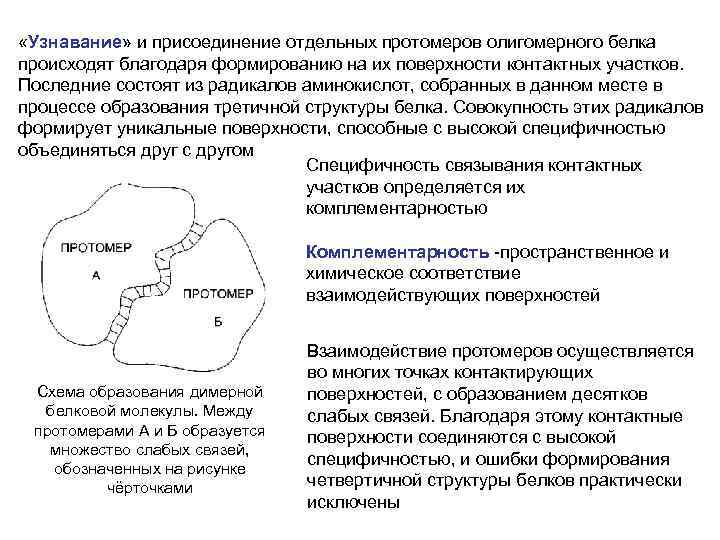
«Узнавание» и присоединение отдельных протомеров олигомерного белка происходят благодаря формированию на их поверхности контактных участков. Последние состоят из радикалов аминокислот, собранных в данном месте в процессе образования третичной структуры белка. Совокупность этих радикалов формирует уникальные поверхности, способные с высокой специфичностью объединяться друг с другом Специфичность связывания контактных участков определяется их комплементарноcтью Комплементарность -пространственное и химическое соответствие взаимодействующих поверхностей Схема образования димерной белковой молекулы. Между протомерами А и Б образуется множество слабых связей, обозначенных на рисунке чёрточками Взаимодействие протомеров осуществляется во многих точках контактирующих поверхностей, с образованием десятков слабых связей. Благодаря этому контактные поверхности соединяются с высокой специфичностью, и ошибки формирования четвертичной структуры белков практически исключены

Комплементарность — универсальный принцип, свойственный живой природе и лежащий в основе узнавания и соединения не только протомеров, но и других (не обязательно белковых) молекул!! ФОРМИРОВАНИЕ ТРЁХМЕРНОЙ СТРУКТУРЫ БЕЛКА В КЛЕТКЕ ►Формирование трёхмерной структуры белков — важнейший биологический процесс, так как от пространственной структуры белков зависит их биологическая функция! ► Процесс сворачивания полипептидной цепи в правильную пространственную структуру получил название «фолдинг белков» . ► Индивидуальные белки, продукты одного гена, имеют идентичную аминокислотную последовательность и приобретают в одинаковых условиях клетки одинаковую конформацию и функцию. Долгое время считалось, что процесс денатурации белков необратим. Однако оказалось, что некоторые очищенные и денатурированные белки способны в опытных условиях восстанавливать конформацию при удалении денатурирующих агентов, например рибонуклеаза.
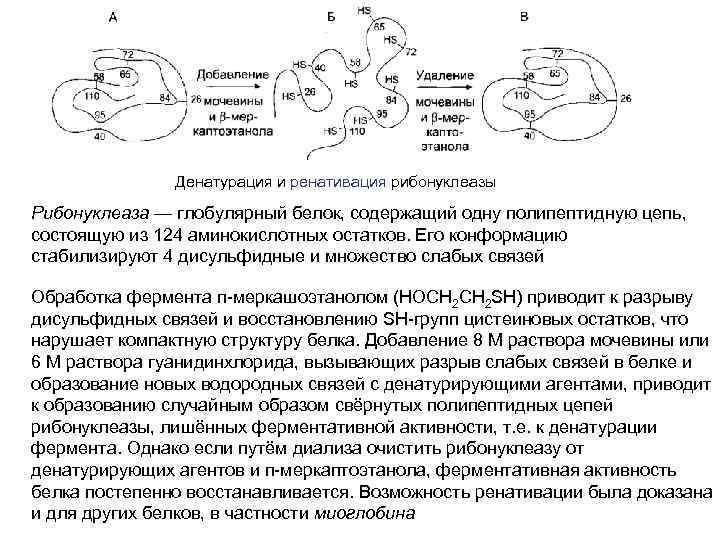
Денатурация и ренативация рибонуклеазы Рибонуклеаза — глобулярный белок, содержащий одну полипептидную цепь, состоящую из 124 аминокислотных остатков. Его конформацию стабилизируют 4 дисульфидные и множество слабых связей Обработка фермента п-меркашоэтанолом (НОСН 2 SH) приводит к разрыву дисульфидных связей и восстановлению SH-групп цистеиновых остатков, что нарушает компактную структуру белка. Добавление 8 М раствора мочевины или 6 М раствора гуанидинхлорида, вызывающих разрыв слабых связей в белке и образование новых водородных связей с денатурирующими агентами, приводит к образованию случайным образом свёрнутых полипептидных цепей рибонуклеазы, лишённых ферментативной активности, т. е. к денатурации фермента. Однако если путём диализа очистить рибонуклеазу от денатурирующих агентов и п-меркаптоэтанола, ферментативная активность белка постепенно восстанавливается. Возможность ренативации была доказана и для других белков, в частности миоглобина

Фундаментальный принцип молекулярной биологии: аминокислотная последовательность белков определяет их конформацию и специфическую функцию! Формирование пространственной структуры белка — самопроизвольный процесс, при котором белок стремится принять в данных условиях конформацию с наименьшей свободной энергией. Изменение условий окружающей среды или изменение первичной структуры данного белка (мутации или пост-трансляционные модификации) могут привести к изменению его конформации и функции. СТРУКТУРА И ФУНКЦИОНАЛЬНАЯ РОЛЬ ШАПЕРОНОВ В ФОЛДИНГЕ БЕЛКОВ В процессе синтеза полипептидных цепей, транспорта их через мембраны, при сборке олигомерных белков возникают промежуточные нестабильные конформации, склонные к агрегации. На вновь синтезированном полипептиде имеется множество гидрофобных радикалов, которые в трёхмерной структуре спрятаны внутри молекулы. Поэтому на время формирования нативной конформации реакционно-способные аминокислотные остатки одних белков должны быть отделены от таких же групп других белков.

Во всех известных организмах от прокариотов до высших эукариотов обнаружены белки, способные связываться с белками, находящимися в неустойчивом, склонном к агрегации состоянии. Они способны стабилизировать их конформацию, обеспечивая фолдинг белков. Эти белки получили название «шапероны» Классификации шаперонов (Ш) В соответствии с молекулярной массой все шапероны можно разделить на 6 основных групп: - высокомолекулярные, с молекулярной массой от 100 до 110 к. Д; - Ш-90 — с молекулярной массой от 83 до 90 к. Д; - Ш-70 — с молекулярной массой от 66 до 78 к. Д; - Ш-60; - Ш-40; - низкомолекулярные шапероны с молекулярной массой от 15 до 30 к. Д.

Среди шаперонов различают: конститутивные белки (высокий базальный синтез которых не зависит от стрессовых воздействий на клетки организма), и индуцибельные, синтез которых в нормальных условиях идёт слабо, но при стрессовых воздействиях на клетку резко увеличивается. Индуцибельные шапероны относят к «белкам теплового шока» , быстрый синтез которых отмечают практически во всех клетках, которые подвергаются любым стрессовым воздействиям. Роль шаперонов в фолдинге белков При синтезе белков N-концевая область полипептида синтезируется раньше, чем С-концевая область. Для формирования конформации белка нужна его полная аминокислотная последовательность. Поэтому в период синтеза белка на рибосоме защиту реакционноспособных радикалов (особенно гидрофобных) осуществляют Ш-70 (высококонсервативный класс белков, который присутствует во всех отделах клетки) Фолдинг многих высокомолекулярных белков, имеющих сложную конформацию (например, доменное строение), осуществляется в специальном пространстве, сформированном Ш-60. Он функционируют в виде олигомерного комплекса, состоящего из 14 субъединиц
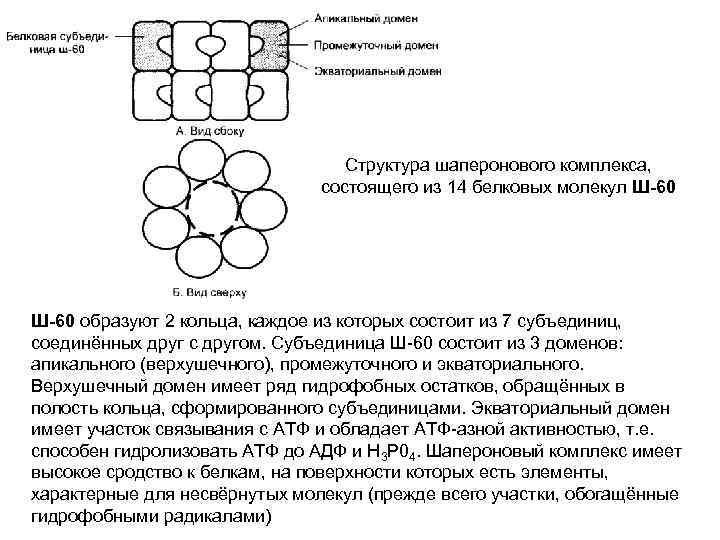
Структура шаперонового комплекса, состоящего из 14 белковых молекул Ш-60 образуют 2 кольца, каждое из которых состоит из 7 субъединиц, соединённых друг с другом. Субъединица Ш-60 состоит из 3 доменов: апикального (верхушечного), промежуточного и экваториального. Верхушечный домен имеет ряд гидрофобных остатков, обращённых в полость кольца, сформированного субъединицами. Экваториальный домен имеет участок связывания с АТФ и обладает АТФ-азной активностью, т. е. способен гидролизовать АТФ до АДФ и Н 3 Р 04. Шапероновый комплекс имеет высокое сродство к белкам, на поверхности которых есть элементы, характерные для несвёрнутых молекул (прежде всего участки, обогащённые гидрофобными радикалами)
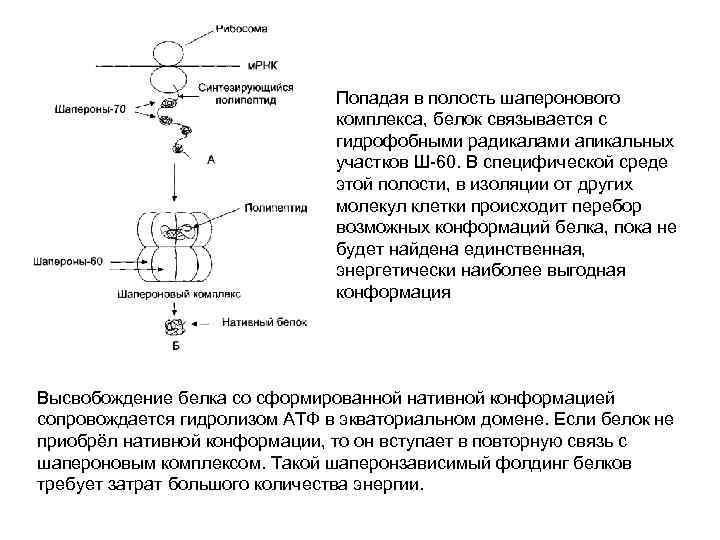
Попадая в полость шаперонового комплекса, белок связывается с гидрофобными радикалами апикальных участков Ш-60. В специфической среде этой полости, в изоляции от других молекул клетки происходит перебор возможных конформаций белка, пока не будет найдена единственная, энергетически наиболее выгодная конформация Высвобождение белка со сформированной нативной конформацией сопровождается гидролизом АТФ в экваториальном домене. Если белок не приобрёл нативной конформации, то он вступает в повторную связь с шапероновым комплексом. Такой шаперонзависимый фолдинг белков требует затрат большого количества энергии.

Белки теплового шока (БТШ) При действии различных стрессовых факторов (высокая температура, гипоксия, инфекция, УФО, изменение р. Н среды, изменение молярности среды, действие токсичных химических веществ, тяжёлых металлов и т. д. ) в клетках усиливается синтез БТШ. Имея высокое сродство к гидрофобным участкам частично денатурированных белков, они могут препятствовать их полной денатурации и восстанавливать нативную конформацию белков. Болезни, связанные с нарушением фолдинга белков Расчёты показали, что лишь небольшая часть теоретически возможных вариантов полипептидных цепей может принимать одну стабильную пространственную структуру. Большинство же таких белков может принимать множество конформаций с примерно одинаковой энергией Гиббса, но с различными свойствами. Первичная структура большинства известных белков, отобранных эволюцией, обеспечивает исключительную стабильность одной конформации. Однако некоторые растворимые в воде белки при изменении условий могут приобретать конформацию плохо растворимых, способных к агрегации молекул, образующих в клетках фибриллярные отложения, именуемые амилоидом (от лат. amylum — крахмал)

Это может происходить: - при гиперпродукции некоторых белков, в результате чего увеличивается их концентрация в клетке; - при попадании в клетки или образовании в них белков, способных влиять на конформацию других молекул белка; - при активации протеолиза нормальных белков организма, с образованием нерастворимых, склонных к агрегации фрагментов; - в результате точечных мутаций в структуре белка В результате отложения амилоида в органах и тканях нарушаются структура и функция клеток, наблюдают их дегенеративные изменения и разрастание соединительнотканных или глиальных клеток. Развиваются болезни, называемые амилоидозами. Для каждого вида амилоидоза характерен определённый тип амилоида. В настоящее время описано более 15 таких болезней

Болезнь Альцгеймера наиболее часто отмечаемый b-амилоидоз нервной системы, как правило, поражающий лиц преклонного возраста и характеризующийся прогрессирующим расстройством памяти и полной деградацией личности. В ткани мозга откладывается b-амилоид - белок, образующий нерастворимые фибриллы, нарушающие структуру и функции нервных клеток, b-амилоид — продукт изменения конформации нормального белка организма человека. b-амилоид образуется из более крупного предшественника частичным протеолизом и синтезируется во многих тканях. b-Амилоид, в отличие от своего нормального предшественника, содержащего много a-спиральных участков, имеет вторичную b-складчатую структуру, агрегирует с образованием нерастворимых фибрилл, устойчив к действию протеолитических ферментов Прионовые болезни Прионы — особый класс белков, обладающих инфекционными свойствами. Попадая в организм человека или спонтанно возникая в нём, они способны вызывать тяжёлые неизлечимые заболевания ЦНС, называемые прионовми болезнями. Название «прионы» происходит от аббревиатуры английской фразы proteinaceous infectious particle — белковая инфекционная частица.

Прионовый белок кодируется тем же геном, что и его нормальный аналог, т. е. они имеют идентичную первичную структуру. Однако два белка обладают различной конформацией: прионовый белок характеризуется высоким содержанием b-слоёв, в то время как нормальный белок имеет много acпиральных участков. Прионовый белок обладает устойчивостью к действию протеаз и, попадая в ткань мозга или образуясь там спонтанно, способствует превращению нормального белка в прионовый в результате межбелковых взаимодействий. Образуется «ядро полимеризации» , состоящее из агрегированных прионовых белков, к которому способны присоединяться новые молекулы нормального белка. В результате в их пространственной структуре происходят конформационные перестройки, характерные для прионовых белков.

ФУНКЦИОНИРОВАНИЕ БЕЛКОВ ► Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от всех остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных функций ► Необходимое условие для функционирования белков — присоединение к нему другого вещества, которое называют «лиганд» . Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы. Взаимодействие белка с лигандом высокоспецифично, что определяется строением участка белка, называемого центром связывания белка с лигандом или активным центром Активный центр белков — определённый участок белковой молекулы, как правило, находящийся в её углублении ( «кармане» ), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга.
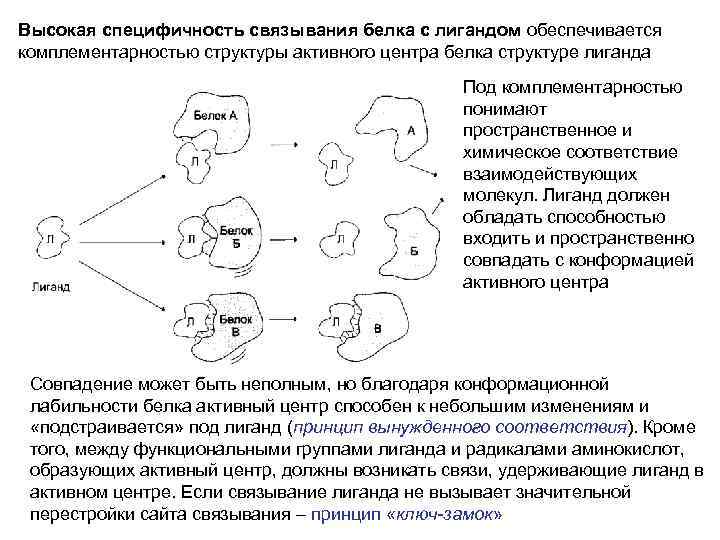
Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка структуре лиганда Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра Совпадение может быть неполным, но благодаря конформационной лабильности белка активный центр способен к небольшим изменениям и «подстраивается» под лиганд (принцип вынужденного соответствия). Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Если связывание лиганда не вызывает значительной перестройки сайта связывания – принцип «ключ-замок»
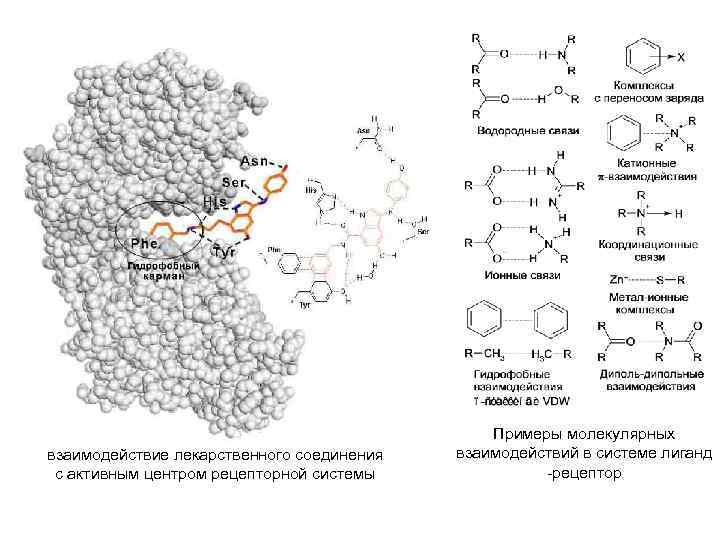
взаимодействие лекарственного соединения с активным центром рецепторной системы Примеры молекулярных взаимодействий в системе лиганд -рецептор
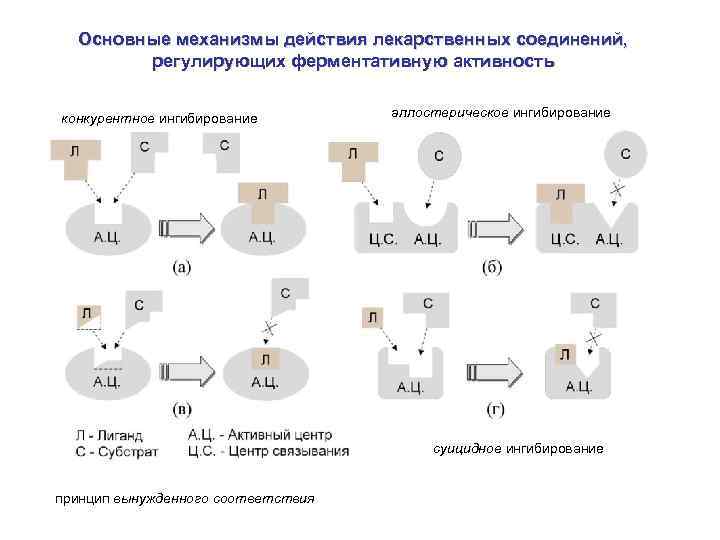
Основные механизмы действия лекарственных соединений, регулирующих ферментативную активность конкурентное ингибирование аллостерическое ингибирование суицидное ингибирование принцип вынужденного соответствия

Активный центр белка — относительно изолированный от окружающей белок среды участок, сформированный аминокислотными остатками. В этом участке каждый остаток благодаря своему индивидуальному размеру и функциональным группам формирует «рельеф» активного центра. ►Объединение таких аминокислот в единый функциональный комплекс (ансамбль) изменяет реакционную способность их радикалов Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными (суицидные/необратимые лиганды) Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка в результате точечных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию. При денатурации активный центр белков разрушается, и происходит утрата их биологической активности.
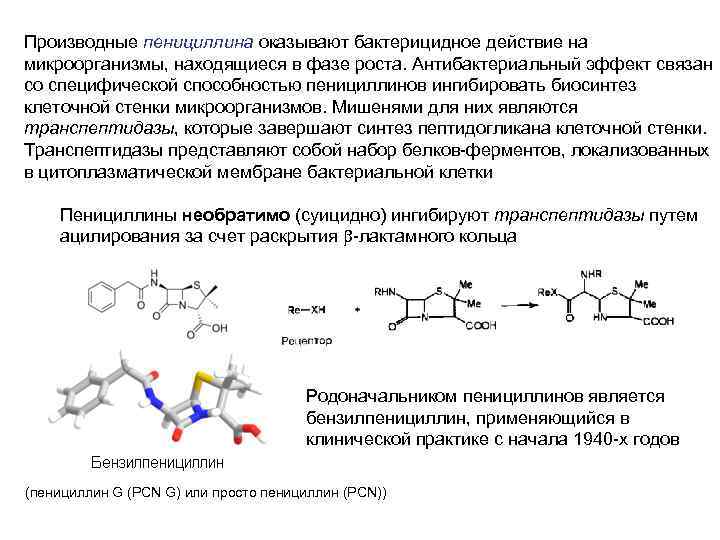
Производные пенициллина оказывают бактерицидное действие на микроорганизмы, находящиеся в фазе роста. Антибактериальный эффект связан со специфической способностью пенициллинов ингибировать биосинтез клеточной стенки микроорганизмов. Мишенями для них являются транспептидазы, которые завершают синтез пептидогликана клеточной стенки. Транспептидазы представляют собой набор белков-ферментов, локализованных в цитоплазматической мембране бактериальной клетки Пенициллины необратимо (суицидно) ингибируют транспептидазы путем ацилирования за счет раскрытия b-лактамного кольца Родоначальником пенициллинов является бензилпенициллин, применяющийся в клинической практике с начала 1940 -х годов (пенициллин G (PCN G) или просто пенициллин (PCN))

►Часто активный центр формируется таким образом, что доступ воды к функциональным группам его радикалов ограничен, т. е. создаются условия для связывания лиганда с радикалами аминокислот. Однако в сайте связывания могут присутствовать молекулы воды (белок и лиганд находятся в сольватированом состоянии). В результате осуществляется конкуренция В некоторых случаях лиганд присоединяется только к одному из атомов, обладающему определённой реакционной способностью, например присоединение 02 к железу миоглобина или гемоглобина. Однако свойства данного атома избирательно взаимодействовать с 02 определяются свойствами радикалов, окружающих атом железа в составе гема. Центр связывания белка с лигандом часто располагается между доменами. Например, протеолитический фермент трипсин, участвующий в гидролизе пептидных связей пищевых белков в кишечнике, имеет 2 домена, разделённых бороздкой. Внутренняя поверхность бороздки формируется аминокислотными радикалами этих доменов, стоящими в полипептидной цепи далеко друг от друга (Сер177, Гис40, Асп 85)
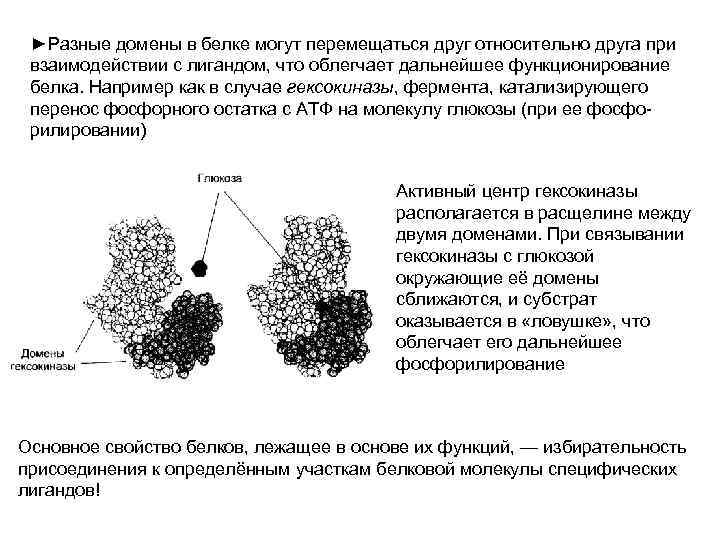
►Разные домены в белке могут перемещаться друг относительно друга при взаимодействии с лигандом, что облегчает дальнейшее функционирование белка. Например как в случае гексокиназы, фермента, катализирующего перенос фосфорного остатка с АТФ на молекулу глюкозы (при ее фосфорилировании) Активный центр гексокиназы располагается в расщелине между двумя доменами. При связывании гексокиназы с глюкозой окружающие её домены сближаются, и субстрат оказывается в «ловушке» , что облегчает его дальнейшее фосфорилирование Основное свойство белков, лежащее в основе их функций, — избирательность присоединения к определённым участкам белковой молекулы специфических лигандов!

Многообразие лигандов ● лигандами могут быть неорганические (часто ионы металлов) и органические вещества, низкомолекулярные и высокомолекулярные вещества; ● существуют лиганды, которые изменяют свою химическую структуру присоединении к активному центру белка (изменения субстрата в активном центре фермента); ● существуют лиганды, присоединяющиеся к белку только в момент функционирования (например, 02, транспортируемый гемоглобином), и лиганды, постоянно связанные с белком, выполняющие вспомогательную роль при функционировании белков (например, железо, входящее в состав гемоглобина) ● лекарственные субстанции и протомеры белковых комплексов ►В тех случаях, когда аминокислотные остатки, формирующие активный центр, не могут обеспечить функционирование данного белка, к определённым участкам активного центра могут присоединяться небелковые молекулы

В активном центре многих ферментов присутствует ион металла (кофактор) или органическая небелковая молекула (кофермент). Небелковую часть, прочно связанную с активным центром белка и необходимую для его функционирования, называют «простетическая группа» . Миоглобин, гемоглобин и цитохромы имеют в активном центре простетическую группу — гем, содержащий железо. Другой пример – родопсин (опсин и ретиналь) ►Соединение протомеров в олигомерном белке — пример взаимодействия высокомолекулярных лигандов. Каждый протомер, соединённый с другими протомерами, служит для них лигандом, так же как они для него. ►Иногда присоединение какого-либо лиганда изменяет конформацию белка, в результате чего формируется центр связывания с другими лигандами. Например, белок кальмодулин после связывания с четырьмя ионами Са 2+ в специфических участках приобретает способность взаимодействовать с некоторыми ферментами, меняя их активность.

Сродство активного центра лиганду Скорость взаимодействия белка с лигандом определяется концентрациями белка и лиганда в растворе, а также степенью комплементарности белка и лиганда Константа диссоциации — характеристика сродства активного центра лиганду. Так как взаимодействие белка с лигандом — обратимый процесс, то его можно описать следующим уравнением: Когда скорости образования и распада комплекса равны, говорят о том, что система находится в состоянии равновесия: [Р] [L] К 1=[PL] К-1, откуда: P – белок L – лиганд PL – комплекс белок-лиганд K 1 – константа связывания (константа ассоциации Ka) K-1 – константа скорости распада (диссоциации, Kd) Соотношение констант распада [PL] комплекса и его образования называется константой диссоциации (К) комплекса [PL] Чем меньше Кдисс, тем больше молекул лиганда связано с белком, тем больше комплементарность между Р и L и тем больше сродство лиганда к белку (обратно пропорциональная связь)
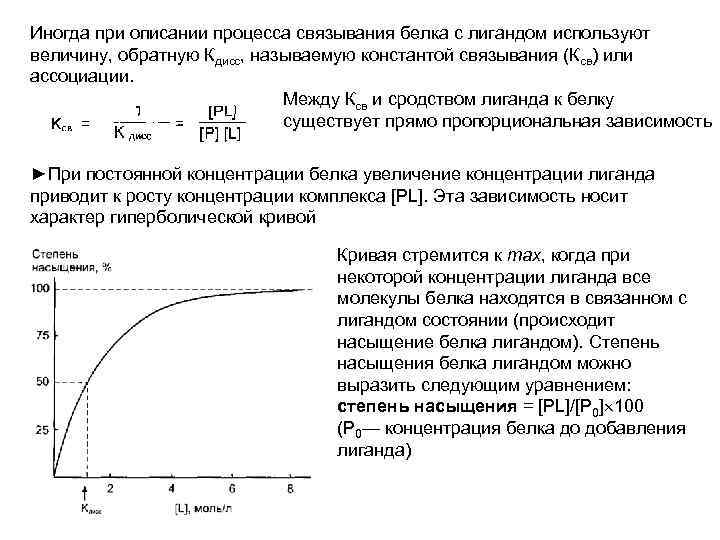
Иногда при описании процесса связывания белка с лигандом используют величину, обратную Кдисс, называемую константой связывания (Ксв) или ассоциации. Между Ксв и сродством лиганда к белку существует прямо пропорциональная зависимость ►При постоянной концентрации белка увеличение концентрации лиганда приводит к росту концентрации комплекса [PL]. Эта зависимость носит характер гиперболической кривой Кривая стремится к max, когда при некоторой концентрации лиганда все молекулы белка находятся в связанном с лигандом состоянии (происходит насыщение белка лигандом). Степень насыщения белка лигандом можно выразить следующим уравнением: степень насыщения = [PL]/[P 0] 100 (Р 0— концентрация белка до добавления лиганда)
![При полунасыщении белка лигандом концентрации [PL] и [Р] равны, и из уравнения Кдисс следует, При полунасыщении белка лигандом концентрации [PL] и [Р] равны, и из уравнения Кдисс следует,](https://present5.com/presentation/12346603_224925379/image-58.jpg)
При полунасыщении белка лигандом концентрации [PL] и [Р] равны, и из уравнения Кдисс следует, что Кдисс = [L], т. е. Кдисс численно равна концентрации лиганда, при которой 50% белка находится в комплексе с лигандом. Соответственно, по кривой насыщения можно найти Кдисс и оценить сродство белка лиганду. ►Концентрацию комплекса [PL] можно регистрировать, например с помощью измерения поглощения света. Учитывая, что его количество пропорционально концентрации белка, можно на основании построенного графика определять концентрацию белка в растворе При избытке лиганда все молекулы белка находятся в составе комплекса [PL], Однако, если увеличивать концентрацию белка, то количество [PL] начнёт увеличиваться пропорционально концентрации белка

ВЕЩЕСТВА, ВЛИЯЮЩИЕ НА ФУНКЦИОНИРОВАНИЕ БЕЛКОВ ► Несмотря на то, что взаимодействие лиганда с активным центром белка высокоспецифично, можно подобрать другое вещество, которое так же будет взаимодействовать с белком. Лиганд, взаимодействующий с белком и нарушающий (блокирующий) его функцию, называют «ингибитор» ► Если такое вещество по структуре похоже на лиганд, его называют структурным аналогом лиганда; оно также взаимодействует с активным центром белка. Аналог, замещающий естественный лиганд в активном центре белка и снижающий его функцию, называют «конкурентный ингибитор» Лекарственные препараты Аналоги эндогенных лигандов белков используют в медицине в качестве лекарственных средств. Широкое применение такие лекарства нашли в регуляции передачи возбуждения через синапсы. Передача сигнала от нерва к нерву или от нерва к эффекторному органу осуществляется через синапсы с помощью химических молекул, называемых нейромедиаторами. Нейромедиатор, выделяемый при прохождении импульса нервными окончаниями, должен высокоспецифично взаимодействовать с белками-рецепторами на пост-синаптической мембране

Модифицируя химическую структуру нейромедиатора, можно получить вещества, которые также связывались бы с рецептором, но при этом менялся физиологический эффект: уменьшался или усиливался. В фармакологии такие вещества называют «антагонисты» и «агонисты» соответственно (термины применяются для рецепторов) Ингибиторы белков-рецепторов в холинэргических синапсах Лекарства, нарушающие проведение нервного импульса через холинергические синапсы, где в качестве нейромедиатора используется ацетилхолин. Холинергические белки-рецепторы неоднородны по своей структуре и способны связываться с другими, кроме ацетилхолина, лигандами. Их делят на 2 большие группы: ● М-холинорецепторы, названные так из-за их способности избирательно взаимодействовать с мускарином (токсин мухомора); ● Н-холинорецепторы, избирательно связывающие никотин В нервно-мышечных синапсах присутствуют Н-холинорецепторы, взаимодействие которых с ацетилхолином вызывает сокращение мышц. Для расслабления мышц в эндоскопических исследованиях, а также при разнообразных хирургических операциях используют структурные аналоги ацетилхолина, служащие ингибиторами функций этих рецепторов

Дитилин, относящийся к группе ЛС, называемых миорелаксантами (вызывающими мышечное расслабление). Первоначально эти свойства были обнаружены у яда кураре, в связи с чем данные препараты называют также курареподобными. Дитилин относится к миорелаксантам деполяризующего действия. В отличие от ацетилхолина, быстро разрушающегося в синаптической шели ферментом - ацетилхолинэстеразой, дитилин из-за значительно более медленного его разрушения ферментом, вызывает стойкую деполяризацию мембраны и нарушение проведения нервного импулса, что и вызывает мышечное расслабление Наиболее известный специфический ингибитор М-холинорецепторов — атропин. Атропин — алкалоид, содержащийся в некоторых растениях (красавке, белене, дурмане). Он присоединяется к М-холинорецепторам, находящимся на мембране эффекторных клеток, в области окончаний парасимпатических нервов. Атропин препятствует их взаимодействию с ацетилхолином, тем самым устраняя эффекты раздражения парасимпатических нервов

Ацетилхолин, связываясь с М-холинорецепторами, вызывает сокращение многих гладких мышц, атропин (как лекарственный препарат) снимает мышечные спазмы (спазмолитик). Кроме того, он снижает стимулируемую ацетилхолином секрецию желёз (бронхиальных, пищеварительных, потовых). М-холинорецепторы присутствуют в разных отделах ЦНС. Передозировка атропина может вызвать двигательное и речевое возбуждение. Лекарственные вещества — стимуляторы белковых функций Некоторые структурные аналоги лигандов рецепторных белков не являются ингибиторами, а вызывают такие же или более сильные физиологические эффекты, чем природные лиганды. Их более сильный и длительный эффект часто связан с тем, что модифицированные лиганды медленнее инактивируются и разрушаются в организме. Например, мезатон по структуре похож на нейромедиаторы симпатической нервной системы (норадреналин, адреналин).

Мезатон повышает тонус сосудов и АД, поэтому его используют при гипотонии и коллапсе. Он менее подвержен действию инактивирующих его ферментов, поэтому оказывает более длительный и сильный эффект, чем его природные аналоги Яды — специфические лиганды определённых белков Некоторые яды, попадая в организм человека, прочно связываются с определёнными белками, ингибируют их и тем самым вызывают нарушения биологических функций. Например, a-нейротоксины кобры специфически взаимодействуют с холинергйческими рецепторами постсинаптических мембран, блокируя их работу, и оказывают курареподобное действие. a-Нейротоксины — небольшие белки с молекулярной массой около 7000 Д (65— 70 аминокислотных остатков). Их третичную структуру стабилизируют 4 или 5 специфических дисульфидных связей (в зависимости от вида токсина). Сродство нейротоксинов к холинергическим рецепторам очень высоко (Кдисс = 10 -11). Между токсином и рецептором образуется множество связей, что и приводит к их практически необратимому соединению.

► Лекарства, назначаемые в дозах, больших чем терапевтические, могут действовать как яды, т. е. вызывать серьёзные нарушения обмена веществ и функций организма!!! ► Яды в микродозах часто используют как лекарственные препараты!!! Атропин, широко применяемый для снятия спазмов гладких мышц, в больших дозах вызывает возбуждение ЦНС, а в ещё больших дозах — сон, переходящий в кому. Известное гипотензивное средство клофелин при передозировке вызывает коллапс.
lecture_2-stud.ppt