Lektsia_2-2012-ookh_i_khn.ppt
- Количество слайдов: 18
 Лекция 2 Алканы
Лекция 2 Алканы
 Синонимы: Алканы, парафины, метановые углеводороды, предельные углеводороды Алканы – это углеводороды, в молекулах которых атомы углерода связаны только одинарными связями. ¡ Общая формула алканов – ¡ Сn. Н 2 n+2 ¡
Синонимы: Алканы, парафины, метановые углеводороды, предельные углеводороды Алканы – это углеводороды, в молекулах которых атомы углерода связаны только одинарными связями. ¡ Общая формула алканов – ¡ Сn. Н 2 n+2 ¡
 1. Общие сведения 1)Гомологический ряд алканов Общая (брутто)формула Название Структурная формула СН 4 Метан СН 4 С 2 Н 6 Этан СН 3 -СН 3 С 3 Н 8 Пропан СН 3 -СН 2 -СН 3 С 4 Н 10 Бутан СН 3 -СН 2 -СН 3 С 5 Н 12 Пентан СН 3 -СН 2 -СН 3 С 6 Н 14 Гексан СН 3 -(СН 2)4 -СН 3 С 7 Н 16 Гептан СН 3 -(СН 2)5 -СН 3 С 8 Н 18 Октан СН 3 -(СН 2)6 -СН 3 С 9 Н 20 Нонан СН 3 -(СН 2)7 -СН 3 С 10 Н 22 Декан СН 3 -(СН 2)8 -СН 3
1. Общие сведения 1)Гомологический ряд алканов Общая (брутто)формула Название Структурная формула СН 4 Метан СН 4 С 2 Н 6 Этан СН 3 -СН 3 С 3 Н 8 Пропан СН 3 -СН 2 -СН 3 С 4 Н 10 Бутан СН 3 -СН 2 -СН 3 С 5 Н 12 Пентан СН 3 -СН 2 -СН 3 С 6 Н 14 Гексан СН 3 -(СН 2)4 -СН 3 С 7 Н 16 Гептан СН 3 -(СН 2)5 -СН 3 С 8 Н 18 Октан СН 3 -(СН 2)6 -СН 3 С 9 Н 20 Нонан СН 3 -(СН 2)7 -СН 3 С 10 Н 22 Декан СН 3 -(СН 2)8 -СН 3
 2). Строение и гибридизация Атомы углерода в молекулах алканов находятся в состоянии гибридизации -sp 3, т. е. все связи у него равноценны и расположены под углом тетраэдра (~109 о) друг к другу. В результате строение алканов - пространственное. 3) Изомерия - структурная, по строению углеродного скелета, например, два углеводорода с общей формулой С 4 Н 10 являются изомерами: СН 3 -СН 2 -СН 3 н. бутан СН 3 -СН-СН 3 | CН 3 изобутан
2). Строение и гибридизация Атомы углерода в молекулах алканов находятся в состоянии гибридизации -sp 3, т. е. все связи у него равноценны и расположены под углом тетраэдра (~109 о) друг к другу. В результате строение алканов - пространственное. 3) Изомерия - структурная, по строению углеродного скелета, например, два углеводорода с общей формулой С 4 Н 10 являются изомерами: СН 3 -СН 2 -СН 3 н. бутан СН 3 -СН-СН 3 | CН 3 изобутан
 4). Номенклатура а)Названия одновалентных радикалов Углеводород Радикал Название радикала СН 3 - метил СН 3 -СН 3 этан СН 3 -СН 2 - этил СН 3 -СН 2 -СН 3 пропан СН 3 -СН 2 - н. пропил СН 3 -СН 2 -СН 3 бутан СН 3 -СН 2 -СН 2 - СН 4 метан СН 3 -СН-СН 3 | СН 3 изобутан СН 3 -СН-СН 3 | СН 3 -СН-СН 2| СН 3 -С-СН 3 | СН 3 изопропил н. бутил втор. бутил изобутил трет. бутил
4). Номенклатура а)Названия одновалентных радикалов Углеводород Радикал Название радикала СН 3 - метил СН 3 -СН 3 этан СН 3 -СН 2 - этил СН 3 -СН 2 -СН 3 пропан СН 3 -СН 2 - н. пропил СН 3 -СН 2 -СН 3 бутан СН 3 -СН 2 -СН 2 - СН 4 метан СН 3 -СН-СН 3 | СН 3 изобутан СН 3 -СН-СН 3 | СН 3 -СН-СН 2| СН 3 -С-СН 3 | СН 3 изопропил н. бутил втор. бутил изобутил трет. бутил
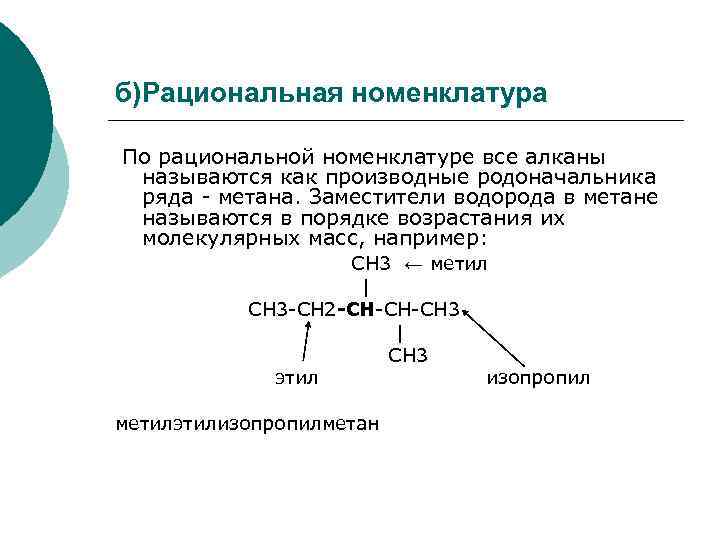 б)Рациональная номенклатура По рациональной номенклатуре все алканы называются как производные родоначальника ряда - метана. Заместители водорода в метане называются в порядке возрастания их молекулярных масс, например: СН 3 ← метил | СН 3 -СН 2 -СН-СН-СН 3 | CН 3 этил изопропил метилэтилизопропилметан
б)Рациональная номенклатура По рациональной номенклатуре все алканы называются как производные родоначальника ряда - метана. Заместители водорода в метане называются в порядке возрастания их молекулярных масс, например: СН 3 ← метил | СН 3 -СН 2 -СН-СН-СН 3 | CН 3 этил изопропил метилэтилизопропилметан
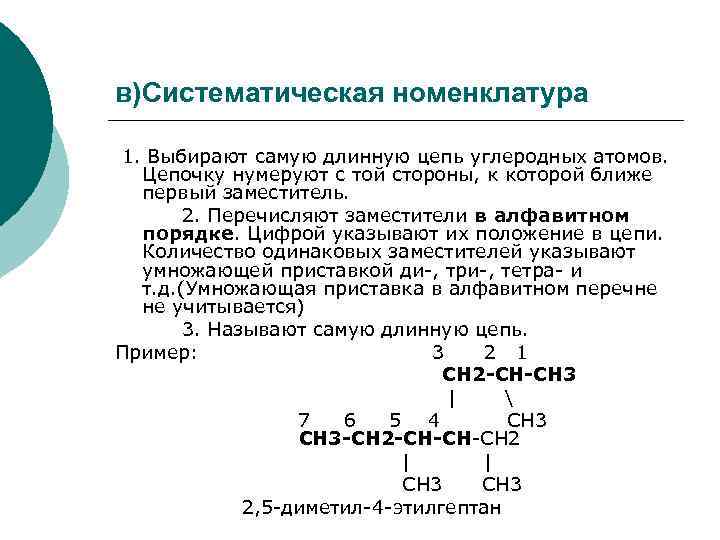 в)Систематическая номенклатура 1. Выбирают самую длинную цепь углеродных атомов. Цепочку нумеруют с той стороны, к которой ближе первый заместитель. 2. Перечисляют заместители в алфавитном порядке. Цифрой указывают их положение в цепи. Количество одинаковых заместителей указывают умножающей приставкой ди-, три-, тетра- и т. д. (Умножающая приставка в алфавитном перечне не учитывается) 3. Называют самую длинную цепь. Пример: 3 2 1 CН 2 -СН-СН 3 | 7 6 5 4 CН 3 СН 3 -СН 2 -СН-СН-СН 2 | | CН 3 2, 5 -диметил-4 -этилгептан
в)Систематическая номенклатура 1. Выбирают самую длинную цепь углеродных атомов. Цепочку нумеруют с той стороны, к которой ближе первый заместитель. 2. Перечисляют заместители в алфавитном порядке. Цифрой указывают их положение в цепи. Количество одинаковых заместителей указывают умножающей приставкой ди-, три-, тетра- и т. д. (Умножающая приставка в алфавитном перечне не учитывается) 3. Называют самую длинную цепь. Пример: 3 2 1 CН 2 -СН-СН 3 | 7 6 5 4 CН 3 СН 3 -СН 2 -СН-СН-СН 2 | | CН 3 2, 5 -диметил-4 -этилгептан
 2. Физические свойства ¡ ¡ ¡ Алканы С 1 - С 4 - газы, С 5 - С 15 - жидкости, С 16 и выше - твердые вещества. Алканы легче воды и почти не растворимы в ней, но способны растворяться в большинстве органических растворителей. Алканы с развлетвленной цепью (изоалканы) кипят при температуре ниже, чем соответствующие неразвлетвленные алканы, температура плавления, наоборот, выше у изоалканов. С повышением молекулярной массы увеличиваются температуры кипения и плавления алканов, растет их плотность (для жидких алканов плотность меняется от 0, 6262 у пентана до 0, 7683 у пентадекана).
2. Физические свойства ¡ ¡ ¡ Алканы С 1 - С 4 - газы, С 5 - С 15 - жидкости, С 16 и выше - твердые вещества. Алканы легче воды и почти не растворимы в ней, но способны растворяться в большинстве органических растворителей. Алканы с развлетвленной цепью (изоалканы) кипят при температуре ниже, чем соответствующие неразвлетвленные алканы, температура плавления, наоборот, выше у изоалканов. С повышением молекулярной массы увеличиваются температуры кипения и плавления алканов, растет их плотность (для жидких алканов плотность меняется от 0, 6262 у пентана до 0, 7683 у пентадекана).
 3. Получение 1. Алканы довольно широко распространены в природе. Их можно выделить из природного и попутного газов, нефти, горного воска. 2. Гидрирование угля над железным катализатором. ~450 o n С + 2 n Н 2 Сn Н 2 n+2 3. Получение из синтез-газа (катализатор - кобальт-ториймагниевая или железо-кобальтовая смесь). ~300 o n. СО + (2 n+1) Н 2 С n Н 2 n+2 + n Н 2 О «синтин» (синтетический бензин) 4. Гидрирование непредельных углеводородов (алкенов, диенов, алкинов) в присутствии катализаторов (Pt, Pd, Ni): СН 3 -СН=СН 2 + Н 2 СН 3 -СН 2 -СН 3
3. Получение 1. Алканы довольно широко распространены в природе. Их можно выделить из природного и попутного газов, нефти, горного воска. 2. Гидрирование угля над железным катализатором. ~450 o n С + 2 n Н 2 Сn Н 2 n+2 3. Получение из синтез-газа (катализатор - кобальт-ториймагниевая или железо-кобальтовая смесь). ~300 o n. СО + (2 n+1) Н 2 С n Н 2 n+2 + n Н 2 О «синтин» (синтетический бензин) 4. Гидрирование непредельных углеводородов (алкенов, диенов, алкинов) в присутствии катализаторов (Pt, Pd, Ni): СН 3 -СН=СН 2 + Н 2 СН 3 -СН 2 -СН 3
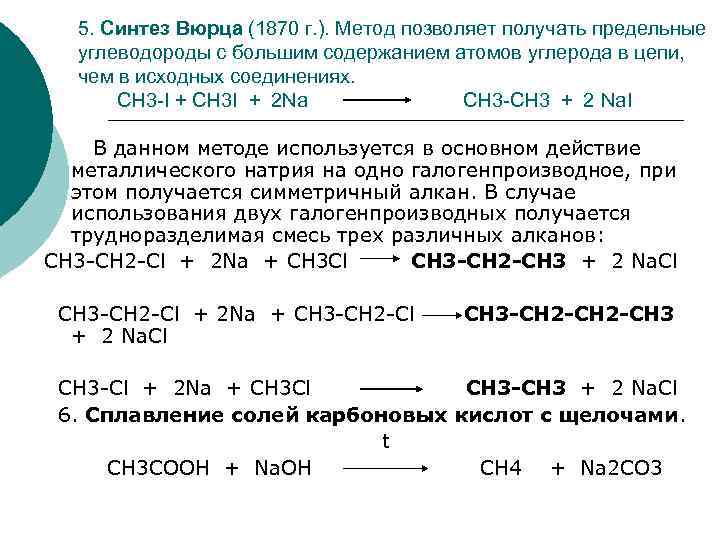 5. Синтез Вюрца (1870 г. ). Метод позволяет получать предельные углеводороды с большим содержанием атомов углерода в цепи, чем в исходных соединениях. СН 3 -I + CH 3 I + 2 Na CH 3 -CH 3 + 2 Na. I В данном методе используется в основном действие металлического натрия на одно галогенпроизводное, при этом получается симметричный алкан. В случае использования двух галогенпроизводных получается трудноразделимая смесь трех различных алканов: СН 3 -СН 2 -Cl + 2 Na + CH 3 Cl CH 3 -CH 2 -CH 3 + 2 Na. Cl CH 3 -CH 2 -Cl + 2 Na + CH 3 -CH 2 -Cl + 2 Na. Cl CH 3 -CH 2 -CH 3 СН 3 -Cl + 2 Na + CH 3 Cl CH 3 -CH 3 + 2 Na. Cl 6. Сплавление солей карбоновых кислот с щелочами. t СН 3 СООН + Na. OH CH 4 + Na 2 CO 3
5. Синтез Вюрца (1870 г. ). Метод позволяет получать предельные углеводороды с большим содержанием атомов углерода в цепи, чем в исходных соединениях. СН 3 -I + CH 3 I + 2 Na CH 3 -CH 3 + 2 Na. I В данном методе используется в основном действие металлического натрия на одно галогенпроизводное, при этом получается симметричный алкан. В случае использования двух галогенпроизводных получается трудноразделимая смесь трех различных алканов: СН 3 -СН 2 -Cl + 2 Na + CH 3 Cl CH 3 -CH 2 -CH 3 + 2 Na. Cl CH 3 -CH 2 -Cl + 2 Na + CH 3 -CH 2 -Cl + 2 Na. Cl CH 3 -CH 2 -CH 3 СН 3 -Cl + 2 Na + CH 3 Cl CH 3 -CH 3 + 2 Na. Cl 6. Сплавление солей карбоновых кислот с щелочами. t СН 3 СООН + Na. OH CH 4 + Na 2 CO 3
 4. Химические свойства 1). Галогенирование а) Хлорирование метана СН 4 + Cl 2 CH 3 Cl + HCl CH 3 Cl + Cl 2 CH 2 Cl 2 + HCl CH 2 Cl 2 + Cl 2 CHCl 3 + HCl CHCl 3 + Cl 2 CCl 4 + HCl
4. Химические свойства 1). Галогенирование а) Хлорирование метана СН 4 + Cl 2 CH 3 Cl + HCl CH 3 Cl + Cl 2 CH 2 Cl 2 + HCl CH 2 Cl 2 + Cl 2 CHCl 3 + HCl CHCl 3 + Cl 2 CCl 4 + HCl
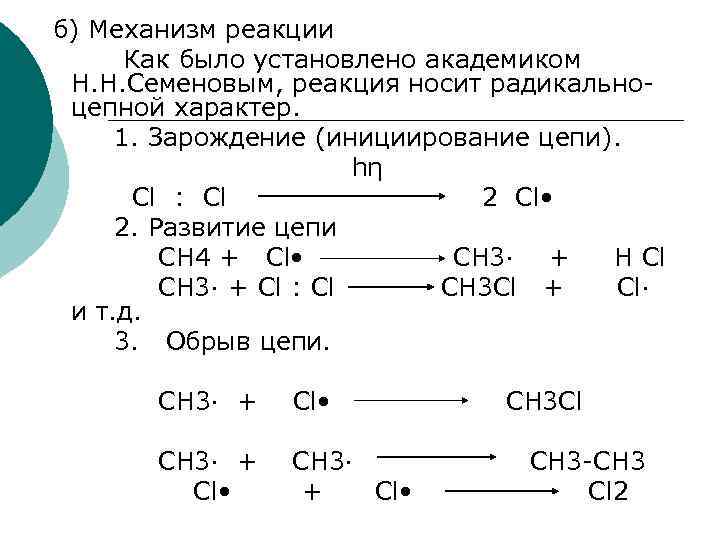 б) Механизм реакции Как было установлено академиком Н. Н. Семеновым, реакция носит радикальноцепной характер. 1. Зарождение (инициирование цепи). hη Сl : Cl 2 Cl • 2. Развитие цепи СН 4 + Cl • CH 3· + H Cl СН 3· + Cl : Cl CH 3 Cl + Cl· и т. д. 3. Обрыв цепи. CH 3· + Cl • CH 3 Cl СН 3 -СН 3 Сl 2
б) Механизм реакции Как было установлено академиком Н. Н. Семеновым, реакция носит радикальноцепной характер. 1. Зарождение (инициирование цепи). hη Сl : Cl 2 Cl • 2. Развитие цепи СН 4 + Cl • CH 3· + H Cl СН 3· + Cl : Cl CH 3 Cl + Cl· и т. д. 3. Обрыв цепи. CH 3· + Cl • CH 3 Cl СН 3 -СН 3 Сl 2
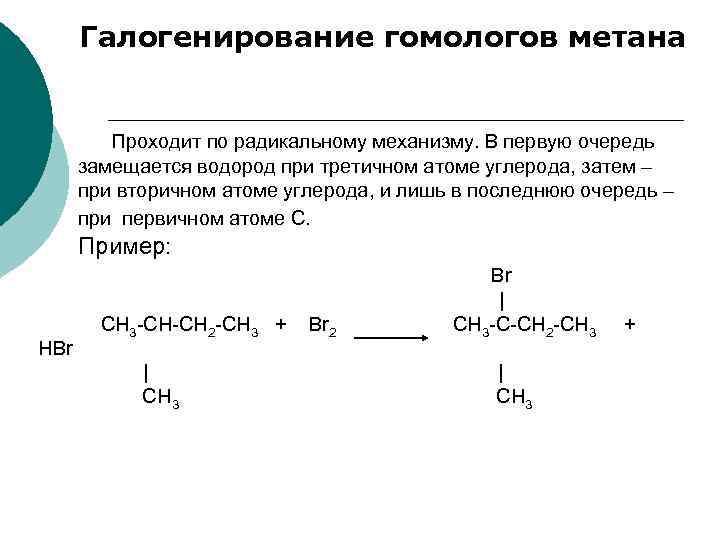 Галогенирование гомологов метана Проходит по радикальному механизму. В первую очередь замещается водород при третичном атоме углерода, затем – при вторичном атоме углерода, и лишь в последнюю очередь – при первичном атоме С. Пример: НBr СН 3 -СН-СН 2 -СН 3 + | CН 3 Br 2 Br | CH 3 -C-CН 2 -СН 3 | CH 3 +
Галогенирование гомологов метана Проходит по радикальному механизму. В первую очередь замещается водород при третичном атоме углерода, затем – при вторичном атоме углерода, и лишь в последнюю очередь – при первичном атоме С. Пример: НBr СН 3 -СН-СН 2 -СН 3 + | CН 3 Br 2 Br | CH 3 -C-CН 2 -СН 3 | CH 3 +
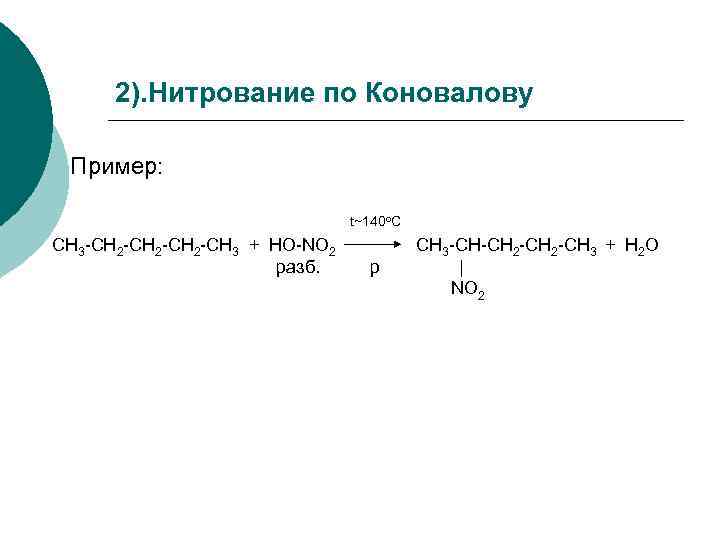 2). Нитрование по Коновалову Пример: t~140 o. C СН 3 -СН 2 -СН 3 + НО-NO 2 разб. p CН 3 -СН-СН 2 -СН 3 + H 2 O | NO 2
2). Нитрование по Коновалову Пример: t~140 o. C СН 3 -СН 2 -СН 3 + НО-NO 2 разб. p CН 3 -СН-СН 2 -СН 3 + H 2 O | NO 2
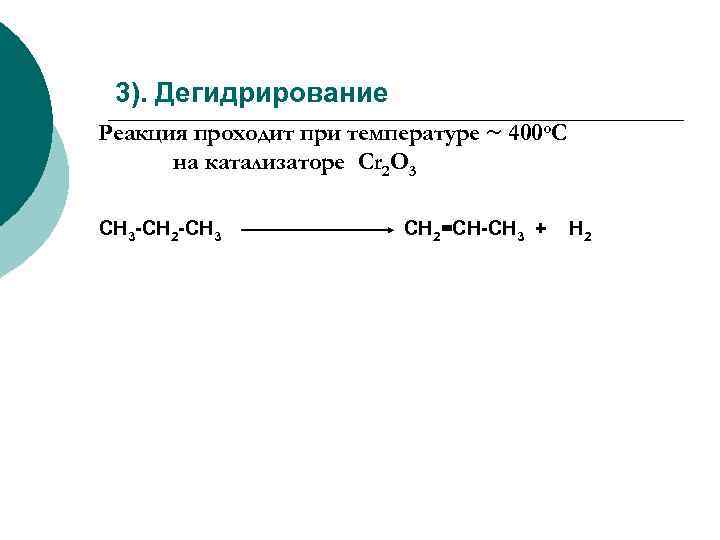 3). Дегидрирование Реакция проходит при температуре ~ 400 o. C на катализаторе Cr 2 O 3 СН 3 -СН 2 -СН 3 СН 2=СН-СН 3 + Н 2
3). Дегидрирование Реакция проходит при температуре ~ 400 o. C на катализаторе Cr 2 O 3 СН 3 -СН 2 -СН 3 СН 2=СН-СН 3 + Н 2
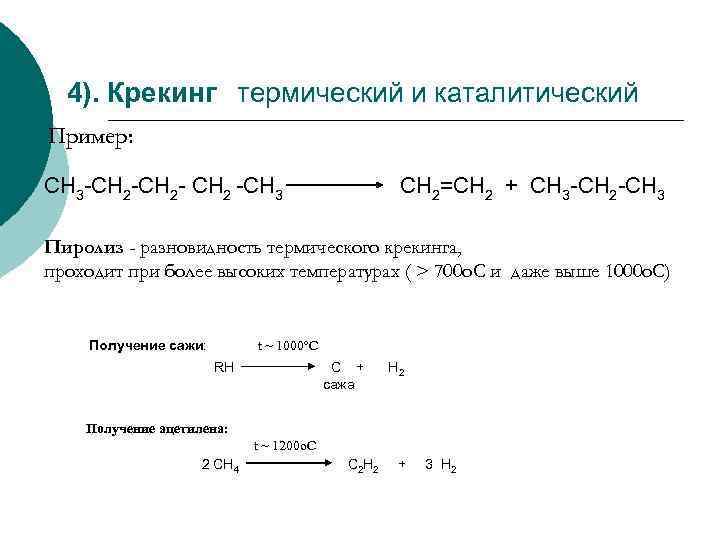 4). Крекинг термический и каталитический Пример: СН 3 -СН 2 - СН 2 -СН 3 СН 2=СН 2 + СН 3 -СН 2 -СН 3 Пиролиз - разновидность термического крекинга, проходит при более высоких температурах ( > 700 o. C и даже выше 1000 о. С) Получение сажи: t ~ 1000 o. C RH C + сажа H 2 Получение ацетилена: t ~ 1200 o. C 2 СН 4 С 2 Н 2 + 3 Н 2
4). Крекинг термический и каталитический Пример: СН 3 -СН 2 - СН 2 -СН 3 СН 2=СН 2 + СН 3 -СН 2 -СН 3 Пиролиз - разновидность термического крекинга, проходит при более высоких температурах ( > 700 o. C и даже выше 1000 о. С) Получение сажи: t ~ 1000 o. C RH C + сажа H 2 Получение ацетилена: t ~ 1200 o. C 2 СН 4 С 2 Н 2 + 3 Н 2
 5). Окисление а) горение (полное окисление). СН 4 + 2 О 2 СО 2 + 2 Н 2 О + Q б) химическое (неполное) окисление (осуществляется при t~ 150 -200 o. C) соли Mn С 5 Н 12 + О 2 СН 3 СООН + СН 3 -СН 2 -СООН Промышленно важная реакция (окисление бутана): СН 3 -СН 2 - СН 2 -СН 3 + 2 О 2 2 СН 3 -СООН уксусная кислота
5). Окисление а) горение (полное окисление). СН 4 + 2 О 2 СО 2 + 2 Н 2 О + Q б) химическое (неполное) окисление (осуществляется при t~ 150 -200 o. C) соли Mn С 5 Н 12 + О 2 СН 3 СООН + СН 3 -СН 2 -СООН Промышленно важная реакция (окисление бутана): СН 3 -СН 2 - СН 2 -СН 3 + 2 О 2 2 СН 3 -СООН уксусная кислота
 5. Применение алканов Метан - используется в качестве промышленного и бытового газа для отопления, для получения ацетилена, газовой сажи, галогенпроизводных. Этан - применяется в основном для получения этилена и затем полиэтилена. Смеси пропана и бутана - используются в качестве топлива (бытовой газ) - для получения непредельных углеводородов Жидкие алканы - как моторное топливо. Высшие жидкие алканы - как дизельное топливо. Твердые парафины - используются как смазочный материал.
5. Применение алканов Метан - используется в качестве промышленного и бытового газа для отопления, для получения ацетилена, газовой сажи, галогенпроизводных. Этан - применяется в основном для получения этилена и затем полиэтилена. Смеси пропана и бутана - используются в качестве топлива (бытовой газ) - для получения непредельных углеводородов Жидкие алканы - как моторное топливо. Высшие жидкие алканы - как дизельное топливо. Твердые парафины - используются как смазочный материал.


