15. Индикаторные теории, кривые титрования.ppt
- Количество слайдов: 52
 ЛЕКЦИЯ 15 1
ЛЕКЦИЯ 15 1
 Индикаторы кислотно-основного титрования 2
Индикаторы кислотно-основного титрования 2
 Требования, предъявляемые к кислотноосновным индикаторам 1. Индикатор должен быть чувствительным, чтобы расход индикатора был как можно меньше 2. Равновесие между двумя формами должно устанавливаться быстро 3. Обе формы или одна из форм должны быть интенсивно окрашены 4. Интервал перехода окраски индикатора не должен быть большим 3
Требования, предъявляемые к кислотноосновным индикаторам 1. Индикатор должен быть чувствительным, чтобы расход индикатора был как можно меньше 2. Равновесие между двумя формами должно устанавливаться быстро 3. Обе формы или одна из форм должны быть интенсивно окрашены 4. Интервал перехода окраски индикатора не должен быть большим 3
 Теории кислотно-основных индикаторов • Ионная теория • Хромофорная теория • Ионно-хромофорная теория 4
Теории кислотно-основных индикаторов • Ионная теория • Хромофорная теория • Ионно-хромофорная теория 4
 Ионная теория: кислотно-основные индикаторы меняют свой цвет при изменении концентрации ионов водорода в растворе, т. е. при изменении р. Н среды. HInd кислая красная H+ + Ind– основная желтая 5
Ионная теория: кислотно-основные индикаторы меняют свой цвет при изменении концентрации ионов водорода в растворе, т. е. при изменении р. Н среды. HInd кислая красная H+ + Ind– основная желтая 5
 Недостатки: 1. Не объясняет природы наличия и изменения окраски индикаторов 2. Не связывает окраску индикаторов с их строением 3. На переход окраски требуется какое время, в то время как ионные реакции протекают быстро 6
Недостатки: 1. Не объясняет природы наличия и изменения окраски индикаторов 2. Не связывает окраску индикаторов с их строением 3. На переход окраски требуется какое время, в то время как ионные реакции протекают быстро 6
 Хромофорная теория: изменение окраски индикатора обусловлено обратимой перегруппировкой атомов в молекуле, в результате которой появляются или исчезают группы, обуславливающие цвет раствора Хромофорные группы: –N=N–, =C=S, –N=O и др Ауксохромные группы: –NH 2, –OH, –OCH 3 и др. 7
Хромофорная теория: изменение окраски индикатора обусловлено обратимой перегруппировкой атомов в молекуле, в результате которой появляются или исчезают группы, обуславливающие цвет раствора Хромофорные группы: –N=N–, =C=S, –N=O и др Ауксохромные группы: –NH 2, –OH, –OCH 3 и др. 7
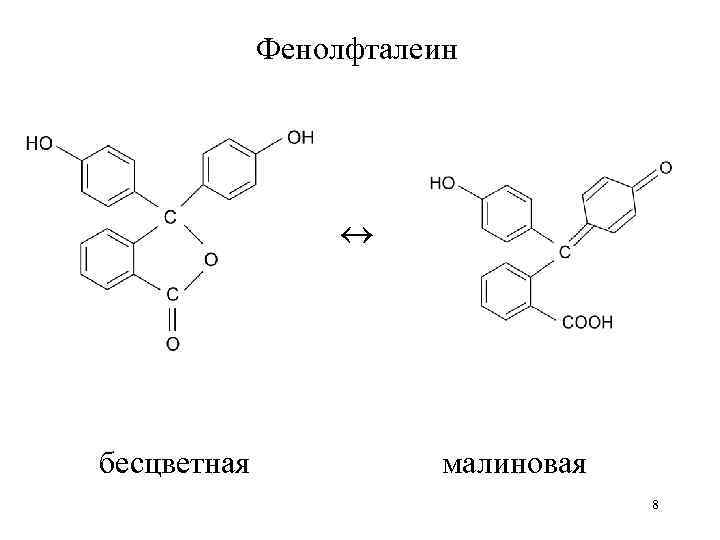 Фенолфталеин бесцветная малиновая 8
Фенолфталеин бесцветная малиновая 8
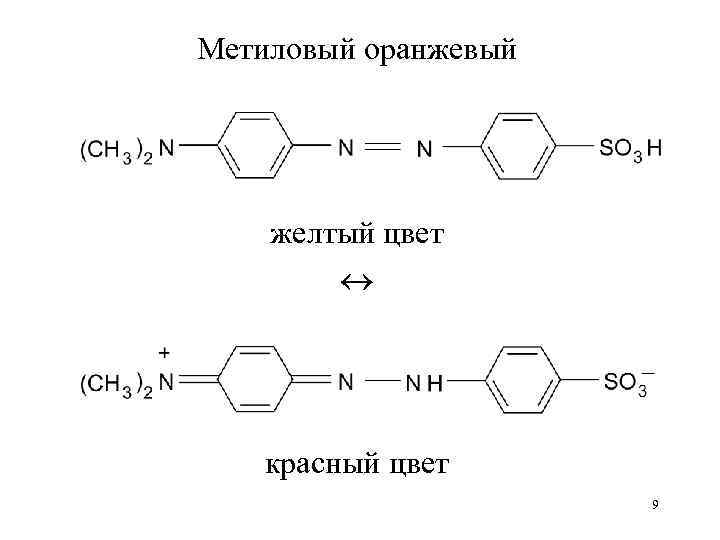 Метиловый оранжевый желтый цвет красный цвет 9
Метиловый оранжевый желтый цвет красный цвет 9
 На таутомерные превращения требуется некоторое время, поэтому окраска индикатора изменяется не мгновенно, очевидна взаимосвязь между окраской и строением молекул Не объясняет, почему изменение происходит при изменении р. Н раствора 10
На таутомерные превращения требуется некоторое время, поэтому окраска индикатора изменяется не мгновенно, очевидна взаимосвязь между окраской и строением молекул Не объясняет, почему изменение происходит при изменении р. Н раствора 10
 Ионно-хромофорная теория индикаторов: отщепление протона или гидроксид-иона привод к перегруппировке атомов в молекуле, что приводит к изменению цвета индикатора Объясняет: Изменение цвета раствора при изменении р. Н Изменение окраски во времени Связывает изменение окраски с его структурой 11
Ионно-хромофорная теория индикаторов: отщепление протона или гидроксид-иона привод к перегруппировке атомов в молекуле, что приводит к изменению цвета индикатора Объясняет: Изменение цвета раствора при изменении р. Н Изменение окраски во времени Связывает изменение окраски с его структурой 11
![HInd кислая красная H+ + Ind– основная желтая [H+] · [Ind–] KInd = —————— HInd кислая красная H+ + Ind– основная желтая [H+] · [Ind–] KInd = ——————](https://present5.com/presentation/3/139200531_169966084.pdf-img/139200531_169966084.pdf-12.jpg) HInd кислая красная H+ + Ind– основная желтая [H+] · [Ind–] KInd = —————— [HInd] 12
HInd кислая красная H+ + Ind– основная желтая [H+] · [Ind–] KInd = —————— [HInd] 12
![[H+] [HInd] = KInd · ——— [Ind–] p. H = p. KInd + lg [H+] [HInd] = KInd · ——— [Ind–] p. H = p. KInd + lg](https://present5.com/presentation/3/139200531_169966084.pdf-img/139200531_169966084.pdf-13.jpg) [H+] [HInd] = KInd · ——— [Ind–] p. H = p. KInd + lg ——— [HInd] Соотношение [Ind–]/[HInd] зависит от р. Н р-ра Человеческий глаз замечает изменение окраски при 10 -кратном избытке одной из форм 13
[H+] [HInd] = KInd · ——— [Ind–] p. H = p. KInd + lg ——— [HInd] Соотношение [Ind–]/[HInd] зависит от р. Н р-ра Человеческий глаз замечает изменение окраски при 10 -кратном избытке одной из форм 13
![[Ind–]/[HInd] 10 – наблюдается окраска основной формы [Ind–] (желтая) p. H = p. KInd [Ind–]/[HInd] 10 – наблюдается окраска основной формы [Ind–] (желтая) p. H = p. KInd](https://present5.com/presentation/3/139200531_169966084.pdf-img/139200531_169966084.pdf-14.jpg) [Ind–]/[HInd] 10 – наблюдается окраска основной формы [Ind–] (желтая) p. H = p. KInd + 1 [Ind–]/[HInd] 10 – наблюдается окраска кислой формы [HInd] (красная) p. H = p. KInd – 1 14
[Ind–]/[HInd] 10 – наблюдается окраска основной формы [Ind–] (желтая) p. H = p. KInd + 1 [Ind–]/[HInd] 10 – наблюдается окраска кислой формы [HInd] (красная) p. H = p. KInd – 1 14
 Интервал перехода окраски индикатора: p. H = p. KInd ± 1 p. H не всегда охватывает две единицы р. Н, т. к. соотношение концентраций двух форм, необходимое для наблюдения изменения окраски индикатора, [Ind–]/[HInd] не всегда равно 10 и зависит от природы индикатора м/о p. H = 3, 2 – 4, 4 красная – желтая м/к p. H = 4, 2 – 6, 2 красная – желтая ф/ф p. H = 8, 2 – 10, 0 бесцветная – малиновая 15
Интервал перехода окраски индикатора: p. H = p. KInd ± 1 p. H не всегда охватывает две единицы р. Н, т. к. соотношение концентраций двух форм, необходимое для наблюдения изменения окраски индикатора, [Ind–]/[HInd] не всегда равно 10 и зависит от природы индикатора м/о p. H = 3, 2 – 4, 4 красная – желтая м/к p. H = 4, 2 – 6, 2 красная – желтая ф/ф p. H = 8, 2 – 10, 0 бесцветная – малиновая 15
 Индикаторы часто характеризуют не интервалом перехода окраски индикатора, а показателем титрования р. Т – это значение р. Н, при котором наиболее резко происходит изменение окраски индикатора. м/о p. H = 3, 2 – 4, 4 м/к p. H = 4, 2 – 6, 2 ф/ф p. H = 8, 2 – 10, 0 р. Т = 4, 0 р. Т = 5, 5 р. Т = 9, 0 16
Индикаторы часто характеризуют не интервалом перехода окраски индикатора, а показателем титрования р. Т – это значение р. Н, при котором наиболее резко происходит изменение окраски индикатора. м/о p. H = 3, 2 – 4, 4 м/к p. H = 4, 2 – 6, 2 ф/ф p. H = 8, 2 – 10, 0 р. Т = 4, 0 р. Т = 5, 5 р. Т = 9, 0 16
 Классификация кислотно-основных индикаторов: 1. По строению: - трифенилметановые индикаторы (ф/ф, ф/к) - нитроиндикаторы (о-, м-, п-нитрофенолы) - других структурных типов (лакмус, индофенол, нейтральный красный и др. ) 2. По способу применения: - внутренние (ф/ф, ф/к, м/о, т/ф и др. ) - внешние ( лакмусовая бумага /красная, нейтральная, синяя/, куркумовая бумага, ф/ф бумага) 17
Классификация кислотно-основных индикаторов: 1. По строению: - трифенилметановые индикаторы (ф/ф, ф/к) - нитроиндикаторы (о-, м-, п-нитрофенолы) - других структурных типов (лакмус, индофенол, нейтральный красный и др. ) 2. По способу применения: - внутренние (ф/ф, ф/к, м/о, т/ф и др. ) - внешние ( лакмусовая бумага /красная, нейтральная, синяя/, куркумовая бумага, ф/ф бумага) 17
 3. По составу: - индивидуальные: (фенолфталеин, метиловый оранжевый и др. ) - смешанные (более резкое изменение окраски): * смесь двух индикаторов (фенолфталеин + тимолфталеин) * смесь индикатора с красителем (фенолфталеин + метиленовый синий) 4. По цветности: одноцветные (ф/ф), двухцветные (м/о) 18
3. По составу: - индивидуальные: (фенолфталеин, метиловый оранжевый и др. ) - смешанные (более резкое изменение окраски): * смесь двух индикаторов (фенолфталеин + тимолфталеин) * смесь индикатора с красителем (фенолфталеин + метиленовый синий) 4. По цветности: одноцветные (ф/ф), двухцветные (м/о) 18
 Кривые кислотно-основного титрования Отображают графическую зависимость р. Н титруемого раствора от объема прибавленного титранта или от степени оттитрованности Анализ кривой титрования позволяет подобрать оптимальные условия титрования (концентрация реагентов, индикатор) 19
Кривые кислотно-основного титрования Отображают графическую зависимость р. Н титруемого раствора от объема прибавленного титранта или от степени оттитрованности Анализ кривой титрования позволяет подобрать оптимальные условия титрования (концентрация реагентов, индикатор) 19
 Расчет, построение и анализ кривой титрования сильной кислоты сильным основанием HCl + Na. OH Na. Cl + H 2 O C(HCl) = C(Na. OH) = 0, 1 M Изменением объема пренебрегаем до ТЭ : р. Н = –lg. Cк-ты ТЭ: р. Н = 7 после ТЭ: р. Н = 14 + lg. Сосн 20
Расчет, построение и анализ кривой титрования сильной кислоты сильным основанием HCl + Na. OH Na. Cl + H 2 O C(HCl) = C(Na. OH) = 0, 1 M Изменением объема пренебрегаем до ТЭ : р. Н = –lg. Cк-ты ТЭ: р. Н = 7 после ТЭ: р. Н = 14 + lg. Сосн 20
 Доб Отт. Ост-к щ. к. % 0 0 100 90 90 10 99 99 1 99, 9 0, 1 100 — изб-к щ. % 100, 1 — 101 — 110 — 0, 1 1 10 Конц к-ты С 10– 1 С 10– 2 С 10– 3 С — р. Н р-ра –lg. C –lg 10– 1 С –lg 10– 2 С –lg 10– 3 С — р. Н С=0, 1 М –lg 10– 1=1 –lg 10– 2=2 –lg 10– 3=3 –lg 10– 4=4 7 конц. щ. 10– 3 С 14+lg 10– 4=10 10– 2 С 14+lg 10– 3=11 10– 1 С 14+lg 10– 2=12 21
Доб Отт. Ост-к щ. к. % 0 0 100 90 90 10 99 99 1 99, 9 0, 1 100 — изб-к щ. % 100, 1 — 101 — 110 — 0, 1 1 10 Конц к-ты С 10– 1 С 10– 2 С 10– 3 С — р. Н р-ра –lg. C –lg 10– 1 С –lg 10– 2 С –lg 10– 3 С — р. Н С=0, 1 М –lg 10– 1=1 –lg 10– 2=2 –lg 10– 3=3 –lg 10– 4=4 7 конц. щ. 10– 3 С 14+lg 10– 4=10 10– 2 С 14+lg 10– 3=11 10– 1 С 14+lg 10– 2=12 21
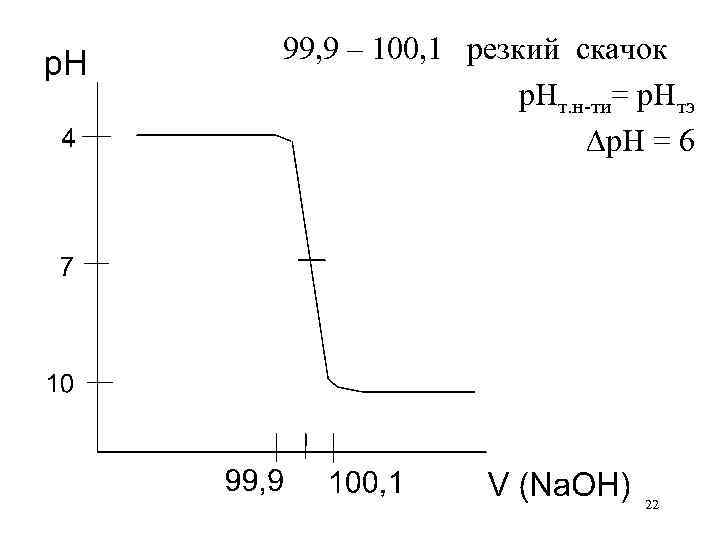 99, 9 – 100, 1 резкий скачок р. Нт. н-ти= р. Нтэ р. Н = 6 22
99, 9 – 100, 1 резкий скачок р. Нт. н-ти= р. Нтэ р. Н = 6 22
 От чего зависит скачок титрования? p. H = р. Н 100, 1 – р. Н 99, 9 = 14+lg 10– 3 С – (–lg 10– 3 С) = = 14 – 3 + lg. C = 8 + 2 lg. C Скачок зависит от: - Температуры (с увеличением tо р. Кводы уменьшается, скачок уменьшается) - Концентрации (с уменьшением концентрации скачок уменьшается) 23
От чего зависит скачок титрования? p. H = р. Н 100, 1 – р. Н 99, 9 = 14+lg 10– 3 С – (–lg 10– 3 С) = = 14 – 3 + lg. C = 8 + 2 lg. C Скачок зависит от: - Температуры (с увеличением tо р. Кводы уменьшается, скачок уменьшается) - Концентрации (с уменьшением концентрации скачок уменьшается) 23
 Как зависит скачок титрования от концентрации? p. H = 8 + 2 lg. C С моль/л 1 p. H 8 0, 1 8– 2=6 0, 01 8– 4=4 0, 001 8– 6=2 0, 0001 8– 8=0 24
Как зависит скачок титрования от концентрации? p. H = 8 + 2 lg. C С моль/л 1 p. H 8 0, 1 8– 2=6 0, 01 8– 4=4 0, 001 8– 6=2 0, 0001 8– 8=0 24
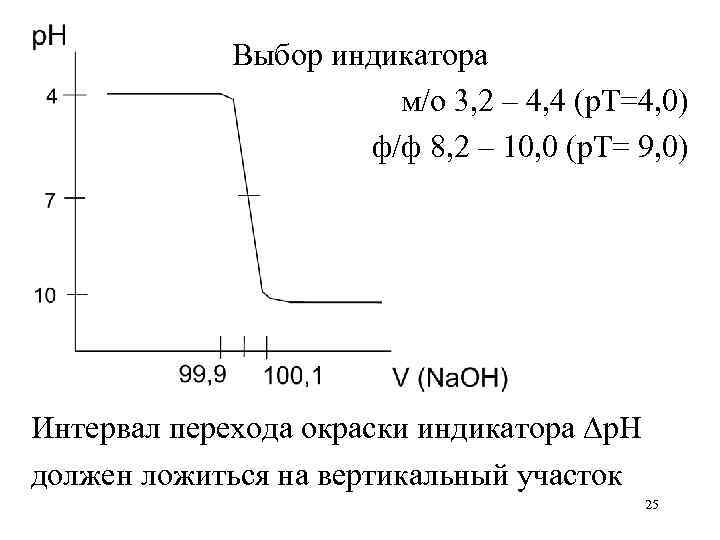 Выбор индикатора м/о 3, 2 – 4, 4 (р. Т=4, 0) ф/ф 8, 2 – 10, 0 (р. Т= 9, 0) Интервал перехода окраски индикатора p. H должен ложиться на вертикальный участок 25
Выбор индикатора м/о 3, 2 – 4, 4 (р. Т=4, 0) ф/ф 8, 2 – 10, 0 (р. Т= 9, 0) Интервал перехода окраски индикатора p. H должен ложиться на вертикальный участок 25
 Расчет, построение и анализ кривой титрования слабой кислоты сильным основанием CH 3 COOH + Na. OH CH 3 COONa + H 2 O C(HA) = C(BOH) = 0, 1 M p. K(CH 3 COOH) = 4, 76 Изменением объема пренебрегаем В начальный момент: слабая кислота р. Н = ½ p. Kк-ты – ½ lg. Cк-ты 26
Расчет, построение и анализ кривой титрования слабой кислоты сильным основанием CH 3 COOH + Na. OH CH 3 COONa + H 2 O C(HA) = C(BOH) = 0, 1 M p. K(CH 3 COOH) = 4, 76 Изменением объема пренебрегаем В начальный момент: слабая кислота р. Н = ½ p. Kк-ты – ½ lg. Cк-ты 26
 До ТЭ: слабая кислота и ее соль Ссоли р. Н = p. Kк-ты + lg——— Ск-ты ТЭ: соль сильного основания и слабой кислоты р. Н = 7 + ½ p. Kк-ты + ½ lg. Cсоли За ТЭ: избыток щелочи и соль (гидролиз подавляется) р. Н = 14 + lg. Сосн 27
До ТЭ: слабая кислота и ее соль Ссоли р. Н = p. Kк-ты + lg——— Ск-ты ТЭ: соль сильного основания и слабой кислоты р. Н = 7 + ½ p. Kк-ты + ½ lg. Cсоли За ТЭ: избыток щелочи и соль (гидролиз подавляется) р. Н = 14 + lg. Сосн 27
 Доб. Отт-но Конц. Ссоли —— щел. к-ты, % к-ты соли Ск-ты — — С 90 90 10– 1 С 9· 10– 1 С 9 10 р. Кк+lg 10 5, 75 99 99 10– 2 С 99· 10– 2 С 99 102 р. Кк+lg 102 6, 75 99, 9 10– 3 С 999· 10– 2 С 999 103 р. Кк+lg 103 7, 75 — ½p. Kк– ½lg. Cк р. Н С=0, 1 0 100 — р. Н р-ра 2, 88 — изб-к щ. % 100, 1 — 0, 1 С конц. щ. 10– 3 С 7+½p. Kк+ ½lg. Cс 8, 88 — 14+lg 10– 3 С 10 101 — 1 10– 2 С — 14+lg 10– 2 С 11 110 — 10 10– 1 С — 14+lg 10– 1 С 12 28
Доб. Отт-но Конц. Ссоли —— щел. к-ты, % к-ты соли Ск-ты — — С 90 90 10– 1 С 9· 10– 1 С 9 10 р. Кк+lg 10 5, 75 99 99 10– 2 С 99· 10– 2 С 99 102 р. Кк+lg 102 6, 75 99, 9 10– 3 С 999· 10– 2 С 999 103 р. Кк+lg 103 7, 75 — ½p. Kк– ½lg. Cк р. Н С=0, 1 0 100 — р. Н р-ра 2, 88 — изб-к щ. % 100, 1 — 0, 1 С конц. щ. 10– 3 С 7+½p. Kк+ ½lg. Cс 8, 88 — 14+lg 10– 3 С 10 101 — 1 10– 2 С — 14+lg 10– 2 С 11 110 — 10 10– 1 С — 14+lg 10– 1 С 12 28
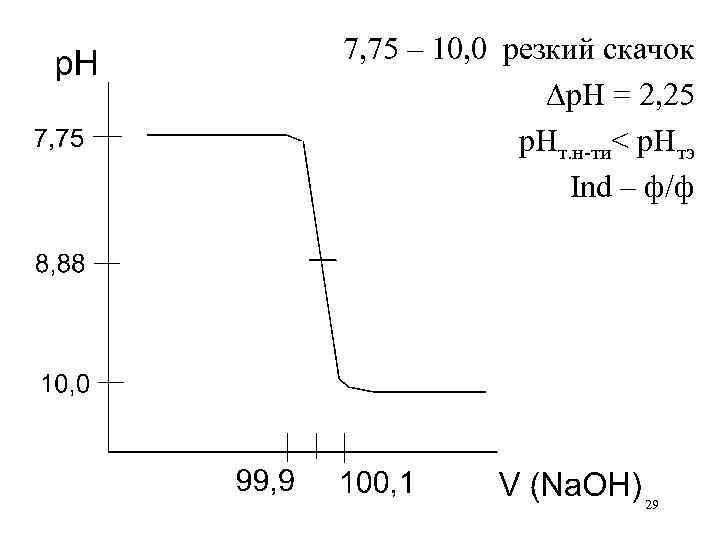 7, 75 – 10, 0 резкий скачок р. Н = 2, 25 р. Нт. н-ти< р. Нтэ Ind – ф/ф 29
7, 75 – 10, 0 резкий скачок р. Н = 2, 25 р. Нт. н-ти< р. Нтэ Ind – ф/ф 29
 От чего зависит скачок титрования? p. H=р. Н 100, 1– р. Н 99, 9=14+lg 10– 3 С – (р. Кк + lg 103) = = 14 – 3 + lg. C – р. Кк– 3 = 8 + lg. C – р. Кк Скачок зависит от: - Температуры (с увеличением tо р. Кводы уменьшается, скачок уменьшается) - Концентрации (с уменьшением концентрации скачок уменьшается) - Природы кислоты (чем слабее кислота, тем меньше скачок) 30
От чего зависит скачок титрования? p. H=р. Н 100, 1– р. Н 99, 9=14+lg 10– 3 С – (р. Кк + lg 103) = = 14 – 3 + lg. C – р. Кк– 3 = 8 + lg. C – р. Кк Скачок зависит от: - Температуры (с увеличением tо р. Кводы уменьшается, скачок уменьшается) - Концентрации (с уменьшением концентрации скачок уменьшается) - Природы кислоты (чем слабее кислота, тем меньше скачок) 30
 Как зависит скачок титрования от силы кислоты? p. H = 8 + lg. C – р. Кк С = 0, 1 моль/л p. H = 7 – р. Кк Если р. Кк 7 p. H = 0 скачка не будет, и нельзя подобрать индикатор 31
Как зависит скачок титрования от силы кислоты? p. H = 8 + lg. C – р. Кк С = 0, 1 моль/л p. H = 7 – р. Кк Если р. Кк 7 p. H = 0 скачка не будет, и нельзя подобрать индикатор 31
 Расчет, построение и анализ кривой титрования сильного основания сильной кислотой Na. OH + HCl Na. Cl + H 2 O C(Na. OH) = C(HCl) = 0, 1 M Изменением объема пренебрегаем до ТЭ : р. Н = 14 + lg. Сосн ТЭ: р. Н = 7 после ТЭ: р. Н = –lg. Cк-ты 32
Расчет, построение и анализ кривой титрования сильного основания сильной кислотой Na. OH + HCl Na. Cl + H 2 O C(Na. OH) = C(HCl) = 0, 1 M Изменением объема пренебрегаем до ТЭ : р. Н = 14 + lg. Сосн ТЭ: р. Н = 7 после ТЭ: р. Н = –lg. Cк-ты 32
 Доб к. Отт. щ. % 0 0 90 90 99 99 99, 9 100 100, 1 — 101 — 110 — Ост-к щ. % Конц щ-чи 100 С 10 10– 1 С 1 10– 2 С 0, 1 10– 3 С — — изб-к конц. к. % к. 0, 1 10– 3 С 1 10– 2 С 10 10– 1 С р. Н р-ра р. Н С=0, 1 М 14+lg. C 14+lg 10– 1 С 14+lg 10– 2 С 14+lg 10– 3 С — 13 12 11 10 7 –lg 10– 3 С –lg 10– 2 С –lg 10– 1 С 4 3 2 33
Доб к. Отт. щ. % 0 0 90 90 99 99 99, 9 100 100, 1 — 101 — 110 — Ост-к щ. % Конц щ-чи 100 С 10 10– 1 С 1 10– 2 С 0, 1 10– 3 С — — изб-к конц. к. % к. 0, 1 10– 3 С 1 10– 2 С 10 10– 1 С р. Н р-ра р. Н С=0, 1 М 14+lg. C 14+lg 10– 1 С 14+lg 10– 2 С 14+lg 10– 3 С — 13 12 11 10 7 –lg 10– 3 С –lg 10– 2 С –lg 10– 1 С 4 3 2 33
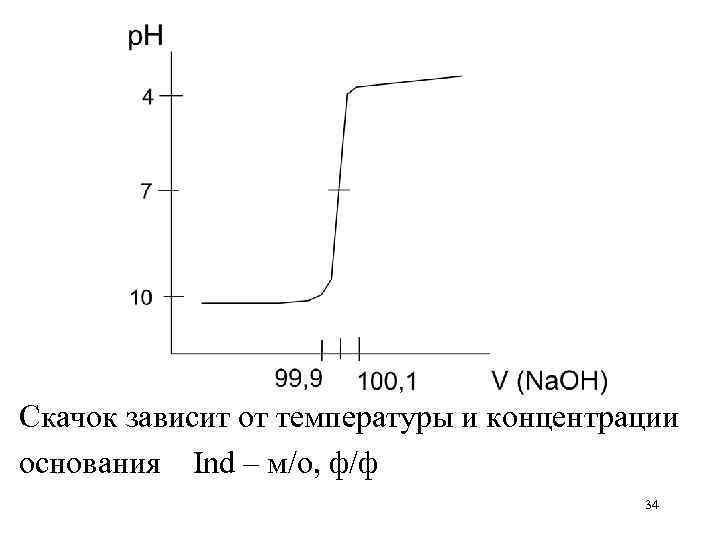 Скачок зависит от температуры и концентрации основания Ind – м/о, ф/ф 34
Скачок зависит от температуры и концентрации основания Ind – м/о, ф/ф 34
 Расчет, построение и анализ кривой титрования слабого основания сильной кислотой NH 4 OH + HCl NH 4 Cl + H 2 O C(NH 4 OH) = C(HCl) = 0, 1 M р. К(NH 4 OH)=4, 75 Изменением объема пренебрегаем В начальный момент: слабое основание р. Н =14 – ½ p. Kосн + ½ lg. Cосн 35
Расчет, построение и анализ кривой титрования слабого основания сильной кислотой NH 4 OH + HCl NH 4 Cl + H 2 O C(NH 4 OH) = C(HCl) = 0, 1 M р. К(NH 4 OH)=4, 75 Изменением объема пренебрегаем В начальный момент: слабое основание р. Н =14 – ½ p. Kосн + ½ lg. Cосн 35
 До ТЭ: слабое основание и его соль Ссоли р. Н =14 – p. Kосн – lg——— Сосн ТЭ: соль сильной кислоты и слабого основания р. Н = 7 – ½ p. Kосн – ½ lg. Cсоли За ТЭ: избыток кислоты и соль (гидролиз подавляется) р. Н = – lg. Ск-ты 36
До ТЭ: слабое основание и его соль Ссоли р. Н =14 – p. Kосн – lg——— Сосн ТЭ: соль сильной кислоты и слабого основания р. Н = 7 – ½ p. Kосн – ½ lg. Cсоли За ТЭ: избыток кислоты и соль (гидролиз подавляется) р. Н = – lg. Ск-ты 36
 Доб. Отт-но Конц. Ссоли —— К-ты. осн, % осн соли Сосн 0 — С 90 90 10– 1 С 99 99 10– 2 С — 9· 10– 1 С — р. Н р-ра р. Н С=0, 1 14–½p. Kо+½lg. Cо 12, 13 9 10 14–р. Ко–lg 10 8, 25 99· 10– 2 С 99 102 14–р. Ко–lg 102 7, 25 99, 9 10– 3 С 999· 10– 2 С 999 103 14–р. Ко– lg 103 6, 25 100 — изб-к к. % 100, 1 — 0, 1 С конц. к. 10– 3 С 101 — 1 110 — 7–½p. Kо–½lg. Cс 5, 13 — –lg 10– 3 С 4 10– 2 С — –lg 10– 2 С 3 10– 1 С — –lg 10– 1 С 37 2
Доб. Отт-но Конц. Ссоли —— К-ты. осн, % осн соли Сосн 0 — С 90 90 10– 1 С 99 99 10– 2 С — 9· 10– 1 С — р. Н р-ра р. Н С=0, 1 14–½p. Kо+½lg. Cо 12, 13 9 10 14–р. Ко–lg 10 8, 25 99· 10– 2 С 99 102 14–р. Ко–lg 102 7, 25 99, 9 10– 3 С 999· 10– 2 С 999 103 14–р. Ко– lg 103 6, 25 100 — изб-к к. % 100, 1 — 0, 1 С конц. к. 10– 3 С 101 — 1 110 — 7–½p. Kо–½lg. Cс 5, 13 — –lg 10– 3 С 4 10– 2 С — –lg 10– 2 С 3 10– 1 С — –lg 10– 1 С 37 2
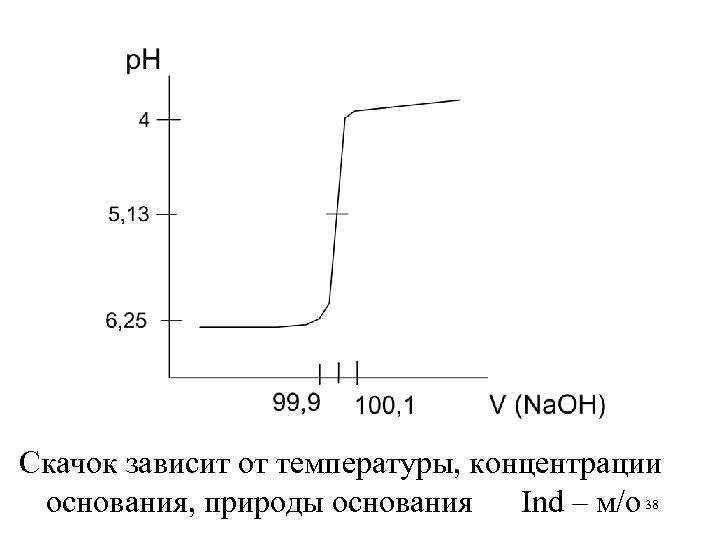 Скачок зависит от температуры, концентрации основания, природы основания Ind – м/о 38
Скачок зависит от температуры, концентрации основания, природы основания Ind – м/о 38
 Расчетные формулы р. Н при титровании слабой двухосновной к-ты сильным основанием H 2 SO 3 + 2 Na. OH Na 2 SO 3 + H 2 O Нач: H 2 SO 3 р. Н = ½ p. K 1 к-ты – ½ lg. Cк-ты До 1 ТЭ: H 2 SO 3 + Na. HSO 3 1 ТЭ: Na. HSO 3 Ссоли р. Н = p. K 1 к-ты + lg——— Ск-ты p. K 1 к-ты + p. K 2 к-ты р. Н = ——————— 2 39
Расчетные формулы р. Н при титровании слабой двухосновной к-ты сильным основанием H 2 SO 3 + 2 Na. OH Na 2 SO 3 + H 2 O Нач: H 2 SO 3 р. Н = ½ p. K 1 к-ты – ½ lg. Cк-ты До 1 ТЭ: H 2 SO 3 + Na. HSO 3 1 ТЭ: Na. HSO 3 Ссоли р. Н = p. K 1 к-ты + lg——— Ск-ты p. K 1 к-ты + p. K 2 к-ты р. Н = ——————— 2 39
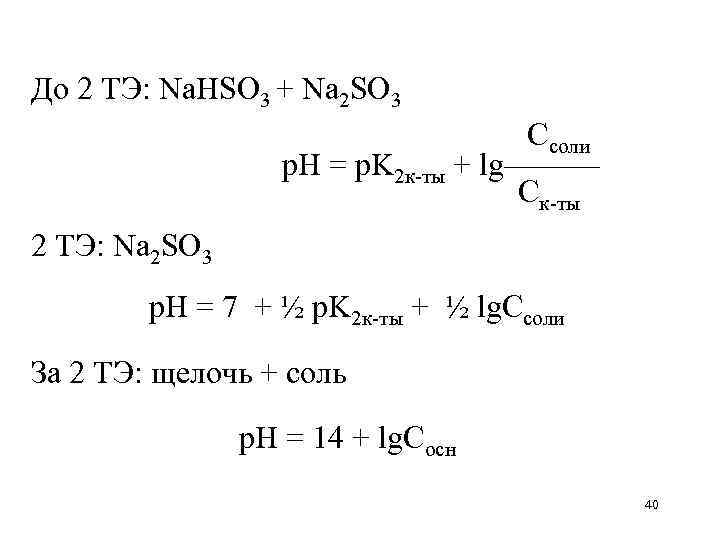 До 2 ТЭ: Na. HSO 3 + Na 2 SO 3 Ссоли р. Н = p. K 2 к-ты + lg——— Ск-ты 2 ТЭ: Na 2 SO 3 р. Н = 7 + ½ p. K 2 к-ты + ½ lg. Cсоли За 2 ТЭ: щелочь + соль р. Н = 14 + lg. Сосн 40
До 2 ТЭ: Na. HSO 3 + Na 2 SO 3 Ссоли р. Н = p. K 2 к-ты + lg——— Ск-ты 2 ТЭ: Na 2 SO 3 р. Н = 7 + ½ p. K 2 к-ты + ½ lg. Cсоли За 2 ТЭ: щелочь + соль р. Н = 14 + lg. Сосн 40
 Расчетные формулы р. Н при титровании соли слабой двухосновной к-ты сильной кислотой Na 2 SO 3 + 2 HCl H 2 SO 3 + 2 Na. Cl Нач: Na 2 SO 3 р. Н = ½ p. K 1 к-ты – ½ lg. Cк-ты До 1 ТЭ: Na 2 SO 3 + Na. HSO 3 1 ТЭ: Na. HSO 3 Ссоли р. Н = p. K 2 к-ты + lg——— Ск-ты p. K 1 к-ты + p. K 2 к-ты р. Н = ——————— 2 41
Расчетные формулы р. Н при титровании соли слабой двухосновной к-ты сильной кислотой Na 2 SO 3 + 2 HCl H 2 SO 3 + 2 Na. Cl Нач: Na 2 SO 3 р. Н = ½ p. K 1 к-ты – ½ lg. Cк-ты До 1 ТЭ: Na 2 SO 3 + Na. HSO 3 1 ТЭ: Na. HSO 3 Ссоли р. Н = p. K 2 к-ты + lg——— Ск-ты p. K 1 к-ты + p. K 2 к-ты р. Н = ——————— 2 41
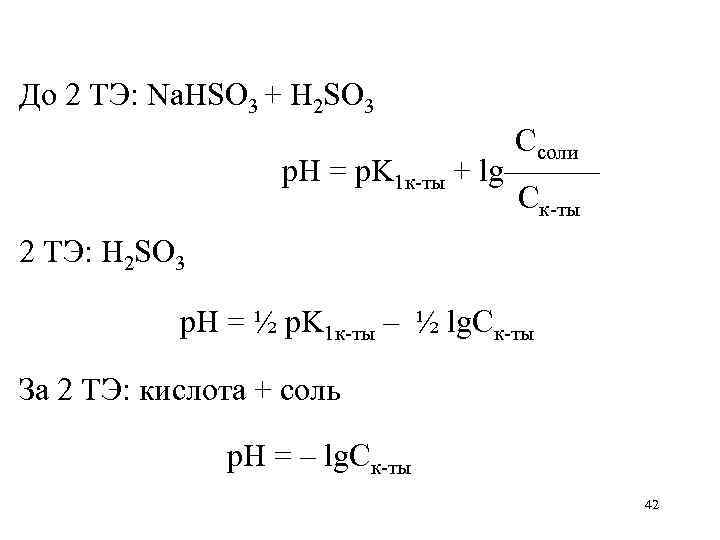 До 2 ТЭ: Na. HSO 3 + H 2 SO 3 Ссоли р. Н = p. K 1 к-ты + lg——— Ск-ты 2 ТЭ: H 2 SO 3 р. Н = ½ p. K 1 к-ты – ½ lg. Cк-ты За 2 ТЭ: кислота + соль р. Н = – lg. Ск-ты 42
До 2 ТЭ: Na. HSO 3 + H 2 SO 3 Ссоли р. Н = p. K 1 к-ты + lg——— Ск-ты 2 ТЭ: H 2 SO 3 р. Н = ½ p. K 1 к-ты – ½ lg. Cк-ты За 2 ТЭ: кислота + соль р. Н = – lg. Ск-ты 42
 Индикаторные ошибки кислотно-основного титрования Индикаторные ошибки обусловлены несовпадением р. Н конца титрования (р. ТInd) и р. Н точки эквивалентности 43
Индикаторные ошибки кислотно-основного титрования Индикаторные ошибки обусловлены несовпадением р. Н конца титрования (р. ТInd) и р. Н точки эквивалентности 43
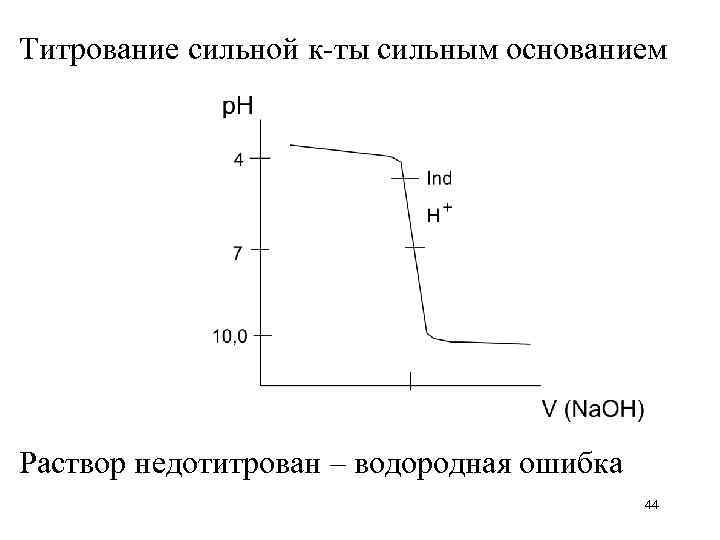 Титрование сильной к-ты сильным основанием Раствор недотитрован – водородная ошибка 44
Титрование сильной к-ты сильным основанием Раствор недотитрован – водородная ошибка 44
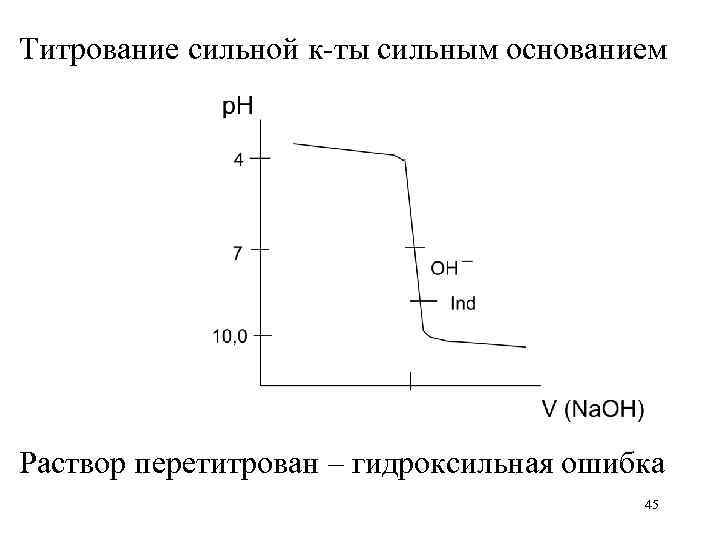 Титрование сильной к-ты сильным основанием Раствор перетитрован – гидроксильная ошибка 45
Титрование сильной к-ты сильным основанием Раствор перетитрован – гидроксильная ошибка 45
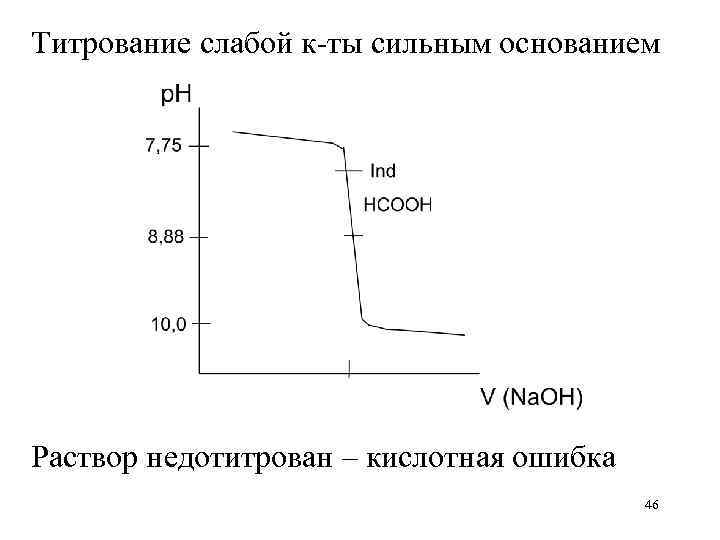 Титрование слабой к-ты сильным основанием Раствор недотитрован – кислотная ошибка 46
Титрование слабой к-ты сильным основанием Раствор недотитрован – кислотная ошибка 46
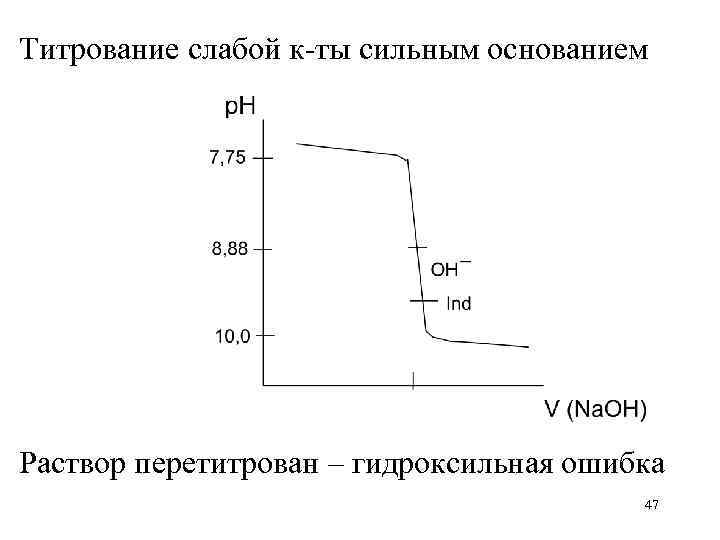 Титрование слабой к-ты сильным основанием Раствор перетитрован – гидроксильная ошибка 47
Титрование слабой к-ты сильным основанием Раствор перетитрован – гидроксильная ошибка 47
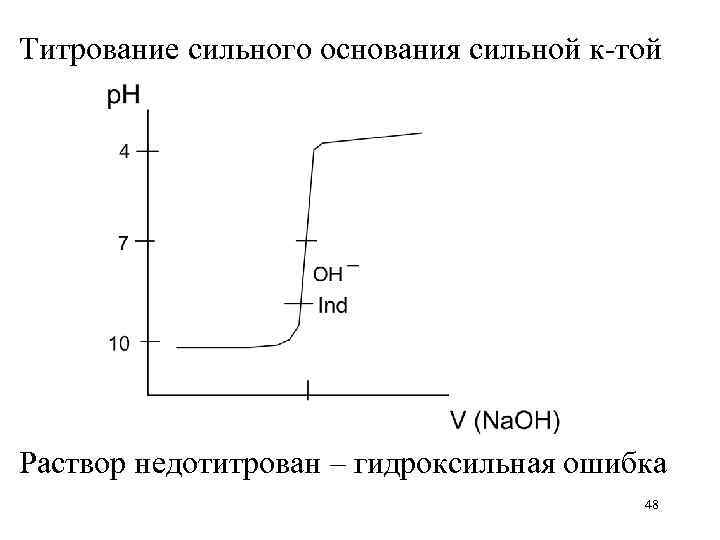 Титрование сильного основания сильной к-той Раствор недотитрован – гидроксильная ошибка 48
Титрование сильного основания сильной к-той Раствор недотитрован – гидроксильная ошибка 48
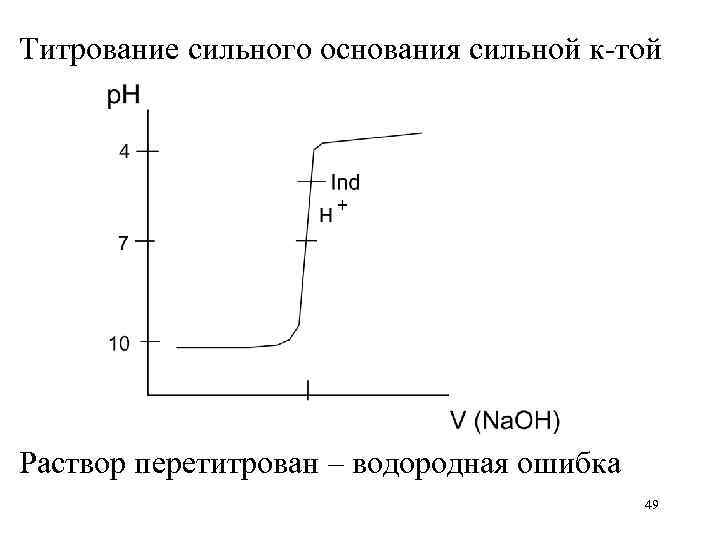 Титрование сильного основания сильной к-той Раствор перетитрован – водородная ошибка 49
Титрование сильного основания сильной к-той Раствор перетитрован – водородная ошибка 49
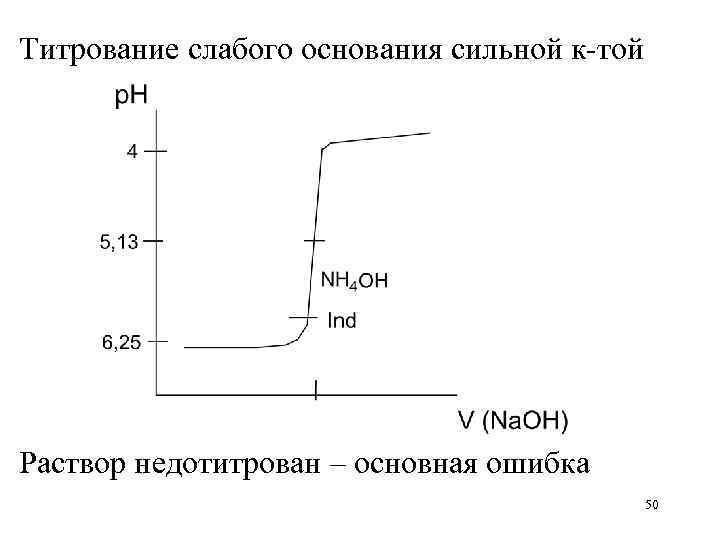 Титрование слабого основания сильной к-той Раствор недотитрован – основная ошибка 50
Титрование слабого основания сильной к-той Раствор недотитрован – основная ошибка 50
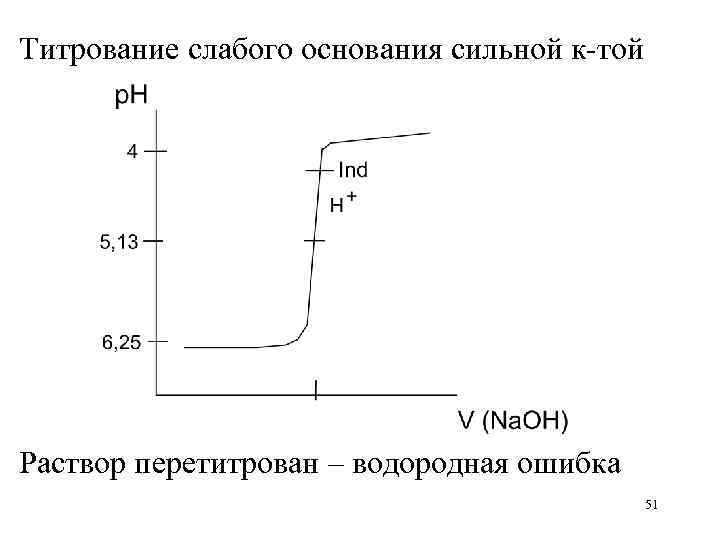 Титрование слабого основания сильной к-той Раствор перетитрован – водородная ошибка 51
Титрование слабого основания сильной к-той Раствор перетитрован – водородная ошибка 51
 52
52


