Lektsia__14-16_2011.ppt
- Количество слайдов: 61
 Лекция 14 "Химия металлов" Зависимость свойств металлов от их положения в периодической системе Д. И. Менделеева. Основные методы получения металлов. Свойства рметаллов и их соединений. Свойства переходных металлов, d-элементы IV-VII групп.
Лекция 14 "Химия металлов" Зависимость свойств металлов от их положения в периодической системе Д. И. Менделеева. Основные методы получения металлов. Свойства рметаллов и их соединений. Свойства переходных металлов, d-элементы IV-VII групп.
 • Металлы отличаются главным образом свойствами: 1. 2. 3. 4. Имеют своеобразный металлический блеск; незначительной светопропускаемостью. Обладают большей частью хорошей ковкостью; высокой теплопроводностью; 5. хорошей электропроводностью от неметаллов следующими
• Металлы отличаются главным образом свойствами: 1. 2. 3. 4. Имеют своеобразный металлический блеск; незначительной светопропускаемостью. Обладают большей частью хорошей ковкостью; высокой теплопроводностью; 5. хорошей электропроводностью от неметаллов следующими
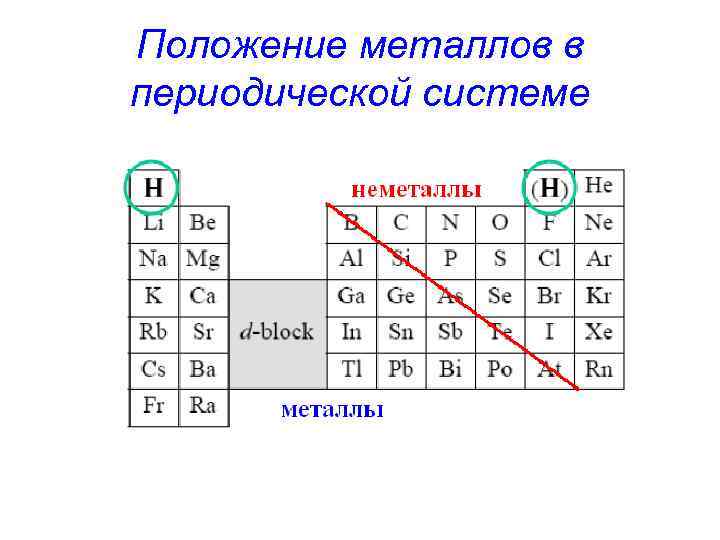 Положение металлов в периодической системе
Положение металлов в периодической системе
 Металлы s-элементы (кроме водорода и гелия); p-элементы ( Al, Ga, In, Tl, Sn, Pb, Bi )
Металлы s-элементы (кроме водорода и гелия); p-элементы ( Al, Ga, In, Tl, Sn, Pb, Bi )
 Способы получения металлов 1. • • Пирометаллургия: Sn. O 2 + C = Sn + CO 2 , 2 Сu 2 О + С = 4 Сu + CО 2 Cr 2 O 3 + 2 Al = 2 Cr + Al 2 O 3 2 Pb. S + 3 O 2 = 2 Pb. O + 2 SO 2; Pb. O +CO = Pb + CO 2; Zn. CO 3 = Zn. O + CO 2; 2 Zn. O + C = 2 Zn + CO 2
Способы получения металлов 1. • • Пирометаллургия: Sn. O 2 + C = Sn + CO 2 , 2 Сu 2 О + С = 4 Сu + CО 2 Cr 2 O 3 + 2 Al = 2 Cr + Al 2 O 3 2 Pb. S + 3 O 2 = 2 Pb. O + 2 SO 2; Pb. O +CO = Pb + CO 2; Zn. CO 3 = Zn. O + CO 2; 2 Zn. O + C = 2 Zn + CO 2
 2. Гидрометаллургия: Cu. S + Fe 2(SO 4)3 = Cu. SO 4 + 2 Fe. SO 4 + S 3. Электрометаллургия - процессы получения металлов с применением электрического тока – электротермия и электролиз (из расплавов солей Na. Cl, Ca. Cl 2 и др. , алюминия).
2. Гидрометаллургия: Cu. S + Fe 2(SO 4)3 = Cu. SO 4 + 2 Fe. SO 4 + S 3. Электрометаллургия - процессы получения металлов с применением электрического тока – электротермия и электролиз (из расплавов солей Na. Cl, Ca. Cl 2 и др. , алюминия).


 • Химия s-металлов и их соединений самостоятельно по учебнику.
• Химия s-металлов и их соединений самостоятельно по учебнику.
 Химия р-металлов и их соединений ns 2 np 1÷ 3, где n = 3 – 6 высшая степень окисления становится менее устойчивой
Химия р-металлов и их соединений ns 2 np 1÷ 3, где n = 3 – 6 высшая степень окисления становится менее устойчивой
 Электрохимический ряд Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, -1. 66 +0. 24 Cu, Hg, Ag, Pd, Pt, Au. • Величины φ° свидетельствуют, что высокой химической активностью pметаллы не обладают (за исключением алюминия). Этим определяется их отношение к воде, кислотам и щелочам
Электрохимический ряд Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, -1. 66 +0. 24 Cu, Hg, Ag, Pd, Pt, Au. • Величины φ° свидетельствуют, что высокой химической активностью pметаллы не обладают (за исключением алюминия). Этим определяется их отношение к воде, кислотам и щелочам
 • 2 Tl + 2 H 2 O = 2 Tl. OH + H 2↑ • В кислотах-неокислителях (HCl, H 2 SO 4(разб)) легко растворяются Al, Ga, In, медленно Sn. • Малоактивные - Gе, Sb, Bi могут растворяться в НCl и H 2 SO 4(разб), в присутствии окислителя O 2: 4 Sb +12 HCl +3 O 2 = 4 Sb. Cl 3 + 6 Н 2 О. • С H 2 SO 4 конц. при нагревании взаимодействуют все металлы, (кроме Al - пассивируется): • Sn + 4 H 2 SO 4 (конц) = 2 SO 2 ↑ + Sn(SO 4)2 + 4 H 2 O • 2 Bi + 6 H 2 SO 4 (конц) = 3 SO 2↑ + Bi 2(SO 4)3 + 6 H 2 O • 2 Sb + 5 H 2 SO 4 (конц) = 5 SO 2↑ + 2 H 3 Sb. O 4 + 2 H 2 O
• 2 Tl + 2 H 2 O = 2 Tl. OH + H 2↑ • В кислотах-неокислителях (HCl, H 2 SO 4(разб)) легко растворяются Al, Ga, In, медленно Sn. • Малоактивные - Gе, Sb, Bi могут растворяться в НCl и H 2 SO 4(разб), в присутствии окислителя O 2: 4 Sb +12 HCl +3 O 2 = 4 Sb. Cl 3 + 6 Н 2 О. • С H 2 SO 4 конц. при нагревании взаимодействуют все металлы, (кроме Al - пассивируется): • Sn + 4 H 2 SO 4 (конц) = 2 SO 2 ↑ + Sn(SO 4)2 + 4 H 2 O • 2 Bi + 6 H 2 SO 4 (конц) = 3 SO 2↑ + Bi 2(SO 4)3 + 6 H 2 O • 2 Sb + 5 H 2 SO 4 (конц) = 5 SO 2↑ + 2 H 3 Sb. O 4 + 2 H 2 O
 • Ge, Sn, Sb - окисляются HNO 3(конц) до кислот (оксидов) – германиевой H 2 Ge. O 3 (Ge. O 2· n Н 2 О), оловянной H 2 Sn. O 3 (Sn. O 2 · 2 H 2 O), сурьмяной H 3 Sb. O 4 (Sb 2 O 5 · n. H 2 O): • 3 Sn + 4 HNO 3(конц) + H 2 O = 3 H 2 Sn. O 3↓ + 4 NO. 2 Sn + 8 HNO 3(разб) = 2 NO↑ + 3 Sn(NO 3)2 + 4 H 2 O, • Bi и Рb по отношению к HNO 3 любых концентраций выступают как металлы • Bi + 4 HNO 3(разб) = NO↑ + Bi(NO 3)3 + 2 H 2 O, • Al пассивируется HNO 3(конц), 3 Ge +4 HNO 3+18 HCl = 4 NO 2↑+ 3 H 2[Ge. Cl 6]+8 H 2 O.
• Ge, Sn, Sb - окисляются HNO 3(конц) до кислот (оксидов) – германиевой H 2 Ge. O 3 (Ge. O 2· n Н 2 О), оловянной H 2 Sn. O 3 (Sn. O 2 · 2 H 2 O), сурьмяной H 3 Sb. O 4 (Sb 2 O 5 · n. H 2 O): • 3 Sn + 4 HNO 3(конц) + H 2 O = 3 H 2 Sn. O 3↓ + 4 NO. 2 Sn + 8 HNO 3(разб) = 2 NO↑ + 3 Sn(NO 3)2 + 4 H 2 O, • Bi и Рb по отношению к HNO 3 любых концентраций выступают как металлы • Bi + 4 HNO 3(разб) = NO↑ + Bi(NO 3)3 + 2 H 2 O, • Al пассивируется HNO 3(конц), 3 Ge +4 HNO 3+18 HCl = 4 NO 2↑+ 3 H 2[Ge. Cl 6]+8 H 2 O.
 Со щелочами взаимодействуют: • активно Al и Ga, • медленно при нагревании In, Sn, Pb. • В присутствие окислителей процесс заметно ускоряется • Sn + 2 KOH + 2 H 2 O = K 2[Sn 2+(OH)4] + H 2↑, • Sn + 2 KOH + 2 H 2 O 2 = K 2[Sn 4+(OH)6].
Со щелочами взаимодействуют: • активно Al и Ga, • медленно при нагревании In, Sn, Pb. • В присутствие окислителей процесс заметно ускоряется • Sn + 2 KOH + 2 H 2 O = K 2[Sn 2+(OH)4] + H 2↑, • Sn + 2 KOH + 2 H 2 O 2 = K 2[Sn 4+(OH)6].
 Соединения p-металлов • Гидриды известны для всех р-металлов: Ge. H 4 – Sn. H 4 – Рb. Н 4 и Al. H 3 – Sb. H 3 – Bi. H 3 восстановительные свойства усиливаются Получают косвенным методом: Mg 2 Sn + 4 HCl = Sn. H 4↑ + 2 Mg. Cl 2, станнан As 2 O 3+6 Zn+12 HCl = 2 As. H 3↑+6 Zn. Cl 2+3 H 2 O, арсин
Соединения p-металлов • Гидриды известны для всех р-металлов: Ge. H 4 – Sn. H 4 – Рb. Н 4 и Al. H 3 – Sb. H 3 – Bi. H 3 восстановительные свойства усиливаются Получают косвенным методом: Mg 2 Sn + 4 HCl = Sn. H 4↑ + 2 Mg. Cl 2, станнан As 2 O 3+6 Zn+12 HCl = 2 As. H 3↑+6 Zn. Cl 2+3 H 2 O, арсин
 • Оксиды образуют все p-металлы. При сгорании некоторых р-металлов в кислороде образуются высшие оксиды (Al 2 O 3, Ga 2 O 3, In 2 O 3, Ge. O 2, Sn. O 2), в ряде случаев − низшие (Tl 2 O, Pb. O, Sb 2 O 3, Bi 2 O 3). • для получения оксидов используют и другие методы: • 4 Bi(NO 3)3 = 2 Bi 2 O 3 + 12 NO + 3 O 2 , • Pb(CH 3 COO)2 + Ca. OCl 2 + H 2 O = Pb. O 2 + Ca. Cl 2 + 2 CH 3 COOH , • Sn. Cl 2 + 2 KOH = Sn. O + 2 KCl + H 2 O.
• Оксиды образуют все p-металлы. При сгорании некоторых р-металлов в кислороде образуются высшие оксиды (Al 2 O 3, Ga 2 O 3, In 2 O 3, Ge. O 2, Sn. O 2), в ряде случаев − низшие (Tl 2 O, Pb. O, Sb 2 O 3, Bi 2 O 3). • для получения оксидов используют и другие методы: • 4 Bi(NO 3)3 = 2 Bi 2 O 3 + 12 NO + 3 O 2 , • Pb(CH 3 COO)2 + Ca. OCl 2 + H 2 O = Pb. O 2 + Ca. Cl 2 + 2 CH 3 COOH , • Sn. Cl 2 + 2 KOH = Sn. O + 2 KCl + H 2 O.
 оксиды р-металлов – это нерастворимые в воде, амфотерные по свойствам соединения (за исключением основных Tl 2 O, Bi 2 O 3). Al 2 O 3 –In 2 O 3 – Tl 2 O 3 Ge. O – Sn. O – Pb. O усиливаются основные св-ва
оксиды р-металлов – это нерастворимые в воде, амфотерные по свойствам соединения (за исключением основных Tl 2 O, Bi 2 O 3). Al 2 O 3 –In 2 O 3 – Tl 2 O 3 Ge. O – Sn. O – Pb. O усиливаются основные св-ва
 • Высшие оксиды являются кислотообразующими, легче растворяются в щелочах • Sn. O 2 + 2 Na. OH + 2 H 2 O = Na 2[Sn(OH)6]. Высшие оксиды, как правило, неустойчивы: • Bi 2 O 5 = Вi 2 O 3 + O 2 , 2 Pb. O 2 = 2 Pb. O + O 2 • Соединения Pb (+4) − сильнейшие окислители, особенно в кислой среде, соединения Tl (+1) − восстановители: 5 Pb. O 2+2 Mn. SO 4+3 H 2 SO 4=5 Pb. SO 4↓+2 HMn. O 4+2 H 2 O, 5 Tl. Cl+2 KBi. O 3+12 HCl = 2 Bi+ 5 Tl. Cl 3 + 2 KCl + 6 H 2 O.
• Высшие оксиды являются кислотообразующими, легче растворяются в щелочах • Sn. O 2 + 2 Na. OH + 2 H 2 O = Na 2[Sn(OH)6]. Высшие оксиды, как правило, неустойчивы: • Bi 2 O 5 = Вi 2 O 3 + O 2 , 2 Pb. O 2 = 2 Pb. O + O 2 • Соединения Pb (+4) − сильнейшие окислители, особенно в кислой среде, соединения Tl (+1) − восстановители: 5 Pb. O 2+2 Mn. SO 4+3 H 2 SO 4=5 Pb. SO 4↓+2 HMn. O 4+2 H 2 O, 5 Tl. Cl+2 KBi. O 3+12 HCl = 2 Bi+ 5 Tl. Cl 3 + 2 KCl + 6 H 2 O.
 • Гидроксиды р-металлов − малорастворимые соединения. Все они амфотерны (кроме Tl. ОН и Bi(OH)3), Растворяются в кислотах и щелочах: • Pb(OH)2 + 4 HNO 3 = 2 Pb(NO 3)2 + 2 H 2 O, • Sn(OH)2 + 2 KOH = K 2[Sn(OH)4] • Ge(OH)4 + 2 Na. OH = Na 2[Ge(OH)6] • с увеличением размеров атомов усиливаются основные свойства.
• Гидроксиды р-металлов − малорастворимые соединения. Все они амфотерны (кроме Tl. ОН и Bi(OH)3), Растворяются в кислотах и щелочах: • Pb(OH)2 + 4 HNO 3 = 2 Pb(NO 3)2 + 2 H 2 O, • Sn(OH)2 + 2 KOH = K 2[Sn(OH)4] • Ge(OH)4 + 2 Na. OH = Na 2[Ge(OH)6] • с увеличением размеров атомов усиливаются основные свойства.
 в гидроксидах Э(ОН)2 преобладают основные свойства, гидроксиды Э(ОН)4 являются кислотными. Они легко теряют воду. Исключение составляет Тl. ОН - является сильным основанием, хорошо растворимым в H 2 O (устойчив до 100°C) Высшим оксидам соответствуют очень слабые, малорастворимые кислоты переменного состава Ме. О 2 · n H 2 O или Ме 2 О 5 · n H 2 O.
в гидроксидах Э(ОН)2 преобладают основные свойства, гидроксиды Э(ОН)4 являются кислотными. Они легко теряют воду. Исключение составляет Тl. ОН - является сильным основанием, хорошо растворимым в H 2 O (устойчив до 100°C) Высшим оксидам соответствуют очень слабые, малорастворимые кислоты переменного состава Ме. О 2 · n H 2 O или Ме 2 О 5 · n H 2 O.
 Химия d-металлов и их соединений • элементы побочных IВ–VIIIВ-подгрупп • электронная формула: (n– 1)d 1– 10 ns 0– 2 • В периоде слева направо происходит уменьшение атомного радиуса элементов эффект «d-сжатия» • Атомный радиус в побочных подгруппах несколько уменьшается или остается практически неизменным за счет сокращения размеров внутренних f-орбиталей ( «лантаноидное сжатие» )
Химия d-металлов и их соединений • элементы побочных IВ–VIIIВ-подгрупп • электронная формула: (n– 1)d 1– 10 ns 0– 2 • В периоде слева направо происходит уменьшение атомного радиуса элементов эффект «d-сжатия» • Атомный радиус в побочных подгруппах несколько уменьшается или остается практически неизменным за счет сокращения размеров внутренних f-орбиталей ( «лантаноидное сжатие» )
 VIIB Iион, э. В Mn, 7. 44 Tc, 7. 28 Re, 7. 88 IB Iион, э. В Cu, 7. 72 Ag, 7. 57 Au, 9. 22 IIB Iион, э. В Zn, 9. 38 Cd, 8. 99 Hg, 10. 43 Cверху вниз в подгруппах (кроме IIIB): увеличивается Iион, э. В уменьшаются металлические свойства Уменьшается восстановительная активность
VIIB Iион, э. В Mn, 7. 44 Tc, 7. 28 Re, 7. 88 IB Iион, э. В Cu, 7. 72 Ag, 7. 57 Au, 9. 22 IIB Iион, э. В Zn, 9. 38 Cd, 8. 99 Hg, 10. 43 Cверху вниз в подгруппах (кроме IIIB): увеличивается Iион, э. В уменьшаются металлические свойства Уменьшается восстановительная активность
 ГРУППА Iион, э. В IV Zr 6. 84 V VI VII Nb Mo Tc 6. 88 7. 10 VIII Ru, Rh, Pd 7. 28 7. 37 7. 46 8. 34 Металлические свойства уменьшаются Первый потенциал ионизации возрастает
ГРУППА Iион, э. В IV Zr 6. 84 V VI VII Nb Mo Tc 6. 88 7. 10 VIII Ru, Rh, Pd 7. 28 7. 37 7. 46 8. 34 Металлические свойства уменьшаются Первый потенциал ионизации возрастает
 • Минимальные восстановительные свойства в периодах с ростом порядкового номера проявляют тяжелые металлы VIIIВ- и IВ-групп. За свою инертность они названы благородными
• Минимальные восстановительные свойства в периодах с ростом порядкового номера проявляют тяжелые металлы VIIIВ- и IВ-групп. За свою инертность они названы благородными
 • Металлы, стоящие за лантаноидами, благодаря fсжатию имеют пониженную активность и большие потенциалы ионизации. Поэтому 3 d-элементы по химической активности существенно отличаются от 4 d- и 5 d-элементов. Так, элементы 4 -го периода (3 d) практически все растворимы в кислотах. • Cr + 2 HCl = Cr. Cl 2 + H 2 , • Ti + 4 H 2 SO 4(к) = Ti(SO 4)2 + 2 SO 2 + 4 H 2 O, • V + 6 HNO 3(к) = VO 2 NO 3 + 5 NO 2 + 3 H 2 O.
• Металлы, стоящие за лантаноидами, благодаря fсжатию имеют пониженную активность и большие потенциалы ионизации. Поэтому 3 d-элементы по химической активности существенно отличаются от 4 d- и 5 d-элементов. Так, элементы 4 -го периода (3 d) практически все растворимы в кислотах. • Cr + 2 HCl = Cr. Cl 2 + H 2 , • Ti + 4 H 2 SO 4(к) = Ti(SO 4)2 + 2 SO 2 + 4 H 2 O, • V + 6 HNO 3(к) = VO 2 NO 3 + 5 NO 2 + 3 H 2 O.
 Лекция 15, 16 "Химия металлов". Свойства переходных металлов, dэлементы IV-VII групп. Химия элементов семейства железа, их химические соединения. Химия металлов подгрупп меди и цинка.
Лекция 15, 16 "Химия металлов". Свойства переходных металлов, dэлементы IV-VII групп. Химия элементов семейства железа, их химические соединения. Химия металлов подгрупп меди и цинка.


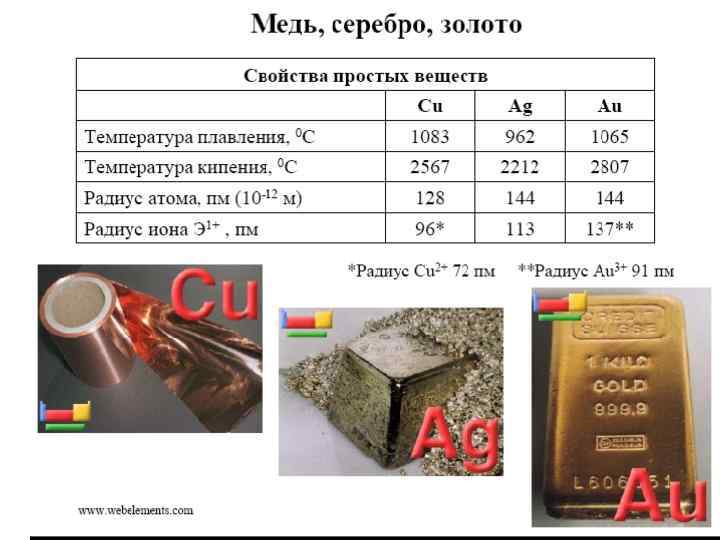
 Свойства элементов
Свойства элементов
 Химические свойства • Взаимодействие с кислотами: • • 3 Cu +8 HNO 3(разб) 3 Сu(NO 3)2 +2 NO + 4 H 2 O Cu + 4 HNO 3(конц) Сu(NO 3)2 + 2 NO 2 + 2 H 2 O Cu + H 2 SO 4(конц) Cu. SO 4 + SO 2 + H 2 O 2 Cu + 4 HCl(разб) + O 2 2 Cu. Cl 2 + 2 H 2 O 2 Cu + 4 HCl(конц) 2 H[Cu. Cl 2] + H 2 Ag. Cl + HCl = H[Ag(Cl 2)] Ag + 2 HNO 3(конц) Ag. NO 3 + NO 2 +H 2 O Au + HNO 3 + 4 HCl = H[Au. Cl 4] + NO + 2 H 2 O • 2 Au + 6 H 2 Se. O 4 Au 2(Se. O 4)3 + 3 H 2 Se. O 3 + 3 H 2 O
Химические свойства • Взаимодействие с кислотами: • • 3 Cu +8 HNO 3(разб) 3 Сu(NO 3)2 +2 NO + 4 H 2 O Cu + 4 HNO 3(конц) Сu(NO 3)2 + 2 NO 2 + 2 H 2 O Cu + H 2 SO 4(конц) Cu. SO 4 + SO 2 + H 2 O 2 Cu + 4 HCl(разб) + O 2 2 Cu. Cl 2 + 2 H 2 O 2 Cu + 4 HCl(конц) 2 H[Cu. Cl 2] + H 2 Ag. Cl + HCl = H[Ag(Cl 2)] Ag + 2 HNO 3(конц) Ag. NO 3 + NO 2 +H 2 O Au + HNO 3 + 4 HCl = H[Au. Cl 4] + NO + 2 H 2 O • 2 Au + 6 H 2 Se. O 4 Au 2(Se. O 4)3 + 3 H 2 Se. O 3 + 3 H 2 O
 Сu(I) • 2 Cu. Cl 2 = 2 Cu. Cl + Cl 2 t = 500 C • Иодид меди +2 распадается в момент образования: • 2 Cu. Cl 2 + 4 KI = 2 Cu. I + I 2 + 4 KCl • В присутствии кислорода медь растворяется в водном растворе аммиака: • 4 Cu + 8 NH 3 + O 2 + 2 H 2 O = 4 [Cu(NH 3)2]OH • [Cu(NH 3)2]+ + e- = Cu + 2 NH 3 E 0 = -0, 12 В
Сu(I) • 2 Cu. Cl 2 = 2 Cu. Cl + Cl 2 t = 500 C • Иодид меди +2 распадается в момент образования: • 2 Cu. Cl 2 + 4 KI = 2 Cu. I + I 2 + 4 KCl • В присутствии кислорода медь растворяется в водном растворе аммиака: • 4 Cu + 8 NH 3 + O 2 + 2 H 2 O = 4 [Cu(NH 3)2]OH • [Cu(NH 3)2]+ + e- = Cu + 2 NH 3 E 0 = -0, 12 В
 Cu(II) • Соединения меди +2 обладают слабо выраженными амфотерными свойствами – гидроксид растворяется в концентрированных щелочах и кислотах • Cu(OH)2 2 Cu. O + H 2 O • Cu(OH)2 + 2 Na. OH = Na 2[Cu(OH)4] • Cu(OH)2 + H 2 SO 4 Cu. SO 4 + H 2 O • Cu(OH)2 + 4(NH 3 H 2 O) [Cu(NH 3)4](OH)2 + 4 H 2 O • R-CHO + 2 Cu(OH)2 = R-COOH + Cu 2 O↓ + 2 H 2 O голубой оранжевый.
Cu(II) • Соединения меди +2 обладают слабо выраженными амфотерными свойствами – гидроксид растворяется в концентрированных щелочах и кислотах • Cu(OH)2 2 Cu. O + H 2 O • Cu(OH)2 + 2 Na. OH = Na 2[Cu(OH)4] • Cu(OH)2 + H 2 SO 4 Cu. SO 4 + H 2 O • Cu(OH)2 + 4(NH 3 H 2 O) [Cu(NH 3)4](OH)2 + 4 H 2 O • R-CHO + 2 Cu(OH)2 = R-COOH + Cu 2 O↓ + 2 H 2 O голубой оранжевый.
 Cu(III) • Na 2 Cu. O 2 + Na 2 O 2+ H 2 O Cu 2 O 3 + Na. OH • Cu 2 O 3 – окислитель. • Cu 2 O 3 + 6 HCl 2 Cu. Cl 2 + 3 H 2 O
Cu(III) • Na 2 Cu. O 2 + Na 2 O 2+ H 2 O Cu 2 O 3 + Na. OH • Cu 2 O 3 – окислитель. • Cu 2 O 3 + 6 HCl 2 Cu. Cl 2 + 3 H 2 O
 Ag(I) • • Ag. NO 3 + 2 KOH Ag 2 O↓ + 2 KNO 3 + H 2 O 2 Ag(OH) Ag 2 O↓ + H 2 O Ag 2 O Ag + O 2 t = 300 C Ag. Br + 2 Na 2 S 2 O 3 = Na 3[Ag(S 2 O 3)2] + Na. Br Кнест. ([Ag(S 2 O 3)2]3 -) = 1 10 -14 Более слабые комплексы образует аммиак: Ag. Cl + 2 NH 3 = [Ag(NH 3)2]Cl • Кнест. ([Ag(NH 3)2]+) = 7 10 -8
Ag(I) • • Ag. NO 3 + 2 KOH Ag 2 O↓ + 2 KNO 3 + H 2 O 2 Ag(OH) Ag 2 O↓ + H 2 O Ag 2 O Ag + O 2 t = 300 C Ag. Br + 2 Na 2 S 2 O 3 = Na 3[Ag(S 2 O 3)2] + Na. Br Кнест. ([Ag(S 2 O 3)2]3 -) = 1 10 -14 Более слабые комплексы образует аммиак: Ag. Cl + 2 NH 3 = [Ag(NH 3)2]Cl • Кнест. ([Ag(NH 3)2]+) = 7 10 -8
![Au • Au + HNO 3 + 4 HCl = H[Au. Cl 4] + Au • Au + HNO 3 + 4 HCl = H[Au. Cl 4] +](https://present5.com/presentation/141344298_132726686/image-36.jpg) Au • Au + HNO 3 + 4 HCl = H[Au. Cl 4] + NO + 2 H 2 O Кнест ([Au. Cl 4]-) = 7 10 -22 • 4 Au + 8 Na. CN + O 2 + 2 H 2 O = 4 Na[Au(CN)2] + 4 Na. OH Кнест. ([Au(CN)2]–) = 1 10 -38 • 2 Au + 3 Cl 2 = 2 Au. Cl 3 t = 150 - 200 C • Au. Cl 3 + H 2 O = H[Au(OH)Cl 3]
Au • Au + HNO 3 + 4 HCl = H[Au. Cl 4] + NO + 2 H 2 O Кнест ([Au. Cl 4]-) = 7 10 -22 • 4 Au + 8 Na. CN + O 2 + 2 H 2 O = 4 Na[Au(CN)2] + 4 Na. OH Кнест. ([Au(CN)2]–) = 1 10 -38 • 2 Au + 3 Cl 2 = 2 Au. Cl 3 t = 150 - 200 C • Au. Cl 3 + H 2 O = H[Au(OH)Cl 3]


 Zn + H 2 SO 4 конц. Zn. SO 4 + H 2 S + H 2 O (H 2 S или S) Zn + H 2 SO 4 разб. Zn. SO 4 + H 2↑ Zn + HNO 3 конц. Zn(NO 3)2 + NO + H 2 O Zn + 2 HCl = Zn. Cl 2 + H 2↑ Как амфотерный металл, цинк растворяется и в щелочах: Zn + 2 Na. OH + 2 H 2 O = Na 2[Zn(OH)4] + H 2↑ Zn + 4(NH 3 H 2 O) [Zn(NH 3)4](OH)2 + H 2↑+ 2 H 2 O Zn(OH)2 + 2 Na. OH(р-р) = Na 2[Zn(OH)4] Zn(OH)2 + 2 Na. OH(сплав) = Na 2 Zn. O 2 + 2 H 2 O Растворимые соли цинка в растворе подвергаются гидролизу : Zn. SO 4 + H 2 O ↔ (Zn. OH)2 SO 4 + H 2 SO 4
Zn + H 2 SO 4 конц. Zn. SO 4 + H 2 S + H 2 O (H 2 S или S) Zn + H 2 SO 4 разб. Zn. SO 4 + H 2↑ Zn + HNO 3 конц. Zn(NO 3)2 + NO + H 2 O Zn + 2 HCl = Zn. Cl 2 + H 2↑ Как амфотерный металл, цинк растворяется и в щелочах: Zn + 2 Na. OH + 2 H 2 O = Na 2[Zn(OH)4] + H 2↑ Zn + 4(NH 3 H 2 O) [Zn(NH 3)4](OH)2 + H 2↑+ 2 H 2 O Zn(OH)2 + 2 Na. OH(р-р) = Na 2[Zn(OH)4] Zn(OH)2 + 2 Na. OH(сплав) = Na 2 Zn. O 2 + 2 H 2 O Растворимые соли цинка в растворе подвергаются гидролизу : Zn. SO 4 + H 2 O ↔ (Zn. OH)2 SO 4 + H 2 SO 4
 • Сd(OH)2 - более сильное основание, не реагирует со щелочами, в присутствии кислорода растворяется в аммиаке: • Сd +8(NH 3 H 2 O) +O 2 2[Cd(H 2 O)2(NH 3)4](OH)2 + 2 H 2 O • Cd. Cl 2 + H 2 S = Cd. S ↓ + 2 HCl • Cd. Cl 2 + Na 2 S = Cd. S ↓ + 2 Na. Cl • 2 Cd. CO 3 + 3 S = 2 Cd. S ↓ + 2 CO 2 + SO 2 • Ртуть образует два ряда соединений – соединения Hg 2+ и соединения Hg(I), содержащие ион Hg 22+ • 3 Hg + 8 HNO 3(конц) 3 Hg(NO 3)2 + 2 NO + 4 H 2 O • 6 Hg + 8 HNO 3(разб) 3 Hg 2(NO 3)2 + 2 NO + 4 H 2 O
• Сd(OH)2 - более сильное основание, не реагирует со щелочами, в присутствии кислорода растворяется в аммиаке: • Сd +8(NH 3 H 2 O) +O 2 2[Cd(H 2 O)2(NH 3)4](OH)2 + 2 H 2 O • Cd. Cl 2 + H 2 S = Cd. S ↓ + 2 HCl • Cd. Cl 2 + Na 2 S = Cd. S ↓ + 2 Na. Cl • 2 Cd. CO 3 + 3 S = 2 Cd. S ↓ + 2 CO 2 + SO 2 • Ртуть образует два ряда соединений – соединения Hg 2+ и соединения Hg(I), содержащие ион Hg 22+ • 3 Hg + 8 HNO 3(конц) 3 Hg(NO 3)2 + 2 NO + 4 H 2 O • 6 Hg + 8 HNO 3(разб) 3 Hg 2(NO 3)2 + 2 NO + 4 H 2 O
 • Hg. O + 4 KI + H 2 O = K 2[Hg. I 4] + 2 KOH • Hg(NO 3)2 + 2 Na. OH(разб. ) Hg. O↓ + 2 Na. NO 3 + H 2 O • • • 2 Hg. O = 2 Hg + O 2 при 4000 С Hg 2 Cl 2 ↔ 2 Hg 2+ + 2 Cl. Hg + S = Hg. S 2 Hg + 2 Fe. Cl 3 = Hg 2 Cl 2 + 2 Fe. Cl 2 Соединения одновалентной ртути являются восстановителями: • Hg 2 Cl 2 + Sn. Cl 2 Hg + Sn. Cl 4 • Hg. S + K 2 S = K 2[Hg. S 2]
• Hg. O + 4 KI + H 2 O = K 2[Hg. I 4] + 2 KOH • Hg(NO 3)2 + 2 Na. OH(разб. ) Hg. O↓ + 2 Na. NO 3 + H 2 O • • • 2 Hg. O = 2 Hg + O 2 при 4000 С Hg 2 Cl 2 ↔ 2 Hg 2+ + 2 Cl. Hg + S = Hg. S 2 Hg + 2 Fe. Cl 3 = Hg 2 Cl 2 + 2 Fe. Cl 2 Соединения одновалентной ртути являются восстановителями: • Hg 2 Cl 2 + Sn. Cl 2 Hg + Sn. Cl 4 • Hg. S + K 2 S = K 2[Hg. S 2]
![Элементы IV Б группы Ti, Zr, Hf Ti Zr Hf 1668 1857 2227 [Ar]3 Элементы IV Б группы Ti, Zr, Hf Ti Zr Hf 1668 1857 2227 [Ar]3](https://present5.com/presentation/141344298_132726686/image-42.jpg) Элементы IV Б группы Ti, Zr, Hf Ti Zr Hf 1668 1857 2227 [Ar]3 d 24 s 2 [Kr] 4 d 25 s 2 [Xe]4 f 145 d 26 s 2 Металлический радиус, пм 146 160 159 ЭО 1. 54 1. 33 1. 30 Тпл ºС Электронная конфигураци я атома СО 0, (2), 3, 4 0, (1), (2), (3), 4 4
Элементы IV Б группы Ti, Zr, Hf Ti Zr Hf 1668 1857 2227 [Ar]3 d 24 s 2 [Kr] 4 d 25 s 2 [Xe]4 f 145 d 26 s 2 Металлический радиус, пм 146 160 159 ЭО 1. 54 1. 33 1. 30 Тпл ºС Электронная конфигураци я атома СО 0, (2), 3, 4 0, (1), (2), (3), 4 4
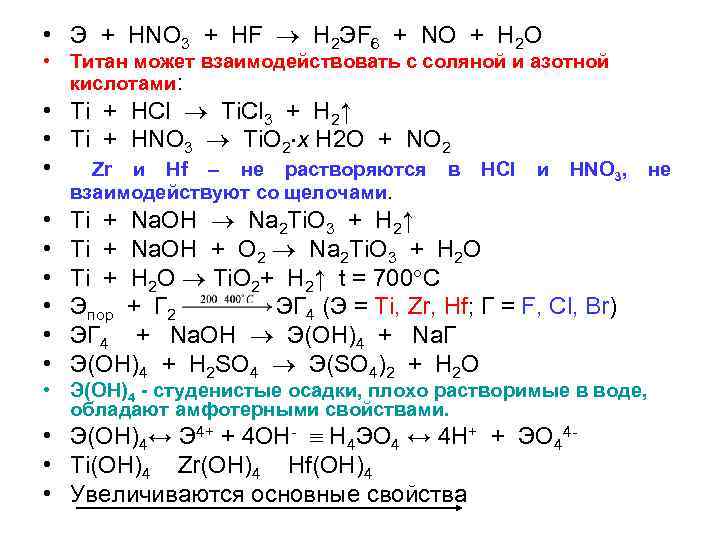 • Э + HNO 3 + HF H 2 ЭF 6 + NO + H 2 O • Титан может взаимодействовать с соляной и азотной кислотами: • Ti + HCl Ti. Cl 3 + H 2↑ • Ti + HNO 3 Ti. O 2 x H 2 O + NO 2 • Zr и Hf – не растворяются в HCl и HNO 3, не взаимодействуют со щелочами. • Ti + Na. OH Na 2 Ti. O 3 + H 2↑ • Ti + Na. OH + O 2 Na 2 Ti. O 3 + H 2 O • Ti + H 2 O Ti. O 2+ H 2↑ t = 700 C • Эпор + Г 2 ЭГ 4 (Э = Ti, Zr, Hf; Г = F, Cl, Br) • ЭГ 4 + Na. OH Э(OH)4 + Na. Г • Э(OH)4 + H 2 SO 4 Э(SO 4)2 + H 2 O • Э(OH)4 - студенистые осадки, плохо растворимые в воде, обладают амфотерными свойствами. • Э(OH)4↔ Э 4+ + 4 OH- H 4 ЭO 4 ↔ 4 H+ + ЭO 44 • Ti(OH)4 Zr(OH)4 Hf(OH)4 • Увеличиваются основные свойства
• Э + HNO 3 + HF H 2 ЭF 6 + NO + H 2 O • Титан может взаимодействовать с соляной и азотной кислотами: • Ti + HCl Ti. Cl 3 + H 2↑ • Ti + HNO 3 Ti. O 2 x H 2 O + NO 2 • Zr и Hf – не растворяются в HCl и HNO 3, не взаимодействуют со щелочами. • Ti + Na. OH Na 2 Ti. O 3 + H 2↑ • Ti + Na. OH + O 2 Na 2 Ti. O 3 + H 2 O • Ti + H 2 O Ti. O 2+ H 2↑ t = 700 C • Эпор + Г 2 ЭГ 4 (Э = Ti, Zr, Hf; Г = F, Cl, Br) • ЭГ 4 + Na. OH Э(OH)4 + Na. Г • Э(OH)4 + H 2 SO 4 Э(SO 4)2 + H 2 O • Э(OH)4 - студенистые осадки, плохо растворимые в воде, обладают амфотерными свойствами. • Э(OH)4↔ Э 4+ + 4 OH- H 4 ЭO 4 ↔ 4 H+ + ЭO 44 • Ti(OH)4 Zr(OH)4 Hf(OH)4 • Увеличиваются основные свойства
 • Растворимые в воде соли подвергаются гидролизу: • Ti. Cl 4 + H 2 O ↔ Ti. O 2+ HCl • Соединения Ti(III) получают в растворах восстановлении Ti(IV), неустойчивы. • Ti. Cl 4 + Zn + HCl TCl 3 + Zn. Cl 2 + H 2↑ • Ti(OH)3 – основной гидроксид, сильный восстановитель при
• Растворимые в воде соли подвергаются гидролизу: • Ti. Cl 4 + H 2 O ↔ Ti. O 2+ HCl • Соединения Ti(III) получают в растворах восстановлении Ti(IV), неустойчивы. • Ti. Cl 4 + Zn + HCl TCl 3 + Zn. Cl 2 + H 2↑ • Ti(OH)3 – основной гидроксид, сильный восстановитель при
 Элементы VБ группы V, Nb, Ta V Nb Ta Tпл ºC 1920 2500 2996 Электронная конфигура ция атома 3 d 34 s 2 … 4 d 45 s 1 … 5 d 36 s 2 136 146 +5, +4, +3, (+2), 0 +5, +4, (+3), (+2), 0 +5, (+4), (+3), (+2), 0 Атомный радиус, пм СО
Элементы VБ группы V, Nb, Ta V Nb Ta Tпл ºC 1920 2500 2996 Электронная конфигура ция атома 3 d 34 s 2 … 4 d 45 s 1 … 5 d 36 s 2 136 146 +5, +4, +3, (+2), 0 +5, +4, (+3), (+2), 0 +5, (+4), (+3), (+2), 0 Атомный радиус, пм СО
 • 3 Nb + 5 HNO 3 + 21 HF 3 H 2 Nb. F 7 + 5 NO + 10 H 2 O • Ванадий может взаимодействовать с HNO 3: • V + HNO 3 HVO 3 + NO + H 2 O • Ta + Na. OH + O 2 Na. Ta. O 3 + H 2 O • Э + О 2 Э 2 О 5 t = 400 - 600 C • NH 4 VO 3 V 2 O 5 + NH 3 + H 2 O t = 500 -550 C • V 2 O 5 Nb 2 O 5 Ta 2 O 5 Уменьшаются кислотные свойства V(V) Nb(V) Ta(V) устойчивость соединений увеличивается.
• 3 Nb + 5 HNO 3 + 21 HF 3 H 2 Nb. F 7 + 5 NO + 10 H 2 O • Ванадий может взаимодействовать с HNO 3: • V + HNO 3 HVO 3 + NO + H 2 O • Ta + Na. OH + O 2 Na. Ta. O 3 + H 2 O • Э + О 2 Э 2 О 5 t = 400 - 600 C • NH 4 VO 3 V 2 O 5 + NH 3 + H 2 O t = 500 -550 C • V 2 O 5 Nb 2 O 5 Ta 2 O 5 Уменьшаются кислотные свойства V(V) Nb(V) Ta(V) устойчивость соединений увеличивается.
 • V 2 O 5 + SO 2 VO 2 + SO 3 • V 2 O 5 + H 2 VO 2 + H 2 O • V 2 O 5 + H 2 V 2 O 3 + H 2 O t = 450 - 500 C для Ta, Nb t = 1000 - 1250 C • V 2 O 3 + V VO VO и V 2 O 3 - основные окислы, не растворяются в воде. • V(OH)2 V(OH)3 V(OH)4 Уменьшаются основные свойства • • Nb (Ta) + Г 2 Nb. Г 5 (Ta. Г 5) Г = F 2, Cl 2 V 2 O 5 + HCl VO 2 Cl + H 2 O V 2 O 5 + HF VF 5 + H 2 O Ta. F 5 + HF H 2[Ta. F 7] - гептафторотанталовая кислота
• V 2 O 5 + SO 2 VO 2 + SO 3 • V 2 O 5 + H 2 VO 2 + H 2 O • V 2 O 5 + H 2 V 2 O 3 + H 2 O t = 450 - 500 C для Ta, Nb t = 1000 - 1250 C • V 2 O 3 + V VO VO и V 2 O 3 - основные окислы, не растворяются в воде. • V(OH)2 V(OH)3 V(OH)4 Уменьшаются основные свойства • • Nb (Ta) + Г 2 Nb. Г 5 (Ta. Г 5) Г = F 2, Cl 2 V 2 O 5 + HCl VO 2 Cl + H 2 O V 2 O 5 + HF VF 5 + H 2 O Ta. F 5 + HF H 2[Ta. F 7] - гептафторотанталовая кислота
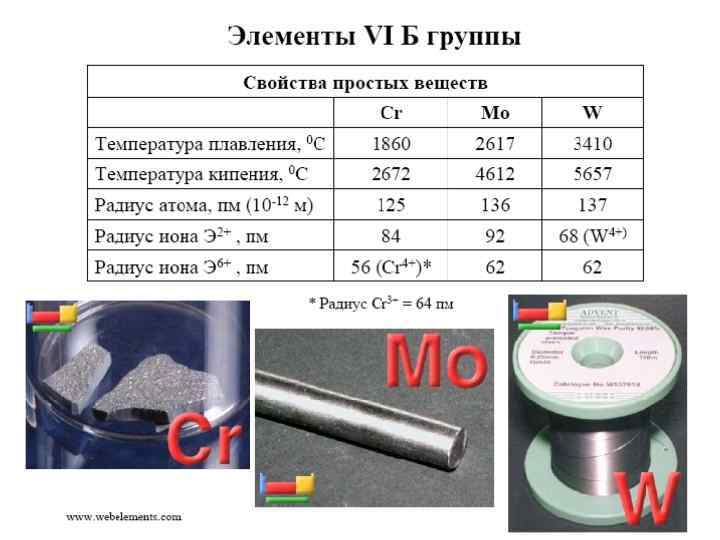
 Химические свойства • Cr + 2 HCl = Cr. Cl 2 + H 2↑ • Двухвалентный хром – сильный восстановитель: • 2 Cr. Cl 2 + 2 H 2 O = 2 Cr(OH)Cl 2 + H 2↑ • Гидроксид хрома +3 амфотерен: [Cr(H 2 O)6]3+ ←--3 H 3 O+ -- Cr(OH)3 --3 OH–-→[Cr(OH)6]3– • В щелочной среде соединения хрома (III) окисляются до хрома (VI): • Cr(OH)3 + 3 H 2 O 2+ Na. OH= 2 Na 2 Cr. O 4 + 8 H 2 O • В кислой среде: • Cr 2(SO 4)3 +KMn. O 4 + H 2 SO 4→ K 2 Cr 2 O 7 + Mn. SO 4 + K 2 SO 4 + H 2 O
Химические свойства • Cr + 2 HCl = Cr. Cl 2 + H 2↑ • Двухвалентный хром – сильный восстановитель: • 2 Cr. Cl 2 + 2 H 2 O = 2 Cr(OH)Cl 2 + H 2↑ • Гидроксид хрома +3 амфотерен: [Cr(H 2 O)6]3+ ←--3 H 3 O+ -- Cr(OH)3 --3 OH–-→[Cr(OH)6]3– • В щелочной среде соединения хрома (III) окисляются до хрома (VI): • Cr(OH)3 + 3 H 2 O 2+ Na. OH= 2 Na 2 Cr. O 4 + 8 H 2 O • В кислой среде: • Cr 2(SO 4)3 +KMn. O 4 + H 2 SO 4→ K 2 Cr 2 O 7 + Mn. SO 4 + K 2 SO 4 + H 2 O
 • Равновесие хромат – бихромат зависит от кислотности среды: 2 Cr. O 42– + 2 H+ ↔ Cr 2 O 72– + H 2 O • H 2 Cr 2 O 7 – дихромовая кислота, H 2 Cr. O 4 – хромовая кислота. • Соединения хрома +6 – сильные окислители: 1. K 2 Cr 2 O 7 +3 H 2 S+4 H 2 SO 4 = Cr 2(SO 4)3+ 3 S+ K 2 SO 4+7 H 2 O 2. K 2 Cr 2 O 7 +6 KI +7 H 2 SO 4 =Cr 2(SO 4)3 + 3 I 2+ 4 K 2 SO 4+7 H 2 O 3. K 2 Cr 2 O 7 + 6 Fe. SO 4 + 7 H 2 SO 4 = Cr 2(SO 4)3 + 3 Fe 2(SO 4)3 + K 2 SO 4+ 7 H 2 O 4. K 2 Cr 2 O 7 + 3 KNO 2 + 4 H 2 SO 4 = Cr 2(SO 4)3 + 3 KNO 3 + K 2 SO 4 + 4 H 2 O 5. K 2 Cr 2 O 7 + 2 H 2 SO 4 (конц) = Cr. O 3↓ +2 KHSO 4 + H 2 O 6. K 2 Cr 2 O 7 + 2 KOH(конц) = K 2 Cr. O 4 +H 2 O 7. (NH 4)2 Cr 2 O 7 = Cr 2 O 3 + 4 H 2 O+ N 2 8. K 2 Cr 2 O 7+14 HCl(конц)= 2 Cr. Cl 3 + Cl 2 +H 2 O+ KCl (HBr, HI)
• Равновесие хромат – бихромат зависит от кислотности среды: 2 Cr. O 42– + 2 H+ ↔ Cr 2 O 72– + H 2 O • H 2 Cr 2 O 7 – дихромовая кислота, H 2 Cr. O 4 – хромовая кислота. • Соединения хрома +6 – сильные окислители: 1. K 2 Cr 2 O 7 +3 H 2 S+4 H 2 SO 4 = Cr 2(SO 4)3+ 3 S+ K 2 SO 4+7 H 2 O 2. K 2 Cr 2 O 7 +6 KI +7 H 2 SO 4 =Cr 2(SO 4)3 + 3 I 2+ 4 K 2 SO 4+7 H 2 O 3. K 2 Cr 2 O 7 + 6 Fe. SO 4 + 7 H 2 SO 4 = Cr 2(SO 4)3 + 3 Fe 2(SO 4)3 + K 2 SO 4+ 7 H 2 O 4. K 2 Cr 2 O 7 + 3 KNO 2 + 4 H 2 SO 4 = Cr 2(SO 4)3 + 3 KNO 3 + K 2 SO 4 + 4 H 2 O 5. K 2 Cr 2 O 7 + 2 H 2 SO 4 (конц) = Cr. O 3↓ +2 KHSO 4 + H 2 O 6. K 2 Cr 2 O 7 + 2 KOH(конц) = K 2 Cr. O 4 +H 2 O 7. (NH 4)2 Cr 2 O 7 = Cr 2 O 3 + 4 H 2 O+ N 2 8. K 2 Cr 2 O 7+14 HCl(конц)= 2 Cr. Cl 3 + Cl 2 +H 2 O+ KCl (HBr, HI)
 Элементы VIIБ – группы. Марганец, технеций, рений. (n-1)d 5 ns 2
Элементы VIIБ – группы. Марганец, технеций, рений. (n-1)d 5 ns 2
 Свойства соединений В соединениях марганец устойчив в степенях окисления +2, +3, +4, +7.
Свойства соединений В соединениях марганец устойчив в степенях окисления +2, +3, +4, +7.
 Гидроксид марганца +2 легко окисляется: • 2 Mn(OH)2 + O 2 = 2 Mn. O 2 + H 2 O Дальнейшее окисление при сплавлении на воздухе со щелочью: • 2 Mn. O 2 + 4 KOH = 2 K 2 Mn. O 4 + 2 H 2 O • 2 Mn 3+ + 2 H 2 O ↔ Mn 2+ + Mn. O 2↓ + 4 H+ (реакция диспропорционирования) • 2 Mn. O 2+ 4 H 2 SO 4 Mn 2(SO 4)3 + O 2+ SO 2+ 4 H 2 O 110ºC Неустойчивый манганат диспропорционирует: • 3 K 2 Mn. O 4 + 2 H 2 O = 2 KMn. O 4 + Mn. O 2 + 4 KOH Соединения марганца +4 и +7 в кислой среде – сильные окислители: • Mn. O 2 + 4 HCl = Mn. Cl 2 + 2 H 2 O Реакция идет через промежуточное образование комплекса: • Mn. O 2 + 6 HCl = H 2[Mn. Cl 6] + 2 H 2 O • H 2[Mn. Cl 6] → Mn. Cl 4 + 2 HCl → Mn. Cl 2 + Cl 2
Гидроксид марганца +2 легко окисляется: • 2 Mn(OH)2 + O 2 = 2 Mn. O 2 + H 2 O Дальнейшее окисление при сплавлении на воздухе со щелочью: • 2 Mn. O 2 + 4 KOH = 2 K 2 Mn. O 4 + 2 H 2 O • 2 Mn 3+ + 2 H 2 O ↔ Mn 2+ + Mn. O 2↓ + 4 H+ (реакция диспропорционирования) • 2 Mn. O 2+ 4 H 2 SO 4 Mn 2(SO 4)3 + O 2+ SO 2+ 4 H 2 O 110ºC Неустойчивый манганат диспропорционирует: • 3 K 2 Mn. O 4 + 2 H 2 O = 2 KMn. O 4 + Mn. O 2 + 4 KOH Соединения марганца +4 и +7 в кислой среде – сильные окислители: • Mn. O 2 + 4 HCl = Mn. Cl 2 + 2 H 2 O Реакция идет через промежуточное образование комплекса: • Mn. O 2 + 6 HCl = H 2[Mn. Cl 6] + 2 H 2 O • H 2[Mn. Cl 6] → Mn. Cl 4 + 2 HCl → Mn. Cl 2 + Cl 2
 Перманганат как окислитель в кислой среде: • 2 KMn. O 4 + 3 H 2 SO 4 + 5 K 2 SO 3 = 2 Mn. SO 4+ 3 H 2 O+6 K 2 SO 4 • 2 KMn. O 4 + 5 SO 2 + 2 H 2 O = 2 Mn. SO 4 + K 2 SO 4 + 2 H 2 SO 4 • 2 KMn. O 4 + 16 HCl = 2 KCl + 2 Mn. Cl 2 + 5 Cl 2 + 8 H 2 O В нейтральной среде: • 2 KMn. O 4 + H 2 O + 3 Na 2 SO 3 = 2 Mn. O 2 + 2 KOH + 3 Na 2 SO 4 • 2 KMn. O 4 + 3 Mn. Cl 2 + 2 H 2 O = 5 Mn. O 2 + 2 KCl + 4 HCl В щелочной среде: • 2 KMn. O 4 + 2 KOH + K 2 SO 3 = 2 K 2 Mn. O 4 + H 2 O + K 2 SO 4 лабораторный способ получения кислорода: 2 KMn. O 4 K 2 Mn. O 4 + Mn. O 2 + O 2 (t = 200 – 240 C)
Перманганат как окислитель в кислой среде: • 2 KMn. O 4 + 3 H 2 SO 4 + 5 K 2 SO 3 = 2 Mn. SO 4+ 3 H 2 O+6 K 2 SO 4 • 2 KMn. O 4 + 5 SO 2 + 2 H 2 O = 2 Mn. SO 4 + K 2 SO 4 + 2 H 2 SO 4 • 2 KMn. O 4 + 16 HCl = 2 KCl + 2 Mn. Cl 2 + 5 Cl 2 + 8 H 2 O В нейтральной среде: • 2 KMn. O 4 + H 2 O + 3 Na 2 SO 3 = 2 Mn. O 2 + 2 KOH + 3 Na 2 SO 4 • 2 KMn. O 4 + 3 Mn. Cl 2 + 2 H 2 O = 5 Mn. O 2 + 2 KCl + 4 HCl В щелочной среде: • 2 KMn. O 4 + 2 KOH + K 2 SO 3 = 2 K 2 Mn. O 4 + H 2 O + K 2 SO 4 лабораторный способ получения кислорода: 2 KMn. O 4 K 2 Mn. O 4 + Mn. O 2 + O 2 (t = 200 – 240 C)
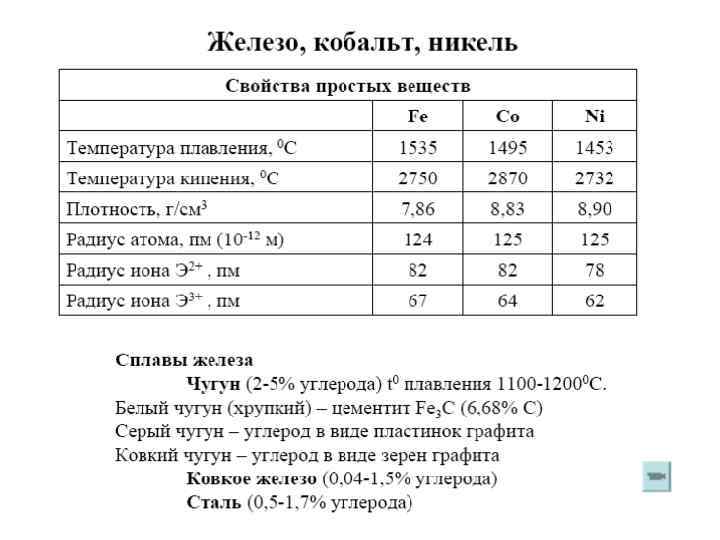
 Химические свойства Химическая активность элементов уменьшается в ряду: Fe > Co > Ni. • Fe + O 2 + H 2 O 2 Fe(OH)2 • Co + Cl 2 Co. Cl 2 t = 100 C Для железа наиболее характерны степени окисления +2 и +3, неустойчивы соединения железа +4 и +6. • Fe(OH)3 Fe 2 O 3 + H 2 O • M(NO 3)2 M 2 O 3 + NO 2 + H 2 O (M = Co, Ni) • Fe(OH)3 > Co(OH)3 > Ni(OH)3 устойчивость соединений уменьшается Оксоферраты (+6) получаются в щелочной среде: • Fe 2 O 3 + 3 KNO 3 + 4 KOH = 2 K 2 Fe. O 4 + 3 KNO 2 + 2 H 2 O
Химические свойства Химическая активность элементов уменьшается в ряду: Fe > Co > Ni. • Fe + O 2 + H 2 O 2 Fe(OH)2 • Co + Cl 2 Co. Cl 2 t = 100 C Для железа наиболее характерны степени окисления +2 и +3, неустойчивы соединения железа +4 и +6. • Fe(OH)3 Fe 2 O 3 + H 2 O • M(NO 3)2 M 2 O 3 + NO 2 + H 2 O (M = Co, Ni) • Fe(OH)3 > Co(OH)3 > Ni(OH)3 устойчивость соединений уменьшается Оксоферраты (+6) получаются в щелочной среде: • Fe 2 O 3 + 3 KNO 3 + 4 KOH = 2 K 2 Fe. O 4 + 3 KNO 2 + 2 H 2 O
 • Соединения железа +6 – сильные окислители: • 2 Fe. O 4 2– + 2 Cr 3+ + 2 H+ = 2 Fe 3+ + Cr 2 O 72– + H 2 O • Устойчивость к окислению и сила окислителей возрастает в ряду: Fe 2+, Co 2+, Ni 2+ • Fe 3+ + e = Fe 2+ E 0 = +0, 77 В • Сo 3+ + e = Co 2+ E 0 = +1, 81 В • Ni 3+ + e = Ni 2+ E 0 = > +2 В • Fe(OH)2 < Co(OH)2 < Ni(OH)2 – основные свойства увеличиваются. Слабые основания, их соли гидролизуются. • М 2+ + HOH ↔ MOH+ + H+
• Соединения железа +6 – сильные окислители: • 2 Fe. O 4 2– + 2 Cr 3+ + 2 H+ = 2 Fe 3+ + Cr 2 O 72– + H 2 O • Устойчивость к окислению и сила окислителей возрастает в ряду: Fe 2+, Co 2+, Ni 2+ • Fe 3+ + e = Fe 2+ E 0 = +0, 77 В • Сo 3+ + e = Co 2+ E 0 = +1, 81 В • Ni 3+ + e = Ni 2+ E 0 = > +2 В • Fe(OH)2 < Co(OH)2 < Ni(OH)2 – основные свойства увеличиваются. Слабые основания, их соли гидролизуются. • М 2+ + HOH ↔ MOH+ + H+
 • Соли Co 2+, Ni 2+ на воздухе устойчивы, а соли Fe 2+ окисляются. • Щелочные железо-никелевые (кадмиево-никелевые) аккумуляторы: • ЭДС мин. 1, 1 В; зарядный ток = 1/4 емкости; емкость 3, 5 -8 Ач/кг • 2 Ni(OH)3 + KOH + Fe (Cd) ↔ 2 Ni(OH)2 + KOH + Fe(OH)2 → разряд
• Соли Co 2+, Ni 2+ на воздухе устойчивы, а соли Fe 2+ окисляются. • Щелочные железо-никелевые (кадмиево-никелевые) аккумуляторы: • ЭДС мин. 1, 1 В; зарядный ток = 1/4 емкости; емкость 3, 5 -8 Ач/кг • 2 Ni(OH)3 + KOH + Fe (Cd) ↔ 2 Ni(OH)2 + KOH + Fe(OH)2 → разряд
 Семейство платины Ru, Rh, Pd, Os, Ir, Pt
Семейство платины Ru, Rh, Pd, Os, Ir, Pt
 • наиболее активный из них – палладий – относится к кислотам, как и серебро; а родий и иридий, в отличие от остальных, не растворяются даже в «царской водке» • Pt + HNO 3 + HCl H 2[Pt. Cl 6] + NO + H 2 O • Pt + H 2 Se. O 4 Pt(Se. O 4)2 + Se. O 2 + H 2 O • H 2[Pt. Cl 4] + H 2 S Pt. S + HCl • 2 Ir + 3 Cl 2 2 Ir. Cl 3 t > 450 C • Pd + Cl 2 -Pd. Cl 2 t > 550 C • Pd + Cl 2 -Pd. Cl 2 t < 550 C • Pt + Cl 2 -Pt. Cl 2 t = 550 C
• наиболее активный из них – палладий – относится к кислотам, как и серебро; а родий и иридий, в отличие от остальных, не растворяются даже в «царской водке» • Pt + HNO 3 + HCl H 2[Pt. Cl 6] + NO + H 2 O • Pt + H 2 Se. O 4 Pt(Se. O 4)2 + Se. O 2 + H 2 O • H 2[Pt. Cl 4] + H 2 S Pt. S + HCl • 2 Ir + 3 Cl 2 2 Ir. Cl 3 t > 450 C • Pd + Cl 2 -Pd. Cl 2 t > 550 C • Pd + Cl 2 -Pd. Cl 2 t < 550 C • Pt + Cl 2 -Pt. Cl 2 t = 550 C



