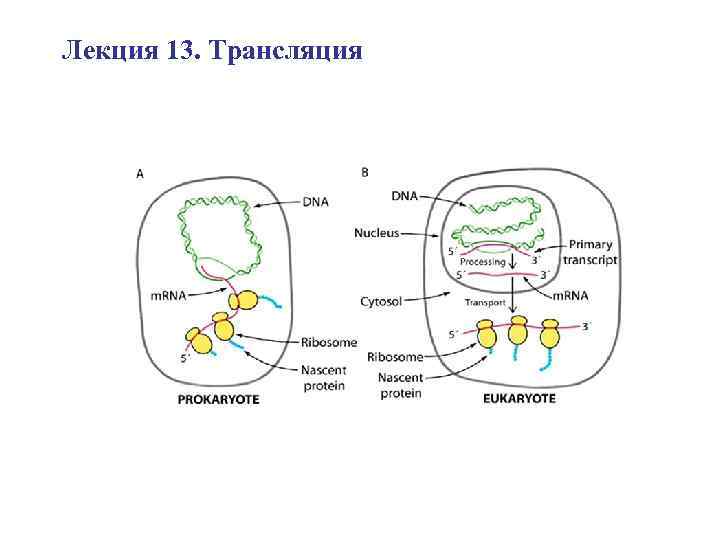
 Лекция 13. Трансляция
Лекция 13. Трансляция
 В начале 50 -ых гг. Георг Гамов предположил, что генетический код является триплетным и перекрывающимся. В середине 60 -ых гг. Ф. Крик, С. Бреннер, Г. Виттман установили, что код вырожденный, триплетный, неперекрывающийся и непрерывный. В 1966 г. М. Ниренберг, С. Очоа, Н. Г. Корана в бесклеточной системе полностью расшифровали код. 1968 – H. Gobind Khorana and Marshall W. Nirenberg - Nobel Prize (M&P) for genetic code
В начале 50 -ых гг. Георг Гамов предположил, что генетический код является триплетным и перекрывающимся. В середине 60 -ых гг. Ф. Крик, С. Бреннер, Г. Виттман установили, что код вырожденный, триплетный, неперекрывающийся и непрерывный. В 1966 г. М. Ниренберг, С. Очоа, Н. Г. Корана в бесклеточной системе полностью расшифровали код. 1968 – H. Gobind Khorana and Marshall W. Nirenberg - Nobel Prize (M&P) for genetic code
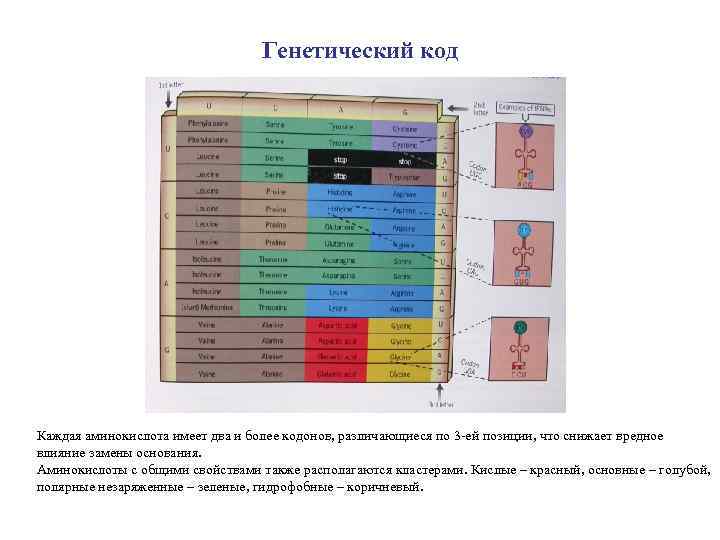 Генетический код Каждая аминокислота имеет два и более кодонов, различающиеся по 3 -ей позиции, что снижает вредное влияние замены основания. Аминокислоты с общими свойствами также располагаются кластерами. Кислые – красный, основные – голубой, полярные незаряженные – зеленые, гидрофобные – коричневый.
Генетический код Каждая аминокислота имеет два и более кодонов, различающиеся по 3 -ей позиции, что снижает вредное влияние замены основания. Аминокислоты с общими свойствами также располагаются кластерами. Кислые – красный, основные – голубой, полярные незаряженные – зеленые, гидрофобные – коричневый.
 Генетический код: - Не случаен. Благодаря одному лишь правильному выбору количества и качества стопкодонов, обеспечивает максимально возможную сохранность генетической информации при сдвиге рамки считывания и замене пар оснований, а также наилучшим образом соответствует распространенности простейших органических соединений (А и Т) на стадии зарождения жизни; - Неоднозначен. В митохондриях многих видов дрожжевых грибов Candida кодон CUG обозначает не только лейцин, но и серин, в результате белки, кодируемые одним геном, не являются абсолютно идентичными химическими соединениями, а фактически представляют собой смесь белков с переменным химическим составом; - Не универсален. Все изменения, и в митохондриях, и в ядрах, состоят либо в присвоении смысла стоп-кодону, либо в превращении смыслового кодона в кодон, не имеющий смысла, либо (крайне редко) в изменении значения смыслового кодона.
Генетический код: - Не случаен. Благодаря одному лишь правильному выбору количества и качества стопкодонов, обеспечивает максимально возможную сохранность генетической информации при сдвиге рамки считывания и замене пар оснований, а также наилучшим образом соответствует распространенности простейших органических соединений (А и Т) на стадии зарождения жизни; - Неоднозначен. В митохондриях многих видов дрожжевых грибов Candida кодон CUG обозначает не только лейцин, но и серин, в результате белки, кодируемые одним геном, не являются абсолютно идентичными химическими соединениями, а фактически представляют собой смесь белков с переменным химическим составом; - Не универсален. Все изменения, и в митохондриях, и в ядрах, состоят либо в присвоении смысла стоп-кодону, либо в превращении смыслового кодона в кодон, не имеющий смысла, либо (крайне редко) в изменении значения смыслового кодона.
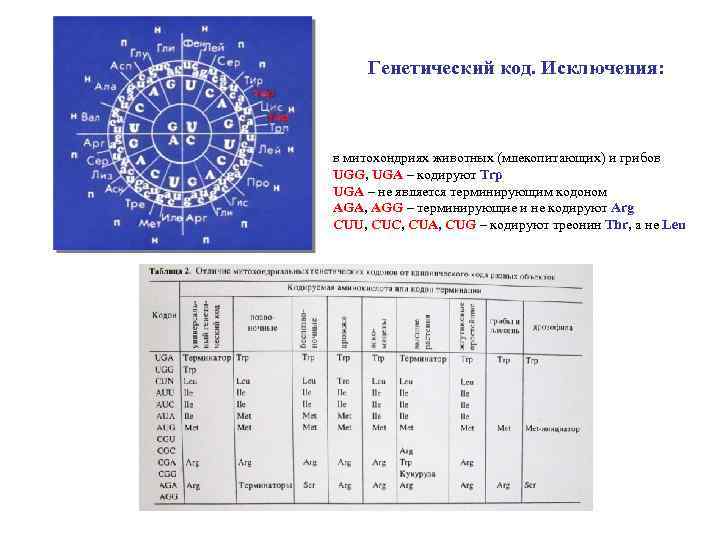 Генетический код. Исключения: в митохондриях животных (млекопитающих) и грибов UGG, UGA – кодируют Trp UGA – не является терминирующим кодоном AGA, AGG – терминирующие и не кодируют Arg CUU, CUC, CUA, CUG – кодируют треонин Thr, а не Leu
Генетический код. Исключения: в митохондриях животных (млекопитающих) и грибов UGG, UGA – кодируют Trp UGA – не является терминирующим кодоном AGA, AGG – терминирующие и не кодируют Arg CUU, CUC, CUA, CUG – кодируют треонин Thr, а не Leu
 т. РНК - небольшие молекулы 73 -97 н, ~20 видов АК, бактерии содержат 30 -45 различных т. РНК, а эукариоты имеют до 50 вид т. РНК Число т. РНК, кодируемых мт. ДНК Организм Saccharomyces cerevisiae Neurospora crassa Xenopus laevis Человек Число т. РНК 25 40 22 19
т. РНК - небольшие молекулы 73 -97 н, ~20 видов АК, бактерии содержат 30 -45 различных т. РНК, а эукариоты имеют до 50 вид т. РНК Число т. РНК, кодируемых мт. ДНК Организм Saccharomyces cerevisiae Neurospora crassa Xenopus laevis Человек Число т. РНК 25 40 22 19
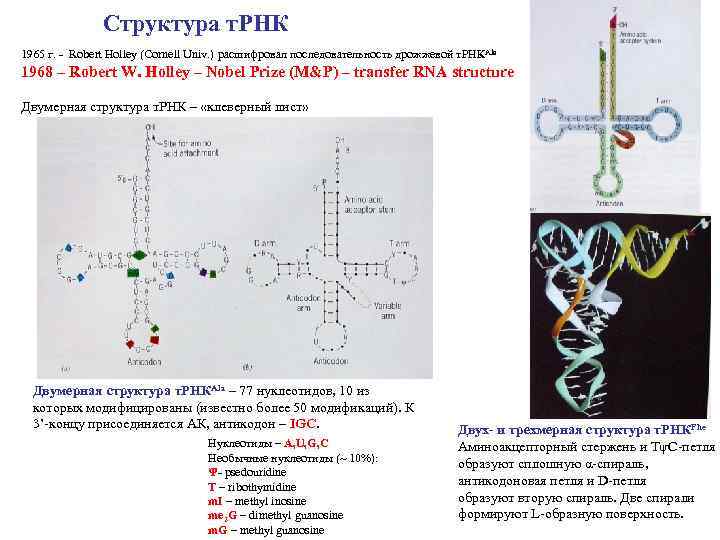 Структура т. РНК 1965 г. - Robert Holley (Cornell Univ. ) расшифровал последовательность дрожжевой т. РНКAla 1968 – Robert W. Holley – Nobel Prize (M&P) – transfer RNA structure Двумерная структура т. РНК – «клеверный лист» Двумерная структура т. РНКAla – 77 нуклеотидов, 10 из которых модифицированы (известно более 50 модификаций). К 3’-концу присоединяется АК, антикодон – IGC. Нуклеотиды – A, U, G, C Необычные нуклеотиды (~ 10%): Ψ- psedouridine T – ribothymidine m. I – methyl inosine me 2 G – dimethyl guanosine m. G – methyl guanosine Двух- и трехмерная структура т. РНКPhe Аминоакцепторный стержень и TψC-петля образуют сплошную α-спираль, антикодоновая петля и D-петля образуют вторую спираль. Две спирали формируют L-образную поверхность.
Структура т. РНК 1965 г. - Robert Holley (Cornell Univ. ) расшифровал последовательность дрожжевой т. РНКAla 1968 – Robert W. Holley – Nobel Prize (M&P) – transfer RNA structure Двумерная структура т. РНК – «клеверный лист» Двумерная структура т. РНКAla – 77 нуклеотидов, 10 из которых модифицированы (известно более 50 модификаций). К 3’-концу присоединяется АК, антикодон – IGC. Нуклеотиды – A, U, G, C Необычные нуклеотиды (~ 10%): Ψ- psedouridine T – ribothymidine m. I – methyl inosine me 2 G – dimethyl guanosine m. G – methyl guanosine Двух- и трехмерная структура т. РНКPhe Аминоакцепторный стержень и TψC-петля образуют сплошную α-спираль, антикодоновая петля и D-петля образуют вторую спираль. Две спирали формируют L-образную поверхность.
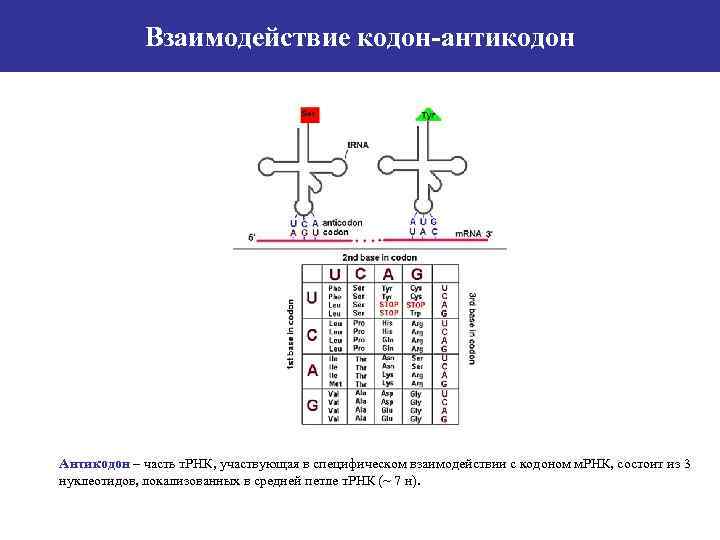 Взаимодействие кодон-антикодон Антикодон – часть т. РНК, участвующая в специфическом взаимодействии с кодоном м. РНК, состоит из 3 нуклеотидов, локализованных в средней петле т. РНК (~ 7 н).
Взаимодействие кодон-антикодон Антикодон – часть т. РНК, участвующая в специфическом взаимодействии с кодоном м. РНК, состоит из 3 нуклеотидов, локализованных в средней петле т. РНК (~ 7 н).
 Вырожденность генетического кода 64 возможных кодона. 61 кодон кодируют АК. 3 кодона – некодирующие (стоп-кодоны). Наблюдается большое сходство между кодонами одной АК – первые два нуклеотида постоянны, третий – варьирует. Например: имеется 16 кодонов с U в 3 положении - U→C – те же АК А→G – те же АК. Wobble гипотеза - стерические требования между кодоном и антикодоном строгие для первых двух нуклеотидов и слабые для третьего нуклеотида (обусловлено локализацией антикодона в петле и изогнутостью триплета). Одна и та же т. РНК может узнавать больше, чем 1 кодон. Следовательно, существуют правила, управляющие «качанием» 3 -его нуклеотида. - U в антикодоне может спариваться с А или G на м. РНК -G U или С -I U, C или А В результате wobble для 6 кодонов Leu, например, требуются только 3 т. РНК. «Качание» во взаимодействии кодонов и антикодонов.
Вырожденность генетического кода 64 возможных кодона. 61 кодон кодируют АК. 3 кодона – некодирующие (стоп-кодоны). Наблюдается большое сходство между кодонами одной АК – первые два нуклеотида постоянны, третий – варьирует. Например: имеется 16 кодонов с U в 3 положении - U→C – те же АК А→G – те же АК. Wobble гипотеза - стерические требования между кодоном и антикодоном строгие для первых двух нуклеотидов и слабые для третьего нуклеотида (обусловлено локализацией антикодона в петле и изогнутостью триплета). Одна и та же т. РНК может узнавать больше, чем 1 кодон. Следовательно, существуют правила, управляющие «качанием» 3 -его нуклеотида. - U в антикодоне может спариваться с А или G на м. РНК -G U или С -I U, C или А В результате wobble для 6 кодонов Leu, например, требуются только 3 т. РНК. «Качание» во взаимодействии кодонов и антикодонов.
 Синтез полипептидной цепи Три химические реакции приводят к включению АК в полипептидную цепь: 1. аминокислота + АТФ → аминоацил-аденилат + РРi 2. аминоацил-аденилат + т. РНК` → аминоацил-т. РНК` +АМФ 3. пептидил (n)-т. РНК + аминоацил-т. РНК` → т. РНК + пептидил (n+1)-т. РНК`
Синтез полипептидной цепи Три химические реакции приводят к включению АК в полипептидную цепь: 1. аминокислота + АТФ → аминоацил-аденилат + РРi 2. аминоацил-аденилат + т. РНК` → аминоацил-т. РНК` +АМФ 3. пептидил (n)-т. РНК + аминоацил-т. РНК` → т. РНК + пептидил (n+1)-т. РНК`
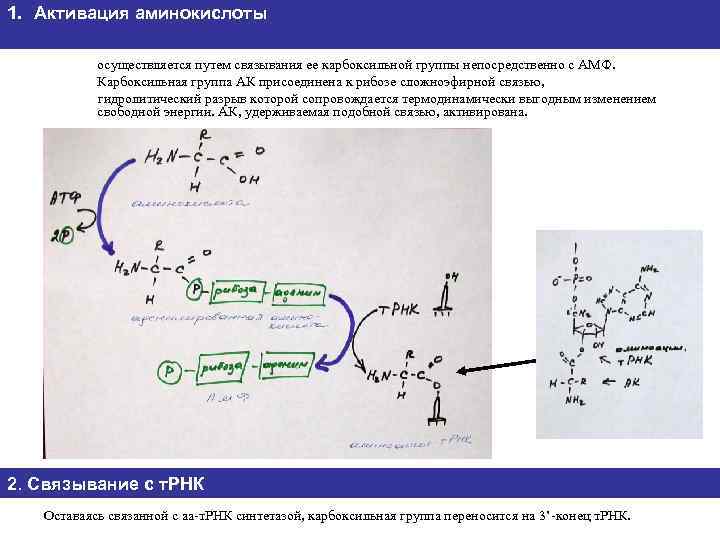 1. Активация аминокислоты осуществляется путем связывания ее карбоксильной группы непосредственно с АМФ. Карбоксильная группа АК присоединена к рибозе сложноэфирной связью, гидролитический разрыв которой сопровождается термодинамически выгодным изменением свободной энергии. АК, удерживаемая подобной связью, активирована. 2. Связывание с т. РНК Оставаясь связанной с аа-т. РНК синтетазой, карбоксильная группа переносится на 3’-конец т. РНК.
1. Активация аминокислоты осуществляется путем связывания ее карбоксильной группы непосредственно с АМФ. Карбоксильная группа АК присоединена к рибозе сложноэфирной связью, гидролитический разрыв которой сопровождается термодинамически выгодным изменением свободной энергии. АК, удерживаемая подобной связью, активирована. 2. Связывание с т. РНК Оставаясь связанной с аа-т. РНК синтетазой, карбоксильная группа переносится на 3’-конец т. РНК.
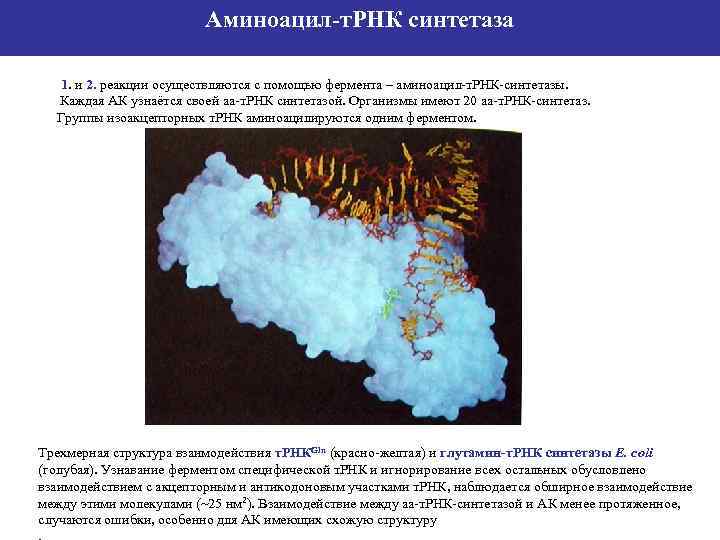 Аминоацил-т. РНК синтетаза 1. и 2. реакции осуществляются с помощью фермента – аминоацил-т. РНК-синтетазы. Каждая АК узнаётся своей аа-т. РНК синтетазой. Организмы имеют 20 аа-т. РНК-синтетаз. Группы изоакцепторных т. РНК аминоацилируются одним ферментом. Трехмерная структура взаимодействия т. РНКGln (красно-желтая) и глутамин-т. РНК синтетазы E. coli (голубая). Узнавание ферментом специфической т. РНК и игнорирование всех остальных обусловлено взаимодействием с акцепторным и антикодоновым участками т. РНК, наблюдается обширное взаимодействие между этими молекулами (~25 нм 2). Взаимодействие между аа-т. РНК-синтетазой и АК менее протяженное, случаются ошибки, особенно для АК имеющих схожую структуру
Аминоацил-т. РНК синтетаза 1. и 2. реакции осуществляются с помощью фермента – аминоацил-т. РНК-синтетазы. Каждая АК узнаётся своей аа-т. РНК синтетазой. Организмы имеют 20 аа-т. РНК-синтетаз. Группы изоакцепторных т. РНК аминоацилируются одним ферментом. Трехмерная структура взаимодействия т. РНКGln (красно-желтая) и глутамин-т. РНК синтетазы E. coli (голубая). Узнавание ферментом специфической т. РНК и игнорирование всех остальных обусловлено взаимодействием с акцепторным и антикодоновым участками т. РНК, наблюдается обширное взаимодействие между этими молекулами (~25 нм 2). Взаимодействие между аа-т. РНК-синтетазой и АК менее протяженное, случаются ошибки, особенно для АК имеющих схожую структуру
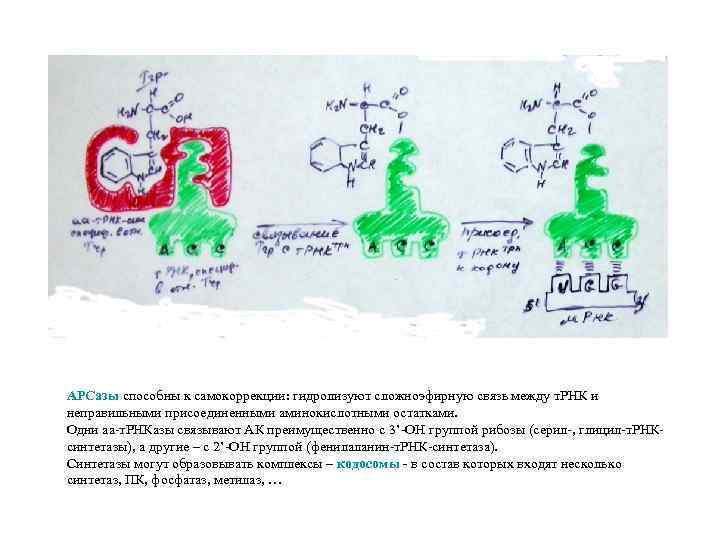 АРСазы способны к самокоррекции: гидролизуют сложноэфирную связь между т. РНК и неправильными присоединенными аминокислотными остатками. Одни аа-т. РНКазы связывают АК преимущественно с 3’-ОН группой рибозы (серил-, глицил-т. РНКсинтетазы), а другие – с 2’-ОН группой (фенилаланин-т. РНК-синтетаза). Синтетазы могут образовывать комплексы – кодосомы - в состав которых входят несколько синтетаз, ПК, фосфатаз, метилаз, …
АРСазы способны к самокоррекции: гидролизуют сложноэфирную связь между т. РНК и неправильными присоединенными аминокислотными остатками. Одни аа-т. РНКазы связывают АК преимущественно с 3’-ОН группой рибозы (серил-, глицил-т. РНКсинтетазы), а другие – с 2’-ОН группой (фенилаланин-т. РНК-синтетаза). Синтетазы могут образовывать комплексы – кодосомы - в состав которых входят несколько синтетаз, ПК, фосфатаз, метилаз, …
 3. Реакция транспептидации, катализируемая пептидилтрансферазным центром большой Rs-субчастицы Карбоксильная группа пептидного остатка переносится на аминогруппу молекулы аа-т. РНК
3. Реакция транспептидации, катализируемая пептидилтрансферазным центром большой Rs-субчастицы Карбоксильная группа пептидного остатка переносится на аминогруппу молекулы аа-т. РНК
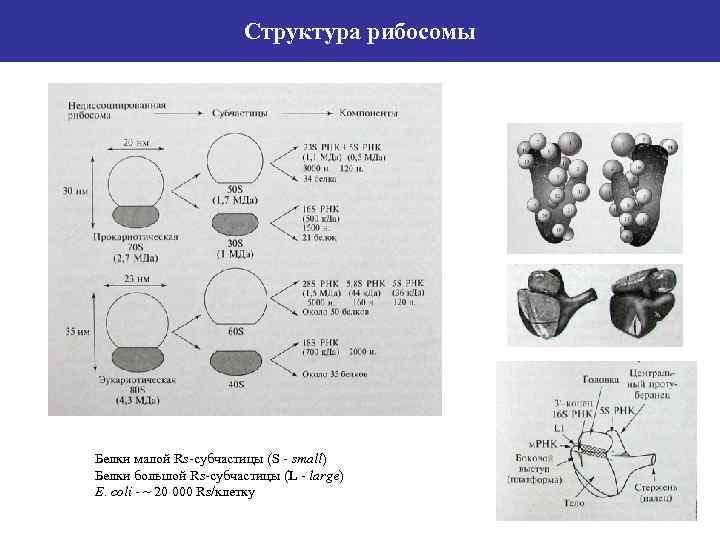 Структура рибосомы Белки малой Rs-субчастицы (S - small) Белки большой Rs-субчастицы (L - large) E. сoli - ~ 20 000 Rs/клетку
Структура рибосомы Белки малой Rs-субчастицы (S - small) Белки большой Rs-субчастицы (L - large) E. сoli - ~ 20 000 Rs/клетку
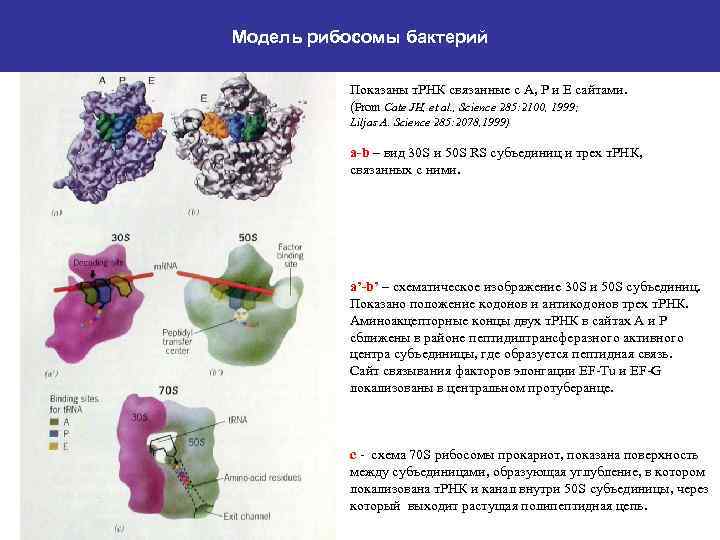 Модель рибосомы бактерий Показаны т. РНК связанные с А, Р и Е сайтами. (From Cate JH, et al. , Science 285: 2100, 1999; Liljas A. Science 285: 2078, 1999) a-b – вид 30 S и 50 S RS субъединиц и трех т. РНК, связанных с ними. a’-b’ – схематическое изображение 30 S и 50 S субъединиц. Показано положение кодонов и антикодонов трех т. РНК. Аминоакцепторные концы двух т. РНК в сайтах А и Р сближены в районе пептидилтрансферазного активного центра субъединицы, где образуется пептидная связь. Сайт связывания факторов элонгации EF-Tu и EF-G локализованы в центральном протуберанце. с - схема 70 S рибосомы прокариот, показана поверхность между субъединицами, образующая углубление, в котором локализована т. РНК и канал внутри 50 S субъединицы, через который выходит растущая полипептидная цепь.
Модель рибосомы бактерий Показаны т. РНК связанные с А, Р и Е сайтами. (From Cate JH, et al. , Science 285: 2100, 1999; Liljas A. Science 285: 2078, 1999) a-b – вид 30 S и 50 S RS субъединиц и трех т. РНК, связанных с ними. a’-b’ – схематическое изображение 30 S и 50 S субъединиц. Показано положение кодонов и антикодонов трех т. РНК. Аминоакцепторные концы двух т. РНК в сайтах А и Р сближены в районе пептидилтрансферазного активного центра субъединицы, где образуется пептидная связь. Сайт связывания факторов элонгации EF-Tu и EF-G локализованы в центральном протуберанце. с - схема 70 S рибосомы прокариот, показана поверхность между субъединицами, образующая углубление, в котором локализована т. РНК и канал внутри 50 S субъединицы, через который выходит растущая полипептидная цепь.
 Функции рибосомы Rs – сложная белоксинтезирующая частица, обладающая одновременно генетической, энзиматической и механической функциями: принимает кодированную генетическую информацию от ДНК в виде м. РНК и расшифровывает её; катализирует образование пептидных связей в реакции транспептидации; передвигает цепь м. РНК и молекулы т. РНК. Малая Rs-субчастица: Служит приемником генетической информации; Осуществляет распознавание инициаторного участка; Обеспечивает кодон-антикодоновое взаимодействие. Большая Rs-субчастица: индуцирует гидролиз ГТФ на факторе инициации IF 2; вытесняет все факторы инициации с малой Rs-субчастицы; надлежащим образом устанавливает субстраты - т. РНКi и связывающуюся с А-участком аа-т. РНК – в своем пептидилтрансферазном центре; катализирует реакцию транспептидации между субстратами.
Функции рибосомы Rs – сложная белоксинтезирующая частица, обладающая одновременно генетической, энзиматической и механической функциями: принимает кодированную генетическую информацию от ДНК в виде м. РНК и расшифровывает её; катализирует образование пептидных связей в реакции транспептидации; передвигает цепь м. РНК и молекулы т. РНК. Малая Rs-субчастица: Служит приемником генетической информации; Осуществляет распознавание инициаторного участка; Обеспечивает кодон-антикодоновое взаимодействие. Большая Rs-субчастица: индуцирует гидролиз ГТФ на факторе инициации IF 2; вытесняет все факторы инициации с малой Rs-субчастицы; надлежащим образом устанавливает субстраты - т. РНКi и связывающуюся с А-участком аа-т. РНК – в своем пептидилтрансферазном центре; катализирует реакцию транспептидации между субстратами.
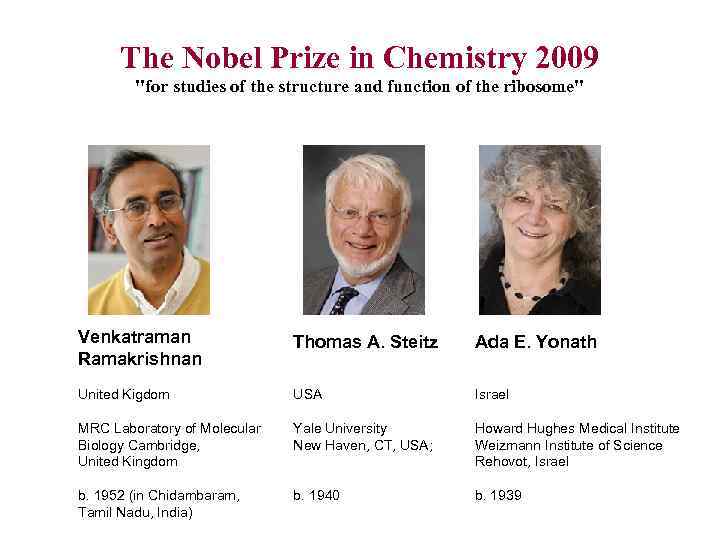 The Nobel Prize in Chemistry 2009 "for studies of the structure and function of the ribosome" Venkatraman Ramakrishnan Thomas A. Steitz Ada E. Yonath United Kigdom USA Israel MRC Laboratory of Molecular Biology Cambridge, United Kingdom Yale University New Haven, CT, USA; Howard Hughes Medical Institute Weizmann Institute of Science Rehovot, Israel b. 1952 (in Chidambaram, Tamil Nadu, India) b. 1940 b. 1939
The Nobel Prize in Chemistry 2009 "for studies of the structure and function of the ribosome" Venkatraman Ramakrishnan Thomas A. Steitz Ada E. Yonath United Kigdom USA Israel MRC Laboratory of Molecular Biology Cambridge, United Kingdom Yale University New Haven, CT, USA; Howard Hughes Medical Institute Weizmann Institute of Science Rehovot, Israel b. 1952 (in Chidambaram, Tamil Nadu, India) b. 1940 b. 1939
 13 -October-2009 Nobel Prize Awarded for the Structure of the Ribosome Three structural biologists have won the 2009 Nobel Prize in Chemistry for studies of the structure and function of the ribosome -- Venkatraman Ramakrishnan (MRC Laboratory of Molecular Biology), Thomas A. Steitz (Yale University), and Ada E. Yonath (Weizmann Institute of Science). The depositions of their first complete ribosome subunit structures (1 fjg, 1 ffk, and 1 fka) almost a decade ago ushered structural biology into a new era. Since that time, more than 120 ribosome structures consisting of 50 S, 30 S subunits and complete 70 S ribosomes have been contributed by these Nobel scientists. The structures, complexed with and without antibiotics, t. RNAs, m. RNAs, initiation factors, and release factors, provide a basis for understanding how the ribosome works and are useful tools for drug development.
13 -October-2009 Nobel Prize Awarded for the Structure of the Ribosome Three structural biologists have won the 2009 Nobel Prize in Chemistry for studies of the structure and function of the ribosome -- Venkatraman Ramakrishnan (MRC Laboratory of Molecular Biology), Thomas A. Steitz (Yale University), and Ada E. Yonath (Weizmann Institute of Science). The depositions of their first complete ribosome subunit structures (1 fjg, 1 ffk, and 1 fka) almost a decade ago ushered structural biology into a new era. Since that time, more than 120 ribosome structures consisting of 50 S, 30 S subunits and complete 70 S ribosomes have been contributed by these Nobel scientists. The structures, complexed with and without antibiotics, t. RNAs, m. RNAs, initiation factors, and release factors, provide a basis for understanding how the ribosome works and are useful tools for drug development.
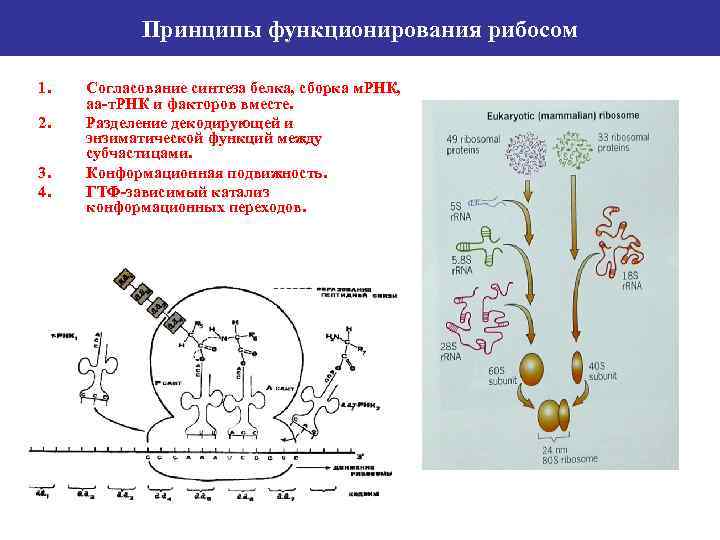 Принципы функционирования рибосом 1. 2. 3. 4. Согласование синтеза белка, сборка м. РНК, аа-т. РНК и факторов вместе. Разделение декодирующей и энзиматической функций между субчастицами. Конформационная подвижность. ГТФ-зависимый катализ конформационных переходов.
Принципы функционирования рибосом 1. 2. 3. 4. Согласование синтеза белка, сборка м. РНК, аа-т. РНК и факторов вместе. Разделение декодирующей и энзиматической функций между субчастицами. Конформационная подвижность. ГТФ-зависимый катализ конформационных переходов.
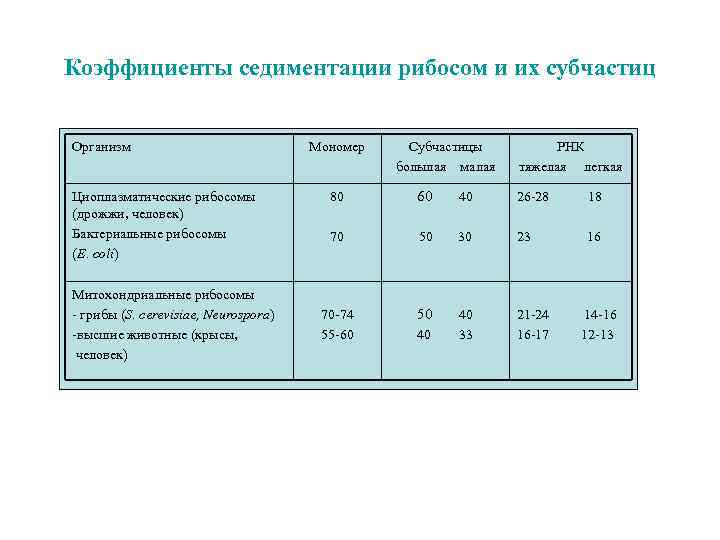 Коэффициенты седиментации рибосом и их субчастиц Организм Циоплазматические рибосомы (дрожжи, человек) Бактериальные рибосомы (E. coli) Митохондриальные рибосомы - грибы (S. cerevisiae, Neurospora) -высшие животные (крысы, человек) Мономер Cубчастицы большая малая РНК тяжелая легкая 80 60 40 26 -28 18 70 50 30 23 16 70 -74 55 -60 50 40 40 33 21 -24 16 -17 14 -16 12 -13
Коэффициенты седиментации рибосом и их субчастиц Организм Циоплазматические рибосомы (дрожжи, человек) Бактериальные рибосомы (E. coli) Митохондриальные рибосомы - грибы (S. cerevisiae, Neurospora) -высшие животные (крысы, человек) Мономер Cубчастицы большая малая РНК тяжелая легкая 80 60 40 26 -28 18 70 50 30 23 16 70 -74 55 -60 50 40 40 33 21 -24 16 -17 14 -16 12 -13
 Эпицикл синтеза белка Эпицикл (греч. epíkykios, от epí — на и kýkios — круг, окружность), вспомогательная окружность, по которой движется планета в геоцентрической системе мира; эпициклы используют для объяснения циклических процессов. 1. Инициация - этап связывания м. РНК с Rs и несколько последующих событий, приводящих к образованию первой пептидной связи. 2. Элонгация – синтез полипептидной цепи. 3. Терминация – завершение синтеза белка.
Эпицикл синтеза белка Эпицикл (греч. epíkykios, от epí — на и kýkios — круг, окружность), вспомогательная окружность, по которой движется планета в геоцентрической системе мира; эпициклы используют для объяснения циклических процессов. 1. Инициация - этап связывания м. РНК с Rs и несколько последующих событий, приводящих к образованию первой пептидной связи. 2. Элонгация – синтез полипептидной цепи. 3. Терминация – завершение синтеза белка.
 Инициация у прокариот Малая Rs-субчастица связывается с инициирующим кодоном AUG (90%) или GUG (10%). Как она его узнает? За 5 -10 н до инициирующего кодона располагается последовательность Shina Dalgarno, комплементарная последовательности в 3’- конце 16 S р. РНК малой Rs-субчастицы р. РНК - ACCUCCUUUA 3’ м. РНК - GGAGGA 5’ Присоединение 30 S Rs к AUG осуществляется в результате взаимодействия между этими комплементарными последовательностями. Для инициации требуются факторы инициации (у прокариот IF - Initiation Factors, у эукариот – e. IF – eukaryotic Initiation Factors). IF 1, IF 2 и IF 3 присоединяются к 30 S Rs. IF 2 - GTP-связывающий белок, необходим для присоединения первой аа-т. РНК. IF 3 – предотвращает присоединение 50 S Rs. IF 1 – облегчает присоединение 30 S к м. РНК и предотвращает проникновение аа-т. РНК в неправильное место в Rs.
Инициация у прокариот Малая Rs-субчастица связывается с инициирующим кодоном AUG (90%) или GUG (10%). Как она его узнает? За 5 -10 н до инициирующего кодона располагается последовательность Shina Dalgarno, комплементарная последовательности в 3’- конце 16 S р. РНК малой Rs-субчастицы р. РНК - ACCUCCUUUA 3’ м. РНК - GGAGGA 5’ Присоединение 30 S Rs к AUG осуществляется в результате взаимодействия между этими комплементарными последовательностями. Для инициации требуются факторы инициации (у прокариот IF - Initiation Factors, у эукариот – e. IF – eukaryotic Initiation Factors). IF 1, IF 2 и IF 3 присоединяются к 30 S Rs. IF 2 - GTP-связывающий белок, необходим для присоединения первой аа-т. РНК. IF 3 – предотвращает присоединение 50 S Rs. IF 1 – облегчает присоединение 30 S к м. РНК и предотвращает проникновение аа-т. РНК в неправильное место в Rs.
 Включение первой аминокислоты. AUG- не только инициирующий кодон, но и Мet-кодон. В N-конце полипептида всегда включается Met-Nformylmethionine, потом он удаляется специальной протеазой. Формальдегидная группа присоединяется к Met ферментативно уже после того, как Met присоединится к т. РНК. Такая АК может включаться только в начале, и не может в процессе элонгации, из-за отсутствия свободной аминогруппы. Таким образом, существует 2 т. РНКMet – t-RNAi. Met - инициирующая и t-RNAMet - кодирующая. t-RNAi. Met входит в преинициирующий комплекс, связываясь с AUG кодоном м. РНК и IF 2. IF 1 и IF 3 высвобождаются.
Включение первой аминокислоты. AUG- не только инициирующий кодон, но и Мet-кодон. В N-конце полипептида всегда включается Met-Nformylmethionine, потом он удаляется специальной протеазой. Формальдегидная группа присоединяется к Met ферментативно уже после того, как Met присоединится к т. РНК. Такая АК может включаться только в начале, и не может в процессе элонгации, из-за отсутствия свободной аминогруппы. Таким образом, существует 2 т. РНКMet – t-RNAi. Met - инициирующая и t-RNAMet - кодирующая. t-RNAi. Met входит в преинициирующий комплекс, связываясь с AUG кодоном м. РНК и IF 2. IF 1 и IF 3 высвобождаются.
 Сборка полного инициативного комплекса Как только инициирующая т. РНК связывается с AUG, 50 S Rs присоединяется к комплексу и происходит гидролиз GTP-IF 2, обеспечивая энергией конформационные изменения, необходимые для высвобождения IF 2 -GDP. Сродство IF 2 к Met-t-RNAi теряется и IF 2 -GDP легко вытесняется из Rs. 50 S Rs при ассоциации с 30 S Rs вытесняет и другие факторы, включая IF 3. В итоге образуется полная 70 S Rs с Р-участком занятым Met-t-RNAi и с вакантным А-участком.
Сборка полного инициативного комплекса Как только инициирующая т. РНК связывается с AUG, 50 S Rs присоединяется к комплексу и происходит гидролиз GTP-IF 2, обеспечивая энергией конформационные изменения, необходимые для высвобождения IF 2 -GDP. Сродство IF 2 к Met-t-RNAi теряется и IF 2 -GDP легко вытесняется из Rs. 50 S Rs при ассоциации с 30 S Rs вытесняет и другие факторы, включая IF 3. В итоге образуется полная 70 S Rs с Р-участком занятым Met-t-RNAi и с вакантным А-участком.
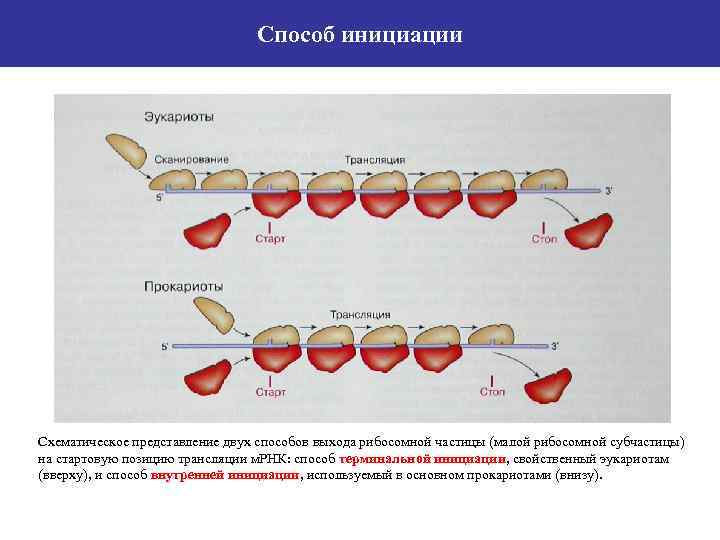 Способ инициации Схематическое представление двух способов выхода рибосомной частицы (малой рибосомной субчастицы) на стартовую позицию трансляции м. РНК: способ терминальной инициации, свойственный эукариотам (вверху), и способ внутренней инициации, используемый в основном прокариотами (внизу).
Способ инициации Схематическое представление двух способов выхода рибосомной частицы (малой рибосомной субчастицы) на стартовую позицию трансляции м. РНК: способ терминальной инициации, свойственный эукариотам (вверху), и способ внутренней инициации, используемый в основном прокариотами (внизу).
 Инициация у эукариот - Необходимо по крайней мере 10 факторов инициации (~25 полипептидных цепей) – e. IF 1 -e. IF 5. - Некоторые факторы инициации (e. IF 1, e. IF 2, e. IF 1 A, e. IF 2 B, e. IF 3) соединяются с 40 S и подготавливают ее к присоединению т. РНКMet и м. РНК. - т. РНКМет связываются с 40 S посредством e. IF 2 -GTP. - Комплекс 43 S находит 5’–кэпированный конец м. РНК. 43 S доставляется к м. РНК с помощью факторов инициации, расплетающих и связанных с м. РНК, среди них: e. IF 4 F – белковый комплекс (3 субъединицы α, β и γ), γ обладает РНК -зависимой хеликазной и АТФазной активностью. e. IF 4 E – связывается с 5’-кэпом. e. IF 4 A – белок 45 к. Да, движется вдоль 5’-конца, удаляя все шпильки. e. IF 4 G - служит связующим звеном между 5’-кэпом и 3’-полиаденилированным концом, превращая линейную молекулу м. РНК в кольцевую. -Сев на 5’-конец, 43 S сканирует м. РНК до тех пор пока не достигнет последовательности (5’-CCACCAUGC-3’), содержащую AUG инициирующий кодон. Существуют специальные белки, обеспечивающие движение и в том числе расщепляющие АТФ и использующие энергию для расплетания и движения. -Когда 43 S достигнет AUG, e. IF 2 -GTP подвергается гидролизу, e. IF 2 -GDP высвобождается и присоединяется большая субъединица 60 S Rs, т. е. завершается инициация трансляции.
Инициация у эукариот - Необходимо по крайней мере 10 факторов инициации (~25 полипептидных цепей) – e. IF 1 -e. IF 5. - Некоторые факторы инициации (e. IF 1, e. IF 2, e. IF 1 A, e. IF 2 B, e. IF 3) соединяются с 40 S и подготавливают ее к присоединению т. РНКMet и м. РНК. - т. РНКМет связываются с 40 S посредством e. IF 2 -GTP. - Комплекс 43 S находит 5’–кэпированный конец м. РНК. 43 S доставляется к м. РНК с помощью факторов инициации, расплетающих и связанных с м. РНК, среди них: e. IF 4 F – белковый комплекс (3 субъединицы α, β и γ), γ обладает РНК -зависимой хеликазной и АТФазной активностью. e. IF 4 E – связывается с 5’-кэпом. e. IF 4 A – белок 45 к. Да, движется вдоль 5’-конца, удаляя все шпильки. e. IF 4 G - служит связующим звеном между 5’-кэпом и 3’-полиаденилированным концом, превращая линейную молекулу м. РНК в кольцевую. -Сев на 5’-конец, 43 S сканирует м. РНК до тех пор пока не достигнет последовательности (5’-CCACCAUGC-3’), содержащую AUG инициирующий кодон. Существуют специальные белки, обеспечивающие движение и в том числе расщепляющие АТФ и использующие энергию для расплетания и движения. -Когда 43 S достигнет AUG, e. IF 2 -GTP подвергается гидролизу, e. IF 2 -GDP высвобождается и присоединяется большая субъединица 60 S Rs, т. е. завершается инициация трансляции.
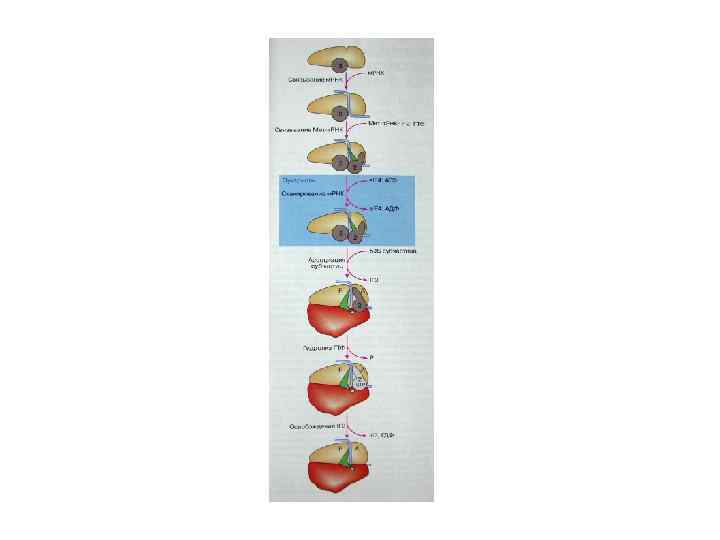
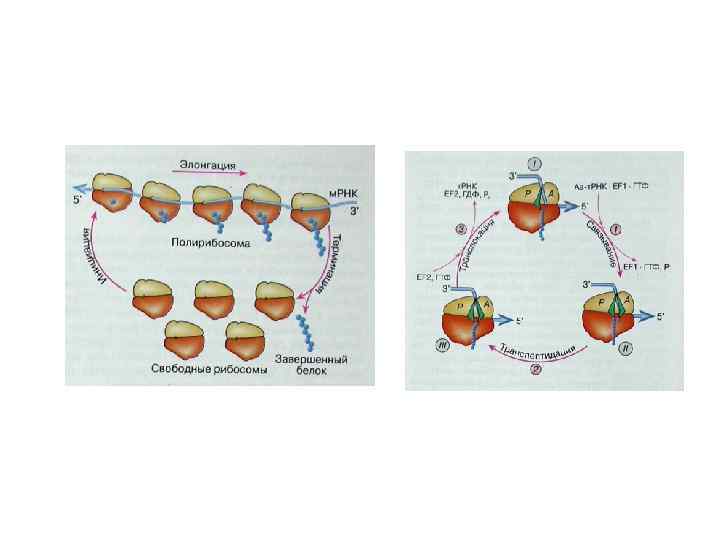
 Элонгация трансляции 1. Поступление аа-т. РНК. В случае нахождения и-т. РНК в Р-сайте возможно поступление второй аа-т. РНК в А-сайт. Перед прочным связыванием аа-т. РНК с м. РНК в А-сайте, она связывается с фактором элонгации EF-Tu/e. EF 1α, который необходим для доставки аа-т. РНК к А-сайту. Хотя любая аа-т. РНК-Tu-GTP может проникнуть в А-сайт, но связывается только комплементарная м. РНК. Малая Rs субчастица играет роль в узнавании взаимодействующих кодон-антикодон. Как только соответствующая аа-т. РНК-Tu. GTP свяжется с кодоном м. РНК, GTP гидролизуется и компонент Tu-GDP высвобождается, покидая аа-т. РНК. Для восстановления Tu-GTP из Tu-GDP требуется фактор элонгации EF-Ts. 2. Образование пептидной связи (транспептидация). Met-t. RNAi + Aa-t. RNAe → Met-Aa-t. RNAe + t. RNAi Две аа-т. РНК располагаются рядом и могут взаимодействовать друг с другом, образуя пептидную связь между АК (n) в Р-сайте и АК (n+1) в А-сайте. Спонтанно без затраты энергии, катализируется пептидилтрансферазой (р. РНК бол. Rs-суб. )= рибозим. Пептидил-т. РНК занимает не положенный А-сайт – это претранслокационное состояние. 3. Транслокация. м. РНК и Rs двигаются относительно друга в направлении 5’→ 3’. Транслокации содействует второй GTP-связывающий фактор элонгации – EF-G/e. EF 2. 4. Высвобождение деацетил-т. РНК из Е-сайта. При элонгации используется 2 GTP при - связывание аа-т. РНК с м. РНК и транслокация. Цикл элонгации занимает 1/20 сек ORF, frameshift mutations Обнаружено, что м. РНК содержит recoding signal, который заставляет Rs изменить рамку считывания, либо вернув назад на 1 н (-1), либо перепрыгнув через 1 н (+1).
Элонгация трансляции 1. Поступление аа-т. РНК. В случае нахождения и-т. РНК в Р-сайте возможно поступление второй аа-т. РНК в А-сайт. Перед прочным связыванием аа-т. РНК с м. РНК в А-сайте, она связывается с фактором элонгации EF-Tu/e. EF 1α, который необходим для доставки аа-т. РНК к А-сайту. Хотя любая аа-т. РНК-Tu-GTP может проникнуть в А-сайт, но связывается только комплементарная м. РНК. Малая Rs субчастица играет роль в узнавании взаимодействующих кодон-антикодон. Как только соответствующая аа-т. РНК-Tu. GTP свяжется с кодоном м. РНК, GTP гидролизуется и компонент Tu-GDP высвобождается, покидая аа-т. РНК. Для восстановления Tu-GTP из Tu-GDP требуется фактор элонгации EF-Ts. 2. Образование пептидной связи (транспептидация). Met-t. RNAi + Aa-t. RNAe → Met-Aa-t. RNAe + t. RNAi Две аа-т. РНК располагаются рядом и могут взаимодействовать друг с другом, образуя пептидную связь между АК (n) в Р-сайте и АК (n+1) в А-сайте. Спонтанно без затраты энергии, катализируется пептидилтрансферазой (р. РНК бол. Rs-суб. )= рибозим. Пептидил-т. РНК занимает не положенный А-сайт – это претранслокационное состояние. 3. Транслокация. м. РНК и Rs двигаются относительно друга в направлении 5’→ 3’. Транслокации содействует второй GTP-связывающий фактор элонгации – EF-G/e. EF 2. 4. Высвобождение деацетил-т. РНК из Е-сайта. При элонгации используется 2 GTP при - связывание аа-т. РНК с м. РНК и транслокация. Цикл элонгации занимает 1/20 сек ORF, frameshift mutations Обнаружено, что м. РНК содержит recoding signal, который заставляет Rs изменить рамку считывания, либо вернув назад на 1 н (-1), либо перепрыгнув через 1 н (+1).
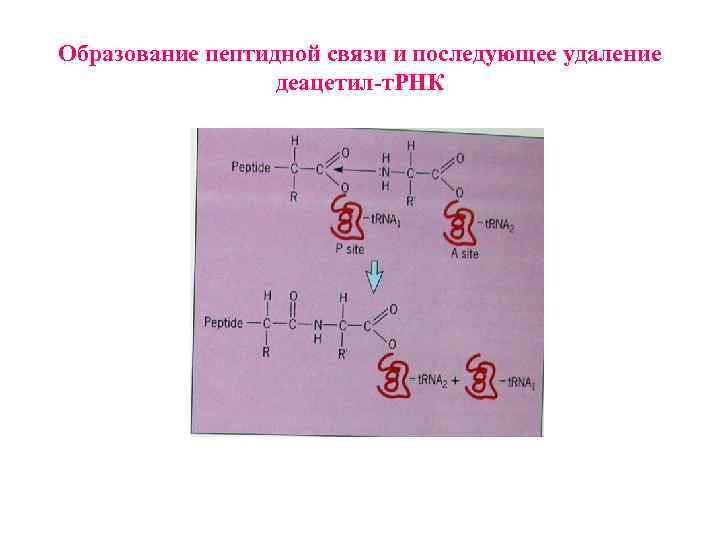 Образование пептидной связи и последующее удаление деацетил-т. РНК
Образование пептидной связи и последующее удаление деацетил-т. РНК
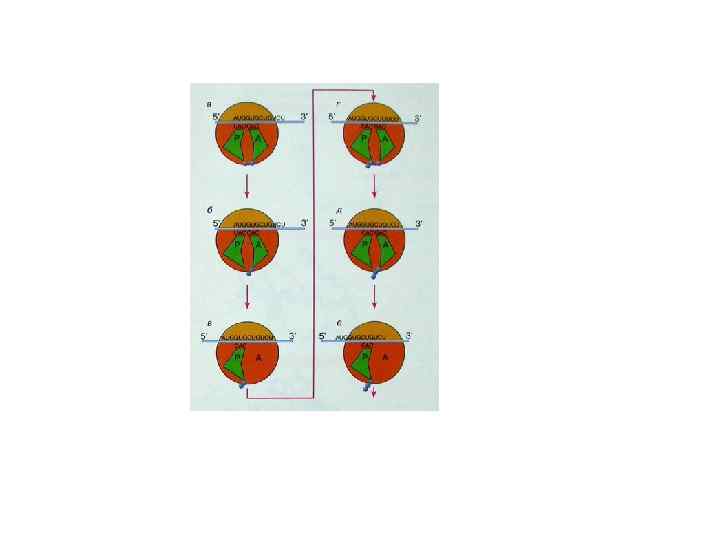
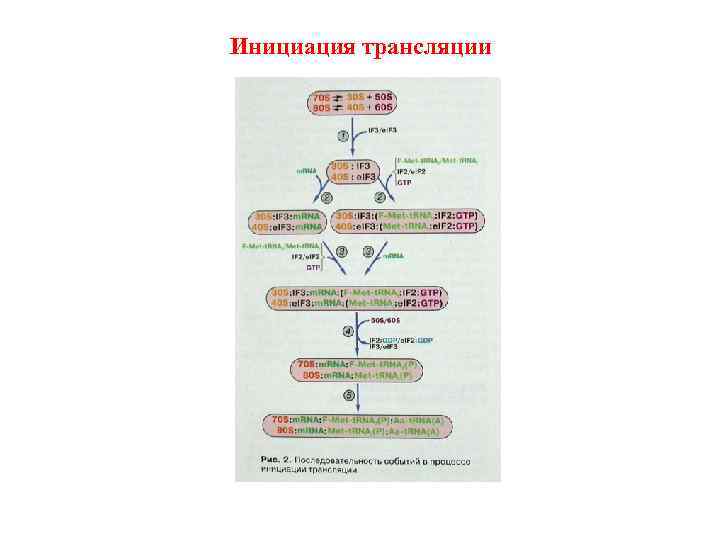 Инициация трансляции
Инициация трансляции
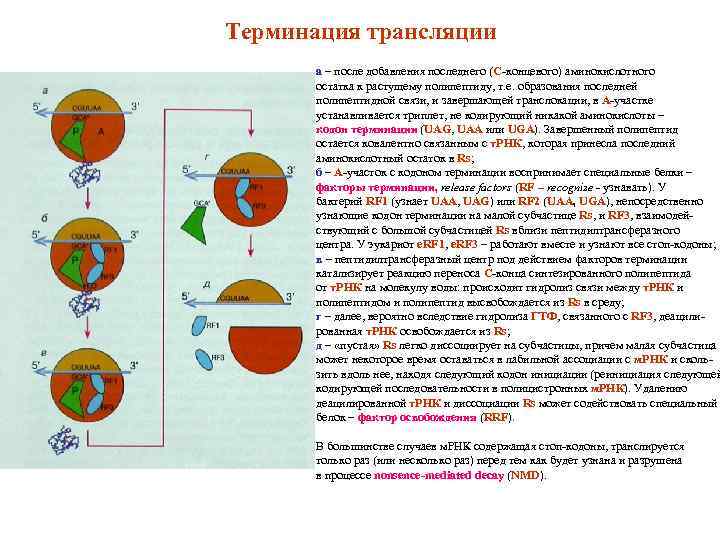 Терминация трансляции а – после добавления последнего (С-концевого) аминокислотного остатка к растущему полипептиду, т. е. образования последней полипептидной связи, и завершающей транслокации, в А-участке устанавливается триплет, не кодирующий никакой аминокислоты – кодон терминации (UAG, UAA или UGA). Завершенный полипептид остается ковалентно связанным с т. РНК, которая принесла последний аминокислотный остаток в Rs; б – А-участок с кодоном терминации воспринимает специальные белки – факторы терминации, release factors (RF – recognize - узнавать). У бактерий RF 1 (узнает UAA, UAG) или RF 2 (UAA, UGA), непосредственно узнающие кодон терминации на малой субчастице Rs, и RF 3, взаимодействующий с большой субчастицей Rs вблизи пептидилтрансферазного центра. У эукариот e. RF 1, e. RF 3 – работают вместе и узнают все стоп-кодоны; в – пептидилтрансферазный центр под действием факторов терминации катализирует реакцию переноса С-конца синтезированного полипептида от т. РНК на молекулу воды: происходит гидролиз связи между т. РНК и полипептидом и полипептид высвобождается из Rs в среду; г – далее, вероятно вследствие гидролиза ГТФ, связанного с RF 3, деацилированная т. РНК освобождается из Rs; д – «пустая» Rs легко диссоциирует на субчастицы, причем малая субчастица может некоторое время оставаться в лабильной ассоциации с м. РНК и скользить вдоль нее, находя следующий кодон инициации (реинициация следующей кодирующей последовательности в полицистронных м. РНК). Удалению деацилированной т. РНК и диссоциации Rs может содействовать специальный белок – фактор освобождения (RRF). В большинстве случаев м. РНК содержащая стоп-кодоны, транслируется только раз (или несколько раз) перед тем как будет узнана и разрушена в процессе nonsence-mediated decay (NMD).
Терминация трансляции а – после добавления последнего (С-концевого) аминокислотного остатка к растущему полипептиду, т. е. образования последней полипептидной связи, и завершающей транслокации, в А-участке устанавливается триплет, не кодирующий никакой аминокислоты – кодон терминации (UAG, UAA или UGA). Завершенный полипептид остается ковалентно связанным с т. РНК, которая принесла последний аминокислотный остаток в Rs; б – А-участок с кодоном терминации воспринимает специальные белки – факторы терминации, release factors (RF – recognize - узнавать). У бактерий RF 1 (узнает UAA, UAG) или RF 2 (UAA, UGA), непосредственно узнающие кодон терминации на малой субчастице Rs, и RF 3, взаимодействующий с большой субчастицей Rs вблизи пептидилтрансферазного центра. У эукариот e. RF 1, e. RF 3 – работают вместе и узнают все стоп-кодоны; в – пептидилтрансферазный центр под действием факторов терминации катализирует реакцию переноса С-конца синтезированного полипептида от т. РНК на молекулу воды: происходит гидролиз связи между т. РНК и полипептидом и полипептид высвобождается из Rs в среду; г – далее, вероятно вследствие гидролиза ГТФ, связанного с RF 3, деацилированная т. РНК освобождается из Rs; д – «пустая» Rs легко диссоциирует на субчастицы, причем малая субчастица может некоторое время оставаться в лабильной ассоциации с м. РНК и скользить вдоль нее, находя следующий кодон инициации (реинициация следующей кодирующей последовательности в полицистронных м. РНК). Удалению деацилированной т. РНК и диссоциации Rs может содействовать специальный белок – фактор освобождения (RRF). В большинстве случаев м. РНК содержащая стоп-кодоны, транслируется только раз (или несколько раз) перед тем как будет узнана и разрушена в процессе nonsence-mediated decay (NMD).
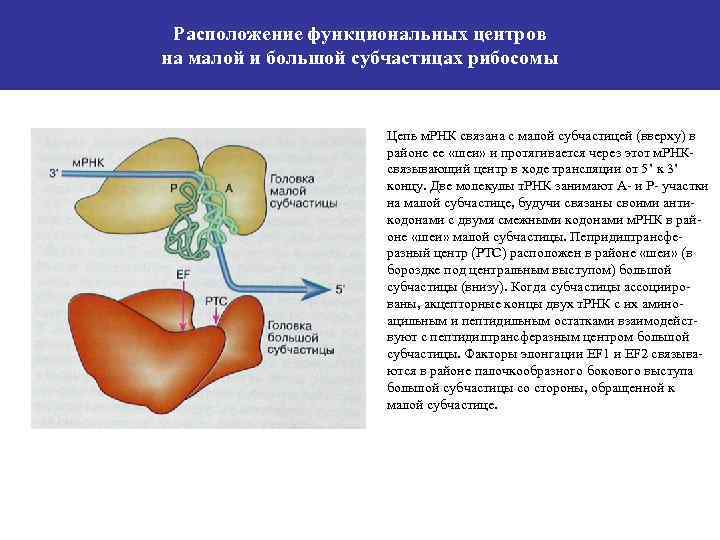 Расположение функциональных центров на малой и большой субчастицах рибосомы Цепь м. РНК связана с малой субчастицей (вверху) в районе ее «шеи» и протягивается через этот м. РНКсвязывающий центр в ходе трансляции от 5’ к 3’ концу. Две молекулы т. РНК занимают А- и Р- участки на малой субчастице, будучи связаны своими антикодонами с двумя смежными кодонами м. РНК в районе «шеи» малой субчастицы. Пепридилтрансферазный центр (РТС) расположен в районе «шеи» (в бороздке под центральным выступом) большой субчастицы (внизу). Когда субчастицы ассоциированы, акцепторные концы двух т. РНК с их аминоацильным и пептидильным остатками взаимодействуют с пептидилтрансферазным центром большой субчастицы. Факторы элонгации EF 1 и EF 2 связываются в районе палочкообразного бокового выступа большой субчастицы со стороны, обращенной к малой субчастице.
Расположение функциональных центров на малой и большой субчастицах рибосомы Цепь м. РНК связана с малой субчастицей (вверху) в районе ее «шеи» и протягивается через этот м. РНКсвязывающий центр в ходе трансляции от 5’ к 3’ концу. Две молекулы т. РНК занимают А- и Р- участки на малой субчастице, будучи связаны своими антикодонами с двумя смежными кодонами м. РНК в районе «шеи» малой субчастицы. Пепридилтрансферазный центр (РТС) расположен в районе «шеи» (в бороздке под центральным выступом) большой субчастицы (внизу). Когда субчастицы ассоциированы, акцепторные концы двух т. РНК с их аминоацильным и пептидильным остатками взаимодействуют с пептидилтрансферазным центром большой субчастицы. Факторы элонгации EF 1 и EF 2 связываются в районе палочкообразного бокового выступа большой субчастицы со стороны, обращенной к малой субчастице.
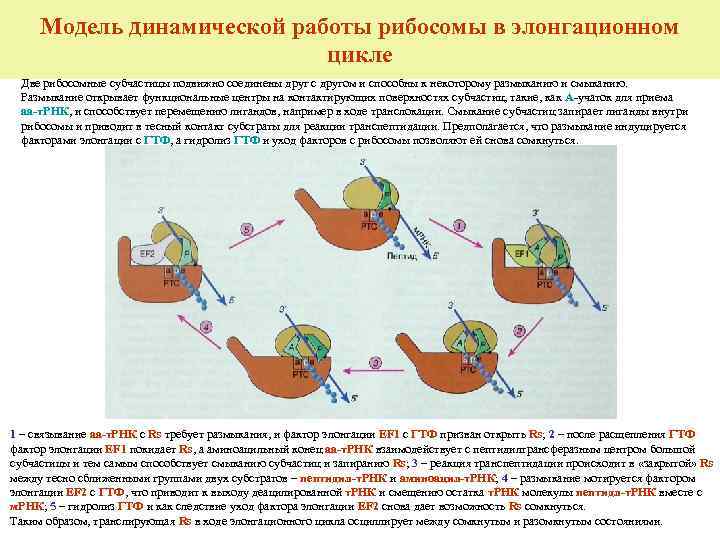 Модель динамической работы рибосомы в элонгационном цикле Две рибосомные субчастицы подвижно соединены друг с другом и способны к некоторому размыканию и смыканию. Размыкание открывает функциональные центры на контактирующих поверхностях субчастиц, такие, как А-учаток для приема аа-т. РНК, и способствует перемещению лигандов, например в ходе транслокации. Смыкание субчастиц запирает лиганды внутри рибосомы и приводит в тесный контакт субстраты для реакции транспептидации. Предполагается, что размыкание индуцируется факторами элонгации с ГТФ, а гидролиз ГТФ и уход факторов с рибосомы позволяют ей снова сомкнуться. 1 – связывание аа-т. РНК с Rs требует размыкания, и фактор элонгации EF 1 с ГТФ призван открыть Rs; 2 – после расщепления ГТФ фактор элонгации EF 1 покидает Rs, а аминоацильный конец аа-т. РНК взаимодействует с пептидилтрансферазным центром большой субчастицы и тем самым способствует смыканию субчастиц и запиранию Rs; 3 – реакция транспептидации происходит в «закрытой» Rs между тесно сближенными группами двух субстратов – пептидил-т. РНК и аминоацил-т. РНК; 4 – размыкание мотируется фактором элонгации EF 2 с ГТФ, что приводит к выходу деацилированной т. РНК и смещению остатка т. РНК молекулы пептидл-т. РНК вместе с м. РНК; 5 – гидролиз ГТФ и как следствие уход фактора элонгации EF 2 снова дает возможность Rs сомкнуться. Таким образом, транслирующая Rs в ходе элонгационного цикла осциллирует между сомкнутым и разомкнутым состояниями.
Модель динамической работы рибосомы в элонгационном цикле Две рибосомные субчастицы подвижно соединены друг с другом и способны к некоторому размыканию и смыканию. Размыкание открывает функциональные центры на контактирующих поверхностях субчастиц, такие, как А-учаток для приема аа-т. РНК, и способствует перемещению лигандов, например в ходе транслокации. Смыкание субчастиц запирает лиганды внутри рибосомы и приводит в тесный контакт субстраты для реакции транспептидации. Предполагается, что размыкание индуцируется факторами элонгации с ГТФ, а гидролиз ГТФ и уход факторов с рибосомы позволяют ей снова сомкнуться. 1 – связывание аа-т. РНК с Rs требует размыкания, и фактор элонгации EF 1 с ГТФ призван открыть Rs; 2 – после расщепления ГТФ фактор элонгации EF 1 покидает Rs, а аминоацильный конец аа-т. РНК взаимодействует с пептидилтрансферазным центром большой субчастицы и тем самым способствует смыканию субчастиц и запиранию Rs; 3 – реакция транспептидации происходит в «закрытой» Rs между тесно сближенными группами двух субстратов – пептидил-т. РНК и аминоацил-т. РНК; 4 – размыкание мотируется фактором элонгации EF 2 с ГТФ, что приводит к выходу деацилированной т. РНК и смещению остатка т. РНК молекулы пептидл-т. РНК вместе с м. РНК; 5 – гидролиз ГТФ и как следствие уход фактора элонгации EF 2 снова дает возможность Rs сомкнуться. Таким образом, транслирующая Rs в ходе элонгационного цикла осциллирует между сомкнутым и разомкнутым состояниями.
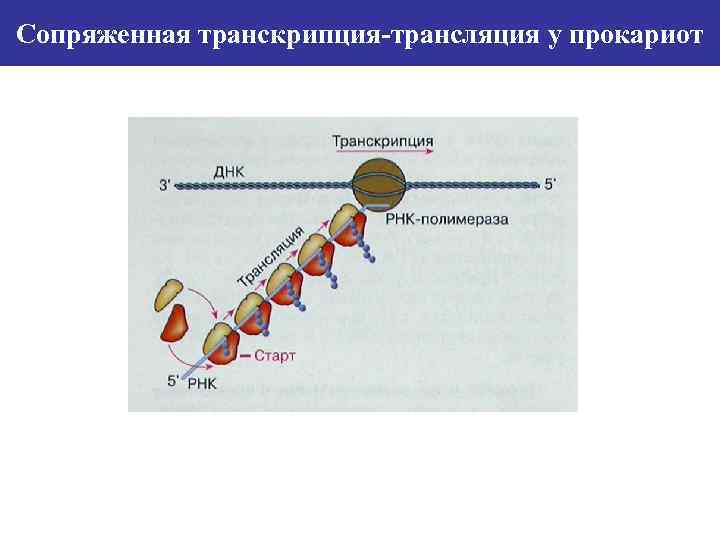 Сопряженная транскрипция-трансляция у прокариот
Сопряженная транскрипция-трансляция у прокариот
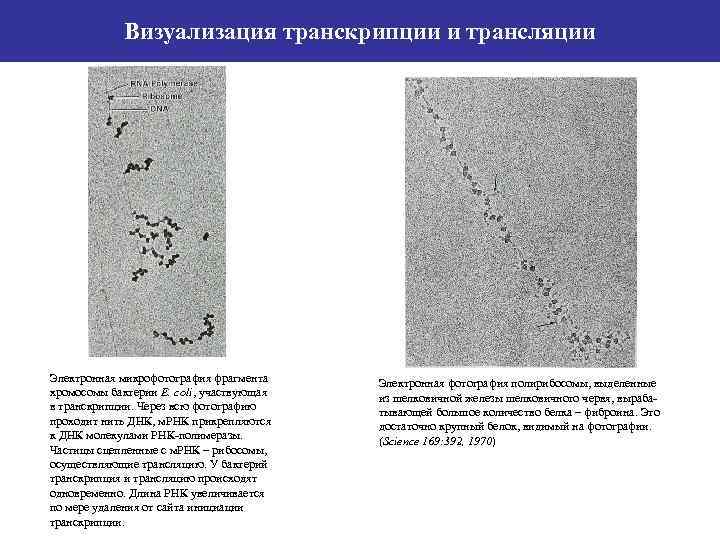 Визуализация транскрипции и трансляции Электронная микрофотография фрагмента хромосомы бактерии E. coli, участвующая в транскрипции. Через всю фотографию проходит нить ДНК, м. РНК прикрепляются к ДНК молекулами РНК-полимеразы. Частицы сцепленные с м. РНК – рибосомы, осуществляющие трансляцию. У бактерий транскрипция и трансляцию происходят одновременно. Длина РНК увеличивается по мере удаления от сайта инициации транскрипции. Электронная фотография полирибосомы, выделенные из шелковичной железы шелковичного червя, вырабатывающей большое количество белка – фиброина. Это достаточно крупный белок, видимый на фотографии. (Science 169: 392, 1970)
Визуализация транскрипции и трансляции Электронная микрофотография фрагмента хромосомы бактерии E. coli, участвующая в транскрипции. Через всю фотографию проходит нить ДНК, м. РНК прикрепляются к ДНК молекулами РНК-полимеразы. Частицы сцепленные с м. РНК – рибосомы, осуществляющие трансляцию. У бактерий транскрипция и трансляцию происходят одновременно. Длина РНК увеличивается по мере удаления от сайта инициации транскрипции. Электронная фотография полирибосомы, выделенные из шелковичной железы шелковичного червя, вырабатывающей большое количество белка – фиброина. Это достаточно крупный белок, видимый на фотографии. (Science 169: 392, 1970)
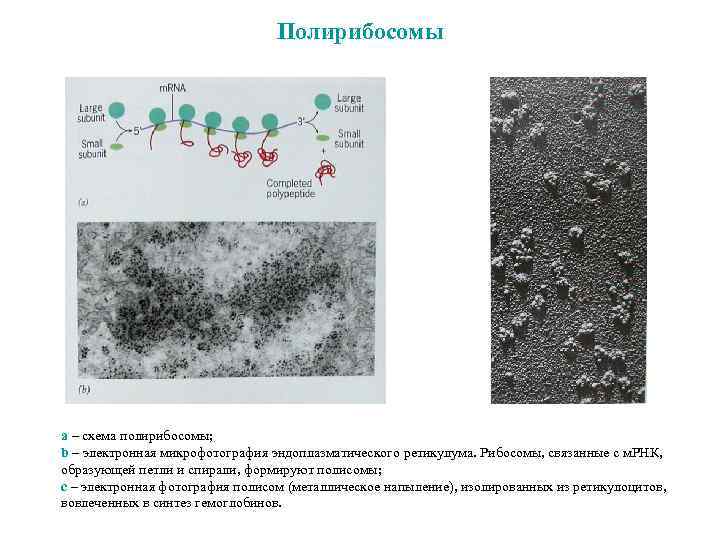 Полирибосомы a – схема полирибосомы; b – электронная микрофотография эндоплазматического ретикулума. Рибосомы, связанные с м. РНК, образующей петли и спирали, формируют полисомы; с – электронная фотография полисом (металлическое напыление), изолированных из ретикулоцитов, вовлеченных в синтез гемоглобинов.
Полирибосомы a – схема полирибосомы; b – электронная микрофотография эндоплазматического ретикулума. Рибосомы, связанные с м. РНК, образующей петли и спирали, формируют полисомы; с – электронная фотография полисом (металлическое напыление), изолированных из ретикулоцитов, вовлеченных в синтез гемоглобинов.
 Особенности трансляции у эукариот : • • трансляция проходит - в цитоплазме, транскрипция - в ядре; для инициации трансляции требуется не только 5’-конец, но и 3’-конец, являющийся «усилителем» инициации трансляции. Rs может вмещать не более 10 -30 АК С-концевых, N-конец – вне Rs. Средний размер белка 100 -300 АК.
Особенности трансляции у эукариот : • • трансляция проходит - в цитоплазме, транскрипция - в ядре; для инициации трансляции требуется не только 5’-конец, но и 3’-конец, являющийся «усилителем» инициации трансляции. Rs может вмещать не более 10 -30 АК С-концевых, N-конец – вне Rs. Средний размер белка 100 -300 АК.
 Особенности формирования структуры белка По мере роста полипептида происходит котрансляционное формирование структуры белка. Некоторые белки не предназначены для немедленного использования и должны транспортироваться через мембрану. Для транспорта требуется несвернутое состояние полипептидной цепи. 1) 2) а – формирование начальных спиральных участков в растущей полипептидной цепи глобина до момента связывания гема; б – формирование спиралей E и F, связывание гема между ними и складывание цепи в третичную структуру; в – дальнейший рост цепи и завершение формирования вторичной и третичной структуры глобина на рибосоме. В клетке используется 2 стратегии: Rs сидят на мембране и растущий полипептид в развернутом виде поступает из них непосредственно в мембрану; Свободная Rs синтезирует полипептидную цепь, которая по мере выхода из Rs взаимодействует со специальными белками – молекулярными шаперонами. Шапероны препятствуют полному сворачиванию белка в компактную структуру и поддерживают его недосвернутое состояние в растворе. После освобождения из Rs эти недоствернутые белки взаимодействуют с мембраной и транспортируются через неё.
Особенности формирования структуры белка По мере роста полипептида происходит котрансляционное формирование структуры белка. Некоторые белки не предназначены для немедленного использования и должны транспортироваться через мембрану. Для транспорта требуется несвернутое состояние полипептидной цепи. 1) 2) а – формирование начальных спиральных участков в растущей полипептидной цепи глобина до момента связывания гема; б – формирование спиралей E и F, связывание гема между ними и складывание цепи в третичную структуру; в – дальнейший рост цепи и завершение формирования вторичной и третичной структуры глобина на рибосоме. В клетке используется 2 стратегии: Rs сидят на мембране и растущий полипептид в развернутом виде поступает из них непосредственно в мембрану; Свободная Rs синтезирует полипептидную цепь, которая по мере выхода из Rs взаимодействует со специальными белками – молекулярными шаперонами. Шапероны препятствуют полному сворачиванию белка в компактную структуру и поддерживают его недосвернутое состояние в растворе. После освобождения из Rs эти недоствернутые белки взаимодействуют с мембраной и транспортируются через неё.


