Lection 13.ppt
- Количество слайдов: 37
 Лекция 13. Репликация и транскрипция сквозь нуклеосомы
Лекция 13. Репликация и транскрипция сквозь нуклеосомы
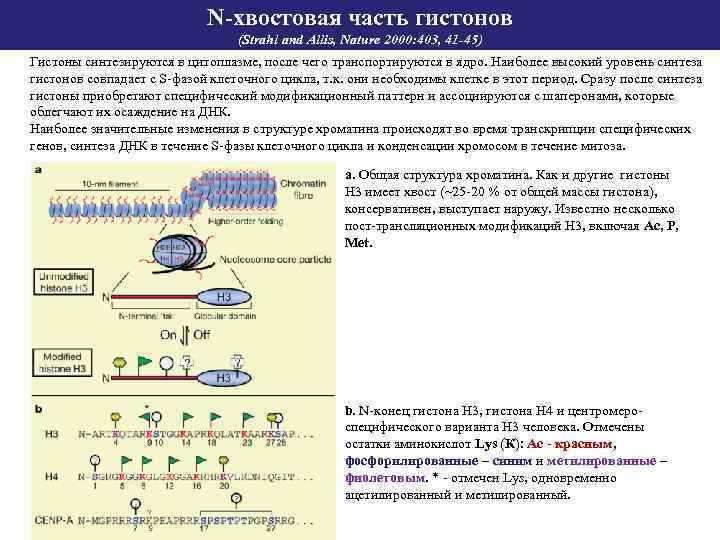 N-хвостовая часть гистонов (Strahl and Allis, Nature 2000: 403, 41 -45) Гистоны синтезируются в цитоплазме, после чего транспортируются в ядро. Наиболее высокий уровень синтеза гистонов совпадает с S-фазой клеточного цикла, т. к. они необходимы клетке в этот период. Сразу после синтеза гистоны приобретают специфический модификационный паттерн и ассоциируются с шаперонами, которые облегчают их осаждение на ДНК. Наиболее значительные изменения в структуре хроматина происходят во время транскрипции специфических генов, синтеза ДНК в течение S-фазы клеточного цикла и конденсации хромосом в течение митоза. а. Общая структура хроматина. Как и другие гистоны Н 3 имеет хвост (~25 -20 % от общей массы гистона), консервативен, выступает наружу. Известно несколько пост-трансляционных модификаций Н 3, включая Ас, Р, Меt. b. N-конец гистона Н 3, гистона Н 4 и центромероспецифического варианта Н 3 человека. Отмечены остатки аминокислот Lys (К): Ac - красным, фосфорилированные – синим и метилированные – фиолетовым. * - отмечен Lys, одновременно ацетилированный и метилированный.
N-хвостовая часть гистонов (Strahl and Allis, Nature 2000: 403, 41 -45) Гистоны синтезируются в цитоплазме, после чего транспортируются в ядро. Наиболее высокий уровень синтеза гистонов совпадает с S-фазой клеточного цикла, т. к. они необходимы клетке в этот период. Сразу после синтеза гистоны приобретают специфический модификационный паттерн и ассоциируются с шаперонами, которые облегчают их осаждение на ДНК. Наиболее значительные изменения в структуре хроматина происходят во время транскрипции специфических генов, синтеза ДНК в течение S-фазы клеточного цикла и конденсации хромосом в течение митоза. а. Общая структура хроматина. Как и другие гистоны Н 3 имеет хвост (~25 -20 % от общей массы гистона), консервативен, выступает наружу. Известно несколько пост-трансляционных модификаций Н 3, включая Ас, Р, Меt. b. N-конец гистона Н 3, гистона Н 4 и центромероспецифического варианта Н 3 человека. Отмечены остатки аминокислот Lys (К): Ac - красным, фосфорилированные – синим и метилированные – фиолетовым. * - отмечен Lys, одновременно ацетилированный и метилированный.
 Ковалентные модификации гистонов Модификация гистонов играет структурную роль. Фосфорилирование радикалов серина приводит к образованию отрицательно заряженного остатка фосфосерина. Ацетилирование хвостов гистонов нейтрализует (снижает положительный заряд) лизин и ослабляет взаимодействие с соседними нуклеосомами и линкерной ДНК, разрыхляет нуклеосому. Метилирование делает лизин невосприимчивым к ацетилированию.
Ковалентные модификации гистонов Модификация гистонов играет структурную роль. Фосфорилирование радикалов серина приводит к образованию отрицательно заряженного остатка фосфосерина. Ацетилирование хвостов гистонов нейтрализует (снижает положительный заряд) лизин и ослабляет взаимодействие с соседними нуклеосомами и линкерной ДНК, разрыхляет нуклеосому. Метилирование делает лизин невосприимчивым к ацетилированию.
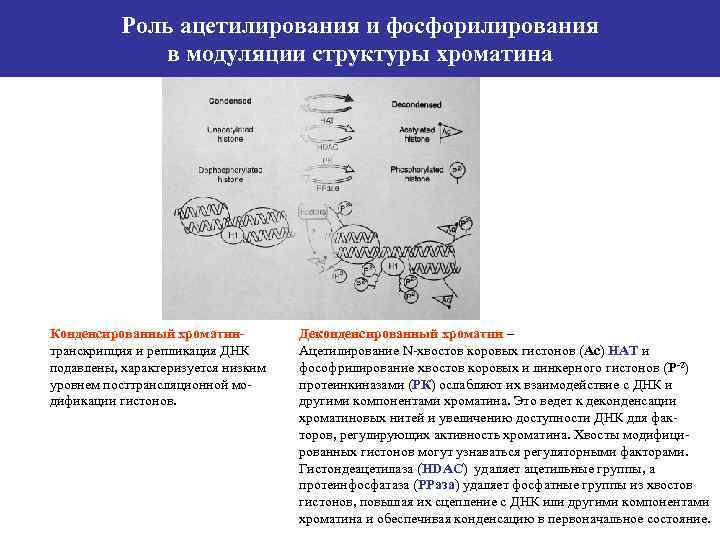 Роль ацетилирования и фосфорилирования в модуляции структуры хроматина Конденсированный хроматинтранскрипция и репликация ДНК подавлены, характеризуется низким уровнем посттрансляционной модификации гистонов. Деконденсированный хроматин – Ацетилирование N-хвостов коровых гистонов (Аc) НАТ и фософрилирование хвостов коровых и линкерного гистонов (Р-2) протеинкиназами (РК) ослабляют их взаимодействие с ДНК и другими компонентами хроматина. Это ведет к деконденсации хроматиновых нитей и увеличению доступности ДНК для факторов, регулирующих активность хроматина. Хвосты модифицированных гистонов могут узнаваться регуляторными факторами. Гистондеацетилаза (HDAC) удаляет ацетильные группы, а протеинфосфатаза (РРаза) удаляет фосфатные группы из хвостов гистонов, повышая их сцепление с ДНК или другими компонентами хроматина и обеспечивая конденсацию в первоначальное состояние.
Роль ацетилирования и фосфорилирования в модуляции структуры хроматина Конденсированный хроматинтранскрипция и репликация ДНК подавлены, характеризуется низким уровнем посттрансляционной модификации гистонов. Деконденсированный хроматин – Ацетилирование N-хвостов коровых гистонов (Аc) НАТ и фософрилирование хвостов коровых и линкерного гистонов (Р-2) протеинкиназами (РК) ослабляют их взаимодействие с ДНК и другими компонентами хроматина. Это ведет к деконденсации хроматиновых нитей и увеличению доступности ДНК для факторов, регулирующих активность хроматина. Хвосты модифицированных гистонов могут узнаваться регуляторными факторами. Гистондеацетилаза (HDAC) удаляет ацетильные группы, а протеинфосфатаза (РРаза) удаляет фосфатные группы из хвостов гистонов, повышая их сцепление с ДНК или другими компонентами хроматина и обеспечивая конденсацию в первоначальное состояние.
 Фософорилирование гистонов совпадает с началом митоза, который начинается с фосфорилирования линкерного гистона H 1. Хвосты (N-концевые части) коровых гистонов подвергаются фосфорилированию во время деления клетки (Т 3, S 10, S 28 гистона Н 3 и S 1 гистона Н 4). В середине 1960 -ых гг показали, что активно-транскрибируемые гены связаны с более ацетилированными гистонами, чем неактивные. С помощью ферментов НАТ (histone acetyltransferase) ацетильная группа переносится с ацетил-кофермента А (acetyl-Co. A) на ε-амино группу определенных лизиновых остатков в хвостовой области гистона.
Фософорилирование гистонов совпадает с началом митоза, который начинается с фосфорилирования линкерного гистона H 1. Хвосты (N-концевые части) коровых гистонов подвергаются фосфорилированию во время деления клетки (Т 3, S 10, S 28 гистона Н 3 и S 1 гистона Н 4). В середине 1960 -ых гг показали, что активно-транскрибируемые гены связаны с более ацетилированными гистонами, чем неактивные. С помощью ферментов НАТ (histone acetyltransferase) ацетильная группа переносится с ацетил-кофермента А (acetyl-Co. A) на ε-амино группу определенных лизиновых остатков в хвостовой области гистона.
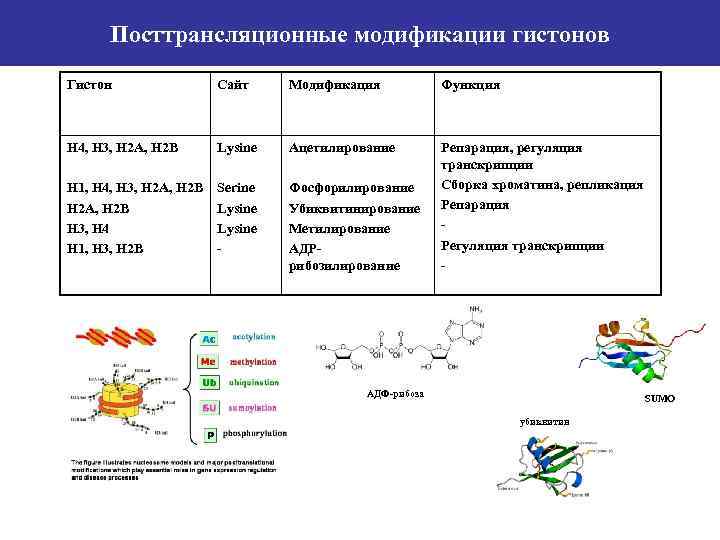 Посттрансляционные модификации гистонов Гистон Сайт Модификация Функция Н 4, Н 3, Н 2 А, Н 2 В Lysine Ацетилирование Н 1, Н 4, Н 3, Н 2 А, Н 2 В Н 3, Н 4 Н 1, Н 3, Н 2 В Serine Lysine - Фосфорилирование Убиквитинирование Метилирование АДРрибозилирование Репарация, регуляция транскрипции Cборка хроматина, репликация Репарация Регуляция транскрипции - АДФ-рибоза SUMO убиквитин
Посттрансляционные модификации гистонов Гистон Сайт Модификация Функция Н 4, Н 3, Н 2 А, Н 2 В Lysine Ацетилирование Н 1, Н 4, Н 3, Н 2 А, Н 2 В Н 3, Н 4 Н 1, Н 3, Н 2 В Serine Lysine - Фосфорилирование Убиквитинирование Метилирование АДРрибозилирование Репарация, регуляция транскрипции Cборка хроматина, репликация Репарация Регуляция транскрипции - АДФ-рибоза SUMO убиквитин
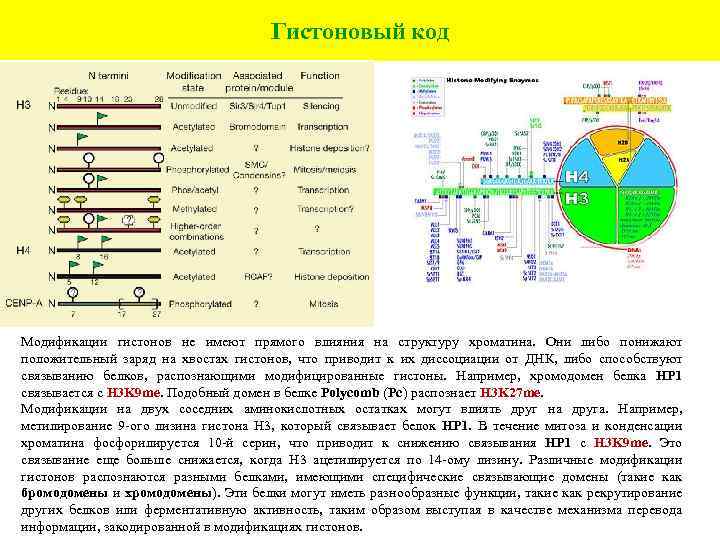 Гистоновый код Модификации гистонов не имеют прямого влияния на структуру хроматина. Они либо понижают положительный заряд на хвостах гистонов, что приводит к их диссоциации от ДНК, либо способствуют связыванию белков, распознающими модифицированные гистоны. Например, хромодомен белка HP 1 связывается с H 3 K 9 me. Подобный домен в белке Polycomb (Pc) распознает H 3 K 27 me. Модификации на двух соседних аминокислотных остатках могут влиять друг на друга. Например, метилирование 9 -ого лизина гистона Н 3, который связывает белок HP 1. В течение митоза и конденсации хроматина фосфорилируется 10 -й серин, что приводит к снижению связывания HP 1 с Н 3 K 9 me. Это связывание еще больше снижается, когда Н 3 ацетилируется по 14 -ому лизину. Различные модификации гистонов распознаются разными белками, имеющими специфические связывающие домены (такие как бромодомены и хромодомены). Эти белки могут иметь разнообразные функции, такие как рекрутирование других белков или ферментативную активность, таким образом выступая в качестве механизма перевода информации, закодированной в модификациях гистонов.
Гистоновый код Модификации гистонов не имеют прямого влияния на структуру хроматина. Они либо понижают положительный заряд на хвостах гистонов, что приводит к их диссоциации от ДНК, либо способствуют связыванию белков, распознающими модифицированные гистоны. Например, хромодомен белка HP 1 связывается с H 3 K 9 me. Подобный домен в белке Polycomb (Pc) распознает H 3 K 27 me. Модификации на двух соседних аминокислотных остатках могут влиять друг на друга. Например, метилирование 9 -ого лизина гистона Н 3, который связывает белок HP 1. В течение митоза и конденсации хроматина фосфорилируется 10 -й серин, что приводит к снижению связывания HP 1 с Н 3 K 9 me. Это связывание еще больше снижается, когда Н 3 ацетилируется по 14 -ому лизину. Различные модификации гистонов распознаются разными белками, имеющими специфические связывающие домены (такие как бромодомены и хромодомены). Эти белки могут иметь разнообразные функции, такие как рекрутирование других белков или ферментативную активность, таким образом выступая в качестве механизма перевода информации, закодированной в модификациях гистонов.
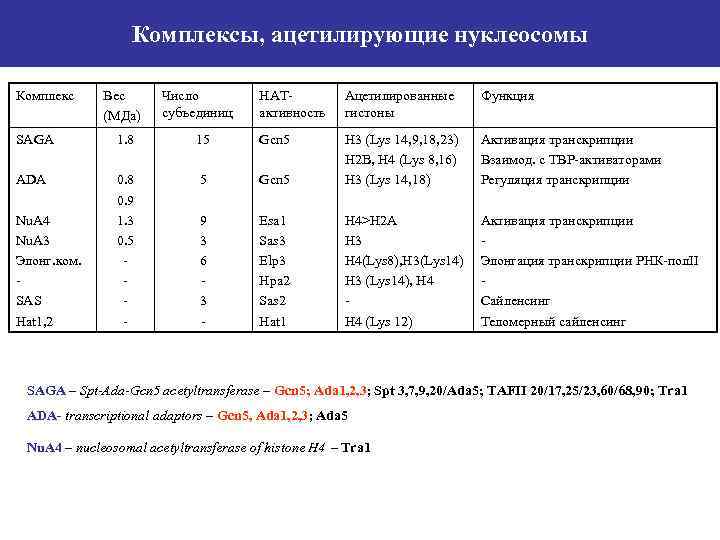 Комплексы, ацетилирующие нуклеосомы Комплекс Вес (МДа) Число субъединиц НАТактивность Ацетилированные гистоны Функция Активация транскрипции Взаимод. с ТВР-активаторами Регуляция транскрипции Активация транскрипции Элонгация транскрипции РНК-пол. II Сайленсинг Теломерный сайленсинг SAGA 1. 8 15 Gcn 5 ADA 0. 8 0. 9 1. 3 0. 5 - 5 Gcn 5 H 3 (Lys 14, 9, 18, 23) H 2 B, H 4 (Lys 8, 16) H 3 (Lys 14, 18) 9 3 6 3 - Esa 1 Sas 3 Elp 3 Hpa 2 Sas 2 Hat 1 H 4>H 2 A H 3 H 4(Lys 8), H 3(Lys 14) H 3 (Lys 14), H 4 (Lys 12) Nu. A 4 Nu. A 3 Элонг. ком. SAS Hat 1, 2 SAGA – Spt-Ada-Gcn 5 acetyltransferase – Gcn 5; Ada 1, 2, 3; Spt 3, 7, 9, 20/Ada 5; TAFII 20/17, 25/23, 60/68, 90; Tra 1 ADA- transcriptional adaptors – Gcn 5, Ada 1, 2, 3; Ada 5 Nu. A 4 – nucleosomal acetyltransferase of histone H 4 – Tra 1
Комплексы, ацетилирующие нуклеосомы Комплекс Вес (МДа) Число субъединиц НАТактивность Ацетилированные гистоны Функция Активация транскрипции Взаимод. с ТВР-активаторами Регуляция транскрипции Активация транскрипции Элонгация транскрипции РНК-пол. II Сайленсинг Теломерный сайленсинг SAGA 1. 8 15 Gcn 5 ADA 0. 8 0. 9 1. 3 0. 5 - 5 Gcn 5 H 3 (Lys 14, 9, 18, 23) H 2 B, H 4 (Lys 8, 16) H 3 (Lys 14, 18) 9 3 6 3 - Esa 1 Sas 3 Elp 3 Hpa 2 Sas 2 Hat 1 H 4>H 2 A H 3 H 4(Lys 8), H 3(Lys 14) H 3 (Lys 14), H 4 (Lys 12) Nu. A 4 Nu. A 3 Элонг. ком. SAS Hat 1, 2 SAGA – Spt-Ada-Gcn 5 acetyltransferase – Gcn 5; Ada 1, 2, 3; Spt 3, 7, 9, 20/Ada 5; TAFII 20/17, 25/23, 60/68, 90; Tra 1 ADA- transcriptional adaptors – Gcn 5, Ada 1, 2, 3; Ada 5 Nu. A 4 – nucleosomal acetyltransferase of histone H 4 – Tra 1
 SAGA-комплекс Комплекс содержит многочисленные транскрипционные регуляторные белки, включая компоненты вовлеченные во взаимодействие с ТВР (Spt и ТAF), транскрипционными активаторами (Ada и Tra 1) и ацетилирование гистонов (Gcn 5). Gcn 5 обладает НАТ-активностью, входит в состав 3 комплексов SAGA и ADA, имеющих общие субъединицы, перекрывающийся, но различный спектр ацетилирования. ADA 2, ADA 3, Gcn 5 – принимают участие в ацетилировании нуклеосом; ADA 1, ADA 5 – рекрутируют ТВР и, возможно, другие основные транскрипционные факторы к ТАТА-box. Ас, ацетилированные гистоны; Act, белок-активатор. Для работы Рol. II-зависимой транскрипции необходимы основные факторы транскрипции (Pol. II, TBP, TFIID, B, F и Е), которые образуют предынициативный комплекс на промоторе, а также ген-специфические активаторы транскрипции, связывающиеся с UAS или энхансеры, стимулирующие транскрипцию через активационные домены. Существуют транскрипционные факторы третьего типа, названные медиаторами, коактиваторами или адапторами. В 1990 г. было обнаружено, что многие коактиваторы обладают НАТ-активностью. Мутации, нарушающие НАТ-активность, сопровождались снижением транскрипционной активности. SAGA имеет глобальную роль в транскрипции. Показано, что SAGA и TFIID участвуют в экспрессии ~70% всех генов дрожжей.
SAGA-комплекс Комплекс содержит многочисленные транскрипционные регуляторные белки, включая компоненты вовлеченные во взаимодействие с ТВР (Spt и ТAF), транскрипционными активаторами (Ada и Tra 1) и ацетилирование гистонов (Gcn 5). Gcn 5 обладает НАТ-активностью, входит в состав 3 комплексов SAGA и ADA, имеющих общие субъединицы, перекрывающийся, но различный спектр ацетилирования. ADA 2, ADA 3, Gcn 5 – принимают участие в ацетилировании нуклеосом; ADA 1, ADA 5 – рекрутируют ТВР и, возможно, другие основные транскрипционные факторы к ТАТА-box. Ас, ацетилированные гистоны; Act, белок-активатор. Для работы Рol. II-зависимой транскрипции необходимы основные факторы транскрипции (Pol. II, TBP, TFIID, B, F и Е), которые образуют предынициативный комплекс на промоторе, а также ген-специфические активаторы транскрипции, связывающиеся с UAS или энхансеры, стимулирующие транскрипцию через активационные домены. Существуют транскрипционные факторы третьего типа, названные медиаторами, коактиваторами или адапторами. В 1990 г. было обнаружено, что многие коактиваторы обладают НАТ-активностью. Мутации, нарушающие НАТ-активность, сопровождались снижением транскрипционной активности. SAGA имеет глобальную роль в транскрипции. Показано, что SAGA и TFIID участвуют в экспрессии ~70% всех генов дрожжей.
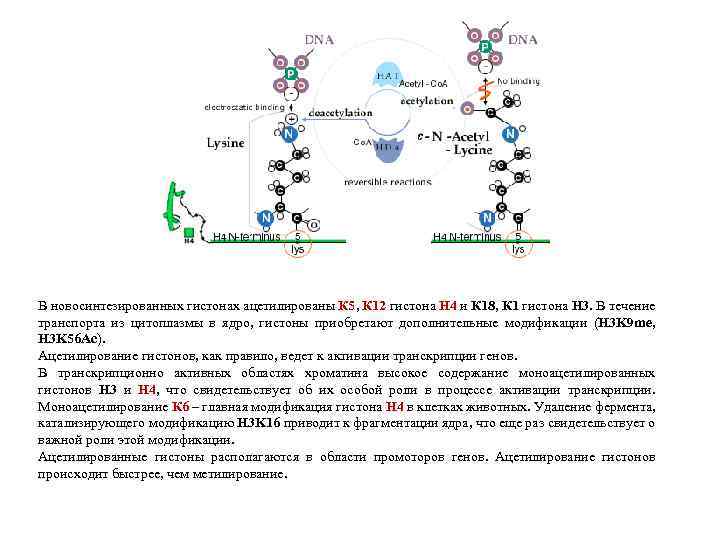 В новосинтезированных гистонах ацетилированы К 5, К 12 гистона Н 4 и К 18, К 1 гистона Н 3. В течение транспорта из цитоплазмы в ядро, гистоны приобретают дополнительные модификации (H 3 K 9 me, H 3 K 56 Ac). Ацетилирование гистонов, как правило, ведет к активации транскрипции генов. В транскрипционно активных областях хроматина высокое содержание моноацетилированных гистонов H 3 и H 4, что свидетельствует об их особой роли в процессе активации транскрипции. Моноацетилирование К 6 – главная модификация гистона H 4 в клетках животных. Удаление фермента, катализирующего модификацию H 3 K 16 приводит к фрагментации ядра, что еще раз свидетельствует о важной роли этой модификации. Ацетилированные гистоны располагаются в области промоторов генов. Ацетилирование гистонов происходит быстрее, чем метилирование.
В новосинтезированных гистонах ацетилированы К 5, К 12 гистона Н 4 и К 18, К 1 гистона Н 3. В течение транспорта из цитоплазмы в ядро, гистоны приобретают дополнительные модификации (H 3 K 9 me, H 3 K 56 Ac). Ацетилирование гистонов, как правило, ведет к активации транскрипции генов. В транскрипционно активных областях хроматина высокое содержание моноацетилированных гистонов H 3 и H 4, что свидетельствует об их особой роли в процессе активации транскрипции. Моноацетилирование К 6 – главная модификация гистона H 4 в клетках животных. Удаление фермента, катализирующего модификацию H 3 K 16 приводит к фрагментации ядра, что еще раз свидетельствует о важной роли этой модификации. Ацетилированные гистоны располагаются в области промоторов генов. Ацетилирование гистонов происходит быстрее, чем метилирование.
 - - Ацетилирование гистонов может стимулировать транскрипцию in vitro хроматиновых матриц РНКполимеразой III (Ura et al. , 1997; Tse et al. , 1998), но не РНК-полимеразой II (Nightingale et al. , 1998). HAT – Nu. A 3 как in vitro, так и in vivo, взаимодействует с комплексом FACT-CP (John et al. , 2000) HAT – Elp 3, вовлеченная в перестройку хроматина (Wittschieben et al. , 2000), является частью элонгационного комплекса РНК-полимеразы II (Wittschieben et al. , 1999). Нуклеосомный барьер труднее всего преодолевает РНК-полимераза II. Хроматин отнюдь не является только «упаковочным материалом» , но скорее динамичной структурой, активно используемой в клетке для регуляции активности генов. Структура нуклеосом играет важнейшую роль в регуляции активности генов на уровне инициации и, по-видимому, используется для регуляции скорости элонгации транскрипта.
- - Ацетилирование гистонов может стимулировать транскрипцию in vitro хроматиновых матриц РНКполимеразой III (Ura et al. , 1997; Tse et al. , 1998), но не РНК-полимеразой II (Nightingale et al. , 1998). HAT – Nu. A 3 как in vitro, так и in vivo, взаимодействует с комплексом FACT-CP (John et al. , 2000) HAT – Elp 3, вовлеченная в перестройку хроматина (Wittschieben et al. , 2000), является частью элонгационного комплекса РНК-полимеразы II (Wittschieben et al. , 1999). Нуклеосомный барьер труднее всего преодолевает РНК-полимераза II. Хроматин отнюдь не является только «упаковочным материалом» , но скорее динамичной структурой, активно используемой в клетке для регуляции активности генов. Структура нуклеосом играет важнейшую роль в регуляции активности генов на уровне инициации и, по-видимому, используется для регуляции скорости элонгации транскрипта.
 Модель участия коактиваторов в регуляции транскрипции посредством ацетилирования гистонов Модель: Нуклеосомы ингибируют связывание ТВР с ТАТА-box и это ингибирование опосредовано хвостовыми участками гистонов. Как составная часть TFIID, TAFII 250, может облегчать связывание ТВР непосредственно через ацетилирование гистонов ТАТА-box, позволяя образование предынициирующего комплекса. В дополнение к TAFII 250 -НАТ-активности TFIID содержит гистоноктамер-подобную структуру, которая может замещать нуклеосомные гистоны. Транскрипционные факторы (GR) связываются со специальным сайтом (GRE) и рекрутируют коактиватор (CPB), осуществляющий ацетилирование гистонов. 1. Репрессированное состояние хроматина. ДНК ассоциирует с диацетилированными гистонами. 2. Транскрипционный фактор GR связывается с GRE-элементом, коактиватор CBP связывается с GR. Гистоны нуклеосом в области ТАТА-box ацетилированы. 3. Ацетилированные гистоны диссоциируют с ДНК. 4. TFIID связывается с открытой областью ДНК. Одна из субъединиц TFIID (TAFII 250), обладающая НАТ-активностью, вместе с СВР разрушает дополнительные нуклеосомы, позволяя осуществить инициацию транскрипции. 5. Ацетилируются оставшиеся нуклеосомы, РНК-полимераза связывается с промотором, начинается транскрипция.
Модель участия коактиваторов в регуляции транскрипции посредством ацетилирования гистонов Модель: Нуклеосомы ингибируют связывание ТВР с ТАТА-box и это ингибирование опосредовано хвостовыми участками гистонов. Как составная часть TFIID, TAFII 250, может облегчать связывание ТВР непосредственно через ацетилирование гистонов ТАТА-box, позволяя образование предынициирующего комплекса. В дополнение к TAFII 250 -НАТ-активности TFIID содержит гистоноктамер-подобную структуру, которая может замещать нуклеосомные гистоны. Транскрипционные факторы (GR) связываются со специальным сайтом (GRE) и рекрутируют коактиватор (CPB), осуществляющий ацетилирование гистонов. 1. Репрессированное состояние хроматина. ДНК ассоциирует с диацетилированными гистонами. 2. Транскрипционный фактор GR связывается с GRE-элементом, коактиватор CBP связывается с GR. Гистоны нуклеосом в области ТАТА-box ацетилированы. 3. Ацетилированные гистоны диссоциируют с ДНК. 4. TFIID связывается с открытой областью ДНК. Одна из субъединиц TFIID (TAFII 250), обладающая НАТ-активностью, вместе с СВР разрушает дополнительные нуклеосомы, позволяя осуществить инициацию транскрипции. 5. Ацетилируются оставшиеся нуклеосомы, РНК-полимераза связывается с промотором, начинается транскрипция.
 Репрессия транскрипции у эукариот Метилирование ДНК У млекопитающих ДНК интенсивно метилирована (1 из 100 н). Метилирование осуществляется ДНК-метилтрансферазой, кодируемой геном h. DNMT. Метилируется С 5 -цитозин в динуклеотидной паре 5’-Cp. G-3’. Такая последовательность распределена по ДНК неслучайным образом, CG-богатые области образуют островки (~1000 пн), которые чаще всего локализованы в промоторной области. Метилирование промоторной ДНК строго коррелирует с репрессией гена и служит для поддержания репрессированного состояния, а не для инициации инактивации. Метилированная ДНК препятствует взаимодействию регуляторных белков с промотором. Степень репрессии пропорциональна плотности m. C на условную единицу длины. Однако метилирование может препятствовать взаимодействию участка ДНК с репрессорными белками. Например, метилирование района интрона может обеспечить активность гена, поскольку в интронах могут располагаться энхансеры транскрипции. Образование гетерохроматина также связано с метилированием.
Репрессия транскрипции у эукариот Метилирование ДНК У млекопитающих ДНК интенсивно метилирована (1 из 100 н). Метилирование осуществляется ДНК-метилтрансферазой, кодируемой геном h. DNMT. Метилируется С 5 -цитозин в динуклеотидной паре 5’-Cp. G-3’. Такая последовательность распределена по ДНК неслучайным образом, CG-богатые области образуют островки (~1000 пн), которые чаще всего локализованы в промоторной области. Метилирование промоторной ДНК строго коррелирует с репрессией гена и служит для поддержания репрессированного состояния, а не для инициации инактивации. Метилированная ДНК препятствует взаимодействию регуляторных белков с промотором. Степень репрессии пропорциональна плотности m. C на условную единицу длины. Однако метилирование может препятствовать взаимодействию участка ДНК с репрессорными белками. Например, метилирование района интрона может обеспечить активность гена, поскольку в интронах могут располагаться энхансеры транскрипции. Образование гетерохроматина также связано с метилированием.
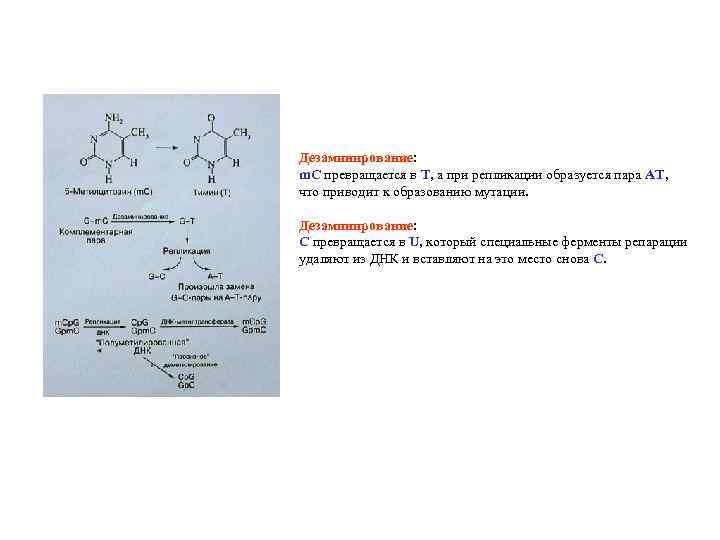 Дезаминирование: m. C превращается в Т, а при репликации образуется пара АТ, что приводит к образованию мутации. Дезаминирование: С превращается в U, который специальные ферменты репарации удаляют из ДНК и вставляют на это место снова С.
Дезаминирование: m. C превращается в Т, а при репликации образуется пара АТ, что приводит к образованию мутации. Дезаминирование: С превращается в U, который специальные ферменты репарации удаляют из ДНК и вставляют на это место снова С.
 При присоединении фермента к ДНК водородные связи С с комплементарным основанием G в двунитевой ДНК разрываются и метильная группа присоединяется к С, находящемся в момент метилирования вне двойной спирали ДНК. Затем m. C возвращается на место С напротив G, водородные связи между m. C и G восстанавливаются. С метилируется, если рядом находится G в сочетании Cp. G (р –остаток фосфорной кислоты). После репликации метилированной ДНК новообразованная цепь не метилированна (полуметилированная ДНК). m. C p G G p m. C репликация ДНК Cp G ДНК-метил- G p m. C трансфераза m. C p G G p m. C Полуметилированная ДНК – это субстрат для ДНК-метилтрансферазы, которая метилирует С, комплементарный G в новообразованной цепи ДНК. Таким образом, если отдельные С, соседствующие с G в родительской нити ДНК, уже метилированы, то метилированы будут и С в комплементарной, вновь синтезированной цепи ДНК. В результате благодаря способности метилтрансферазы узнавать полуметилированные районы ДНК рисунок распределения метилированных оснований будет автоматически поддерживаться при репликации ДНК в процессе клеточных делений.
При присоединении фермента к ДНК водородные связи С с комплементарным основанием G в двунитевой ДНК разрываются и метильная группа присоединяется к С, находящемся в момент метилирования вне двойной спирали ДНК. Затем m. C возвращается на место С напротив G, водородные связи между m. C и G восстанавливаются. С метилируется, если рядом находится G в сочетании Cp. G (р –остаток фосфорной кислоты). После репликации метилированной ДНК новообразованная цепь не метилированна (полуметилированная ДНК). m. C p G G p m. C репликация ДНК Cp G ДНК-метил- G p m. C трансфераза m. C p G G p m. C Полуметилированная ДНК – это субстрат для ДНК-метилтрансферазы, которая метилирует С, комплементарный G в новообразованной цепи ДНК. Таким образом, если отдельные С, соседствующие с G в родительской нити ДНК, уже метилированы, то метилированы будут и С в комплементарной, вновь синтезированной цепи ДНК. В результате благодаря способности метилтрансферазы узнавать полуметилированные районы ДНК рисунок распределения метилированных оснований будет автоматически поддерживаться при репликации ДНК в процессе клеточных делений.
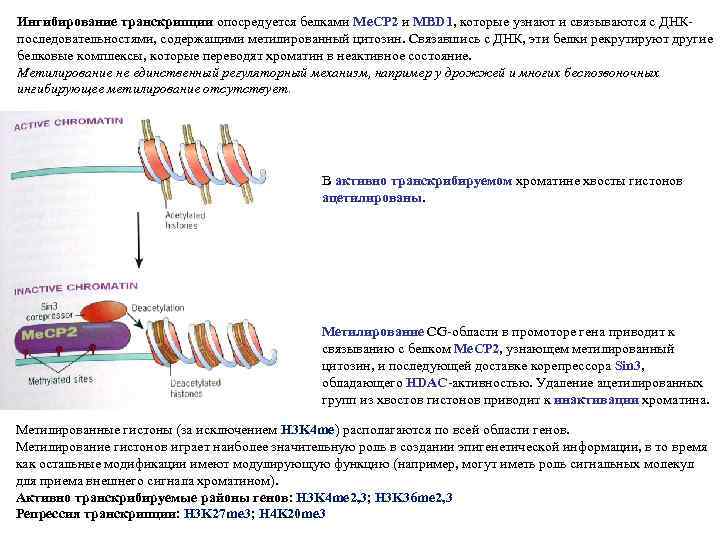 Ингибирование транскрипции опосредуется белками Me. СP 2 и MBD 1, которые узнают и связываются с ДНКпоследовательностями, содержащими метилированный цитозин. Связавшись с ДНК, эти белки рекрутируют другие белковые комплексы, которые переводят хроматин в неактивное состояние. Метилирование не единственный регуляторный механизм, например у дрожжей и многих беспозвоночных ингибирующее метилирование отсутствует. В активно транскрибируемом хроматине хвосты гистонов ацетилированы. Метилирование CG-области в промоторе гена приводит к связыванию с белком Ме. СР 2, узнающем метилированный цитозин, и последующей доставке корепрессора Sin 3, обладающего HDAC-активностью. Удаление ацетилированных групп из хвостов гистонов приводит к инактивации хроматина. Метилированные гистоны (за исключением H 3 K 4 me) располагаются по всей области генов. Метилирование гистонов играет наиболее значительную роль в создании эпигенетической информации, в то время как остальные модификации имеют модулирующую функцию (например, могут иметь роль сигнальных молекул для приема внешнего сигнала хроматином). Активно транскрибируемые районы генов: H 3 K 4 me 2, 3; H 3 K 36 me 2, 3 Репрессия транскрипции: H 3 K 27 me 3; H 4 K 20 me 3
Ингибирование транскрипции опосредуется белками Me. СP 2 и MBD 1, которые узнают и связываются с ДНКпоследовательностями, содержащими метилированный цитозин. Связавшись с ДНК, эти белки рекрутируют другие белковые комплексы, которые переводят хроматин в неактивное состояние. Метилирование не единственный регуляторный механизм, например у дрожжей и многих беспозвоночных ингибирующее метилирование отсутствует. В активно транскрибируемом хроматине хвосты гистонов ацетилированы. Метилирование CG-области в промоторе гена приводит к связыванию с белком Ме. СР 2, узнающем метилированный цитозин, и последующей доставке корепрессора Sin 3, обладающего HDAC-активностью. Удаление ацетилированных групп из хвостов гистонов приводит к инактивации хроматина. Метилированные гистоны (за исключением H 3 K 4 me) располагаются по всей области генов. Метилирование гистонов играет наиболее значительную роль в создании эпигенетической информации, в то время как остальные модификации имеют модулирующую функцию (например, могут иметь роль сигнальных молекул для приема внешнего сигнала хроматином). Активно транскрибируемые районы генов: H 3 K 4 me 2, 3; H 3 K 36 me 2, 3 Репрессия транскрипции: H 3 K 27 me 3; H 4 K 20 me 3
 Распределение модификаций гистонов в активных и «молчащих» генах Модификационные паттерны различаются в активно транскрибирующихся и «молчащих» генах (нуклеосомы a, c и гены b, d). Состояние активных генов показано на a и b. Внешний сигнал приводит к активации киназ (оранжевые), которые затем могут фосфорилировать гистоны и факторы транскрипции (TF, красный). Транскрипционные факторы затем связываются с областью промотора, облегчая связывание РНК-полимеразы II с ДНК (RNAPII, зеленый). С этого момента начинается транскрипция. В процессе элонгации РНК-полимераза. II (фосфорилированная с С-конца) может взаимодействовать с модификаторами гистонов (розовый), например, с Set 2, который метилирует H 3 K 36. Нуклеосомы с промоторами активно транскрибирующихся генов имеют высокий уровень модификаций гистонов (ацетилирование и метилирование H 3 K 4). Неактивные области генов (c и d) имеют достаточно равномерное распределение репрессирующих модификаций, таких как H 3 K 9 me, а промоторы этих генов обогащены модификациями H 3 K 27 me. Эти модифицированные гистоны связываются с HP 1 (синий), таким образом приводя хроматин в конденсированное состояние.
Распределение модификаций гистонов в активных и «молчащих» генах Модификационные паттерны различаются в активно транскрибирующихся и «молчащих» генах (нуклеосомы a, c и гены b, d). Состояние активных генов показано на a и b. Внешний сигнал приводит к активации киназ (оранжевые), которые затем могут фосфорилировать гистоны и факторы транскрипции (TF, красный). Транскрипционные факторы затем связываются с областью промотора, облегчая связывание РНК-полимеразы II с ДНК (RNAPII, зеленый). С этого момента начинается транскрипция. В процессе элонгации РНК-полимераза. II (фосфорилированная с С-конца) может взаимодействовать с модификаторами гистонов (розовый), например, с Set 2, который метилирует H 3 K 36. Нуклеосомы с промоторами активно транскрибирующихся генов имеют высокий уровень модификаций гистонов (ацетилирование и метилирование H 3 K 4). Неактивные области генов (c и d) имеют достаточно равномерное распределение репрессирующих модификаций, таких как H 3 K 9 me, а промоторы этих генов обогащены модификациями H 3 K 27 me. Эти модифицированные гистоны связываются с HP 1 (синий), таким образом приводя хроматин в конденсированное состояние.
 Механизмы, способствующие эффективной транскрипции через нуклеосомы: 1. 2. - Фактор FACT (facilitates chromatin transcription) – фактор элонгации, облегчает транскрипцию РНК-pol. II через нуклеосомы, не разрушая их, а дестабилизируя нуклеосомную структуру, удаляя только один из димеров Н 2 А-Н 2 В. Состоит из двух субъединиц - р140 h/Spt 16 (Spt 16/y. Cdc 68) и SSRP 1 (structure-specific recognition protein 1). Spt 16 обладает шаперонной активностью, которая позволяет немедленно собирать позади интактную нуклеосому. Комплексы (SWI/SNF-комплекс), изменяющие упаковку ДНК, при инициации транскрипции (АТР-зависимый процесс). Комплексы перестройки хроматина используют энергию гидролиза АТР для разрушения нуклеосом и позволяют транскрипционным факторам связываться с промотором. Хорошо изучено семейство SWI/SNF. Первоначально были открыты у мутантов дрожжей с измененной транскрипцией некоторых генов, участвующих в переключении типа спаривания – mating type switching SWI – и метаболизма сахаров – sucrose nonfermentation metabolism SNF). SWI/SNFкомплекс (М ~2000 к. Да) состоит из 11 субъединиц. Субъединица Swi 2/Snf 2 обладает АТР-азной активностью, участвует в транскрипции специфических генов, рекрутируется к специфическим Р транскрипционными факторами, связывающимися с UR-сайтами (upstream regulatory sites). Этот комплекс действует 2 способами: Изменяя конформацию нуклеосомных коровых частиц в результате ослабления взаимодействия ДНК с гистонами, что вызывает более слабую накрутку ДНК на коровый октамер; Обеспечивая подвижность гистонового октамера, т. е. он может скользить вдоль ДНК и занимать новое положение, высвобождая тот участок ДНК, который был до того связан с гистонами. Комплекс SWI/SNF необходим также для элонгации.
Механизмы, способствующие эффективной транскрипции через нуклеосомы: 1. 2. - Фактор FACT (facilitates chromatin transcription) – фактор элонгации, облегчает транскрипцию РНК-pol. II через нуклеосомы, не разрушая их, а дестабилизируя нуклеосомную структуру, удаляя только один из димеров Н 2 А-Н 2 В. Состоит из двух субъединиц - р140 h/Spt 16 (Spt 16/y. Cdc 68) и SSRP 1 (structure-specific recognition protein 1). Spt 16 обладает шаперонной активностью, которая позволяет немедленно собирать позади интактную нуклеосому. Комплексы (SWI/SNF-комплекс), изменяющие упаковку ДНК, при инициации транскрипции (АТР-зависимый процесс). Комплексы перестройки хроматина используют энергию гидролиза АТР для разрушения нуклеосом и позволяют транскрипционным факторам связываться с промотором. Хорошо изучено семейство SWI/SNF. Первоначально были открыты у мутантов дрожжей с измененной транскрипцией некоторых генов, участвующих в переключении типа спаривания – mating type switching SWI – и метаболизма сахаров – sucrose nonfermentation metabolism SNF). SWI/SNFкомплекс (М ~2000 к. Да) состоит из 11 субъединиц. Субъединица Swi 2/Snf 2 обладает АТР-азной активностью, участвует в транскрипции специфических генов, рекрутируется к специфическим Р транскрипционными факторами, связывающимися с UR-сайтами (upstream regulatory sites). Этот комплекс действует 2 способами: Изменяя конформацию нуклеосомных коровых частиц в результате ослабления взаимодействия ДНК с гистонами, что вызывает более слабую накрутку ДНК на коровый октамер; Обеспечивая подвижность гистонового октамера, т. е. он может скользить вдоль ДНК и занимать новое положение, высвобождая тот участок ДНК, который был до того связан с гистонами. Комплекс SWI/SNF необходим также для элонгации.
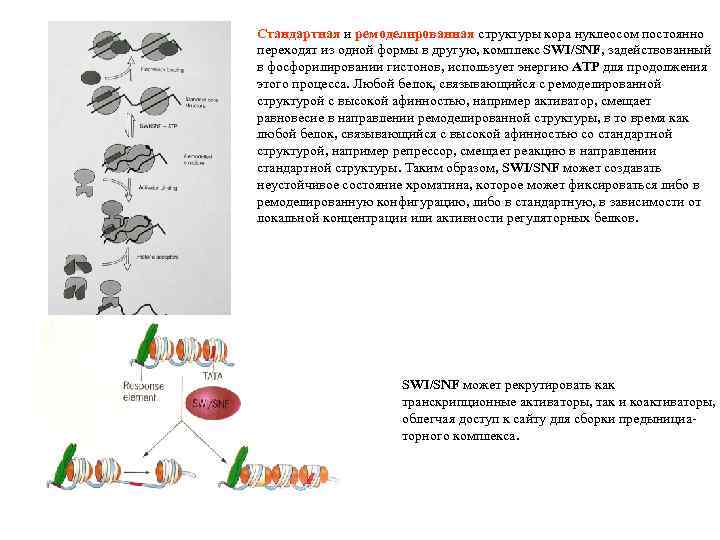 Стандартная и ремоделированная структуры кора нуклеосом постоянно переходят из одной формы в другую, комплекс SWI/SNF, задействованный в фосфорилировании гистонов, использует энергию АТР для продолжения этого процесса. Любой белок, связывающийся с ремоделированной структурой с высокой афинностью, например активатор, смещает равновесие в направлении ремоделированной структуры, в то время как любой белок, связывающийся с высокой афинностью со стандартной структурой, например репрессор, смещает реакцию в направлении стандартной структуры. Таким образом, SWI/SNF может создавать неустойчивое состояние хроматина, которое может фиксироваться либо в ремоделированную конфигурацию, либо в стандартную, в зависимости от локальной концентрации или активности регуляторных белков. SWI/SNF может рекрутировать как транскрипционные активаторы, так и коактиваторы, облегчая доступ к сайту для сборки предынициаторного комплекса.
Стандартная и ремоделированная структуры кора нуклеосом постоянно переходят из одной формы в другую, комплекс SWI/SNF, задействованный в фосфорилировании гистонов, использует энергию АТР для продолжения этого процесса. Любой белок, связывающийся с ремоделированной структурой с высокой афинностью, например активатор, смещает равновесие в направлении ремоделированной структуры, в то время как любой белок, связывающийся с высокой афинностью со стандартной структурой, например репрессор, смещает реакцию в направлении стандартной структуры. Таким образом, SWI/SNF может создавать неустойчивое состояние хроматина, которое может фиксироваться либо в ремоделированную конфигурацию, либо в стандартную, в зависимости от локальной концентрации или активности регуляторных белков. SWI/SNF может рекрутировать как транскрипционные активаторы, так и коактиваторы, облегчая доступ к сайту для сборки предынициаторного комплекса.
 Обратимые изменения активности генов в процессе индивидуального развития организма, не связанные с нарушением нуклеотидной последовательности ДНК, но приводящие к сохранению неактивного или активного состояния генов в ряду клеточных поколений, называют эпигенетическими.
Обратимые изменения активности генов в процессе индивидуального развития организма, не связанные с нарушением нуклеотидной последовательности ДНК, но приводящие к сохранению неактивного или активного состояния генов в ряду клеточных поколений, называют эпигенетическими.
 Рисунок метилирования может стираться при образовании зародышевой ткани – яичников и семенников, а затем вновь формироваться в зрелых гаметах или в процессе раннего развития эмбриона. Заново возникающие М полностью неметилированной ДНК может осуществляться с помощью особого фермента (нарушение DNMT не приводит к полному исчезновению метилирования). В некоторых случаях при образовании гамет или развитии эмбриона специфичный рисунок метилирования различается для отцовских и материнских генов. В этом случае говорят о наличии родительского импринтинга (imprint – оставлять отпечаток, след). Импринтингу подвергается около 0, 1% из 50 -70 тыс. генов. 20 генов идентифицированы. Некоторые находятся сравнительно недалеко друг от друга на расстоянии ~100 тыс. пн, но в целом импринтинг охватывает протяженный участок хромосом. Например: ген фактора роста и его ингибитор. Инактивация Х-хромосомы у женщин – метилирование необходимо для завершения инактивации (гетерохроматизированное состояние). Наряду с инактивацией практически всей Х-хромосомы у женщин наблюдается и родительский импринтинг отдельных генов Х-хромосомы. Выбор одной из двух Х-хромосом для инактивации случаен. Инактивации подвергается основная масса генов, но отдельные гены неактивной Х-хромосомы избегают инактивации, например ген человека, определяющий социальные контакты. Пациенты с Х-хромосомой от отца имеют существенно меньше аномалий в социальном поведении и менее подвержены аутизму (уходу в себя).
Рисунок метилирования может стираться при образовании зародышевой ткани – яичников и семенников, а затем вновь формироваться в зрелых гаметах или в процессе раннего развития эмбриона. Заново возникающие М полностью неметилированной ДНК может осуществляться с помощью особого фермента (нарушение DNMT не приводит к полному исчезновению метилирования). В некоторых случаях при образовании гамет или развитии эмбриона специфичный рисунок метилирования различается для отцовских и материнских генов. В этом случае говорят о наличии родительского импринтинга (imprint – оставлять отпечаток, след). Импринтингу подвергается около 0, 1% из 50 -70 тыс. генов. 20 генов идентифицированы. Некоторые находятся сравнительно недалеко друг от друга на расстоянии ~100 тыс. пн, но в целом импринтинг охватывает протяженный участок хромосом. Например: ген фактора роста и его ингибитор. Инактивация Х-хромосомы у женщин – метилирование необходимо для завершения инактивации (гетерохроматизированное состояние). Наряду с инактивацией практически всей Х-хромосомы у женщин наблюдается и родительский импринтинг отдельных генов Х-хромосомы. Выбор одной из двух Х-хромосом для инактивации случаен. Инактивации подвергается основная масса генов, но отдельные гены неактивной Х-хромосомы избегают инактивации, например ген человека, определяющий социальные контакты. Пациенты с Х-хромосомой от отца имеют существенно меньше аномалий в социальном поведении и менее подвержены аутизму (уходу в себя).
 Эпигенетическое наследование (ЭН) – передача состояния экспрессии хроматина в ряду клеточных делений и развития. В некоторых случаях ЭН связано с картиной ДНК-метилирования, но у дрожжей и мух не наблюдается метилирования. ЭН может опосредоваться гистонами. 1. Как происходит спецификация? Гистоны могут участвовать в спецификации несколькими способами, например изменение способности нуклеосом раскручиваться или создавать сайты для связывания или моделирование белков, ассоциированных с хроматином. 2. Поддержание и наследование. Известно, что происходит физическое разделение ДНК и гистонов и случайное распределение старых и новых гистонов на дочерней нити после репликации ДНК. Помимо модификации гистонов существуют различные варианты гистонов которые могут определять различные состояния хроматина. Типы эпигенетических модификаций: - ДНК-метилирование, - ремоделлинг нуклеосомы – изменение позиции нуклеосомы АТФ-зависимым путем, - вариантные формы гистонов, - модификации гистонов (ацетилирование, фосфорилирование, метилирование, АТФрибозилирование, сумоилирование, убиквитинирование), могут быть активирующими и репрессирующими, - РНК-интерференция.
Эпигенетическое наследование (ЭН) – передача состояния экспрессии хроматина в ряду клеточных делений и развития. В некоторых случаях ЭН связано с картиной ДНК-метилирования, но у дрожжей и мух не наблюдается метилирования. ЭН может опосредоваться гистонами. 1. Как происходит спецификация? Гистоны могут участвовать в спецификации несколькими способами, например изменение способности нуклеосом раскручиваться или создавать сайты для связывания или моделирование белков, ассоциированных с хроматином. 2. Поддержание и наследование. Известно, что происходит физическое разделение ДНК и гистонов и случайное распределение старых и новых гистонов на дочерней нити после репликации ДНК. Помимо модификации гистонов существуют различные варианты гистонов которые могут определять различные состояния хроматина. Типы эпигенетических модификаций: - ДНК-метилирование, - ремоделлинг нуклеосомы – изменение позиции нуклеосомы АТФ-зависимым путем, - вариантные формы гистонов, - модификации гистонов (ацетилирование, фосфорилирование, метилирование, АТФрибозилирование, сумоилирование, убиквитинирование), могут быть активирующими и репрессирующими, - РНК-интерференция.
 Нуклеосомные гистоны и их варианты Гистон Свойства H 2 A, H 2 B, H 3, H 4 Гистоны упаковки Канонические коровые гистоны; Варианты коровых и линкерных гистонов, адаптированные к высокой упаковке ДНК в сперме и пыльце у некоторых организмов; Центромерная форма Н 3, имеет характерный N-хвост, вариабильный по длине и последовательности, и более протяженную петлю 1; Вариант Н 3, отличается по 4 аминокислотным остаткам. Н 3 включается при репликации, Н 3. 3 включается в процессе клеточного цикла, обнаруживается в активном эухроматине, но не в гетерохроматине. Вскоре после индукции транскрипции Н 3. 3 замещает Н 3; содержит лизин Н 3 К 9 me. RI (replication independent) включение Н 3. 3 делает хроматин активным; Вариант Н 2 А, структура похожа, но биохимически менее стабильный, что возможно облегчает активацию транскрипции. В дрожжевых клетках включается вблизи silent-областей и ингибирует распространение «молчащего» состояния; Специфический для позвоночных вариант Н 2 А с характерным С-концевым глобулярным доменом, сконцентрирован в неактивной Х-хромосоме млекопитающих; Специфический для позвоночных вариант Н 2 А, обнаруживается в неактивной Ххромосоме; Вариант Н 2 А, обладает мотивом из 4 аминокислотных остатков SQ[E/D] в Сконце, который превращается в серин-фосфорилированный сайт в двунитевых разрывах. Cen. H 3. 3 H 2 A. Z Macro H 2 A-Bbd H 2 A. X
Нуклеосомные гистоны и их варианты Гистон Свойства H 2 A, H 2 B, H 3, H 4 Гистоны упаковки Канонические коровые гистоны; Варианты коровых и линкерных гистонов, адаптированные к высокой упаковке ДНК в сперме и пыльце у некоторых организмов; Центромерная форма Н 3, имеет характерный N-хвост, вариабильный по длине и последовательности, и более протяженную петлю 1; Вариант Н 3, отличается по 4 аминокислотным остаткам. Н 3 включается при репликации, Н 3. 3 включается в процессе клеточного цикла, обнаруживается в активном эухроматине, но не в гетерохроматине. Вскоре после индукции транскрипции Н 3. 3 замещает Н 3; содержит лизин Н 3 К 9 me. RI (replication independent) включение Н 3. 3 делает хроматин активным; Вариант Н 2 А, структура похожа, но биохимически менее стабильный, что возможно облегчает активацию транскрипции. В дрожжевых клетках включается вблизи silent-областей и ингибирует распространение «молчащего» состояния; Специфический для позвоночных вариант Н 2 А с характерным С-концевым глобулярным доменом, сконцентрирован в неактивной Х-хромосоме млекопитающих; Специфический для позвоночных вариант Н 2 А, обнаруживается в неактивной Ххромосоме; Вариант Н 2 А, обладает мотивом из 4 аминокислотных остатков SQ[E/D] в Сконце, который превращается в серин-фосфорилированный сайт в двунитевых разрывах. Cen. H 3. 3 H 2 A. Z Macro H 2 A-Bbd H 2 A. X
 Варианты гистонов и модификации Вариантные формы гистонов – коровые гистоны (за исключением Н 4) существуют в разных формах (вариантах). Пул гистона Н 3 в клетке состоит из вариантов Н 3. 3 (требуются в течение всего клеточного цикла), CENP-A и H 3. 1, H 3. 2 (синтезируются в S-фазе). Н 3. 3 ассоциирован с транскрипционно активными областями генов и богат посттрансляционными модификациями. H 3. 2 несет репрессирующие модификации. H 3. 1 и активирующие, и репрессирующие. Активный хроматин обогащен ацетилированным лизином (Н 3, Н 4) и метилированным лизином (Н 3 -К 4, Н 3 -К 79). Причем различные варианты отличаются по модификациям. Активный хроматин обогащен ацетилированным лизином (К 9, К 14, К 18, К 23) и метилированным лизином (К 4, К 79) в 2 -5 раз больше в Н 3. 3, чем в Н 3. «Молчащий» хроматин обогащен метилированным лизином К 9 гистона Н 3 больше, чем Н 3. 3.
Варианты гистонов и модификации Вариантные формы гистонов – коровые гистоны (за исключением Н 4) существуют в разных формах (вариантах). Пул гистона Н 3 в клетке состоит из вариантов Н 3. 3 (требуются в течение всего клеточного цикла), CENP-A и H 3. 1, H 3. 2 (синтезируются в S-фазе). Н 3. 3 ассоциирован с транскрипционно активными областями генов и богат посттрансляционными модификациями. H 3. 2 несет репрессирующие модификации. H 3. 1 и активирующие, и репрессирующие. Активный хроматин обогащен ацетилированным лизином (Н 3, Н 4) и метилированным лизином (Н 3 -К 4, Н 3 -К 79). Причем различные варианты отличаются по модификациям. Активный хроматин обогащен ацетилированным лизином (К 9, К 14, К 18, К 23) и метилированным лизином (К 4, К 79) в 2 -5 раз больше в Н 3. 3, чем в Н 3. «Молчащий» хроматин обогащен метилированным лизином К 9 гистона Н 3 больше, чем Н 3. 3.
 Варианты гистонов собираются специальными белковыми комплексами: Различные варианты гистонов модифицируются в процессе сборки нуклеосом. Обогащение модификациями происходит в результате использования различных машин сборки, таких как SWR 1, CAF-1 и HIRA. H 2 A. Z – SWR 1 -комплекс, содержащий Swi 2/Snf 2 -АТРазу (относится к семейству SWI/SNF зависимых ферментов, ремодулирующих нуклеосомы) в процессе транскрипции дестабилизирует нуклеосомы, удаляя Н 2 А-Н 2 В. Н 3. 3 – для RI включения Н 3. 3 необходим кластер из 3 специальных остатков в histone-fold домене. Для RC включения Н 3. 3 требуется N-хвост. Осуществляется различными комплексами. RC-комплекс включает все три субъединицы CAF-1 (chromatin assembly factor -1), необходимого для включения Н 3 -Н 4 в процессе репликации. RI- комплекс не содержит р150 и р60 субъединицы CAF-1, но содержит Hir. A (histone regulator A).
Варианты гистонов собираются специальными белковыми комплексами: Различные варианты гистонов модифицируются в процессе сборки нуклеосом. Обогащение модификациями происходит в результате использования различных машин сборки, таких как SWR 1, CAF-1 и HIRA. H 2 A. Z – SWR 1 -комплекс, содержащий Swi 2/Snf 2 -АТРазу (относится к семейству SWI/SNF зависимых ферментов, ремодулирующих нуклеосомы) в процессе транскрипции дестабилизирует нуклеосомы, удаляя Н 2 А-Н 2 В. Н 3. 3 – для RI включения Н 3. 3 необходим кластер из 3 специальных остатков в histone-fold домене. Для RC включения Н 3. 3 требуется N-хвост. Осуществляется различными комплексами. RC-комплекс включает все три субъединицы CAF-1 (chromatin assembly factor -1), необходимого для включения Н 3 -Н 4 в процессе репликации. RI- комплекс не содержит р150 и р60 субъединицы CAF-1, но содержит Hir. A (histone regulator A).
 Наследование хроматина и сборка нуклеосом При репликации ДНК материнские гистоны распределяются случайным образом по дочерним цепям. Для димеров Н 3 -Н 4 показано, что после раунда репликации обнаруживаются только старые и новые тетрамеры, но не обнаруживаются смешанные консервативная модель (старые, интактные нуклеосомы распределяются по дочерним нитям, дополнительно собираются новые, которые включаются с помощью двух CAF-1 комплексов. Гистоновые шапероны временно экранируют заряд гистонов, обеспечивая правильную сборку нуклеосомы. Шаперон CAF 1 связан с PCNA, сидит в репликативной вилке, связывая «старые» димеры H 3 -H 4, начинает пострепликационную сборку нуклеосом с посадки этого димера.
Наследование хроматина и сборка нуклеосом При репликации ДНК материнские гистоны распределяются случайным образом по дочерним цепям. Для димеров Н 3 -Н 4 показано, что после раунда репликации обнаруживаются только старые и новые тетрамеры, но не обнаруживаются смешанные консервативная модель (старые, интактные нуклеосомы распределяются по дочерним нитям, дополнительно собираются новые, которые включаются с помощью двух CAF-1 комплексов. Гистоновые шапероны временно экранируют заряд гистонов, обеспечивая правильную сборку нуклеосомы. Шаперон CAF 1 связан с PCNA, сидит в репликативной вилке, связывая «старые» димеры H 3 -H 4, начинает пострепликационную сборку нуклеосом с посадки этого димера.
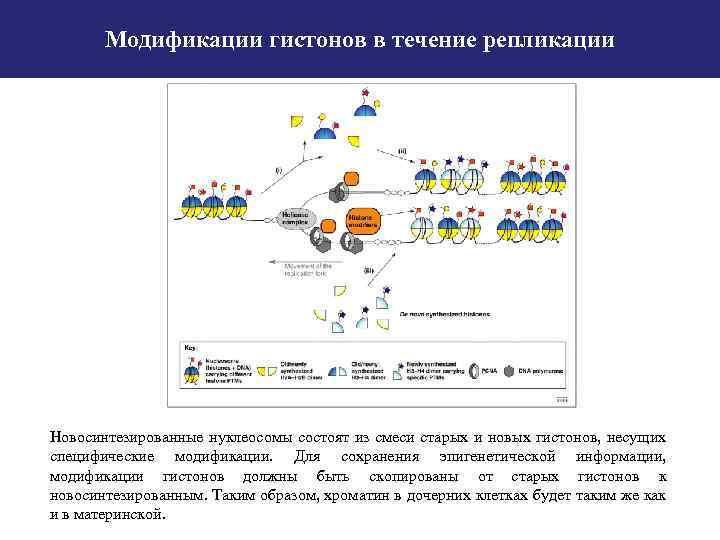 Модификации гистонов в течение репликации Новосинтезированные нуклеосомы состоят из смеси старых и новых гистонов, несущих специфические модификации. Для сохранения эпигенетической информации, модификации гистонов должны быть скопированы от старых гистонов к новосинтезированным. Таким образом, хроматин в дочерних клетках будет таким же как и в материнской.
Модификации гистонов в течение репликации Новосинтезированные нуклеосомы состоят из смеси старых и новых гистонов, несущих специфические модификации. Для сохранения эпигенетической информации, модификации гистонов должны быть скопированы от старых гистонов к новосинтезированным. Таким образом, хроматин в дочерних клетках будет таким же как и в материнской.
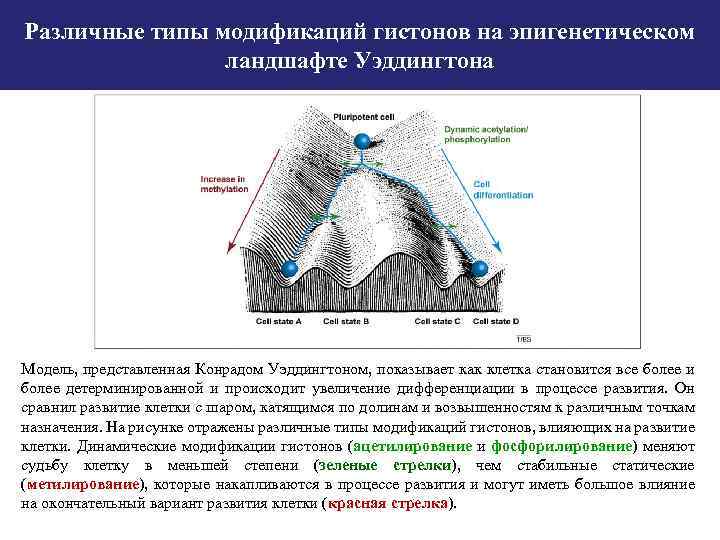 Различные типы модификаций гистонов на эпигенетическом ландшафте Уэддингтона Модель, представленная Конрадом Уэддингтоном, показывает как клетка становится все более и более детерминированной и происходит увеличение дифференциации в процессе развития. Он сравнил развитие клетки с шаром, катящимся по долинам и возвышенностям к различным точкам назначения. На рисунке отражены различные типы модификаций гистонов, влияющих на развитие клетки. Динамические модификации гистонов (ацетилирование и фосфорилирование) меняют судьбу клетку в меньшей степени (зеленые стрелки), чем стабильные статические (метилирование), которые накапливаются в процессе развития и могут иметь большое влияние на окончательный вариант развития клетки (красная стрелка).
Различные типы модификаций гистонов на эпигенетическом ландшафте Уэддингтона Модель, представленная Конрадом Уэддингтоном, показывает как клетка становится все более и более детерминированной и происходит увеличение дифференциации в процессе развития. Он сравнил развитие клетки с шаром, катящимся по долинам и возвышенностям к различным точкам назначения. На рисунке отражены различные типы модификаций гистонов, влияющих на развитие клетки. Динамические модификации гистонов (ацетилирование и фосфорилирование) меняют судьбу клетку в меньшей степени (зеленые стрелки), чем стабильные статические (метилирование), которые накапливаются в процессе развития и могут иметь большое влияние на окончательный вариант развития клетки (красная стрелка).
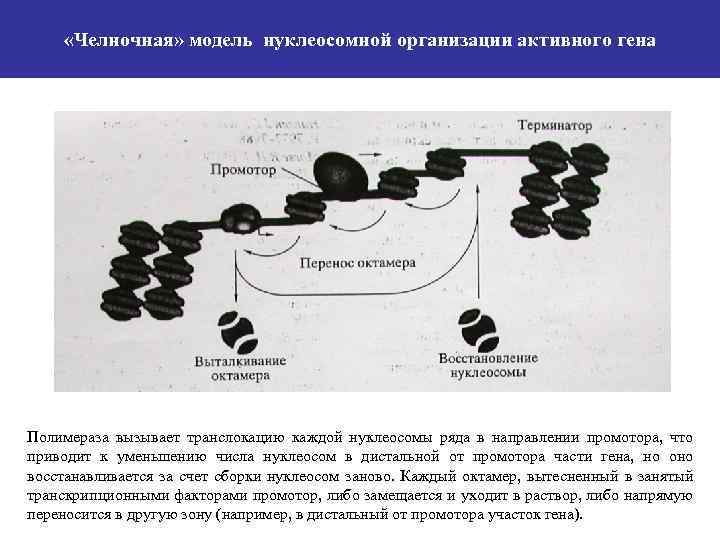 «Челночная» модель нуклеосомной организации активного гена Полимераза вызывает транслокацию каждой нуклеосомы ряда в направлении промотора, что приводит к уменьшению числа нуклеосом в дистальной от промотора части гена, но оно восстанавливается за счет сборки нуклеосом заново. Каждый октамер, вытесненный в занятый транскрипционными факторами промотор, либо замещается и уходит в раствор, либо напрямую переносится в другую зону (например, в дистальный от промотора участок гена).
«Челночная» модель нуклеосомной организации активного гена Полимераза вызывает транслокацию каждой нуклеосомы ряда в направлении промотора, что приводит к уменьшению числа нуклеосом в дистальной от промотора части гена, но оно восстанавливается за счет сборки нуклеосом заново. Каждый октамер, вытесненный в занятый транскрипционными факторами промотор, либо замещается и уходит в раствор, либо напрямую переносится в другую зону (например, в дистальный от промотора участок гена).
 Модель транскрипции через нуклеосому Раскручивание дуплекса ДНК РНК-полимеразой создает положительные сверхвитки перед ней, которые дестабилизируют нуклеосому, и отрицательные сверхвитки позади, которые обеспечивают сборку. Этот процесс облегчает FACTкомплекс, который связывается с Н 2 А-Н 2 В димером, как только нуклеосома развернется, и переносит его позади РНК-полимеразы. HIRA-комплекс доставляет новый Н 3. 3 -Н 4 димер, а старый гетеродимер удаляется, что приводит к образованию старых и новых тетрамеров. Процессивное движение вперед РНК-полимеразы создает позитивные сверхвитки, которые дестабилизируют два оставшихся димера перед РНКполимеразой и вызывают их соединение позади. Перемещение димерных единиц вызывает минимальное разрушение. Димерный Н 3 -Н 4 обмен происходит на том или ином шаге продвижения РНК-полимеразы и приводит к полному замещению Н 3 на гистон Н 3. 3.
Модель транскрипции через нуклеосому Раскручивание дуплекса ДНК РНК-полимеразой создает положительные сверхвитки перед ней, которые дестабилизируют нуклеосому, и отрицательные сверхвитки позади, которые обеспечивают сборку. Этот процесс облегчает FACTкомплекс, который связывается с Н 2 А-Н 2 В димером, как только нуклеосома развернется, и переносит его позади РНК-полимеразы. HIRA-комплекс доставляет новый Н 3. 3 -Н 4 димер, а старый гетеродимер удаляется, что приводит к образованию старых и новых тетрамеров. Процессивное движение вперед РНК-полимеразы создает позитивные сверхвитки, которые дестабилизируют два оставшихся димера перед РНКполимеразой и вызывают их соединение позади. Перемещение димерных единиц вызывает минимальное разрушение. Димерный Н 3 -Н 4 обмен происходит на том или ином шаге продвижения РНК-полимеразы и приводит к полному замещению Н 3 на гистон Н 3. 3.
 В процессе активной транскрипции непрерывно включается Н 3. 3, замещая Н 3, полученный в процессе репликации. Таким путем область, проходимая РНК-полимеразой (красная), определяет границы активного хроматина. Нуклеосомы с гистонами, хвосты которых утратили активационные модификации (зеленый) связываются с ДНК и соседними нуклеосомами. Нуклеосомы с активирующей модификацией более мобильны (красный) и их хвосты не пакуют плотный хроматин в результате ацетилирования лизинов. В процессе репликации ДНК CAF-1 включает Н 3 и тем самым разводит Н 3. 3 -содержащие гистоны на 50%, частично снижая мобильность в транскрибируемой области. Наличие этих мобильных нуклеосом достаточно для протекания транскрипции.
В процессе активной транскрипции непрерывно включается Н 3. 3, замещая Н 3, полученный в процессе репликации. Таким путем область, проходимая РНК-полимеразой (красная), определяет границы активного хроматина. Нуклеосомы с гистонами, хвосты которых утратили активационные модификации (зеленый) связываются с ДНК и соседними нуклеосомами. Нуклеосомы с активирующей модификацией более мобильны (красный) и их хвосты не пакуют плотный хроматин в результате ацетилирования лизинов. В процессе репликации ДНК CAF-1 включает Н 3 и тем самым разводит Н 3. 3 -содержащие гистоны на 50%, частично снижая мобильность в транскрибируемой области. Наличие этих мобильных нуклеосом достаточно для протекания транскрипции.
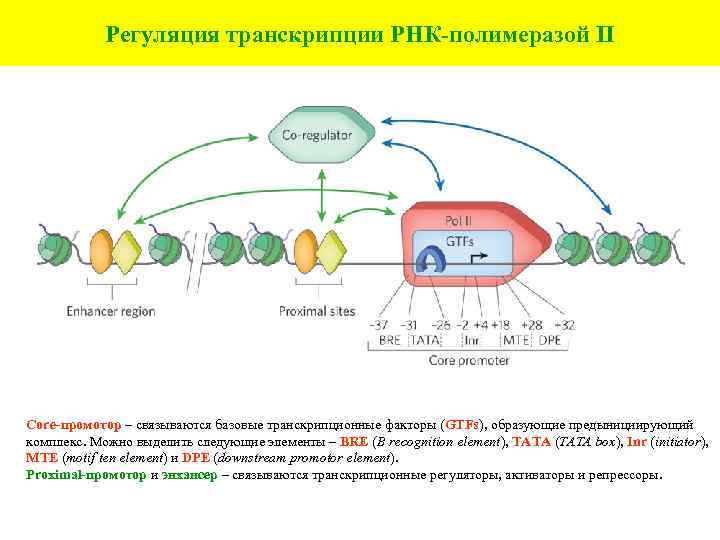 Регуляция транскрипции РНК-полимеразой II Сore-промотор – связываются базовые транскрипционные факторы (GTFs), образующие предынициирующий комплекс. Можно выделить следующие элементы – BRE (B recognition element), TATA (TATA box), Inr (initiator), MTE (motif ten element) и DPE (downstream promotor element). Proximal-промотор и энхансер – связываются транскрипционные регуляторы, активаторы и репрессоры.
Регуляция транскрипции РНК-полимеразой II Сore-промотор – связываются базовые транскрипционные факторы (GTFs), образующие предынициирующий комплекс. Можно выделить следующие элементы – BRE (B recognition element), TATA (TATA box), Inr (initiator), MTE (motif ten element) и DPE (downstream promotor element). Proximal-промотор и энхансер – связываются транскрипционные регуляторы, активаторы и репрессоры.
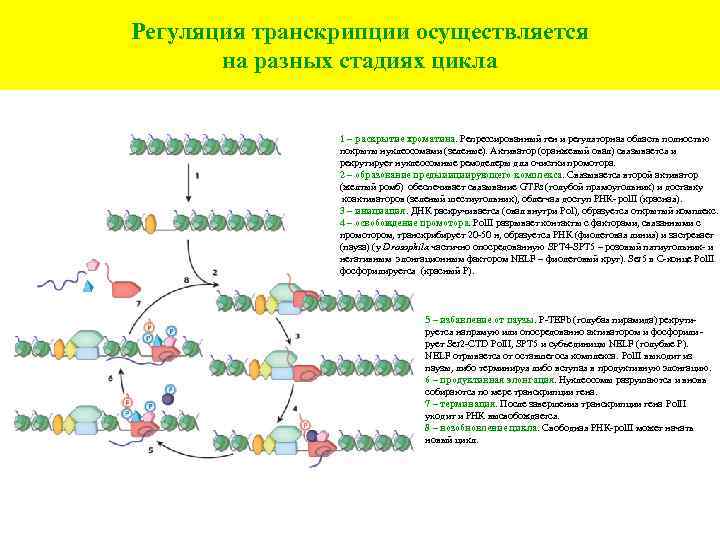 Регуляция транскрипции осуществляется на разных стадиях цикла 1 – раскрытие хроматина. Репрессированный ген и регуляторная область полностью покрыты нуклеосомами (зеленые). Активатор (оранжевый овал) связывается и рекрутирует нуклеосомные ремоделеры для очистки промотора. 2 – образование предыиициирующего комплекса. Связывается второй активатор (желтый ромб) обеспечивает связывание GTFs (голубой прямоугольник) и доставку коактиваторов (зеленый шестиугольник), облегчая доступ РНК- pol. II (красная). 3 – инициация. ДНК раскручивается (овал внутри Pol), образуется открытый комплекс. 4 – освобождение промотора. Pol. II разрывает контакты с факторами, связанными с промотором, транскрибирует 20 -50 н, образуется РНК (фиолетовая линия) и застревает (пауза) (у Drosophila частично опосредованную SPT 4 -SPT 5 – розовый пятиугольник- и негативным элонгационным фактором NELF – фиолетовый круг). Ser 5 в С-конце Pol. II фосфорилируется (красный Р). 5 – избавление от паузы. P-TEFb (голубая пирамида) рекрутируется напрямую или опосредованно активатором и фосфорили рует Ser 2 -CTD Pol. II, SPT 5 и субъединицы NELF (голубые Р). NELF отрывается от оставшегося комплекса. Pol. II выходит из паузы, либо терминируя либо вступая в продуктивную элонгацию. 6 – продуктивная элонгация. Нуклеосомы разрушаются и вновь собираются по мере транскрипции гена. 7 – терминация. После завершения транскрипции гена Pol. II уходит и РНК высвобождается. 8 – возобновление цикла. Свободная РНК-pol. II может начать новый цикл.
Регуляция транскрипции осуществляется на разных стадиях цикла 1 – раскрытие хроматина. Репрессированный ген и регуляторная область полностью покрыты нуклеосомами (зеленые). Активатор (оранжевый овал) связывается и рекрутирует нуклеосомные ремоделеры для очистки промотора. 2 – образование предыиициирующего комплекса. Связывается второй активатор (желтый ромб) обеспечивает связывание GTFs (голубой прямоугольник) и доставку коактиваторов (зеленый шестиугольник), облегчая доступ РНК- pol. II (красная). 3 – инициация. ДНК раскручивается (овал внутри Pol), образуется открытый комплекс. 4 – освобождение промотора. Pol. II разрывает контакты с факторами, связанными с промотором, транскрибирует 20 -50 н, образуется РНК (фиолетовая линия) и застревает (пауза) (у Drosophila частично опосредованную SPT 4 -SPT 5 – розовый пятиугольник- и негативным элонгационным фактором NELF – фиолетовый круг). Ser 5 в С-конце Pol. II фосфорилируется (красный Р). 5 – избавление от паузы. P-TEFb (голубая пирамида) рекрутируется напрямую или опосредованно активатором и фосфорили рует Ser 2 -CTD Pol. II, SPT 5 и субъединицы NELF (голубые Р). NELF отрывается от оставшегося комплекса. Pol. II выходит из паузы, либо терминируя либо вступая в продуктивную элонгацию. 6 – продуктивная элонгация. Нуклеосомы разрушаются и вновь собираются по мере транскрипции гена. 7 – терминация. После завершения транскрипции гена Pol. II уходит и РНК высвобождается. 8 – возобновление цикла. Свободная РНК-pol. II может начать новый цикл.
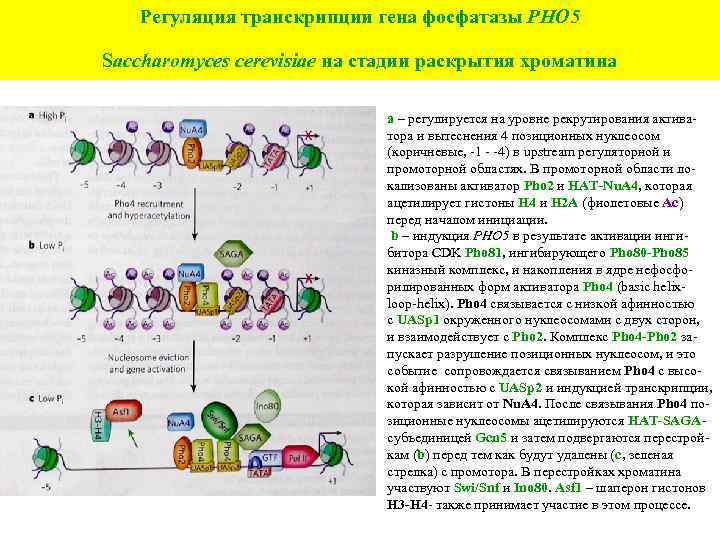 Регуляция транскрипции гена фосфатазы PHO 5 Saccharomyces cerevisiae на стадии раскрытия хроматина а – регулируется на уровне рекрутирования активатора и вытеснения 4 позиционных нуклеосом (коричневые, -1 - -4) в upstream регуляторной и промоторной областях. В промоторной области локализованы активатор Pho 2 и HAT-Nu. A 4, которая ацетилирует гистоны Н 4 и Н 2 А (фиолетовые Ас) перед началом инициации. b – индукция PHO 5 в результате активации ингибитора СDK Pho 81, ингибирующего Pho 80 -Pho 85 киназный комплекс, и накопления в ядре нефосфорилированных форм активатора Pho 4 (basic helixloop-helix). Pho 4 связывается с низкой афинностью с UASp 1 окруженного нуклеосомами с двух сторон, и взаимодействует с Pho 2. Комплекс Pho 4 -Pho 2 запускает разрушение позиционных нуклеосом, и это событие сопровождается связыванием Pho 4 с высокой афинностью с UASp 2 и индукцией транскрипции, которая зависит от Nu. A 4. После связывания Pho 4 позиционные нуклеосомы ацетилируются HAT-SAGAсубъединицей Gcn 5 и затем подвергаются перестройкам (b) перед тем как будут удалены (с, зеленая стрелка) с промотора. В перестройках хроматина участвуют Swi/Snf и Ino 80. Asf 1 – шаперон гистонов Н 3 -Н 4 - также принимает участие в этом процессе.
Регуляция транскрипции гена фосфатазы PHO 5 Saccharomyces cerevisiae на стадии раскрытия хроматина а – регулируется на уровне рекрутирования активатора и вытеснения 4 позиционных нуклеосом (коричневые, -1 - -4) в upstream регуляторной и промоторной областях. В промоторной области локализованы активатор Pho 2 и HAT-Nu. A 4, которая ацетилирует гистоны Н 4 и Н 2 А (фиолетовые Ас) перед началом инициации. b – индукция PHO 5 в результате активации ингибитора СDK Pho 81, ингибирующего Pho 80 -Pho 85 киназный комплекс, и накопления в ядре нефосфорилированных форм активатора Pho 4 (basic helixloop-helix). Pho 4 связывается с низкой афинностью с UASp 1 окруженного нуклеосомами с двух сторон, и взаимодействует с Pho 2. Комплекс Pho 4 -Pho 2 запускает разрушение позиционных нуклеосом, и это событие сопровождается связыванием Pho 4 с высокой афинностью с UASp 2 и индукцией транскрипции, которая зависит от Nu. A 4. После связывания Pho 4 позиционные нуклеосомы ацетилируются HAT-SAGAсубъединицей Gcn 5 и затем подвергаются перестройкам (b) перед тем как будут удалены (с, зеленая стрелка) с промотора. В перестройках хроматина участвуют Swi/Snf и Ino 80. Asf 1 – шаперон гистонов Н 3 -Н 4 - также принимает участие в этом процессе.
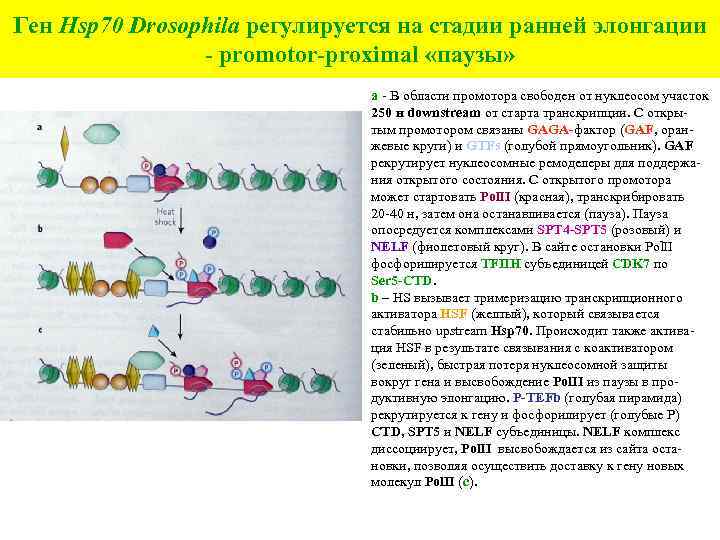 Ген Hsp 70 Drosophila регулируется на стадии ранней элонгации - promotor-proximal «паузы» а - В области промотора свободен от нуклеосом участок 250 н downstream от старта транскрипции. С открытым промотором связаны GAGA-фактор (GAF, оранжевые круги) и GTFs (голубой прямоугольник). GAF рекрутирует нуклеосомные ремоделеры для поддержания открытого состояния. С открытого промотора может стартовать Pol. II (красная), транскрибировать 20 -40 н, затем она останавливается (пауза). Пауза опосредуется комплексами SPT 4 -SPT 5 (розовый) и NELF (фиолетовый круг). В сайте остановки Pol. II фосфорилируется TFIIH субъединицей CDK 7 по Ser 5 -CTD. b – HS вызывает тримеризацию транскрипционного активатора HSF (желтый), который связывается стабильно upstream Hsp 70. Происходит также активация HSF в результате связывания с коактиватором (зеленый), быстрая потеря нуклеосомной защиты вокруг гена и высвобождение Pol. II из паузы в продуктивную элонгацию. P-TEFb (голубая пирамида) рекрутируется к гену и фосфорилирует (голубые Р) CTD, SPT 5 и NELF субъединицы. NELF комплекс диссоциирует, Pol. II высвобождается из сайта остановки, позволяя осуществить доставку к гену новых молекул Pol. II (с).
Ген Hsp 70 Drosophila регулируется на стадии ранней элонгации - promotor-proximal «паузы» а - В области промотора свободен от нуклеосом участок 250 н downstream от старта транскрипции. С открытым промотором связаны GAGA-фактор (GAF, оранжевые круги) и GTFs (голубой прямоугольник). GAF рекрутирует нуклеосомные ремоделеры для поддержания открытого состояния. С открытого промотора может стартовать Pol. II (красная), транскрибировать 20 -40 н, затем она останавливается (пауза). Пауза опосредуется комплексами SPT 4 -SPT 5 (розовый) и NELF (фиолетовый круг). В сайте остановки Pol. II фосфорилируется TFIIH субъединицей CDK 7 по Ser 5 -CTD. b – HS вызывает тримеризацию транскрипционного активатора HSF (желтый), который связывается стабильно upstream Hsp 70. Происходит также активация HSF в результате связывания с коактиватором (зеленый), быстрая потеря нуклеосомной защиты вокруг гена и высвобождение Pol. II из паузы в продуктивную элонгацию. P-TEFb (голубая пирамида) рекрутируется к гену и фосфорилирует (голубые Р) CTD, SPT 5 и NELF субъединицы. NELF комплекс диссоциирует, Pol. II высвобождается из сайта остановки, позволяя осуществить доставку к гену новых молекул Pol. II (с).
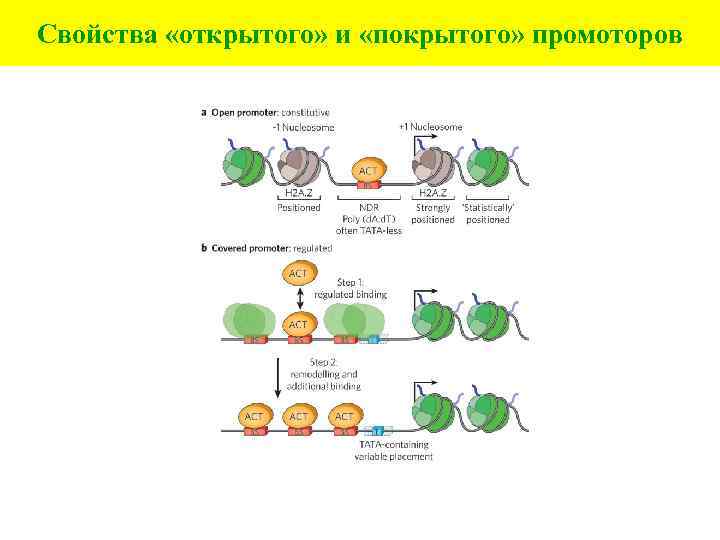 Свойства «открытого» и «покрытого» промоторов
Свойства «открытого» и «покрытого» промоторов
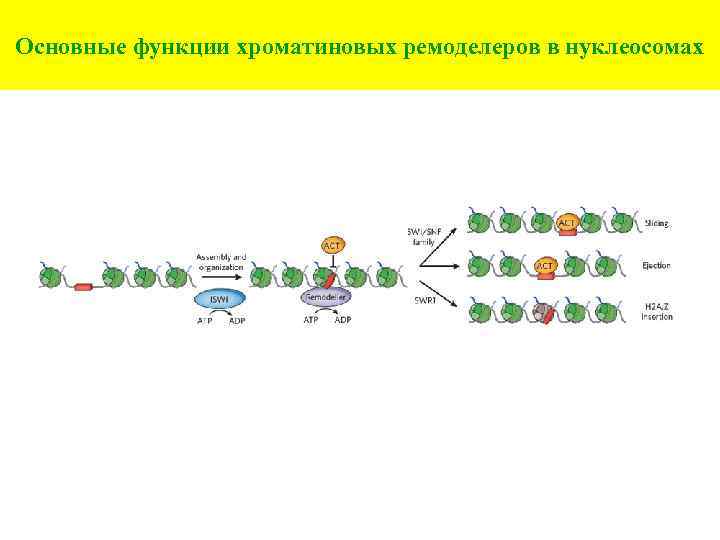 Основные функции хроматиновых ремоделеров в нуклеосомах
Основные функции хроматиновых ремоделеров в нуклеосомах


