2010 ЛЕКЦИЯ 13 переходные.ppt
- Количество слайдов: 34

ЛЕКЦИЯ 13 ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ

Общие физические и химические свойства • Простые вещества – металлы • Широкий диапазон проявляемых степеней окисления и разнообразие окислительно- восстановительных свойств • Способность к образованию значительного числа комплексов (часто инертных) • Окрашенность многих соединений

Электронное строение переходных элементов 1 s 2 2 p 6 3 s 2 3 p 6 … (n-1)dx nsy, при этом x = 1 - 10, а у = 0 – 2. n – номер периода, в котором находится элемент. х+у – номер побочной группы: если сумма составляет 3 – 7, то номер группы численно равен этой сумме; если х+у = 8; 9; 10, то элемент находится в группе VIIIb; если х+у = 11, то то элемент находится в группе Ib; если х+у = 12, то то элемент находится в группе IIb.

Электронные структуры переходных элементов

Радиусы атомов d- элементов в периодах с увеличением порядкового номера монотонно уменьшаются вследствие увеличения зарядов ядер (d- сжатие). Однако, это уменьшение не столь значительно, как у s- и p элементов.
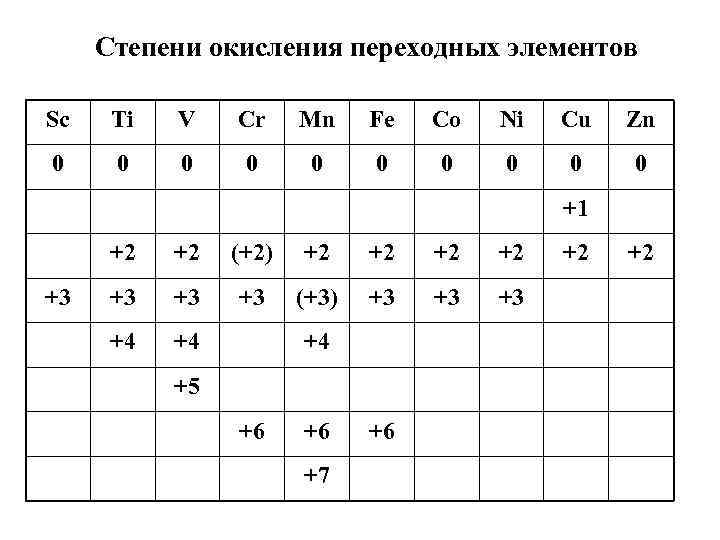
Степени окисления переходных элементов Sc Ti V Cr Mn Fe Co Ni Cu Zn 0 0 0 0 0 0 +1 +2 (+2) +2 +2 +2 +2 +3 +3 (+3) +3 +3 +4 +5 +6 +6 +6 +7

ПОЛУЧЕНИЕ И ОЧИСТКА ПЕРЕХОДНЫХ МЕТАЛЛОВ. В природе: оксидные минералы сульфидные минералы в самородном состоянии в виде примесей в минералах (железа, никеля, меди).

Основные минералы переходных элементов. Под- 4 период 5 период 6 период группа IIIb Тортвейтит (Sc, Y)2 Si 2 O 7 Ксенотим YPO 4 Монацит (Ce, La, …)PO 4, бастнезит (Ce, La, …)(CO 3)F IVb Ильменит Fe. Ti. O 3, рутил Ti. O 2, титанит Циркон Zr. Si. O 4, бадделеит альвит Ca. Ti. Si. O 5 Zr. O 2 (Hf, Th, Zr)Si. O 4*x. H 2 O Vb Патронит VS 4, ванадинит Pb 5(VO 4)3 Cl Колумбит (Fe, Mn)Nb 2 O 6 Танталит (Fe, Mn)Ta 2 O 6 VIb Хромит Fe. Cr 2 O 4, крокоит Pb. Cr. O 4 Молибденит Mo. S 2 Шеелит Ca. WO 4, вольфрамит (Fe, Mn)WO 4 VIIb Пиролюзит Mn. O 2, псиломелан Mn. O 2(с Сопутствующий элемент примесями), криптомелан KMn 8 O 16, молибденовых руд манганит Mn. O(OH) VIIIb Гематит Fe 2 O 3, магнезит Fe 3 O 4, Самородный рутений Ru Самородный осмий Os, сидерит Fe. CO 3 осмирид Ir. Os VIIIb Смальтит Co. As 2, кобальтин Co. As. S, Примесь (до 0, 1 %) в Осмирид Ir. Os, иридоосмит линнеит Co 3 S 4 медных и никелевых рудах (Os, Ir) VIIIb Гарниерит (Ni, Mg)6 Si 4 O 10(OH)2, Руды платины, побочный пенландит (Ni, Fe)9 S 8 продукт при очистке Cu и Ni продукт при очистке Cu и Ni Ib Халькопирит Cu. Fe. S 2, халькозин Cu 2 S, Аргенит (серебряный блеск) Самородное золото Au куприт Cu 2 O, малахит Cu 2(CO 3)(OH)2 Ag 2 S IIb Цинковая обманка Zn. S, смитсонит Гринокит Cd. S Самородная ртуть Hg, Zn. CO 3, сфалерит (Zn, Fe)S киноварь Hg. S

Получение – восстановление Кремнием : 2 V 2 O 5 + 5 Si = 5 Si. O 2 + 4 V Углеродом: Fe. Cr 2 O 4 + 4 C = Fe + 2 Cr + 4 CO Активным металлом (алюминотермия, кальцийтермия и пр. ): 3 Mn 3 O 4 + 8 Al = 9 Mn = 4 Al 2 O 3 Или водородом: 2 Mo. O 3 + 6 H 2 = 2 Mo + 6 H 2 O Электрохимическое восстановление (рафинирование) элементов из растворов их солей (Cr, Mn, Co, Cu, Ag, Au и пр. ), очистка разложением карбонилов металлов (Mn, Fe, Ni и пр. ): Ni + 4 CO = Ni(CO)4 (318 – 323 K) Ni(CO)4 = Ni + 4 CO (453 – 473 K)

ХИМИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ ПЕРЕХОДНЫХ МЕТАЛЛОВ

ХРОМ Белый , твердый металл, чрезвычайно устойчивый к действию различных корродирующих агентов. Пассивируется холодной азотной кислотой (в т. ч. разбавленной).

СТЕПЕНЬ ОКИСЛЕНИЯ +2 Cr + 2 HCl = Cr. Cl 2 + H 2 (синий) Растворы хрома (II) легко и быстро окисляются, причем окислителем может служить как кислород воздуха, так и собственно вода Гидроксид хрома (II) – основание, мадорастворим.

СТЕПЕНЬ ОКИСЛЕНИЯ +3 2 Cr + 2 Cl 2 = 2 Cr. Cl 3 Гидроксид хрома (III) малорастворим (ПР = 5, 4*10 -31); серовато-зеленый. Свежеосажденный гидроксид хрома (III) – амфотерен: Cr(OH)3 + 3 H 3 O+ = [Cr(H 2 O)6]3+ (сине-фиолетовый) Cr(OH)3 + 3 OH- = [Cr(OH)6]3 - (зеленый)

СТЕПЕНЬ ОКИСЛЕНИЯ +6. H 2 Cr. O 4 Соли- хроматы и бихроматы. 2 Cr. O 42 - + 2 H+ = Cr 2 O 72 - + H 2 O желтый оранжевый Хроматы и бихроматы – окислители.
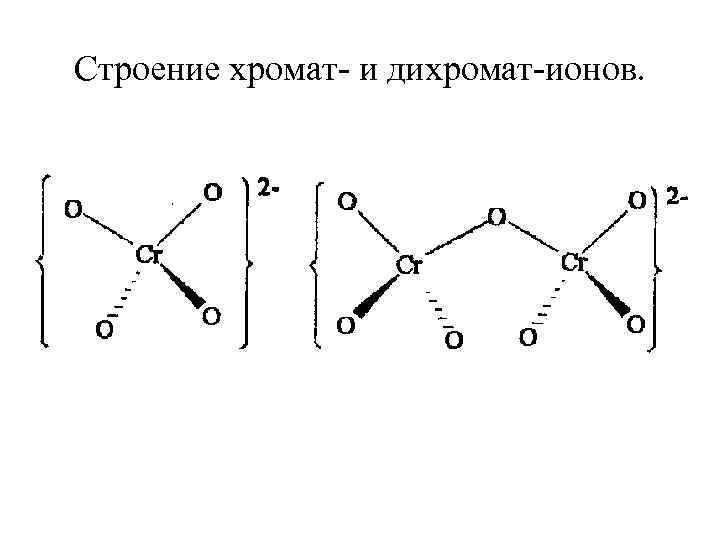
Строение хромат- и дихромат-ионов.



K 2 Cr 2 O 7 + H 2 SO 4 = Cr. O 3 + K 2 SO 4 + H 2 O Cr. O 3 – темно-красные кристаллы, гигроскопичное легкоплавкое соединение, обладает сильными окислительными свойствами.

МАРГАНЕЦ Серебристо-белый металл, схож по физическим и химическим свойствам с железом. На поверхности образуется оксидная пленка Mn. O 2 красноватого оттенка. ПОЛУЧЕНИЕ – алюминотермия. 3 Mn. O 2 = Mn 3 O 4 + O 2 Mn + 2 H 2 O = Mn(OH)2 + H 2 (мелкораздробленный)

СТЕПЕНЬ ОКИСЛЕНИЯ +2 Соли Mn(II) – бледно-розовые, растворы бесцветны, в воде нерастворимы: Mn. S (ПР 1, 4*10 -15), Mn. CO 3 (ПР 1, 8*10 -11) и Mn 3(PO 4)2 Монооксид марганца Mn. O – серо-зеленый Mn(OH)2 - малорастворим (ПР 1, 9*10 -13), основание.

Степень окисления +4. Mn. O 2 (пиролюзит). Темно-серой вещество, обычно переменного состава, широко используется в промышленности в качестве исходного сырья для получения марганца, для обесцвечивания стекла, в спичечном производстве. Окислительные свойства: Mn. O 2 + 4 HCl = Mn. Cl 2 + 2 H 2 O Восстановительные свойства: 3 Mn. O 2 + 6 KOH + KCl. O 3 = 3 K 2 Mn. O 4 + KCl + 3 H 2 O

Степень окисления +6. В индивидуальном состоянии выделены только Na 2 Mn. O 4*n. H 2 O и K 2 Mn. O 4. Манганат-ион – сильный окислитель: легко восстанавливается при нагревании: K 2 Mn. VIO 4 = K 2 Mn. IVO 3 + 1/2 O 2 либо под действием различных восстановителей. Манганат-ионы способны диспропорционировать:

Степень окисления +7. KMn. O 4. Сильный окислитель. Раствор малиновый. Промышленное получение- окисление хлором, озоном или электрохимически (анодное окисление) 2 KMn. O 4 + O 3 + H 2 O = 2 KMn. O 4 + O 2 + 2 KOH

ЖЕЛЕЗО Оксиды: Fe. O, красно-коричневый Fe 2 O 3 (гематит), черный Fe 3 O 4 (магнетит).

![Степень окисления +3. [Fe(H 2 O)6]3+ - красно-оранжевый Ион железа (III) легко гидролизуется, Степень окисления +3. [Fe(H 2 O)6]3+ - красно-оранжевый Ион железа (III) легко гидролизуется,](https://present5.com/presentation/3/14143876_40806091.pdf-img/14143876_40806091.pdf-26.jpg)
Степень окисления +3. [Fe(H 2 O)6]3+ - красно-оранжевый Ион железа (III) легко гидролизуется, причем степень гидролиза велика уже в кислых растворах (при р. Н = 2 -3): Fe(OH)3 легко образует коллоидные растворы.

Степень окисления +6 2 Fe(OH)3 + 10 KOH + 3 Br 2 = 2 K 2 Fe. O 4 + 8 H 2 O + 6 KBr Феррат (VI) – фиолетовый, достаточно устойчив в щелочных средах. В нейтральных и кислых: 4 Fe 42 - + 20 H+ = 4 Fe 3+ + 3 O 2 + 10 H 2 O

МЕДЬ Металл красного цвета, обладает исключительно высокой тепло - и электропроводностью. Cu + O 2 = Cu. O (при комнатной температуре реагирует с поверхности) Сu + 2 H 2 SO 4 (конц. ) = Cu. SO 4 + SO 2 + 2 H 2 O Степень окисления +1. Cu 1+ - неустойчива 2 Cu 1+ = Cu + Cu 2+ Cu. Cl – белый, нерастворим в воде; Cu. Cl 2 – синий, хорошо растворим в воде; Cu 2 O – красный.

Степень окисления +2. Cu(OH)2 – светло-синий, малорастворим в воде (ПР 2, 2*10 -20), основание, растворяется в избытке аммиака: Cu(OH)2 + 4 NH 3*H 2 O = [Cu(NH 3)4](OH)2 Cu(OH)2 = Cu. O + H 2 O (нагрев) Cu. O- черный Cu. S – черный (ПР 6, 3*10 -36) Cu. SO 4*5 H 2 O – медный купорос


РТУТЬ Металлическая ртуть – серебристая легкоподвижная жидкость. Достаточно инертна, ни в щелочах, ни в кислотах не растворяется. Взаимодействует только с кислотами – сильными окислителями: Hg + 4 HNO 3(конц. ) = Hg(NO 3)3 + 2 NO 2 + 2 H 2 O При нагревании взаимодействует с большинством активных неметаллов: Hg + S = Hg. S Сплавы ртути с другими металлами называют амальгамами.

Степень окисления +2. Оксид ртути (II) существует в двух модификациях – желтой и красной.

СЕРЕБРО Малоактивный мягкий металл. Встречается в природе в самородном состоянии. Реагирует только с концентрированными кислотами- окислителями: 2 Ag + 2 H 2 SO 4 (конц. )= Ag 2 SO 4 + SO 2 + 2 H 2 O Степень окисления +1. Гидроксид серебра (+1) не существует: 2 Ag. NO 3 + 2 KOH = Ag 2 O + 2 KNO 3 + H 2 O темно-коричн. Ag. F Ag. Cl Ag. Br Ag. I белый Св-желтый растворим ПР 1, 78*10 -10 ПР 5, 3*10 -13 ПР 8, 3*10 -17 Реакция: Ag+ +Cl- = Ag. Cl (Br, I) используется для обнаружения серебра в фотографии.
![Ag. Cl + Cl- = [Ag. Cl 2]- Kнест. = 9*10 -6 Ag. Cl Ag. Cl + Cl- = [Ag. Cl 2]- Kнест. = 9*10 -6 Ag. Cl](https://present5.com/presentation/3/14143876_40806091.pdf-img/14143876_40806091.pdf-34.jpg)
Ag. Cl + Cl- = [Ag. Cl 2]- Kнест. = 9*10 -6 Ag. Cl + 3 Cl- = [Ag. Cl 4]3 - [Ag. Cl 4]3 - [Ag. Br 4]3 - [Ag. I 4]3 - К нестойкости 5*10 -6 1, 9*10 -9 7, 9*10 -14 р. К нестойкости 5, 3 8, 773 13, 10 Другие комплексы: Ag+ + 2 NH 3 = [Ag(NH 3)2]+ Kнест. = 7, 8*10 -8 Ag+ + 2 S 2 O 32 - = [Ag(S 2 O 3)2]3 - Kнест. = 3, 4*10 -14 Ag+ + 3 S 2 O 32 - = [Ag(S 2 O 3)3]5 - Kнест. = 7, 1*10 -15
2010 ЛЕКЦИЯ 13 переходные.ppt