15 Амины 12 лекция(1).ppt
- Количество слайдов: 26

ЛЕКЦИЯ 12 ТЕМА: «АМИНЫ»

План: 1)Общая характеристика аминов. 2)Номенклатура аминов. 3)Изомерия аминов. 4)Физические свойства. 5)Способы получения. 6)Химические свойства. 7)Отдельные представители и их применение.

I. Общая характеристика аминов Амины – производные аммиака, в котором атомы водорода замещены на углеводородный радикал. Амины бывают: 1)Первичные. СН 3—NH 2 ( метиламин ) R Общая формула: N— H H

2)Вторичные R Общая формула: N— R 1 Н CH 3 – NH – CH 3 диметиламин

3)Третичные Общая формула: R N— R 1 R 2 CH 3 | CH 3 – N – CH 3 триметиламин

4)Четвертичные R Общая формула: ——R 1 R 3 R 2 донорно-акцепторная связь CH 3 | CH 3 – – CH 3 | CH 3

• По природе углеводородных радикалов амины делятся на: 1) алифатические 2) алициклические 3) ароматические 4) смешанные

органические соединения, содержащие две группы – NH 2. а) Н 2 N—CH 2—NH 2 этилендиамин б) H 2 N— ( CН 2 )6—NH 2 гексаметилендиамин – 1, 6 Применяют для получения волокна нейлона

II. Номенклатура аминов. Амины называют с суффиксом – амин на конце. 3 2 1 а) СН 3—СН—СН 2—NH 2 │ CH 3 2 -метилпропанамин-1

г) б) СН 3—NH 2 метиламин в) CH 3—NH―CH 3 диметиламин СН 3—СН 2—N—CH 2—CH 3 │ СН 3 Метилпропилэтиламин

III. Изомерия аминов. Для аминов характерен следующий вид изомерии: 1) изомерия углеродного скелета 2) изомерия положения аминогруппы

IV. Физические свойства. Низшие амины (метиламин, диметиламин, триметиламин) при нормальных условиях – газы, имеющие запах аммиака. Средние члены ряда аминов – жидкости со слабым запахом, высшие – твердые вещества без запаха.
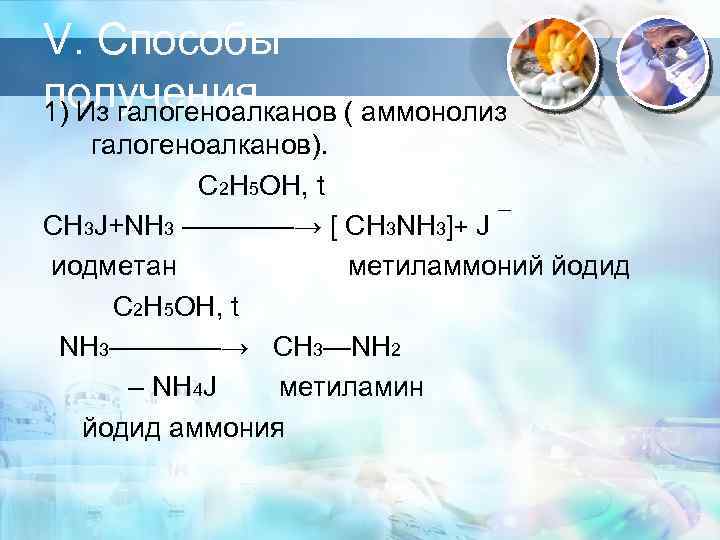
V. Способы получения. 1) Из галогеноалканов ( аммонолиз галогеноалканов). С 2 Н 5 OH, t CH 3 J+NH 3 ————→ [ CH 3 NH 3]+ J иодметан метиламмоний йодид С 2 Н 5 OH, t NH 3————→ CH 3—NH 2 – NH 4 J метиламин йодид аммония
![получение аминов из нитросоединений +2 [ H+ ] ): 2 —————→C 6 H 5—N═O получение аминов из нитросоединений +2 [ H+ ] ): 2 —————→C 6 H 5—N═O](https://present5.com/presentation/31377123_184582929/image-14.jpg)
получение аминов из нитросоединений +2 [ H+ ] ): 2 —————→C 6 H 5—N═O — С 6 Н 5 NO Нитробензол нитрозобензол +4[ H+ ] – H 2 O ———→ C 6 H 5—NH 2 – H 2 O анилин Водород, используемый в данной р-ии, получают при взаимодействии металлов с серной или хлороводородной кислотами.

VI. Химические свойства. I) Основные свойства аминов: R—CH 2 ———— N — H основной цетор Нуклеофильный центр Н

Неподеленная пара электронов азота обуславливает основные свойства аминов. В ароматических аминах аминогруппа участвует в сопряжении с π-электронным облаком бензольного кольца. В связи с этим ароматические амины более слабые основания.
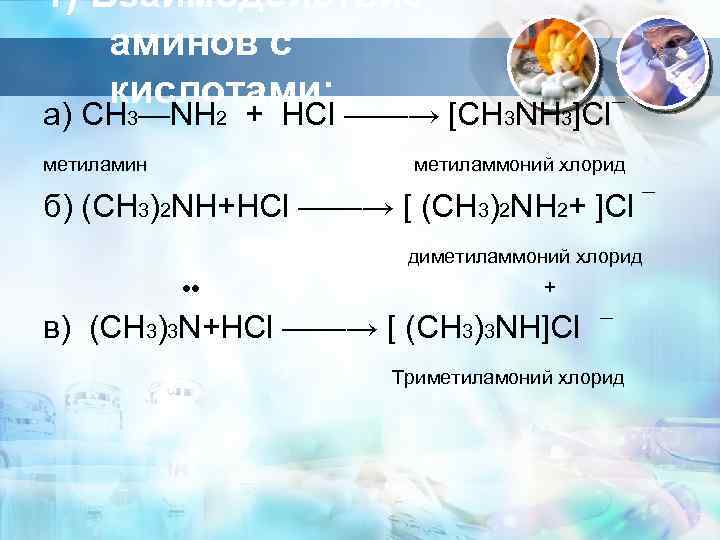
1) Взаимодействие аминов с кислотами: a) CH 3—NH 2 + HCl ——→ [CH 3 NH 3]Cl метиламин метиламмоний хлорид б) (СН 3)2 NH+HCl ——→ [ (CH 3)2 NH 2+ ]Cl диметиламмоний хлорид + в) (CH 3)3 N+HCl ——→ [ (CH 3)3 NH]Cl Триметиламоний хлорид

г) C 6 H 5—NH 2 +H 2 SO 4 ——→ Фениламин(анилин) → [ C 6 H 5 NH 3]HSO 4 Гидросульфат-фениламмония

II. Алкилирование аминов ( реакция Гофмана ) H 3 C—NH 2 +CH 3 J—→[CH 3—NH 2—CH 3+ ]J Первичный амин диметиламмоний йодид + Na. OH——→CH 3—NH—CH 3 -Na. J диметиламин(вторич. амин) -H 2 O Соли аминов – кристаллические вещества, растворимые в воде, водные растворы их проводят электрический ток.

III. Ацилирование аминов ( реакция Гофмана ) O // t, к C 6 H 5—NH 2+CH 3—C—Cl ———→ анилин O хлорангидрид ║ C 6 H 5—NH—C—CH 3 Анилид уксусной к-ты

IV. Галогенирование (качественная реакция на анилин) NH 2 + 3 Br 2 Br t=20º ————→ Br анилин NH 2 Br + 3 НBr 2, 4, 6 – триброманилин белого цвета

VI. Сульфирование NH 2 +OH—SO 3—H NH 2 t=200ºC – H 2 O HO 3 S сульфаниловая к-та (пара-аминобензолсульфакислота)
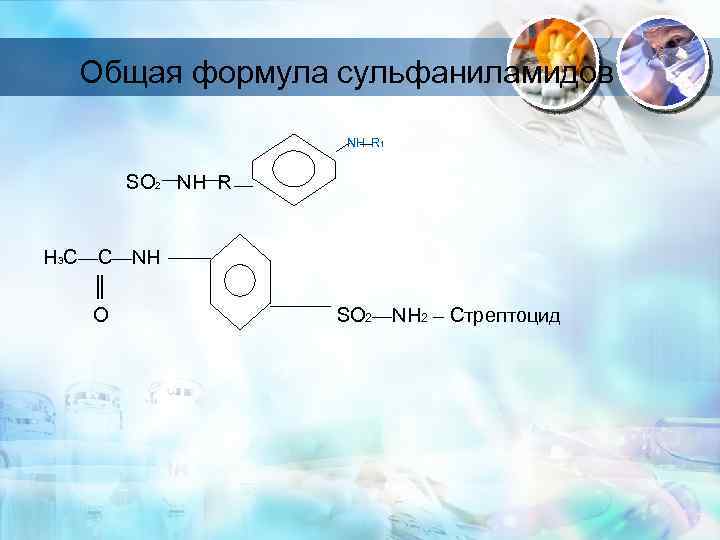
Общая формула сульфаниламидов NH R 1 SO 2 NH R H 3 C—C—NH ║ O SO 2—NH 2 – Cтрептоцид

VII. Отдельные представители и их применение. 1. Метиламин СН 3—NH 2 Газ с запахом NH 3. Используется в кожевенной промышленности , в синтезе лекарственных средств.

2. Фениламин С 6 Н 5—NH 2. (анилин) Бесцветная маслообразная жидкость, тяжелее воды, яд ! При окислении становится красно-бурого цвета, со слабым запахом, малорастворим в воде, хорошо в спирте, эфире, бензоле. Используют для синтеза сульфаниламидов, анестезина.

Качественные реакции на анилин. 1) анилин + хлорная известь ——→ фиолетовое окрашивание 2) анилин + лингин + HCl ——→ яркожелтый цвет (для определения качества бумаги ) 3) образование 2, 4, 6 -трибромаанилина. Анилин используется для получения красителей, пластмасс.
15 Амины 12 лекция(1).ppt