ОХ_13_био.ppt
- Количество слайдов: 38
 Лекция № 12 Основы электрохимии • Электрохимическими называют реакции (процессы), в которых происходит взаимное превращение электрической и химической форм энергии. В основе этих процессов лежат окислительно-восстановительные реакции. Как и любые термодинамические процессы, электрохимические превращения могут протекать при бесконечно малом значении силы тока с близкой к нулю скоростью (равновесный процесс) или при измеримых значениях силы тока с конечной скоростью (неравновесный процесс).
Лекция № 12 Основы электрохимии • Электрохимическими называют реакции (процессы), в которых происходит взаимное превращение электрической и химической форм энергии. В основе этих процессов лежат окислительно-восстановительные реакции. Как и любые термодинамические процессы, электрохимические превращения могут протекать при бесконечно малом значении силы тока с близкой к нулю скоростью (равновесный процесс) или при измеримых значениях силы тока с конечной скоростью (неравновесный процесс).
 Лекция № 12 Основы электрохимии • Электрохимической системой (ЭХС) называют устройство, в котором осуществляются взаимные превращения электрической и химической форм энергии.
Лекция № 12 Основы электрохимии • Электрохимической системой (ЭХС) называют устройство, в котором осуществляются взаимные превращения электрической и химической форм энергии.
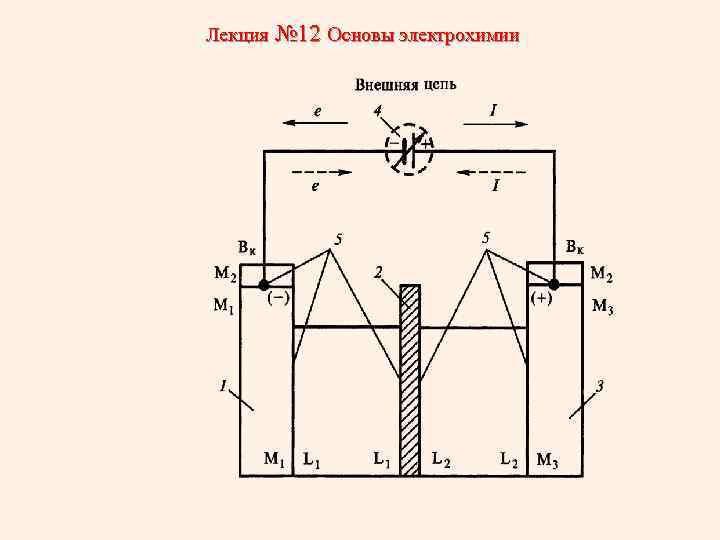 Лекция № 12 Основы электрохимии
Лекция № 12 Основы электрохимии
 Лекция № 12 Основы электрохимии • В электрохимии в стандартной форме записи, когда на электроде протекает процесс восстановления, электроды изображают в виде схемы (условной записи): слева от вертикальной черты, означающей границу раздела фаз, указывают вещества, находящиеся в растворе; справа — вещества, образующие электродный материал (другую фазу). Если фаза содержит несколько веществ, то их формулы разделяются запятыми. Например, электроды Zn 2+|Zn- цинковый; Сl-|Сl 2, Pt- хлорный; Mn. O-4, Mn 2+, H+| Pt — перманганатный (в кислотной среде).
Лекция № 12 Основы электрохимии • В электрохимии в стандартной форме записи, когда на электроде протекает процесс восстановления, электроды изображают в виде схемы (условной записи): слева от вертикальной черты, означающей границу раздела фаз, указывают вещества, находящиеся в растворе; справа — вещества, образующие электродный материал (другую фазу). Если фаза содержит несколько веществ, то их формулы разделяются запятыми. Например, электроды Zn 2+|Zn- цинковый; Сl-|Сl 2, Pt- хлорный; Mn. O-4, Mn 2+, H+| Pt — перманганатный (в кислотной среде).
 Лекция № 12 Основы электрохимии • Относительные величины электродных потенциалов (их значения в вольтах по водородной шкале) обозначают греческой буквой с индексом в виде дроби. В числителе дроби через запятую указывают исходные вещества (окисленная форма, Оф) электродной реакции со стехиометрическими коэффициентами, в знаменателетаким же образом, продукты этого процесса (восстановленная форма, Вф). В сокращенной форме записи стехиометрические коэффициенты не указывают. Электродную реакцию записывают как процесс восстановления (присоединения электронов). • Внешняя цепь обеспечивает прохождение тока между электродами и представляет собой металлический проводник. В зависимости от вида ЭХС во внешнюю цепь включают гальванометр или источник постоянного тока.
Лекция № 12 Основы электрохимии • Относительные величины электродных потенциалов (их значения в вольтах по водородной шкале) обозначают греческой буквой с индексом в виде дроби. В числителе дроби через запятую указывают исходные вещества (окисленная форма, Оф) электродной реакции со стехиометрическими коэффициентами, в знаменателетаким же образом, продукты этого процесса (восстановленная форма, Вф). В сокращенной форме записи стехиометрические коэффициенты не указывают. Электродную реакцию записывают как процесс восстановления (присоединения электронов). • Внешняя цепь обеспечивает прохождение тока между электродами и представляет собой металлический проводник. В зависимости от вида ЭХС во внешнюю цепь включают гальванометр или источник постоянного тока.
 Лекция № 12 Основы электрохимии • Устройство, осуществляющее превращение химической энергии окислительно-восстановительной реакции в электрическую, называют химическим источником тока (ХИТ). В этом случае ЭХС генерирует постоянный электрический ток, во внешнюю цепь включается гальванометр. Различают три вида ХИТ: гальванические элементы, аккумуляторы, топливные элементы. В источниках тока окислительно-восстановительные реакции протекают самопроизвольно,
Лекция № 12 Основы электрохимии • Устройство, осуществляющее превращение химической энергии окислительно-восстановительной реакции в электрическую, называют химическим источником тока (ХИТ). В этом случае ЭХС генерирует постоянный электрический ток, во внешнюю цепь включается гальванометр. Различают три вида ХИТ: гальванические элементы, аккумуляторы, топливные элементы. В источниках тока окислительно-восстановительные реакции протекают самопроизвольно,
 Лекция № 12 Основы электрохимии • Устройство, превращающее электрическую энергию постоянного тока в химическую, называют электролизером. В его внешнюю цепь включается источник постоянного тока, на электродах протекают химические реакции (например, анодное растворение или катодное осаждение металла, выделение газа на аноде или катоде). Окислительно-восстановительные реакции на электродах электролизера осуществляются принудительно, под действием электрической энергии внешнего источника тока
Лекция № 12 Основы электрохимии • Устройство, превращающее электрическую энергию постоянного тока в химическую, называют электролизером. В его внешнюю цепь включается источник постоянного тока, на электродах протекают химические реакции (например, анодное растворение или катодное осаждение металла, выделение газа на аноде или катоде). Окислительно-восстановительные реакции на электродах электролизера осуществляются принудительно, под действием электрической энергии внешнего источника тока
 Лекция № 12 Основы электрохимии • В связи с противоположным направлением процессов в гальваническом элементе (ГЭ) и в электролизере (Э) одноименные электроды (полюсы) имеют разные знаки. На аноде (знаки «-» в ГЭ, «+» в Э) протекают реакции • окисления, на катоде (знаки «+» в ГЭ, «-» в Э)- процессы восстановления. • Для реакций, происходящих во всех ЭХС, справедливы законы Фарадея (1833), химической термодинамики и химической кинетики. • Законы Фарадея связывают массу или эквивалентное количество вещества, прореагировавшего на электроде, с зарядом, прошедшим через ЭХС.
Лекция № 12 Основы электрохимии • В связи с противоположным направлением процессов в гальваническом элементе (ГЭ) и в электролизере (Э) одноименные электроды (полюсы) имеют разные знаки. На аноде (знаки «-» в ГЭ, «+» в Э) протекают реакции • окисления, на катоде (знаки «+» в ГЭ, «-» в Э)- процессы восстановления. • Для реакций, происходящих во всех ЭХС, справедливы законы Фарадея (1833), химической термодинамики и химической кинетики. • Законы Фарадея связывают массу или эквивалентное количество вещества, прореагировавшего на электроде, с зарядом, прошедшим через ЭХС.
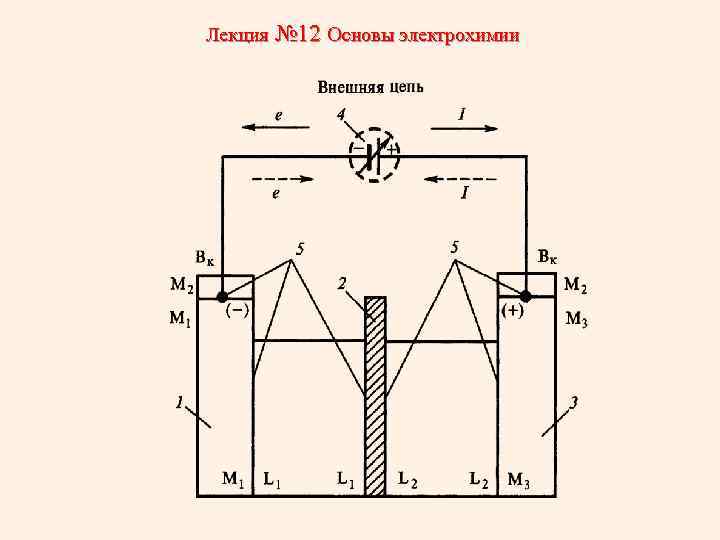 Лекция № 12 Основы электрохимии
Лекция № 12 Основы электрохимии
 Лекция № 12 Основы электрохимии • Первый закон Фарадея. Масса mi вещества i, прореагировавшего на электроде ЭХС, пропорциональна электрическому заряду q, прошедшему через систему • где Мэхt- коэффициент пропорциональности, называемый электрохимической эквивалентной массой, г/Кл или г/(А • ч); i- сила тока, А; t- время пропускания тока, с; q — электрический заряд, Кл. • Мэхt численно равна массе вещества, прореагировавшего на электроде при пропускании через систему заряда q = 1 Кл.
Лекция № 12 Основы электрохимии • Первый закон Фарадея. Масса mi вещества i, прореагировавшего на электроде ЭХС, пропорциональна электрическому заряду q, прошедшему через систему • где Мэхt- коэффициент пропорциональности, называемый электрохимической эквивалентной массой, г/Кл или г/(А • ч); i- сила тока, А; t- время пропускания тока, с; q — электрический заряд, Кл. • Мэхt численно равна массе вещества, прореагировавшего на электроде при пропускании через систему заряда q = 1 Кл.
 Лекция № 12 Основы электрохимии • Второй закон Фарадея. При постоянном заряде, прошедшем через ЭХС, массы веществ, прореагировавших на электродах, соотносятся между собой как молярные массы их химических эквивалентов: • при q = const • Второй закон Фарадея применим к веществам, реагирующим: а) на аноде и катоде одной и той же ЭХС; б) на электродах последовательно соединенных ЭХС, для которых I=const, t= const, а следовательно, и q = const; в) на электродах любых ЭХС при q = const.
Лекция № 12 Основы электрохимии • Второй закон Фарадея. При постоянном заряде, прошедшем через ЭХС, массы веществ, прореагировавших на электродах, соотносятся между собой как молярные массы их химических эквивалентов: • при q = const • Второй закон Фарадея применим к веществам, реагирующим: а) на аноде и катоде одной и той же ЭХС; б) на электродах последовательно соединенных ЭХС, для которых I=const, t= const, а следовательно, и q = const; в) на электродах любых ЭХС при q = const.
 Лекция № 12 Основы электрохимии • Можно получить другую формулировку второго закона Фарадея: при постоянном заряде, прошедшем через ЭХС, эквивалентные количества веществ, прореагировавших на электродах, равны между собой: • при q = const • Следствие из закона Фарадея устанавливает пропорциональность электрохимических эквивалентных масс и молярных масс химических эквивалентов веществ
Лекция № 12 Основы электрохимии • Можно получить другую формулировку второго закона Фарадея: при постоянном заряде, прошедшем через ЭХС, эквивалентные количества веществ, прореагировавших на электродах, равны между собой: • при q = const • Следствие из закона Фарадея устанавливает пропорциональность электрохимических эквивалентных масс и молярных масс химических эквивалентов веществ
 Лекция № 12 Основы электрохимии • Для электрохимического превращения 1 моль эквивалента вещества необходим постоянный заряд F, называемый константой (числом) Фарадея: • F = e. NA =1, 6022 • 10 -19 • 6, 022 • 1023=96484 Кл/мольэкв = =26, 8 А • ч/мольэкв. • Для расчетов принимают F= 96500 Кл/моль экв. Постоянная Фарадея равна заряду, переносимому 1 моль элементарных носителей (электронов, однозарядных ионов). Число F представляет собой коэффициент пропорциональности
Лекция № 12 Основы электрохимии • Для электрохимического превращения 1 моль эквивалента вещества необходим постоянный заряд F, называемый константой (числом) Фарадея: • F = e. NA =1, 6022 • 10 -19 • 6, 022 • 1023=96484 Кл/мольэкв = =26, 8 А • ч/мольэкв. • Для расчетов принимают F= 96500 Кл/моль экв. Постоянная Фарадея равна заряду, переносимому 1 моль элементарных носителей (электронов, однозарядных ионов). Число F представляет собой коэффициент пропорциональности
 Лекция № 12 Основы электрохимии • Обобщенное выражение законов Фарадея: • где Mi — молярная масса вещества, г/моль; zэкв, - —число эквивалентности, равное заряду катиона металла или числу электронов, принимающих участие в электродном процессе (так называемое зарядовое число); • -фактор эквивалентности.
Лекция № 12 Основы электрохимии • Обобщенное выражение законов Фарадея: • где Mi — молярная масса вещества, г/моль; zэкв, - —число эквивалентности, равное заряду катиона металла или числу электронов, принимающих участие в электродном процессе (так называемое зарядовое число); • -фактор эквивалентности.
 Лекция № 12 Основы электрохимии • В применении к газам, подвергающимся превращению на электродах (выделение при электролизе водорода на катоде, хлора или кислорода на аноде, поглощение кислорода на катоде при электрохимической коррозии), обобщенное выражение законов Фарадея записывают чаще через объемы реагирующих веществ: • где Vi- объем выделившегося или поглощенного газа; Vэквi- молярный объем химического эквивалента этого газа (при н. у. для О 2 - 5, 6 л/моль экв, для Н 2, Сl 2 - 11, 2 л/моль экв).
Лекция № 12 Основы электрохимии • В применении к газам, подвергающимся превращению на электродах (выделение при электролизе водорода на катоде, хлора или кислорода на аноде, поглощение кислорода на катоде при электрохимической коррозии), обобщенное выражение законов Фарадея записывают чаще через объемы реагирующих веществ: • где Vi- объем выделившегося или поглощенного газа; Vэквi- молярный объем химического эквивалента этого газа (при н. у. для О 2 - 5, 6 л/моль экв, для Н 2, Сl 2 - 11, 2 л/моль экв).
 Лекция № 12 Основы электрохимии • Величина коэффициент выхода по току i, в долях единицы равна отношению массы вещества практически подвергшейся превращению, к теоретически • вычисленной в соответствии с законами Фарадея • Коэффициент i равен доле от общего пропущенного заряда, пошедшей на осуществление данного процесса.
Лекция № 12 Основы электрохимии • Величина коэффициент выхода по току i, в долях единицы равна отношению массы вещества практически подвергшейся превращению, к теоретически • вычисленной в соответствии с законами Фарадея • Коэффициент i равен доле от общего пропущенного заряда, пошедшей на осуществление данного процесса.
 Лекция № 12 Основы электрохимии • Уравнение Нернста. Уравнение связывает электродный потенциал с природой металла, активностью (концентрацией) его ионов в растворе и абсолютной температурой. Электрод, на котором происходит данная реакция, представляет собой металлическую пластинку, опущенную в раствор соли этого же металла (так называемый металлический электрод).
Лекция № 12 Основы электрохимии • Уравнение Нернста. Уравнение связывает электродный потенциал с природой металла, активностью (концентрацией) его ионов в растворе и абсолютной температурой. Электрод, на котором происходит данная реакция, представляет собой металлическую пластинку, опущенную в раствор соли этого же металла (так называемый металлический электрод).
 Лекция № 12 Основы электрохимии • Зависимость электродного потенциала от природы окислительно-восстановительной системы характеризуется величиной стандартного потенциала, значение), зависимость от абсолютной температуры и активностей окисленной и восстановленной форм- вторым слагаемым правой части
Лекция № 12 Основы электрохимии • Зависимость электродного потенциала от природы окислительно-восстановительной системы характеризуется величиной стандартного потенциала, значение), зависимость от абсолютной температуры и активностей окисленной и восстановленной форм- вторым слагаемым правой части
 Лекция № 12 Основы электрохимии • Абсолютное значение электродного потенциала металлического электрода (скачок потенциала) определить невозможно. В связи с этим на практике выбирают так называемый электрод сравнения, потенциал которого принимают равным нулю при любой температуре и относительно него измеряют потенциалы всех других электродов. • Электродным потенциалом называют величину, равную по модулю электродвижущей силе Е (ЭДС) правильно разомкнутого гальванического элемента, составленного из исследуемого электрода и электрода сравнения.
Лекция № 12 Основы электрохимии • Абсолютное значение электродного потенциала металлического электрода (скачок потенциала) определить невозможно. В связи с этим на практике выбирают так называемый электрод сравнения, потенциал которого принимают равным нулю при любой температуре и относительно него измеряют потенциалы всех других электродов. • Электродным потенциалом называют величину, равную по модулю электродвижущей силе Е (ЭДС) правильно разомкнутого гальванического элемента, составленного из исследуемого электрода и электрода сравнения.
 Лекция № 12 Основы электрохимии • Согласно правилам ИЮПАК, электродвижущая сила Е равна максимальной разности потенциалов катода и анода (правого и левого электродов соответственно) при равновесном проведении процесса в правильно разомкнутом гальваническом элементе • При этом сила тока в цепи равна бесконечно малой величине (в пределе — нулю). При конечном (измеряемом) значении силы тока в гальваническом элементе происходит неравновесный процесс. В этом случае разность потенциалов катода и анода называют напряжением
Лекция № 12 Основы электрохимии • Согласно правилам ИЮПАК, электродвижущая сила Е равна максимальной разности потенциалов катода и анода (правого и левого электродов соответственно) при равновесном проведении процесса в правильно разомкнутом гальваническом элементе • При этом сила тока в цепи равна бесконечно малой величине (в пределе — нулю). При конечном (измеряемом) значении силы тока в гальваническом элементе происходит неравновесный процесс. В этом случае разность потенциалов катода и анода называют напряжением
 Лекция № 12 Основы электрохимии • За электрод сравнения принимают стандартный водородный электрод, у которого активность ионов водорода в растворе равна 1 моль/л и давление газообразного водорода над раствором составляет 101, 3 к. Па. Поскольку водород при температуре 298 К является газом, из него невозможно, как из металла, изготовить пластинку. В качестве твердой фазы в водородном электроде используют инертный металл (например Pt).
Лекция № 12 Основы электрохимии • За электрод сравнения принимают стандартный водородный электрод, у которого активность ионов водорода в растворе равна 1 моль/л и давление газообразного водорода над раствором составляет 101, 3 к. Па. Поскольку водород при температуре 298 К является газом, из него невозможно, как из металла, изготовить пластинку. В качестве твердой фазы в водородном электроде используют инертный металл (например Pt).
 Лекция № 12 Основы электрохимии • Составив гальванический элемент из стандартных водородного и исследуемого металлического электродов, можно экспериментально измерить стандартный потенциал металлического электрода. При расположении металлов в горизонтальный (вертикальный) ряд в порядке возрастания слева направо (сверху вниз) значений получают ряд стандартных электродных потенциалов (или электрохимический ряд напряжений) металлов, для которого справедливы следующие положения. • 1. Потенциалу металла присваивается тот же знак, который имеет стандартный металлический электрод в паре со стандартным водородным. Металлы, стоящие левее (выше) водорода, имеют отрицательные значения, правее (ниже) — положительные.
Лекция № 12 Основы электрохимии • Составив гальванический элемент из стандартных водородного и исследуемого металлического электродов, можно экспериментально измерить стандартный потенциал металлического электрода. При расположении металлов в горизонтальный (вертикальный) ряд в порядке возрастания слева направо (сверху вниз) значений получают ряд стандартных электродных потенциалов (или электрохимический ряд напряжений) металлов, для которого справедливы следующие положения. • 1. Потенциалу металла присваивается тот же знак, который имеет стандартный металлический электрод в паре со стандартным водородным. Металлы, стоящие левее (выше) водорода, имеют отрицательные значения, правее (ниже) — положительные.
 Лекция № 12 Основы электрохимии • 2. При перемещении по ряду слева направо (сверху вниз) возрастает окисляющая способность катионов Mz+ в водном растворе, при продвижении справа налево (снизу вверх) увеличивается восстанавливающая способность металлов М. Например, железо (-0, 440 В) более сильный восстановитель, чем медь (0, 337 В), но катионы Сu 2+ в водном растворе более сильный окислитель, чем Fe 2+.
Лекция № 12 Основы электрохимии • 2. При перемещении по ряду слева направо (сверху вниз) возрастает окисляющая способность катионов Mz+ в водном растворе, при продвижении справа налево (снизу вверх) увеличивается восстанавливающая способность металлов М. Например, железо (-0, 440 В) более сильный восстановитель, чем медь (0, 337 В), но катионы Сu 2+ в водном растворе более сильный окислитель, чем Fe 2+.
 Лекция № 12 Основы электрохимии • 3. Отрицательные значения электродных потенциалов свидетельствуют о том, что данные металлы окисляются катионами водорода, т. е. металлы вытесняют Н+ из растворов минеральных кислот, анионы которых не проявляют окислительных свойств, — так называемых кислот-неокислителей (НС 1, HBr, HI, H 3 PO 4, разбавленная H 2 SO 4) и разлагают воду
Лекция № 12 Основы электрохимии • 3. Отрицательные значения электродных потенциалов свидетельствуют о том, что данные металлы окисляются катионами водорода, т. е. металлы вытесняют Н+ из растворов минеральных кислот, анионы которых не проявляют окислительных свойств, — так называемых кислот-неокислителей (НС 1, HBr, HI, H 3 PO 4, разбавленная H 2 SO 4) и разлагают воду
 Лекция № 12 Основы электрохимии • 4. Положительные значения электродных потенциалов означают, что катионы Mz+ являются окислителями по отношению к молекулам водорода. Эти металлы не разлагают воду и не вытесняют водород из растворов кислот-неокислителей. Напротив, водород вытесняет металлы из растворов их солей.
Лекция № 12 Основы электрохимии • 4. Положительные значения электродных потенциалов означают, что катионы Mz+ являются окислителями по отношению к молекулам водорода. Эти металлы не разлагают воду и не вытесняют водород из растворов кислот-неокислителей. Напротив, водород вытесняет металлы из растворов их солей.
 Лекция № 12 Основы электрохимии • Все перечисленные выше положения справедливы не только для металлических, но и для всех окислительновосстановительных систем. При проведении окислительно -восстановительных реакций окисленная форма системы с большим потенциалом всегда является окислителем по отношению к восстановленной форме системы с меньшим потенциалом.
Лекция № 12 Основы электрохимии • Все перечисленные выше положения справедливы не только для металлических, но и для всех окислительновосстановительных систем. При проведении окислительно -восстановительных реакций окисленная форма системы с большим потенциалом всегда является окислителем по отношению к восстановленной форме системы с меньшим потенциалом.
 Лекция № 12 Основы электрохимии • Классификация электродов • Электроды подразделяют на обратимые и необратимые. Если изменить направление электрического тока во внешней цепи на противоположное, то на обратимом электроде протекает тот же самый процесс в обратном направлении, а на необратимом — другой процесс.
Лекция № 12 Основы электрохимии • Классификация электродов • Электроды подразделяют на обратимые и необратимые. Если изменить направление электрического тока во внешней цепи на противоположное, то на обратимом электроде протекает тот же самый процесс в обратном направлении, а на необратимом — другой процесс.
 Лекция № 12 Основы электрохимии • Серебряная пластинка, находящаяся в растворе нитрата серебра, представляет собой обратимый электрод. • Серебряная пластинка, находящаяся в растворе кислоты, служит примером необратимого электрода.
Лекция № 12 Основы электрохимии • Серебряная пластинка, находящаяся в растворе нитрата серебра, представляет собой обратимый электрод. • Серебряная пластинка, находящаяся в растворе кислоты, служит примером необратимого электрода.
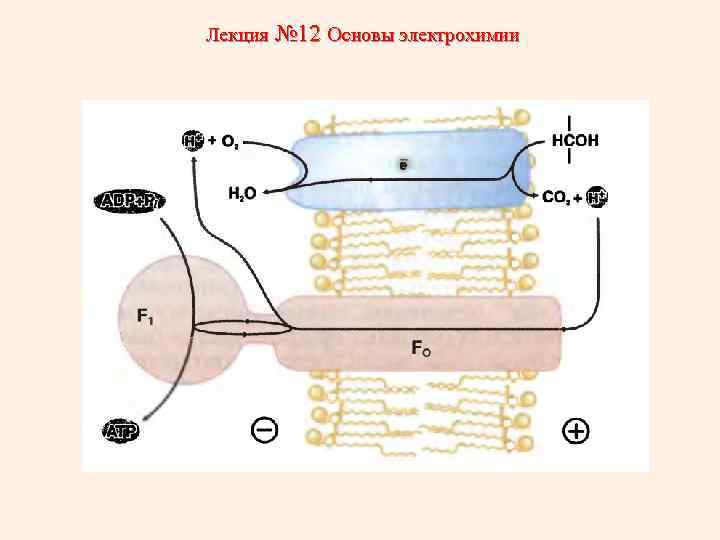 Лекция № 12 Основы электрохимии
Лекция № 12 Основы электрохимии
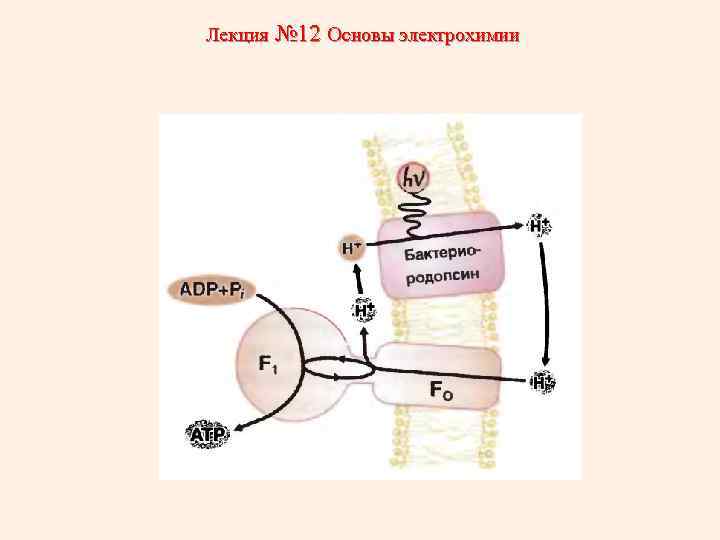 Лекция № 12 Основы электрохимии
Лекция № 12 Основы электрохимии
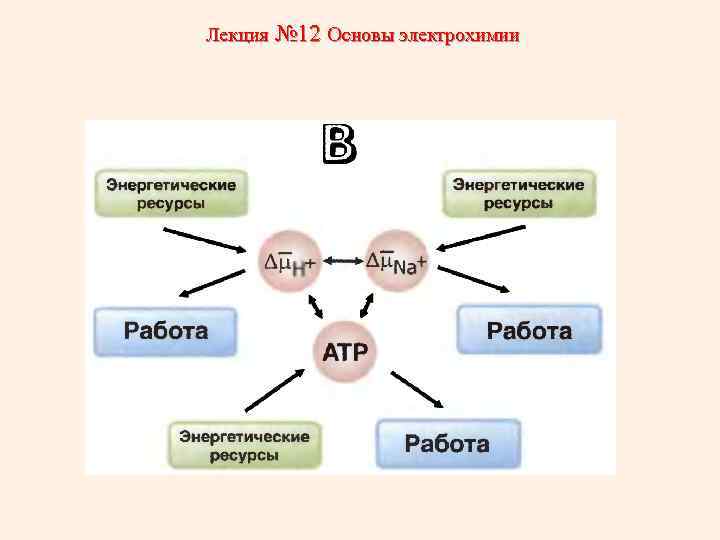 Лекция № 12 Основы электрохимии
Лекция № 12 Основы электрохимии
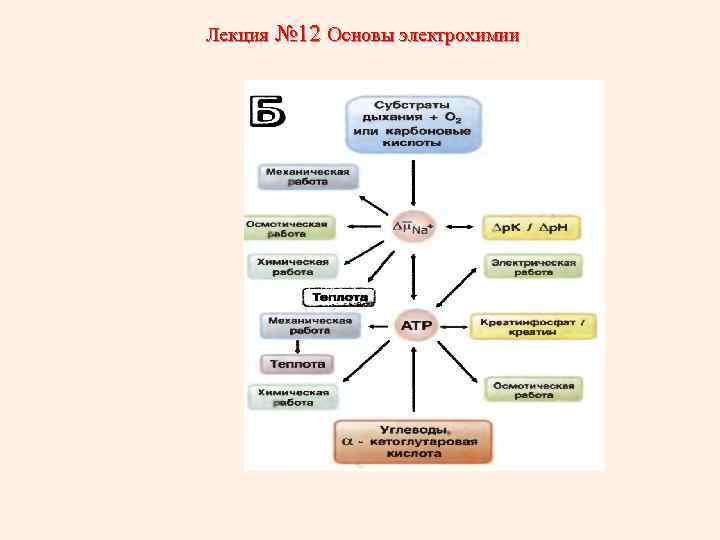 Лекция № 12 Основы электрохимии
Лекция № 12 Основы электрохимии
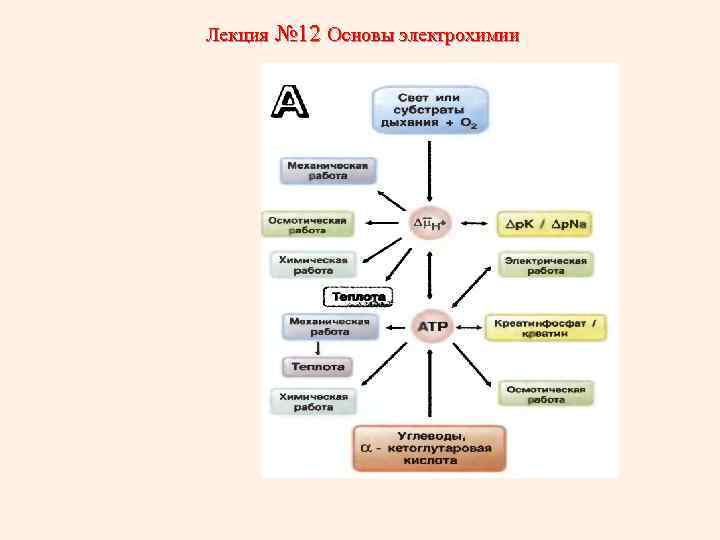 Лекция № 12 Основы электрохимии
Лекция № 12 Основы электрохимии
 Лекция № 12 Основы электрохимии
Лекция № 12 Основы электрохимии
 Лекция № 12 Основы электрохимии
Лекция № 12 Основы электрохимии
 Лекция № 12 Основы электрохимии
Лекция № 12 Основы электрохимии
 Лекция № 12 Основы электрохимии
Лекция № 12 Основы электрохимии
 Лекция № 12 Основы электрохимии
Лекция № 12 Основы электрохимии


