cлайд_к_лекц12.ppt
- Количество слайдов: 47
 Лекция № 12 Окислительно-восстановительные реакции 1. Cтепень окисления 2. Cущность ОВР 3. Важнейшие окислители и восстановители 4. Cоставление уравнений ОВР и подбор стехиометрических коэффициентов 5. Основные типы окислительно-восстановительных реакций 6. Влияние различных факторов на протекание ОВР 7. Окислительно-восстановительный эквивалент
Лекция № 12 Окислительно-восстановительные реакции 1. Cтепень окисления 2. Cущность ОВР 3. Важнейшие окислители и восстановители 4. Cоставление уравнений ОВР и подбор стехиометрических коэффициентов 5. Основные типы окислительно-восстановительных реакций 6. Влияние различных факторов на протекание ОВР 7. Окислительно-восстановительный эквивалент
 Cтепень окисления (CO) Степень окисления (CO) - это условный заряд атома в молекуле, вычисленный, исходя из предположения, что все связи в молекуле имеют ионный характер Обозначение CO: +I +VI -II K 2 Cr 2 O 7 или +1 +6 -2 K 2 Cr 2 O 7
Cтепень окисления (CO) Степень окисления (CO) - это условный заряд атома в молекуле, вычисленный, исходя из предположения, что все связи в молекуле имеют ионный характер Обозначение CO: +I +VI -II K 2 Cr 2 O 7 или +1 +6 -2 K 2 Cr 2 O 7
 В отличии от степени окисления заряд иона - величина реальная Обозначение заряда: катион железа (III) Fe 3+ сульфид-ион S 2 -
В отличии от степени окисления заряд иона - величина реальная Обозначение заряда: катион железа (III) Fe 3+ сульфид-ион S 2 -
 Основные правила определения CO 1. СO атомов в простых соединениях равна нулю 0 0 N 2 Me P 4 S 8 N N 2. СO атомов, образующих ионы, совпадает с их зарядом Mg 2+ S 2 - Mg+II S-II
Основные правила определения CO 1. СO атомов в простых соединениях равна нулю 0 0 N 2 Me P 4 S 8 N N 2. СO атомов, образующих ионы, совпадает с их зарядом Mg 2+ S 2 - Mg+II S-II
 3. Металлы всегда имеют положительную степень окисления (кроме простых веществ). СO металлов главных подгрупп равна номеру группы CO щелочных металлов (IA подгруппы) +1: +I KCl +I Fr. OH CO щелочноземельных металлов (IIA подгруппы), а также цинка и кадмия +2 +II Ca. SO 4 Sr(OH)2
3. Металлы всегда имеют положительную степень окисления (кроме простых веществ). СO металлов главных подгрупп равна номеру группы CO щелочных металлов (IA подгруппы) +1: +I KCl +I Fr. OH CO щелочноземельных металлов (IIA подгруппы), а также цинка и кадмия +2 +II Ca. SO 4 Sr(OH)2
 Степень окисления алюминия +3 СО металлов побочных подгрупп может принимать несколько значений +II Cr. O +III Cr 2 O 3 +VI Cr. O 3 4. Фтор имеет всегда степень окисления -1
Степень окисления алюминия +3 СО металлов побочных подгрупп может принимать несколько значений +II Cr. O +III Cr 2 O 3 +VI Cr. O 3 4. Фтор имеет всегда степень окисления -1
 5. Водород в соединениях имеет СО +I, -I Li. H но в гидридах металлов -I -I Ca. H 2 6. Кислород в соединениях проявляет СО -II, но: -I H 2 O 2 пероксид водорода • • H ( O O ) H +II OF 2 - фторид кислорода O O
5. Водород в соединениях имеет СО +I, -I Li. H но в гидридах металлов -I -I Ca. H 2 6. Кислород в соединениях проявляет СО -II, но: -I H 2 O 2 пероксид водорода • • H ( O O ) H +II OF 2 - фторид кислорода O O
 7. Максимальная положительная СО (или высшая СО) = номеру группы, в которой расположен элемент Минимальная СО = номеру группы минус 8 Все остальные встречающиеся СО элемента называются промежуточными Например: элемент хлор: высшая СО +VII, нисшая СО -I промежуточные СО 0 +I +III +V
7. Максимальная положительная СО (или высшая СО) = номеру группы, в которой расположен элемент Минимальная СО = номеру группы минус 8 Все остальные встречающиеся СО элемента называются промежуточными Например: элемент хлор: высшая СО +VII, нисшая СО -I промежуточные СО 0 +I +III +V
 Cтепень окисления может иметь дробное значение магнитный железняк Fe 3 O 4 CО железа = 8/3
Cтепень окисления может иметь дробное значение магнитный железняк Fe 3 O 4 CО железа = 8/3
 В сложных соединениях +V KNO 3 +VI Сr 2 O 72+V Li. Nb. O 3 углерод С CO азота: 1+х-6=0 CO хрома: 2 х - 14 = -2 х = +5 х=+6 +VI U 2 O 72 -IV 0 +II CH 4 C CO +IV CO 2 H 2 CO 3 Na 2 CO 3
В сложных соединениях +V KNO 3 +VI Сr 2 O 72+V Li. Nb. O 3 углерод С CO азота: 1+х-6=0 CO хрома: 2 х - 14 = -2 х = +5 х=+6 +VI U 2 O 72 -IV 0 +II CH 4 C CO +IV CO 2 H 2 CO 3 Na 2 CO 3
 Сущность ОВР (основные положения теории ОВР) Окислительно-восстановительными называют химические реакции, которые сопровождаются изменением степеней окисления элементов участвующих в реакции веществ Окисление – процесс потери электронов Восстановление – процесс приобретения электронов
Сущность ОВР (основные положения теории ОВР) Окислительно-восстановительными называют химические реакции, которые сопровождаются изменением степеней окисления элементов участвующих в реакции веществ Окисление – процесс потери электронов Восстановление – процесс приобретения электронов
 Окислитель - вещество, в состав которого входят атомы (или ионы), понижающие свою степень окисления. Окислитель принимает электроны, сам при этом восстанавливается. Восстановитель - вещество, в состав которого входят атомы (или ионы), повышающие свою степень окисления. Восстановитель отдает электроны, сам окисляется
Окислитель - вещество, в состав которого входят атомы (или ионы), понижающие свою степень окисления. Окислитель принимает электроны, сам при этом восстанавливается. Восстановитель - вещество, в состав которого входят атомы (или ионы), повышающие свою степень окисления. Восстановитель отдает электроны, сам окисляется
 На окислителе идет процесс восстановления, т. е. присоединения е атомом , молекулой или ионом Cl 2 + 2 е = 2 Сl- Fe 3+ + 1 e = Fe 2+ На восстановителе идет процесс окисления, т. е. процесс отдачи е атомом, молекулой или ионом Fe 2+ - 1 e = Fe 3+ 2 Cl- - 2 e = Cl 2
На окислителе идет процесс восстановления, т. е. присоединения е атомом , молекулой или ионом Cl 2 + 2 е = 2 Сl- Fe 3+ + 1 e = Fe 2+ На восстановителе идет процесс окисления, т. е. процесс отдачи е атомом, молекулой или ионом Fe 2+ - 1 e = Fe 3+ 2 Cl- - 2 e = Cl 2
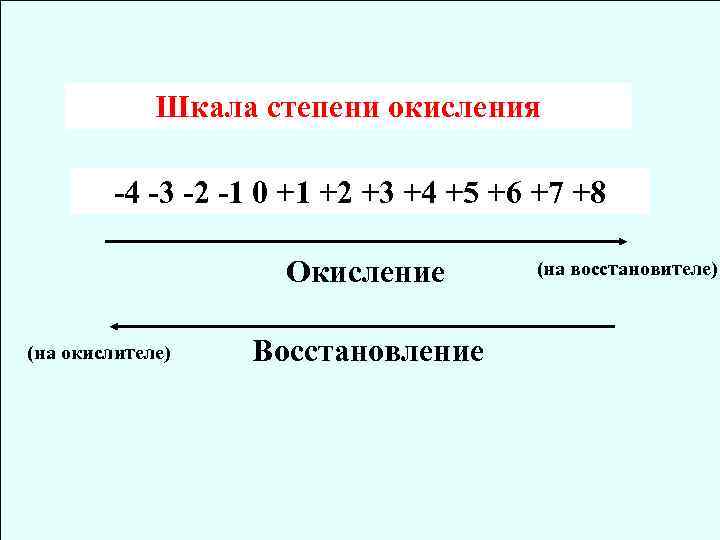 Шкала степени окисления -4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7 +8 Окисление (на окислителе) Восстановление (на восстановителе)
Шкала степени окисления -4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7 +8 Окисление (на окислителе) Восстановление (на восстановителе)
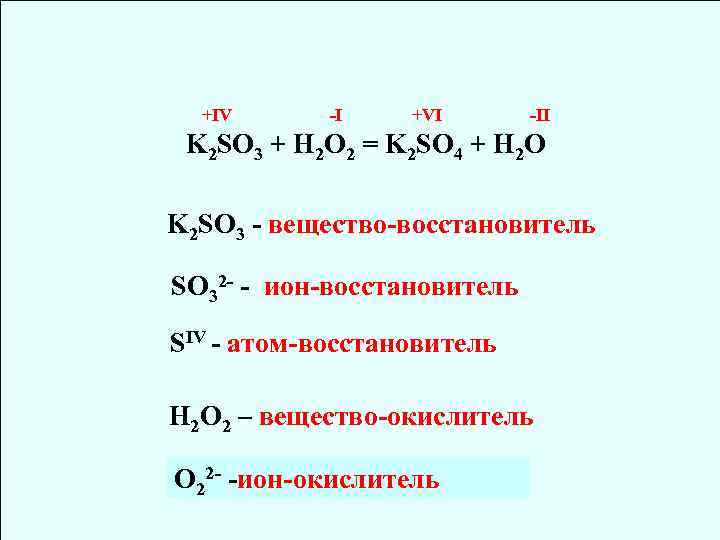 +IV -I +VI -II K 2 SO 3 + H 2 O 2 = K 2 SO 4 + H 2 O K 2 SO 3 - вещество-восстановитель SO 32 - - ион-восстановитель SIV - атом-восстановитель H 2 O 2 – вещество-окислитель О 22 - -ион-окислитель
+IV -I +VI -II K 2 SO 3 + H 2 O 2 = K 2 SO 4 + H 2 O K 2 SO 3 - вещество-восстановитель SO 32 - - ион-восстановитель SIV - атом-восстановитель H 2 O 2 – вещество-окислитель О 22 - -ион-окислитель
 Важнейшие окислители и восстановители Окислители: Галогены - F 2, Cl 2, Br 2 Кислород - О 2 (при повышенных температурах) +VII +VI +IV +V KMn. O 4, K 2 Cr 2 O 7, Pb. O 2, HNO 3, Катионы металлов более высокого заряда (более высокой степени окисления) : Fe 3+, Au 3+, Sn 4+
Важнейшие окислители и восстановители Окислители: Галогены - F 2, Cl 2, Br 2 Кислород - О 2 (при повышенных температурах) +VII +VI +IV +V KMn. O 4, K 2 Cr 2 O 7, Pb. O 2, HNO 3, Катионы металлов более высокого заряда (более высокой степени окисления) : Fe 3+, Au 3+, Sn 4+
 Восстановители: металлы Na, Ca, Zn, Al, неметаллы H 2, C, -II -I +II -III cложные вещества Na 2 S, KI, Sn. Cl 2, Fe(NO 3)2, NH 3, … Катионы металлов более низкой степени окисления: Fe 2+, Sn 2+
Восстановители: металлы Na, Ca, Zn, Al, неметаллы H 2, C, -II -I +II -III cложные вещества Na 2 S, KI, Sn. Cl 2, Fe(NO 3)2, NH 3, … Катионы металлов более низкой степени окисления: Fe 2+, Sn 2+
 Вещества с двойственной природой -I +IV +III H 2 O 2, SO 2, KNO 2, -I -II H 2 O 2 + KI+ H 2 SO 4 = H 2 O + I 2 + K 2 SO 4 окислитель -I 0 H 2 O 2 + KMn. O 4 + H 2 SO 4 = O 2 + Mn. SO 4 + K 2 SO 4 + H 2 O восстановитель
Вещества с двойственной природой -I +IV +III H 2 O 2, SO 2, KNO 2, -I -II H 2 O 2 + KI+ H 2 SO 4 = H 2 O + I 2 + K 2 SO 4 окислитель -I 0 H 2 O 2 + KMn. O 4 + H 2 SO 4 = O 2 + Mn. SO 4 + K 2 SO 4 + H 2 O восстановитель
 Составление уравнений ОВР и подбор стехиометрических коэффициентов 1. Метод электронного баланса Пример 1. Pb. S + O 2 = Pb. O + SO 2 (T ~ 1000 C) Последовательность операций: 1. Расставили степени окисления атомов, меняющих ее в процессе реакции -2 0 -2 +4 -2 Pb. S + O 2 = Pb. O + SO 2
Составление уравнений ОВР и подбор стехиометрических коэффициентов 1. Метод электронного баланса Пример 1. Pb. S + O 2 = Pb. O + SO 2 (T ~ 1000 C) Последовательность операций: 1. Расставили степени окисления атомов, меняющих ее в процессе реакции -2 0 -2 +4 -2 Pb. S + O 2 = Pb. O + SO 2
 2. Составляем электронный баланс O 20 + 4 e=2 O-II S-II - 6 e = SIV 3 ок-ль, процесс восстановления 2 вос-ль, процесс окисления 3 O 20 + 2 S-II =6 O-II +2 SIV 3. Подбираем стехиометрические коэффициенты остальных участников реакции 2 Pb. S + 3 O 2 = 2 Pb. O + 2 SO 2
2. Составляем электронный баланс O 20 + 4 e=2 O-II S-II - 6 e = SIV 3 ок-ль, процесс восстановления 2 вос-ль, процесс окисления 3 O 20 + 2 S-II =6 O-II +2 SIV 3. Подбираем стехиометрические коэффициенты остальных участников реакции 2 Pb. S + 3 O 2 = 2 Pb. O + 2 SO 2
 Пример 2. VI IV III VI K 2 Cr 2 O 7 + K 2 SO 3 + H 2 SO 4 = Cr 2(SO 4)3 + K 2 SO 4 + H 2 O 2 Cr. VI + 6 e = 2 Cr. III SIV - 2 е = SVI 1 ок-ль, процесс восстановления 3 вос-ль, процесс окисления 2 Сr. VI + 3 SIV = 2 Cr. III + 3 SVI K 2 Cr 2 O 7 + 3 K 2 SO 3 + 4 H 2 SO 4 = Cr 2(SO 4)3 + 4 K 2 SO 4 + 4 H 2 O
Пример 2. VI IV III VI K 2 Cr 2 O 7 + K 2 SO 3 + H 2 SO 4 = Cr 2(SO 4)3 + K 2 SO 4 + H 2 O 2 Cr. VI + 6 e = 2 Cr. III SIV - 2 е = SVI 1 ок-ль, процесс восстановления 3 вос-ль, процесс окисления 2 Сr. VI + 3 SIV = 2 Cr. III + 3 SVI K 2 Cr 2 O 7 + 3 K 2 SO 3 + 4 H 2 SO 4 = Cr 2(SO 4)3 + 4 K 2 SO 4 + 4 H 2 O
 2. Метод электронно-ионных полуреакций В этом методе принимают участие реальные частицы, существующие в растворе, и учитывается роль среды Пример 1. K 2 Cr 2 O 7 + K 2 SO 3 + H 2 SO 4 = Cr 2(SO 4)3 + K 2 SO 4 + H 2 O 1. Определяем степени окисления восстановителя и окислителя , а также продуктов их взаимодействия. Определяем среду VI IV III VI K 2 Cr 2 O 7 + K 2 SO 3 + H 2 SO 4 = Cr 2(SO 4)3 + K 2 SO 4 + H 2 O кислая среда
2. Метод электронно-ионных полуреакций В этом методе принимают участие реальные частицы, существующие в растворе, и учитывается роль среды Пример 1. K 2 Cr 2 O 7 + K 2 SO 3 + H 2 SO 4 = Cr 2(SO 4)3 + K 2 SO 4 + H 2 O 1. Определяем степени окисления восстановителя и окислителя , а также продуктов их взаимодействия. Определяем среду VI IV III VI K 2 Cr 2 O 7 + K 2 SO 3 + H 2 SO 4 = Cr 2(SO 4)3 + K 2 SO 4 + H 2 O кислая среда
 2. Ионная схема реакции - делим на ионы сильные электролиты +6 +4 Cr 2 O 72 - + SO 32 - + H+ +3 Cr 3+ + SO 42 - + H 2 O восстановление окислителя +6 +3 Cr 2 O 72 - 2 Cr 3+ окисление восстановителя +4 +6 SO 32 - SO 42 - +6
2. Ионная схема реакции - делим на ионы сильные электролиты +6 +4 Cr 2 O 72 - + SO 32 - + H+ +3 Cr 3+ + SO 42 - + H 2 O восстановление окислителя +6 +3 Cr 2 O 72 - 2 Cr 3+ окисление восстановителя +4 +6 SO 32 - SO 42 - +6
 Для составления полуреакций в кислой среде используем ионы водорода и молекулы воды 3. Составляем материальный баланc полуреакций окисления и восстановления Cr 2 O 72 - + 14 H+ 2 Cr 3+ + 7 H 2 O SO 32 - + H 2 O SO 42 - + 2 H+
Для составления полуреакций в кислой среде используем ионы водорода и молекулы воды 3. Составляем материальный баланc полуреакций окисления и восстановления Cr 2 O 72 - + 14 H+ 2 Cr 3+ + 7 H 2 O SO 32 - + H 2 O SO 42 - + 2 H+
 4. Составляем электронный баланс Cr 2 O 72 - + 14 H+ + 6 е 2 Cr 3+ + 7 H 2 O 1 SO 32 - + H 2 O - 2 е SO 42 - + 2 H+ 3
4. Составляем электронный баланс Cr 2 O 72 - + 14 H+ + 6 е 2 Cr 3+ + 7 H 2 O 1 SO 32 - + H 2 O - 2 е SO 42 - + 2 H+ 3
 5. Проводим суммирование полуреакций, умножая на соответствующие коэффициенты 4 8 Cr 2 O 72 - + 14 H+ + 3 SO 32 - + 3 H 2 O 2 Cr 3+ + 7 H 2 O + 3 SO 42 - + 6 H+ 6. Сокращенное ионное уравнение Cr 2 O 72 - + 8 H+ + 3 SO 32 - 2 Cr 3+ + 4 H 2 O + 3 SO 42 -
5. Проводим суммирование полуреакций, умножая на соответствующие коэффициенты 4 8 Cr 2 O 72 - + 14 H+ + 3 SO 32 - + 3 H 2 O 2 Cr 3+ + 7 H 2 O + 3 SO 42 - + 6 H+ 6. Сокращенное ионное уравнение Cr 2 O 72 - + 8 H+ + 3 SO 32 - 2 Cr 3+ + 4 H 2 O + 3 SO 42 -
 6. Молекулярное уравнение K 2 Cr 2 O 7 + 3 K 2 SO 3 + 4 H 2 SO 4 = Cr 2(SO 4)3 + 4 K 2 SO 4 + 4 H 2 O
6. Молекулярное уравнение K 2 Cr 2 O 7 + 3 K 2 SO 3 + 4 H 2 SO 4 = Cr 2(SO 4)3 + 4 K 2 SO 4 + 4 H 2 O









 Эквивалент. Закон эквивалентов Эквивалентом называют реальную или условную частицу, соответствующую одному электрону в ОВР, или одному протону (одному гидроксилу, одному единичному заряду) в обменной реакции.
Эквивалент. Закон эквивалентов Эквивалентом называют реальную или условную частицу, соответствующую одному электрону в ОВР, или одному протону (одному гидроксилу, одному единичному заряду) в обменной реакции.
 Окислитель и восстановитель реагируют между собой в отношении их эквивалентов Nок Vок = Nвосст Vвосст Число эквивалентов участников процесса есть постоянная величина n окислителя = n восстановителя
Окислитель и восстановитель реагируют между собой в отношении их эквивалентов Nок Vок = Nвосст Vвосст Число эквивалентов участников процесса есть постоянная величина n окислителя = n восстановителя
 Окислительно-восстановительный эквивалент Эквивалент окислителя - это такое количество окислителя, которое соответствует одному присоединенному электрону в данной реакции Э = Мr / z Мr - молекулярная масса окислителя z - число принятых одной молекулой электронов
Окислительно-восстановительный эквивалент Эквивалент окислителя - это такое количество окислителя, которое соответствует одному присоединенному электрону в данной реакции Э = Мr / z Мr - молекулярная масса окислителя z - число принятых одной молекулой электронов
 Эквивалент восстановителя - это такое количество восстановителя, которое соответствует одному отданному в данной реакции электрону Э = Мr / z Мr - молекулярная масса восстановителя z - число отданных одной молекулой электронов
Эквивалент восстановителя - это такое количество восстановителя, которое соответствует одному отданному в данной реакции электрону Э = Мr / z Мr - молекулярная масса восстановителя z - число отданных одной молекулой электронов
 Например: K 2 Cr 2 O 7 + K 2 SO 3 + H 2 SO 4 = Cr 2(SO 4)3 + K 2 SO 4 + H 2 O ок-ль Эок-ля = вос-ль Мrок-ля 6 Эвос-ля = Мrвос-ля 2
Например: K 2 Cr 2 O 7 + K 2 SO 3 + H 2 SO 4 = Cr 2(SO 4)3 + K 2 SO 4 + H 2 O ок-ль Эок-ля = вос-ль Мrок-ля 6 Эвос-ля = Мrвос-ля 2
 Электрохимический ряд напряжений металлов Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au Металлы расположены в порядке возрастания их стандартных электродных потенциалов
Электрохимический ряд напряжений металлов Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au Металлы расположены в порядке возрастания их стандартных электродных потенциалов
 Ряд напряжений характеризует химические свойства металлов: 1. Чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность Например: железо (φ° = - 0, 44) более сильный восстановитель, чем медь (φ° = + 0, 34) Но, катионы Cu 2+ в водном растворе более сильный окислитель, чем Fe 2+
Ряд напряжений характеризует химические свойства металлов: 1. Чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность Например: железо (φ° = - 0, 44) более сильный восстановитель, чем медь (φ° = + 0, 34) Но, катионы Cu 2+ в водном растворе более сильный окислитель, чем Fe 2+
 2. Каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые стоят в ряду напряжений металлов после него Fe + Cu. SO 4 → Fe. SO 4 + Cu ↓ Cu + 2 Ag. NO 3 → Cu(NO 3)2 + 2 Ag ↓ Исключение – щелочные и щелочно-земельные металлы
2. Каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые стоят в ряду напряжений металлов после него Fe + Cu. SO 4 → Fe. SO 4 + Cu ↓ Cu + 2 Ag. NO 3 → Cu(NO 3)2 + 2 Ag ↓ Исключение – щелочные и щелочно-земельные металлы
 3. Все металлы, имеющие отрицательный электродный потенциал, т. е. находящиеся в ряду напряжений металлов левее водорода, способны вытеснять его из растворов кислот (HCl, HBr, HI, H 3 PO 4, разбавленная H 2 SO 4) Fe + H 2 SO 4 → Fe. SO 4 + H 2 ↑; φ°Fe = -0, 44
3. Все металлы, имеющие отрицательный электродный потенциал, т. е. находящиеся в ряду напряжений металлов левее водорода, способны вытеснять его из растворов кислот (HCl, HBr, HI, H 3 PO 4, разбавленная H 2 SO 4) Fe + H 2 SO 4 → Fe. SO 4 + H 2 ↑; φ°Fe = -0, 44
 Все перечисленные положения справедливы также для окислительно-восстановительных систем Количественным критерием оценки возможности протекания окислительно-восстановительной реакции является положительное значение разности стандартных окислительно-восстановительных потенциалов полуреакций окисления и восстановления Электродвижущая сила реакции: E° = φ°окислителя - φ°восстановителя
Все перечисленные положения справедливы также для окислительно-восстановительных систем Количественным критерием оценки возможности протекания окислительно-восстановительной реакции является положительное значение разности стандартных окислительно-восстановительных потенциалов полуреакций окисления и восстановления Электродвижущая сила реакции: E° = φ°окислителя - φ°восстановителя
 Стандартные окислительно-восстановительные потенциалы для неметаллических систем, измеренные при 25 °С (298 К) (Ох +nе = R)
Стандартные окислительно-восстановительные потенциалы для неметаллических систем, измеренные при 25 °С (298 К) (Ох +nе = R)


