Лекция 12 дин и стат.ppt
- Количество слайдов: 29
 Лекция № 12 Динамические и статистические закономерности в природе
Лекция № 12 Динамические и статистические закономерности в природе
 1. 2. 3. 4. 5. ПЛАН Энергия. Становление теории теплоты Хаос и порядок в природе. Энтропия. Начала термодинамики. Самоорганизация в природе. Синергетика. Динамические и статистические закономерности в природе.
1. 2. 3. 4. 5. ПЛАН Энергия. Становление теории теплоты Хаос и порядок в природе. Энтропия. Начала термодинамики. Самоорганизация в природе. Синергетика. Динамические и статистические закономерности в природе.
 1. Энергия. Становление теории теплоты. ЭНЕРГИЯ – это способность совершать работу, мера различных форм движения. Это фундаментальное понятие современного естествознания, вошедшее в физику к середине 19 века. История открытия закона сохранения энергии была связана с изучением механического движения.
1. Энергия. Становление теории теплоты. ЭНЕРГИЯ – это способность совершать работу, мера различных форм движения. Это фундаментальное понятие современного естествознания, вошедшее в физику к середине 19 века. История открытия закона сохранения энергии была связана с изучением механического движения.
 При изучении сохранения механического движения ДЕКАРТ ввел понятие «количество движения» , а ЛЕЙБНИЦ – «живая сила» . Т. о, к 19 веку наука выработала представление об энергии в виде «живой силы» (активное начало движущегося тела) и «мертвой силы» (неподвижная, запасенная энергия). В современной структуре научного знания это соответствует кинетической и потенциальной энергии.
При изучении сохранения механического движения ДЕКАРТ ввел понятие «количество движения» , а ЛЕЙБНИЦ – «живая сила» . Т. о, к 19 веку наука выработала представление об энергии в виде «живой силы» (активное начало движущегося тела) и «мертвой силы» (неподвижная, запасенная энергия). В современной структуре научного знания это соответствует кинетической и потенциальной энергии.
 Затем были открыты и исследованы связи между механическим движением, теплотой, электричеством, химическими явлениями, магнетизмом и т. д. Результаты этих исследований привели к открытию закона сохранения и превращения энергии. Формирование понятия механической энергии было связано с формированием понятия механической работы. Была обнаружена связь между механической работой и теплотой.
Затем были открыты и исследованы связи между механическим движением, теплотой, электричеством, химическими явлениями, магнетизмом и т. д. Результаты этих исследований привели к открытию закона сохранения и превращения энергии. Формирование понятия механической энергии было связано с формированием понятия механической работы. Была обнаружена связь между механической работой и теплотой.
 Было замечено, что во всех случаях механической работы присутствует трение. Трение – тепловое явление, к которым относятся также любые явления изменения температуры тел, переход в разные фазовые состояния. Учение о тепловых явлениях начинает развиваться с середины 18 века. Толчком явилось изобретение термометра ГАЛИЛЕЕМ.
Было замечено, что во всех случаях механической работы присутствует трение. Трение – тепловое явление, к которым относятся также любые явления изменения температуры тел, переход в разные фазовые состояния. Учение о тепловых явлениях начинает развиваться с середины 18 века. Толчком явилось изобретение термометра ГАЛИЛЕЕМ.
 В истории развития взглядов на природу теплоты прослеживаются 2 направления: 1. Вещественная (теплородная) теория, в которой теплота рассматривалась как невесомая жидкость(теплород), способная перетекать от одного тела к другому. 2. Корпускулярная или кинетическая теория теплоты, которая связывает сущность тепловых явлений с движением атомов.
В истории развития взглядов на природу теплоты прослеживаются 2 направления: 1. Вещественная (теплородная) теория, в которой теплота рассматривалась как невесомая жидкость(теплород), способная перетекать от одного тела к другому. 2. Корпускулярная или кинетическая теория теплоты, которая связывает сущность тепловых явлений с движением атомов.
 Корпускулярной теории теплоты придерживались Ф. БЕКОН, И. НЬЮТОН, Р. ДЕКАРТ, Р. ГУК, М. ЛОМОНОСОВ. Большим числом опытов было показано, что тепловой жидкости не существует. Решающее значение имел опыт РУМФОРДА, связанный со сверлением пушечного ствола. Оказалось, что источник тепла неисчерпаем, поэтому он не может быть материальной субстанцией.
Корпускулярной теории теплоты придерживались Ф. БЕКОН, И. НЬЮТОН, Р. ДЕКАРТ, Р. ГУК, М. ЛОМОНОСОВ. Большим числом опытов было показано, что тепловой жидкости не существует. Решающее значение имел опыт РУМФОРДА, связанный со сверлением пушечного ствола. Оказалось, что источник тепла неисчерпаем, поэтому он не может быть материальной субстанцией.
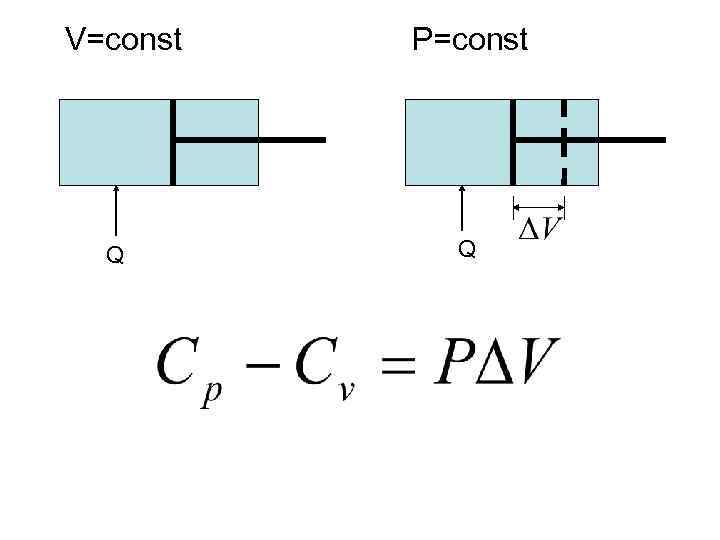
 К середине 19 века была установлена связь между механической работой и количеством теплоты. В 1842 г. немецкий врач Р. МАЙЕР нашел механический эквивалент теплоты т. е МАЙЕР первым сформулировал ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ. Он определил, что теплоемкость при постоянном давлении ( ) всегда больше теплоемкости при постоянном объеме ( ).
К середине 19 века была установлена связь между механической работой и количеством теплоты. В 1842 г. немецкий врач Р. МАЙЕР нашел механический эквивалент теплоты т. е МАЙЕР первым сформулировал ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ. Он определил, что теплоемкость при постоянном давлении ( ) всегда больше теплоемкости при постоянном объеме ( ).
 V=const Q P=const Q
V=const Q P=const Q
 Нагревание при V=const идет только на увеличение внутренней энергии, а при p=const такое же увеличение внутренней энергии сопровождается совершением механической работы. Сопоставив разницу с величиной совершенной работы, можно получить механический эквивалент теплоты (м. э. т. ).
Нагревание при V=const идет только на увеличение внутренней энергии, а при p=const такое же увеличение внутренней энергии сопровождается совершением механической работы. Сопоставив разницу с величиной совершенной работы, можно получить механический эквивалент теплоты (м. э. т. ).
 Затем ДЖОУЛЬ с высокой степенью точности определил м. э. т. 1 ккал = 4, 19 кдж Итак, теплота есть движение. Теплота и работа – это способы передачи энергии. Значительный вклад в развитие теории теплоты внесли КЛАУЗИУС, МАКСВЕЛЛ, БОЛЬЦМАН. История открытия закона сохранения и превращения энергии привела к изучению тепловых явлений в двух направлениях – ТЕРМОДИНАМИЧЕСКОМ и СТАТИСТИЧЕСКОМ.
Затем ДЖОУЛЬ с высокой степенью точности определил м. э. т. 1 ккал = 4, 19 кдж Итак, теплота есть движение. Теплота и работа – это способы передачи энергии. Значительный вклад в развитие теории теплоты внесли КЛАУЗИУС, МАКСВЕЛЛ, БОЛЬЦМАН. История открытия закона сохранения и превращения энергии привела к изучению тепловых явлений в двух направлениях – ТЕРМОДИНАМИЧЕСКОМ и СТАТИСТИЧЕСКОМ.
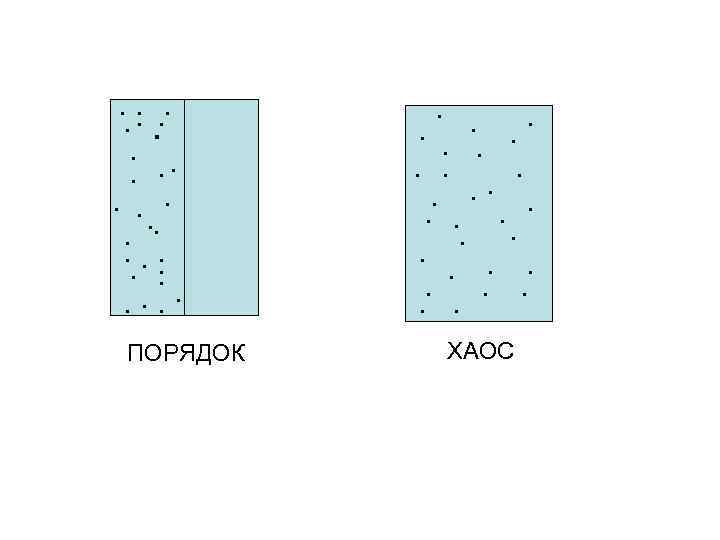
 2. Порядок и хаос в природе. Энтропия. В природе любое явление есть сложная комбинация порядка и хаоса. Пример порядка – созданные природой минералы, сооружения, построенные человеком. Системы, состоящие из большого числа частиц, например, молекулярные, характеризуются беспорядочным перемешиванием всех молекул, полным усреднением всех характеристик т. е ХАОСОМ.
2. Порядок и хаос в природе. Энтропия. В природе любое явление есть сложная комбинация порядка и хаоса. Пример порядка – созданные природой минералы, сооружения, построенные человеком. Системы, состоящие из большого числа частиц, например, молекулярные, характеризуются беспорядочным перемешиванием всех молекул, полным усреднением всех характеристик т. е ХАОСОМ.
 Затратив работу, мы можем упорядочить молекулярную смесь, например, разделить воздух на кислород и азот (это порядок). Случайность, хаотичность характерны для многих других явлений – эпидемии, поведение толпы людей, электрическая активность нервной клетки… В физике очень важным является понятие обратимых и необратимых процессов. Все законы классической механики обратимы. Термодинамические процессы (переход тепла от горячего тела к холодному, расширение газа в пустоту) являются необратимыми.
Затратив работу, мы можем упорядочить молекулярную смесь, например, разделить воздух на кислород и азот (это порядок). Случайность, хаотичность характерны для многих других явлений – эпидемии, поведение толпы людей, электрическая активность нервной клетки… В физике очень важным является понятие обратимых и необратимых процессов. Все законы классической механики обратимы. Термодинамические процессы (переход тепла от горячего тела к холодному, расширение газа в пустоту) являются необратимыми.
 . . . . ПОРЯДОК . . . . ХАОС
. . . . ПОРЯДОК . . . . ХАОС
 Это объясняется тем, что всякая предоставленная самой себе система стремится перейти от порядка в состояние равновесия, хаоса. Достигнув этого состояния система сама по себе из него не выходит.
Это объясняется тем, что всякая предоставленная самой себе система стремится перейти от порядка в состояние равновесия, хаоса. Достигнув этого состояния система сама по себе из него не выходит.
 Пусть в сосуде находится N молекул. Вероятность нахождения в одной половине сосуда: ½ - для одной молекулы ½*½=¼= - для 2 -х молекул ½ * ½= – для 3 -х молекул ……………………………………… - для N молекул
Пусть в сосуде находится N молекул. Вероятность нахождения в одной половине сосуда: ½ - для одной молекулы ½*½=¼= - для 2 -х молекул ½ * ½= – для 3 -х молекул ……………………………………… - для N молекул
 Таким образом, вероятность нахождения всех молекул в одной половине будет ничтожно мала. Вероятность же того, что все молекулы находятся во всем объеме сосуда (т. е состояние беспорядка, хаоса) максимальна. Любое отклонение от хаоса связано с уменьшением вероятности.
Таким образом, вероятность нахождения всех молекул в одной половине будет ничтожно мала. Вероятность же того, что все молекулы находятся во всем объеме сосуда (т. е состояние беспорядка, хаоса) максимальна. Любое отклонение от хаоса связано с уменьшением вероятности.
 В 1865 году КЛАУЗИУС ввел новое понятие – «ЭНТРОПИЯ» . Он показал, что существует некоторая величина S, которая подобно энергии, давлению, температуре характеризует состояние газа. Когда к газу подводится теплота , то S возрастает на величину:
В 1865 году КЛАУЗИУС ввел новое понятие – «ЭНТРОПИЯ» . Он показал, что существует некоторая величина S, которая подобно энергии, давлению, температуре характеризует состояние газа. Когда к газу подводится теплота , то S возрастает на величину:
 T t Фазовый переход
T t Фазовый переход
 Связь между энтропией и вероятностным поведением молекул впервые увидел БОЛЬЦМАН. Всякое макроскопическое состояние может быть осуществлено различными микроскопическими способами. Число различных микросостояний, соответствующих данному макросостоянию, называется статистическим весом или термодинамической вероятностью макросостояния W.
Связь между энтропией и вероятностным поведением молекул впервые увидел БОЛЬЦМАН. Всякое макроскопическое состояние может быть осуществлено различными микроскопическими способами. Число различных микросостояний, соответствующих данному макросостоянию, называется статистическим весом или термодинамической вероятностью макросостояния W.
 Энтропия вероятность выражается где К – постоянная Больцмана. через
Энтропия вероятность выражается где К – постоянная Больцмана. через
 Поскольку в состоянии равновесия W – максимальна (т. к это состояние наиболее вероятно, оно достигается усреднением всех характеристик системы, беспорядочным распределением молекул), то S – тоже Значит S характеризует меру хаоса, беспорядка. максимальна.
Поскольку в состоянии равновесия W – максимальна (т. к это состояние наиболее вероятно, оно достигается усреднением всех характеристик системы, беспорядочным распределением молекул), то S – тоже Значит S характеризует меру хаоса, беспорядка. максимальна.
 Если энергия – это мера возможности системы совершить полезную работу, то энтропия – это мера качества энергии т. е реальной способности ее произвести работу без привлечения внешнего воздействия. Качество энергии снижается при ее рассеянии, переходе в тепло. Одним из основных принципов природы является принцип минимума производства S.
Если энергия – это мера возможности системы совершить полезную работу, то энтропия – это мера качества энергии т. е реальной способности ее произвести работу без привлечения внешнего воздействия. Качество энергии снижается при ее рассеянии, переходе в тепло. Одним из основных принципов природы является принцип минимума производства S.
 Производством энтропии называют приращение энтропии системы в единицу времени. Эволюция системы в новое состояние происходит так, что процесс характеризуется минимальным производством энтропии.
Производством энтропии называют приращение энтропии системы в единицу времени. Эволюция системы в новое состояние происходит так, что процесс характеризуется минимальным производством энтропии.
 Энтропия - величина сохраняющаяся в обратимых процессах ∆S=0. В необратимых процессах энтропия возрастает ∆S>0. Все естественные процессы идут от порядка к хаосу т. е в ходе эволюции системы теряется информация о ее структуре. Существует энтропия: 1. Тепловая (термодинамическая) 2. Структурная 3. Информационная
Энтропия - величина сохраняющаяся в обратимых процессах ∆S=0. В необратимых процессах энтропия возрастает ∆S>0. Все естественные процессы идут от порядка к хаосу т. е в ходе эволюции системы теряется информация о ее структуре. Существует энтропия: 1. Тепловая (термодинамическая) 2. Структурная 3. Информационная
 Структурная S служит мерой неупорядоченности строения систем. Информационная S – мера неопределенности сообщения. В противоположность энтропии в науку введено понятие отрицательной (негативной) энтропии негэнтропии (Sнег). Например, процессы жизнедеятельности обладают отрицательным приростом энтропии ∆S< 0.
Структурная S служит мерой неупорядоченности строения систем. Информационная S – мера неопределенности сообщения. В противоположность энтропии в науку введено понятие отрицательной (негативной) энтропии негэнтропии (Sнег). Например, процессы жизнедеятельности обладают отрицательным приростом энтропии ∆S< 0.
 В настоящее время негэнтропия трактуется как информация.
В настоящее время негэнтропия трактуется как информация.



