2010 ЛЕКЦИЯ 11 КОМПЛЕКСЫ.ppt
- Количество слайдов: 21
 ЛЕКЦИЯ 11 Комплексные соединения
ЛЕКЦИЯ 11 Комплексные соединения
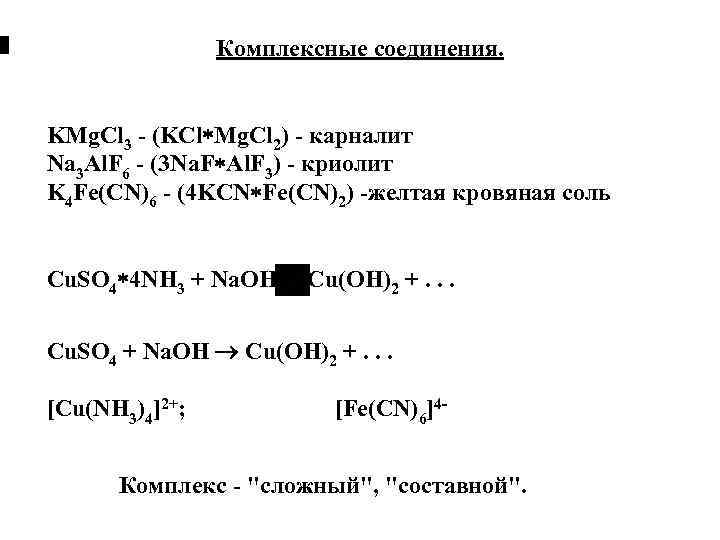 Комплексные соединения. KMg. Cl 3 - (KCl Mg. Cl 2) - карналит Na 3 Al. F 6 - (3 Na. F Al. F 3) - криолит K 4 Fe(CN)6 - (4 KCN Fe(CN)2) -желтая кровяная соль Cu. SO 4 4 NH 3 + Na. OH Cu(OH)2 +. . . Cu. SO 4 + Na. OH Cu(OH)2 +. . . [Cu(NH 3)4]2+; [Fe(CN)6]4 - Комплекс - "сложный", "составной".
Комплексные соединения. KMg. Cl 3 - (KCl Mg. Cl 2) - карналит Na 3 Al. F 6 - (3 Na. F Al. F 3) - криолит K 4 Fe(CN)6 - (4 KCN Fe(CN)2) -желтая кровяная соль Cu. SO 4 4 NH 3 + Na. OH Cu(OH)2 +. . . Cu. SO 4 + Na. OH Cu(OH)2 +. . . [Cu(NH 3)4]2+; [Fe(CN)6]4 - Комплекс - "сложный", "составной".
 Комплексом или комплексной частицей называется группа атомов, в которой число частиц, присоединенных к центральному атому или их суммарная валентность превышает валентность центрального атома. Центральный атом - комплексообразователь. Атомы, ионы или молекулы, присоединенные к центральному атому - лиганды.
Комплексом или комплексной частицей называется группа атомов, в которой число частиц, присоединенных к центральному атому или их суммарная валентность превышает валентность центрального атома. Центральный атом - комплексообразователь. Атомы, ионы или молекулы, присоединенные к центральному атому - лиганды.
 Количество лигандов, непосредственно связанных с центральным атомом, называется координационным числом, а совокупность центрального атома и непосредственно присоединенных к нему лигандов - координационной сферой, которую выделяют квадратными скобками: [Ag(NH 3)2]+.
Количество лигандов, непосредственно связанных с центральным атомом, называется координационным числом, а совокупность центрального атома и непосредственно присоединенных к нему лигандов - координационной сферой, которую выделяют квадратными скобками: [Ag(NH 3)2]+.
 Комплексные частицы существуют как единое целое и в кристаллических веществах, и в растворах. Степень окисления комплексообразователя, а также заряд лигандов в комплексе, остаются теми же, что и в свободном состоянии. Заряд комплексной частицы - сумма зарядов входящих в нее атомов. Связь между координационной и внешней сферами ионная.
Комплексные частицы существуют как единое целое и в кристаллических веществах, и в растворах. Степень окисления комплексообразователя, а также заряд лигандов в комплексе, остаются теми же, что и в свободном состоянии. Заряд комплексной частицы - сумма зарядов входящих в нее атомов. Связь между координационной и внешней сферами ионная.
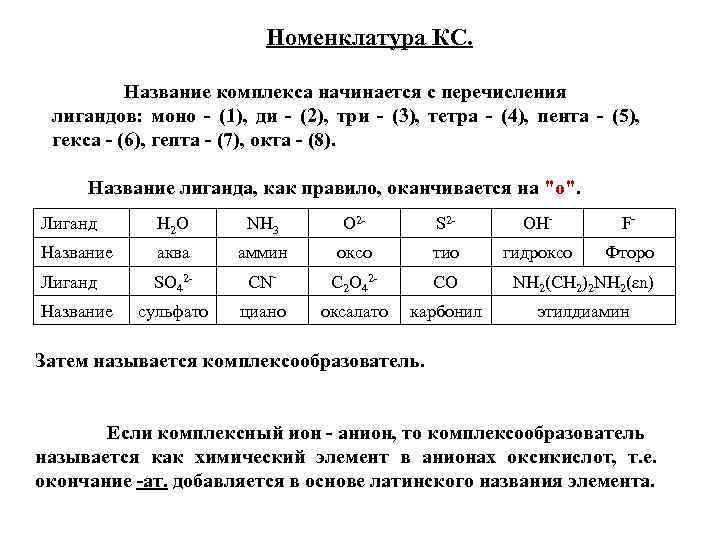 Номенклатура КС. Название комплекса начинается с перечисления лигандов: моно - (1), ди - (2), три - (3), тетра - (4), пента - (5), гекса - (6), гепта - (7), окта - (8). Название лиганда, как правило, оканчивается на "о". Лиганд H 2 O NH 3 О 2 - S 2 - OH- F- Название аква аммин оксо тио гидроксо Фторо Лиганд SO 42 - CN- C 2 O 42 - CO NH 2(CH 2)2 NH 2(εn) сульфато циано оксалато карбонил этилдиамин Название Затем называется комплексообразователь. Если комплексный ион - анион, то комплексообразователь называется как химический элемент в анионах оксикислот, т. е. окончание -ат. добавляется в основе латинского названия элемента.
Номенклатура КС. Название комплекса начинается с перечисления лигандов: моно - (1), ди - (2), три - (3), тетра - (4), пента - (5), гекса - (6), гепта - (7), окта - (8). Название лиганда, как правило, оканчивается на "о". Лиганд H 2 O NH 3 О 2 - S 2 - OH- F- Название аква аммин оксо тио гидроксо Фторо Лиганд SO 42 - CN- C 2 O 42 - CO NH 2(CH 2)2 NH 2(εn) сульфато циано оксалато карбонил этилдиамин Название Затем называется комплексообразователь. Если комплексный ион - анион, то комплексообразователь называется как химический элемент в анионах оксикислот, т. е. окончание -ат. добавляется в основе латинского названия элемента.
![K 2[SO 4] - тетраоксосульфат (VI) калия. Na 2[SO 3] - триоксосульфат (IV) натрия. K 2[SO 4] - тетраоксосульфат (VI) калия. Na 2[SO 3] - триоксосульфат (IV) натрия.](https://present5.com/presentation/3/14143876_40806080.pdf-img/14143876_40806080.pdf-7.jpg) K 2[SO 4] - тетраоксосульфат (VI) калия. Na 2[SO 3] - триоксосульфат (IV) натрия. K 3[Fe(CN)6] - гексацианоферрат (III) калия. K 4[Fe(CN)6] - гексацианоферрат (II) калия. K[Ag(CN)2] - дицианоаргентат калия. Название комплексообразователя в катионном комплексерусское название элемента в родительном падеже. [Cr(NH 3)6]Cl 3 - хлорид гексааминхрома (III) [Co(H 2 O)6]SO 4 - сульфат гексааквакобальта (II) [Cr(NH 3)6][Co(CN)6] - гексацианокобальтат (III) гексааминхрома (III) [Co(NH 3)5 Cl]SO 4 - сульфат хлоропентааминкобальта(III)
K 2[SO 4] - тетраоксосульфат (VI) калия. Na 2[SO 3] - триоксосульфат (IV) натрия. K 3[Fe(CN)6] - гексацианоферрат (III) калия. K 4[Fe(CN)6] - гексацианоферрат (II) калия. K[Ag(CN)2] - дицианоаргентат калия. Название комплексообразователя в катионном комплексерусское название элемента в родительном падеже. [Cr(NH 3)6]Cl 3 - хлорид гексааминхрома (III) [Co(H 2 O)6]SO 4 - сульфат гексааквакобальта (II) [Cr(NH 3)6][Co(CN)6] - гексацианокобальтат (III) гексааминхрома (III) [Co(NH 3)5 Cl]SO 4 - сульфат хлоропентааминкобальта(III)
 Изомерия КС. Изомеры - вещества, имеющие одинаковый состав, но различающиеся строением и, следовательно, свойствами. • Изомерия возникает, когда ионы или молекулы могут замещать друга в координационной сфере. а) [Cr(H 2 O)6]Cl 3, [Cr(H 2 O)5 Cl]Cl 2 H 2 O, [Cr(H 2 O)4 Cl 2]Cl 2 H 2 O - сольватная (гидратная) изомерия. б) [Co(NH 3)5 Br]SO 4, [Co(NH 3)5 SO 4]Br- ионизационная изомерия. в) [Co(NH 3)6][Cr(CN)6], [Cr(NH 3)6][Co(CN)6] -координационная изомерия.
Изомерия КС. Изомеры - вещества, имеющие одинаковый состав, но различающиеся строением и, следовательно, свойствами. • Изомерия возникает, когда ионы или молекулы могут замещать друга в координационной сфере. а) [Cr(H 2 O)6]Cl 3, [Cr(H 2 O)5 Cl]Cl 2 H 2 O, [Cr(H 2 O)4 Cl 2]Cl 2 H 2 O - сольватная (гидратная) изомерия. б) [Co(NH 3)5 Br]SO 4, [Co(NH 3)5 SO 4]Br- ионизационная изомерия. в) [Co(NH 3)6][Cr(CN)6], [Cr(NH 3)6][Co(CN)6] -координационная изомерия.
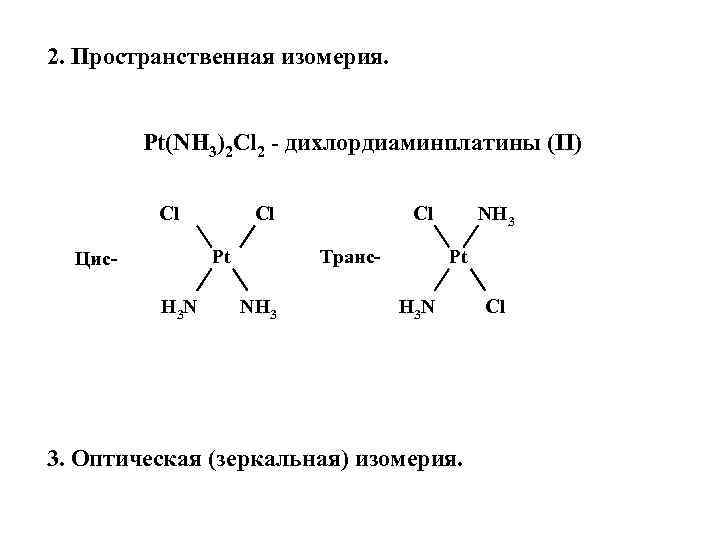 2. Пространственная изомерия. Pt(NH 3)2 Cl 2 - дихлордиаминплатины (II) Cl Cl Pt Цис. H 3 N Cl Транс- NH 3 Pt H 3 N 3. Оптическая (зеркальная) изомерия. Cl
2. Пространственная изомерия. Pt(NH 3)2 Cl 2 - дихлордиаминплатины (II) Cl Cl Pt Цис. H 3 N Cl Транс- NH 3 Pt H 3 N 3. Оптическая (зеркальная) изомерия. Cl
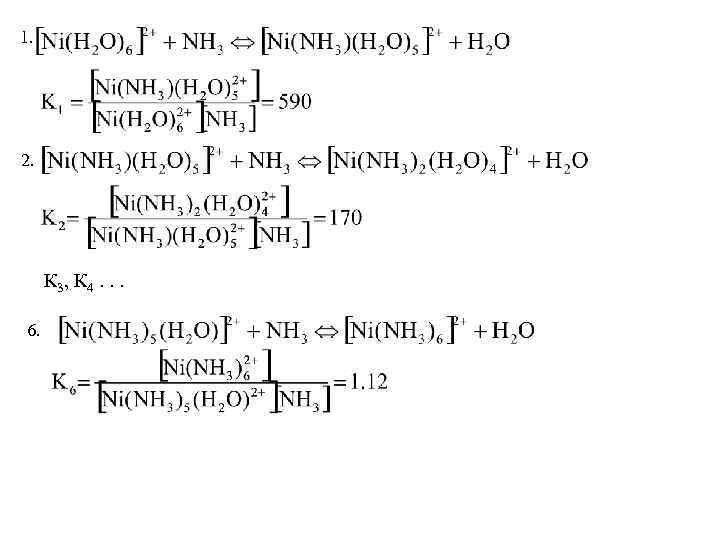 1. 2. К 3, К 4. . . 6.
1. 2. К 3, К 4. . . 6.
 Суммарный процесс Константа равновесия суммарного процесса называется константой устойчивости комплекса – b.
Суммарный процесс Константа равновесия суммарного процесса называется константой устойчивости комплекса – b.
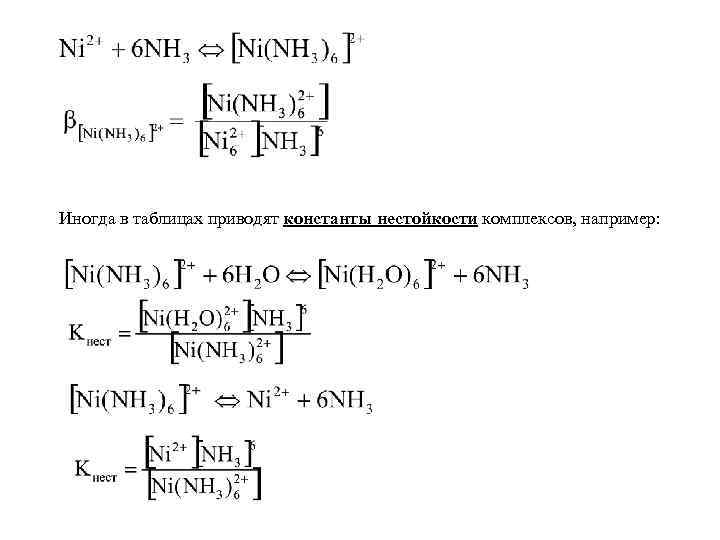 Иногда в таблицах приводят константы нестойкости комплексов, например:
Иногда в таблицах приводят константы нестойкости комплексов, например:
 или
или
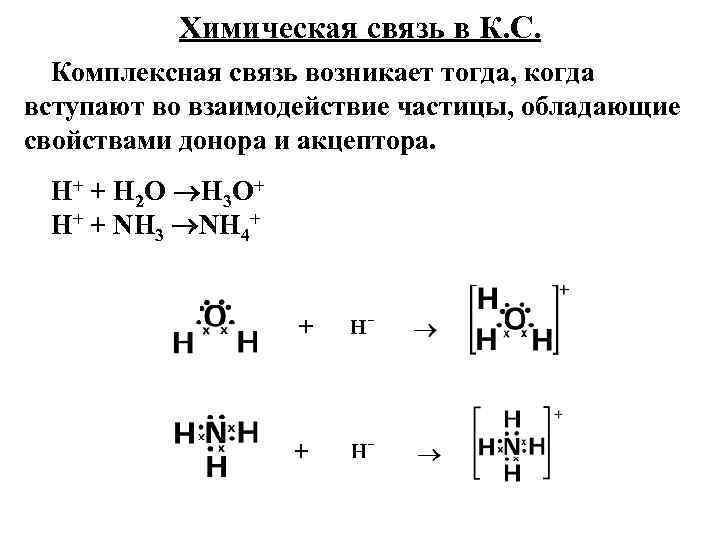 Химическая связь в К. С. Комплексная связь возникает тогда, когда вступают во взаимодействие частицы, обладающие свойствами донора и акцептора. Н+ + Н 2 О Н 3 О+ Н+ + NН 3 NН 4+
Химическая связь в К. С. Комплексная связь возникает тогда, когда вступают во взаимодействие частицы, обладающие свойствами донора и акцептора. Н+ + Н 2 О Н 3 О+ Н+ + NН 3 NН 4+
 Согласно МВС каждый лиганд является донором электронов. Он размещает свои электронные пары на свободных орбиталях центрального иона металла. По силе лиганды располагаются в ряд: CO, CN- NO 2 - NH 3 NCS- OH 2 OH- F- Cl- Br- I-
Согласно МВС каждый лиганд является донором электронов. Он размещает свои электронные пары на свободных орбиталях центрального иона металла. По силе лиганды располагаются в ряд: CO, CN- NO 2 - NH 3 NCS- OH 2 OH- F- Cl- Br- I-

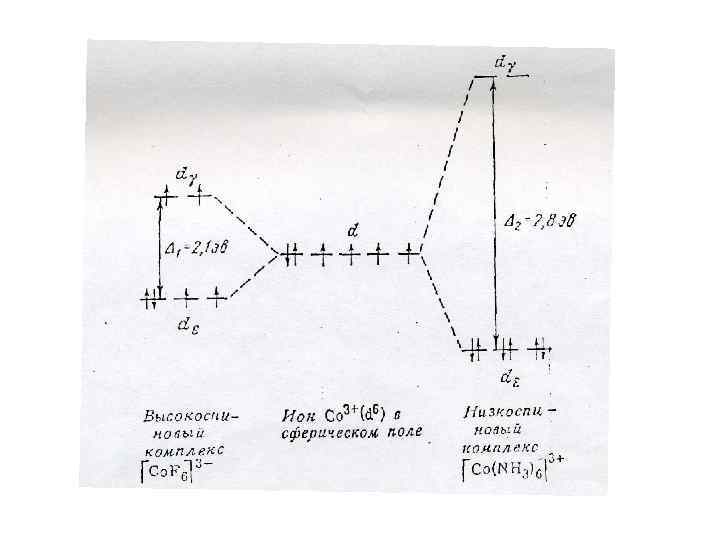
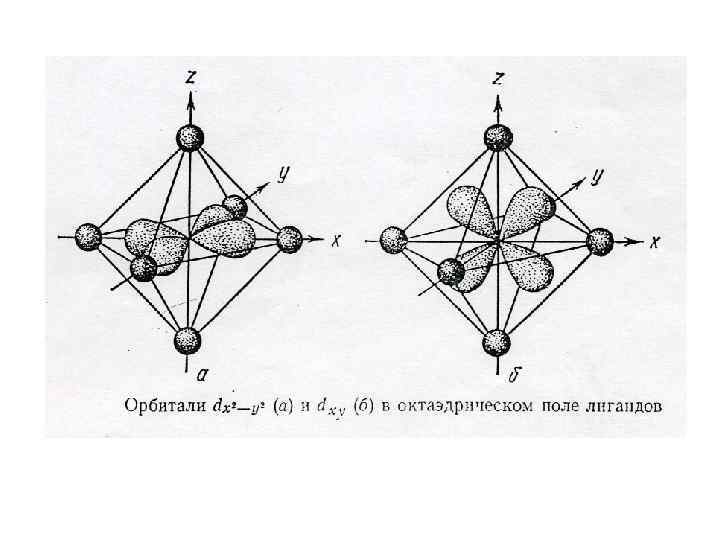
 В пространстве шесть равноценных орбиталей могут располагаться одним единственным образом - в направлении вершин октаэдра. Лиганды Н 2 О и F- - слабые лиганды. Под действием слабых лигандов электроны нижележащего уровня не спариваются, и поэтому ион железа находится в высокоспиновом состоянии. (Внешнеорбитальные комплексы. )
В пространстве шесть равноценных орбиталей могут располагаться одним единственным образом - в направлении вершин октаэдра. Лиганды Н 2 О и F- - слабые лиганды. Под действием слабых лигандов электроны нижележащего уровня не спариваются, и поэтому ион железа находится в высокоспиновом состоянии. (Внешнеорбитальные комплексы. )
 Лиганд CN- - сильный и, благодаря своему сильному полю вытесняет одиночные электроны на соседние орбитали.
Лиганд CN- - сильный и, благодаря своему сильному полю вытесняет одиночные электроны на соседние орбитали.
 У иона Fe 2+ две освободившиеся 3 d-орбитали, одна 4 s- и три 4 p-орбитали способны принять шесть пар электронов от доноров - лигандов CN-. Все образовавшиеся шесть связей равноценны, что указывает на d 2 sp 3 - гибридизацию. Комплексы, в которых комплексообразователь отдает для связи внутренние орбитали, называются внутриорбитальными. В этих комплексах ион Fe 2+ не имеет неспаренных электронов и находится в низкоспиновом состоянии.
У иона Fe 2+ две освободившиеся 3 d-орбитали, одна 4 s- и три 4 p-орбитали способны принять шесть пар электронов от доноров - лигандов CN-. Все образовавшиеся шесть связей равноценны, что указывает на d 2 sp 3 - гибридизацию. Комплексы, в которых комплексообразователь отдает для связи внутренние орбитали, называются внутриорбитальными. В этих комплексах ион Fe 2+ не имеет неспаренных электронов и находится в низкоспиновом состоянии.