Лекции 11,12.pptx-825268168.pptx
- Количество слайдов: 43
 Лекция № 11, 12 Статистическое описание системы частиц. 1. Основные понятия статистической физики. 2. Элементарные сведения из теории вероятностей. 2. 1. Основные понятия. 2. 2. Количественные характеристики. 2. 3. Функция распределения (плотность вероятности). 3. Распределение молекул по скоростям – распределение Максвелла. 3. 1. Функция распределения по компонентам скоростей. 3. 2. Функция распределения по модулям скорости. 3. 3. Характерные скорости. 4. Распределение в поле сил тяжести. Барометрическая формула. 5. Распределение Больцмана. 6. Распределение Максвелла – Больцмана.
Лекция № 11, 12 Статистическое описание системы частиц. 1. Основные понятия статистической физики. 2. Элементарные сведения из теории вероятностей. 2. 1. Основные понятия. 2. 2. Количественные характеристики. 2. 3. Функция распределения (плотность вероятности). 3. Распределение молекул по скоростям – распределение Максвелла. 3. 1. Функция распределения по компонентам скоростей. 3. 2. Функция распределения по модулям скорости. 3. 3. Характерные скорости. 4. Распределение в поле сил тяжести. Барометрическая формула. 5. Распределение Больцмана. 6. Распределение Максвелла – Больцмана.
 Основные понятия статистической физики. Рассмотрим тепловые процессы с точки зрения представления об атомарно-молекулярном строении вещества. В воздуха содержится молекул. Как описать состояние такого количества молекул? Метод классической механики требует знания координат и скоростей частиц в каждый момент времени. Для этого надо записать уравнения движения (2 -ой закон Ньютона) для каждой молекулы. Состояние, описанное так детально, называется микросостоянием, а закон Ньютона – динамическим законом. Но оказывается системы, состоящие из такого большого числа частиц, подчиняются другим закономерностям.
Основные понятия статистической физики. Рассмотрим тепловые процессы с точки зрения представления об атомарно-молекулярном строении вещества. В воздуха содержится молекул. Как описать состояние такого количества молекул? Метод классической механики требует знания координат и скоростей частиц в каждый момент времени. Для этого надо записать уравнения движения (2 -ой закон Ньютона) для каждой молекулы. Состояние, описанное так детально, называется микросостоянием, а закон Ньютона – динамическим законом. Но оказывается системы, состоящие из такого большого числа частиц, подчиняются другим закономерностям.
 Эти закономерности называются статистическими или вероятностными. Они не свойственны отдельным атомам и молекулам. Для их описания используется математический аппарат теории вероятностей. Элементарные сведения из теории вероятностей. Основные понятия. 1. Событие (случай) – явление, относительно которого можно ставить вопрос: может оно произойти или нет. Пример. В ящике 100 шаров: 30 белых, 30 красных, 40 черных). Вынимаем шар, он белый – это событие. 2. Случайное событие. Вынули белый шар – случайное событие.
Эти закономерности называются статистическими или вероятностными. Они не свойственны отдельным атомам и молекулам. Для их описания используется математический аппарат теории вероятностей. Элементарные сведения из теории вероятностей. Основные понятия. 1. Событие (случай) – явление, относительно которого можно ставить вопрос: может оно произойти или нет. Пример. В ящике 100 шаров: 30 белых, 30 красных, 40 черных). Вынимаем шар, он белый – это событие. 2. Случайное событие. Вынули белый шар – случайное событие.
 3. Достоверное событие – событие, которое обязательно произойдет. В ящике остались только белые шары. Вынимание белого шара – достоверное событие. 4. Невозможное событие – событие, которое никогда не произойдет. Из ящика, в котором остались только белые шары вынимание красного шара – невозможное событие. 5. Равновероятные события – события, при которых нет никаких оснований ожидать, что одно из них будет появляться чаще другого. Вынимание белого или красного шаров из полного ящика из 100 шаров – равновероятные события.
3. Достоверное событие – событие, которое обязательно произойдет. В ящике остались только белые шары. Вынимание белого шара – достоверное событие. 4. Невозможное событие – событие, которое никогда не произойдет. Из ящика, в котором остались только белые шары вынимание красного шара – невозможное событие. 5. Равновероятные события – события, при которых нет никаких оснований ожидать, что одно из них будет появляться чаще другого. Вынимание белого или красного шаров из полного ящика из 100 шаров – равновероятные события.
 Количественные характеристики. Вероятность случайного события – количественная мера ожидаемой возможности появления этого события. - общее число опытов, - число опытов с благоприятным исходом (реализуемое событие); . Возможно и другое определение вероятности: вероятность равна отношению числа опытов с благоприятным исходом к общему числу опытов.
Количественные характеристики. Вероятность случайного события – количественная мера ожидаемой возможности появления этого события. - общее число опытов, - число опытов с благоприятным исходом (реализуемое событие); . Возможно и другое определение вероятности: вероятность равна отношению числа опытов с благоприятным исходом к общему числу опытов.
 Среднее значение. Пусть величина x принимает дискретные значения от до. Всего проведено N измерений. измерено раз ……………. . измерено раз Всего измерений Вероятность появления :
Среднее значение. Пусть величина x принимает дискретные значения от до. Всего проведено N измерений. измерено раз ……………. . измерено раз Всего измерений Вероятность появления :
 Среднее значение определяется выражением Из полученного следует, что, зная вероятности различных значений , можно определить. Условие нормировки Сложим все вероятности Фактически найдена вероятность достоверного события Выражение называется условием нормировки
Среднее значение определяется выражением Из полученного следует, что, зная вероятности различных значений , можно определить. Условие нормировки Сложим все вероятности Фактически найдена вероятность достоверного события Выражение называется условием нормировки
 Функция распределения вероятностей (плотность вероятности). Чтобы найти w, надо знать функцию распределения молекул по переменной x, то есть надо знать число молекул, имеющих значения x в заданном интервале : - функция распределения. Если x меняется непрерывно, то - вероятность обнаружить молекулу в интервале : ( ).
Функция распределения вероятностей (плотность вероятности). Чтобы найти w, надо знать функцию распределения молекул по переменной x, то есть надо знать число молекул, имеющих значения x в заданном интервале : - функция распределения. Если x меняется непрерывно, то - вероятность обнаружить молекулу в интервале : ( ).
 Функция распределения вероятностей (плотность вероятности). Чтобы найти w, надо знать функцию распределения молекул по переменной x, то есть надо знать число молекул, имеющих значения x в заданном интервале : - функция распределения. Если x меняется непрерывно, то - вероятность обнаружить молекулу в интервале : ( ).
Функция распределения вероятностей (плотность вероятности). Чтобы найти w, надо знать функцию распределения молекул по переменной x, то есть надо знать число молекул, имеющих значения x в заданном интервале : - функция распределения. Если x меняется непрерывно, то - вероятность обнаружить молекулу в интервале : ( ).
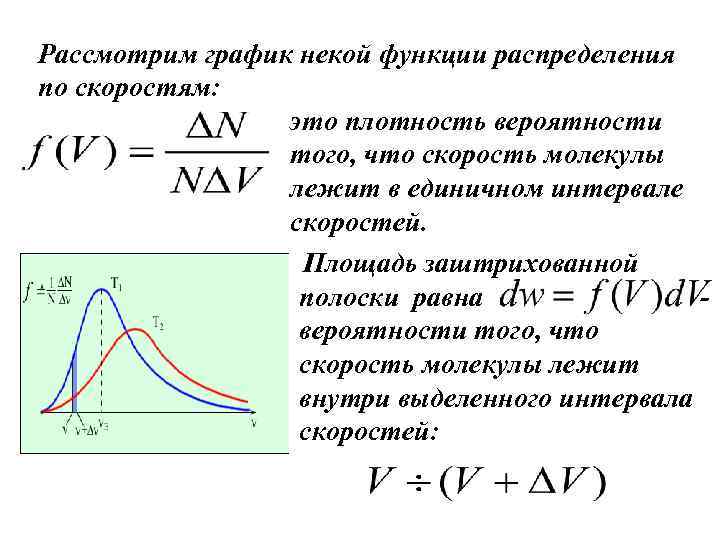 Рассмотрим график некой функции распределения по скоростям: это плотность вероятности того, что скорость молекулы лежит в единичном интервале скоростей. Площадь заштрихованной полоски равна вероятности того, что скорость молекулы лежит внутри выделенного интервала скоростей:
Рассмотрим график некой функции распределения по скоростям: это плотность вероятности того, что скорость молекулы лежит в единичном интервале скоростей. Площадь заштрихованной полоски равна вероятности того, что скорость молекулы лежит внутри выделенного интервала скоростей:
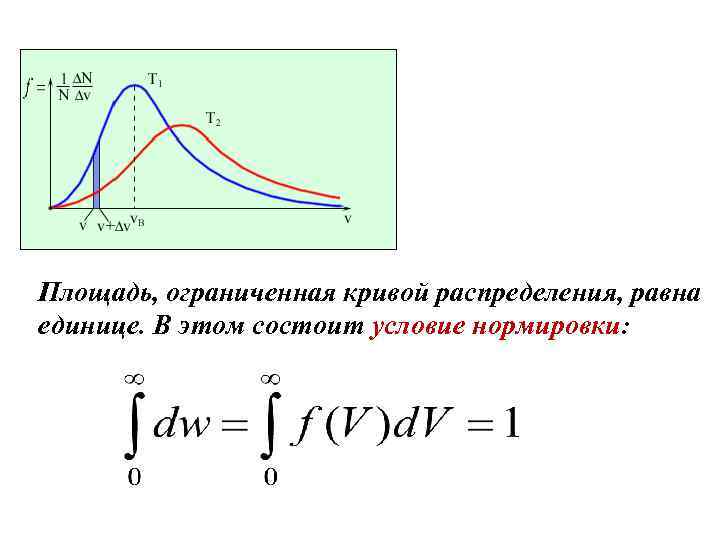 Площадь, ограниченная кривой распределения, равна единице. В этом состоит условие нормировки:
Площадь, ограниченная кривой распределения, равна единице. В этом состоит условие нормировки:
 Распределение молекул по скоростям – распределение Максвелла Максвелл допустил, что в газах в состоянии теплового равновесия при температуре T существует распределение молекул по скоростям, не меняющееся с течением времени. Иными словами, число молекул, имеющих скорости в заданном интервале значений, остается постоянным. И Максвелл нашел это распределение, и оно оказалось наиболее вероятным. Будем искать число частиц ( N), скорости которых лежат в определённом интервале значения скорости υ ( т. е. от υ до ).
Распределение молекул по скоростям – распределение Максвелла Максвелл допустил, что в газах в состоянии теплового равновесия при температуре T существует распределение молекул по скоростям, не меняющееся с течением времени. Иными словами, число молекул, имеющих скорости в заданном интервале значений, остается постоянным. И Максвелл нашел это распределение, и оно оказалось наиболее вероятным. Будем искать число частиц ( N), скорости которых лежат в определённом интервале значения скорости υ ( т. е. от υ до ).
 Число таких молекул тем больше, чем больше υ. Оно пропорционально числу молекул (N). Число N зависит и от самой скорости, так как в одинаковых по величине интервалах, но при разных абсолютных значениях скорости, число молекул будет различным. Учитывая сказанное, получаем: f(υ) – функция распределения по скоростям, N- число молекул. Здесь Перейдя к пределу, можно записать
Число таких молекул тем больше, чем больше υ. Оно пропорционально числу молекул (N). Число N зависит и от самой скорости, так как в одинаковых по величине интервалах, но при разных абсолютных значениях скорости, число молекул будет различным. Учитывая сказанное, получаем: f(υ) – функция распределения по скоростям, N- число молекул. Здесь Перейдя к пределу, можно записать
 Максвелл Джеймс Клерк (1831 – 1879) – английский физик. Работы посвящены электродинамике, молекулярной физике, общей статике, оптике, механике, теории упругости. Установил статистический закон, описывающий распределение молекул газа по скоростям.
Максвелл Джеймс Клерк (1831 – 1879) – английский физик. Работы посвящены электродинамике, молекулярной физике, общей статике, оптике, механике, теории упругости. Установил статистический закон, описывающий распределение молекул газа по скоростям.
 Физический смысл f(υ) в том, что это отношение числа молекул, скорости которых лежат в единичном интервале скоростей, к общему числу молекул. Таким образом, f(υ) – имеет смысл вероятности, то есть показывает, какова вероятность любой молекулы газа иметь скорость, заключённую в единичном интервале, включающем заданную скорость υ. Функцию f(υ) также называют плотностью вероятности.
Физический смысл f(υ) в том, что это отношение числа молекул, скорости которых лежат в единичном интервале скоростей, к общему числу молекул. Таким образом, f(υ) – имеет смысл вероятности, то есть показывает, какова вероятность любой молекулы газа иметь скорость, заключённую в единичном интервале, включающем заданную скорость υ. Функцию f(υ) также называют плотностью вероятности.
 Функции распределения по компонентам скорости. Скорость – векторная величина. Для проекции скорости на ось х (x-ой составляющей скорости), имеем Функция распределения, полученная Максвеллом: Или где
Функции распределения по компонентам скорости. Скорость – векторная величина. Для проекции скорости на ось х (x-ой составляющей скорости), имеем Функция распределения, полученная Максвеллом: Или где
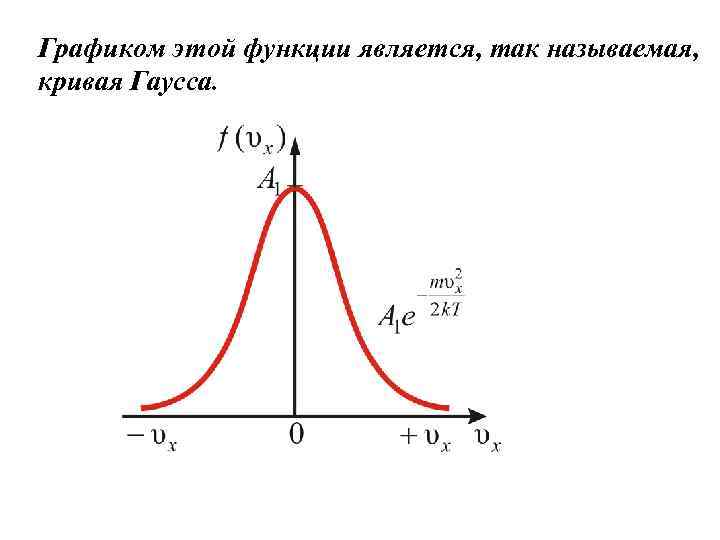 Графиком этой функции является, так называемая, кривая Гаусса.
Графиком этой функции является, так называемая, кривая Гаусса.
 Очевидно, что и функции распределения по y–ым и z–ым компонентам скорости имеют аналогичный вид , так как молекулы газа равновероятно могут обладать x-ой, y-ой или z-ой компонентами скорости. Графики этих функций аналогичны приведенному для .
Очевидно, что и функции распределения по y–ым и z–ым компонентам скорости имеют аналогичный вид , так как молекулы газа равновероятно могут обладать x-ой, y-ой или z-ой компонентами скорости. Графики этих функций аналогичны приведенному для .
 Функция распределения по модулям скоростей. Теперь определим вероятность того, что скорость молекулы одновременно удовлетворяет трём условиям: x – компонента скорости лежит в интервале от до ; y – компонента, в интервале от до ; z – компонента, в интервале от до Вероятность будет равна произведению вероятностей каждого из событий в отдельности: где
Функция распределения по модулям скоростей. Теперь определим вероятность того, что скорость молекулы одновременно удовлетворяет трём условиям: x – компонента скорости лежит в интервале от до ; y – компонента, в интервале от до ; z – компонента, в интервале от до Вероятность будет равна произведению вероятностей каждого из событий в отдельности: где
 Или Введем Этой формуле можно дать геометрическое истолкование: d. Nxyz – это число молекул в параллелепипеде со сторонами dυx, dυy, dυz, то есть в объёме, находящемся на расстоянии от начала координат в пространстве скоростей.
Или Введем Этой формуле можно дать геометрическое истолкование: d. Nxyz – это число молекул в параллелепипеде со сторонами dυx, dυy, dυz, то есть в объёме, находящемся на расстоянии от начала координат в пространстве скоростей.
 Величина (d. Nxyz) не может зависеть от направления вектора скорости. Поэтому надо получить функцию распределения молекул по скоростям независимо от их направления, то есть по абсолютному значению скорости. Молекулы, скорости которых лежат в интервале , располагаются в пространстве скоростей внутри шарового слоя радиусом и толщиной . Объем этого слоя: .
Величина (d. Nxyz) не может зависеть от направления вектора скорости. Поэтому надо получить функцию распределения молекул по скоростям независимо от их направления, то есть по абсолютному значению скорости. Молекулы, скорости которых лежат в интервале , располагаются в пространстве скоростей внутри шарового слоя радиусом и толщиной . Объем этого слоя: .
 Число молекул в этом слое: Здесь , Функция распределения молекул по модулям скоростей.
Число молекул в этом слое: Здесь , Функция распределения молекул по модулям скоростей.
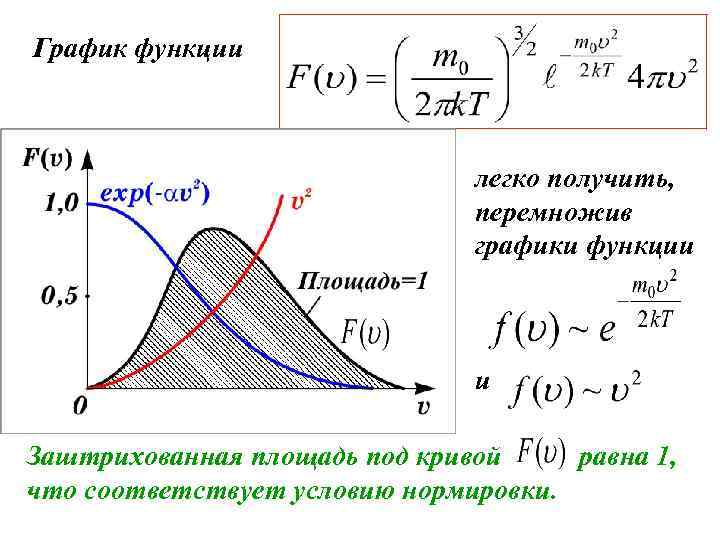 График функции легко получить, перемножив графики функции и Заштрихованная площадь под кривой равна 1, что соответствует условию нормировки.
График функции легко получить, перемножив графики функции и Заштрихованная площадь под кривой равна 1, что соответствует условию нормировки.
 Из выражения для функции распределения следует: - Вид распределения молекул газа по скоростям, для каждого газа зависит от рода газа ( ) и от параметра состояния (Т). Давление p и объём газа V на распределение молекул не влияют. - В показателе степени стоит отношение кинетической энергии, соответствующей данной скорости v к средней энергии теплового движения молекул при данной температуре:
Из выражения для функции распределения следует: - Вид распределения молекул газа по скоростям, для каждого газа зависит от рода газа ( ) и от параметра состояния (Т). Давление p и объём газа V на распределение молекул не влияют. - В показателе степени стоит отношение кинетической энергии, соответствующей данной скорости v к средней энергии теплового движения молекул при данной температуре:
 Значит распределение Максвелла характеризует распределение молекул по значениям кинетической энергии (то есть показывает, какова вероятность при данной температуре иметь именно такое значение кинетической энергии).
Значит распределение Максвелла характеризует распределение молекул по значениям кинетической энергии (то есть показывает, какова вероятность при данной температуре иметь именно такое значение кинетической энергии).
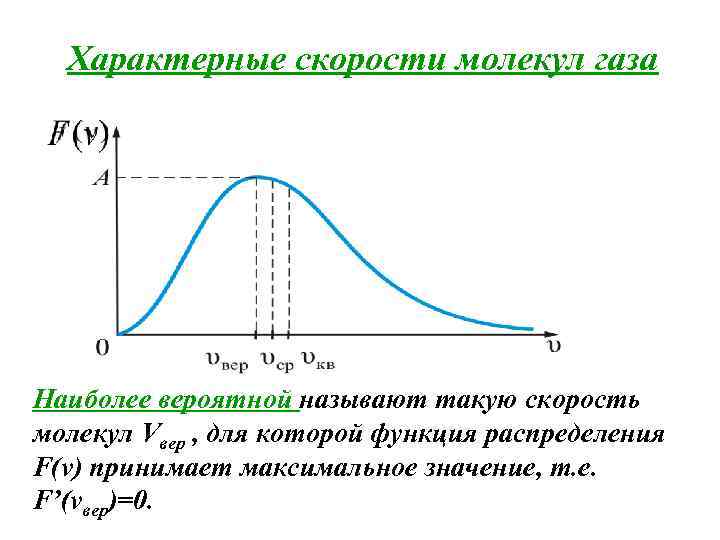 Характерные скорости молекул газа Наиболее вероятной называют такую скорость молекул Vвер , для которой функция распределения F(v) принимает максимальное значение, т. е. F’(vвер)=0.
Характерные скорости молекул газа Наиболее вероятной называют такую скорость молекул Vвер , для которой функция распределения F(v) принимает максимальное значение, т. е. F’(vвер)=0.
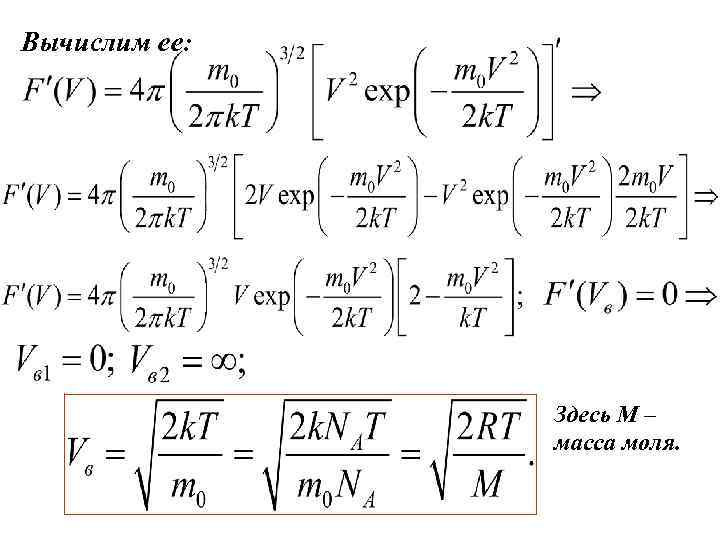 Вычислим ее: Здесь М – масса моля.
Вычислим ее: Здесь М – масса моля.
 Найдем среднюю скорость молекул Vcр с помощью функции распределения. По определению:
Найдем среднюю скорость молекул Vcр с помощью функции распределения. По определению:
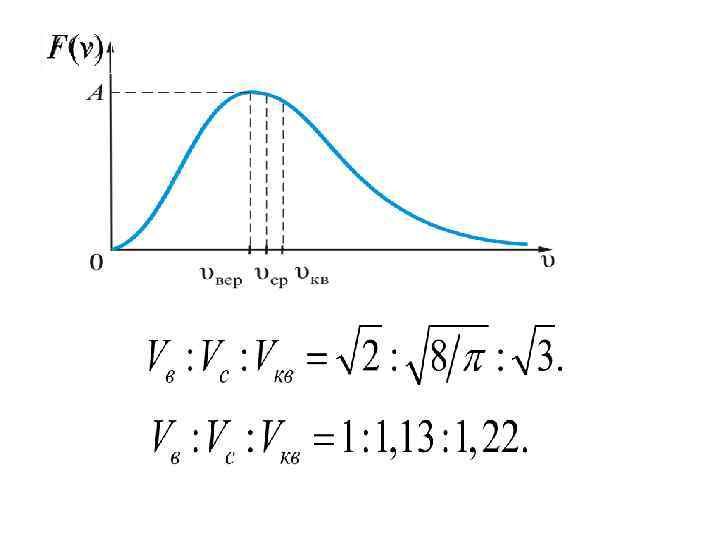
 Средней квадратичной скоростью молекул Vкв называется квадратный корень из среднего значения квадрата скорости, то есть По теореме о равнораспределении энергии по степеням свободы Нахождении (V 2)c с помощью функции распределения:
Средней квадратичной скоростью молекул Vкв называется квадратный корень из среднего значения квадрата скорости, то есть По теореме о равнораспределении энергии по степеням свободы Нахождении (V 2)c с помощью функции распределения:
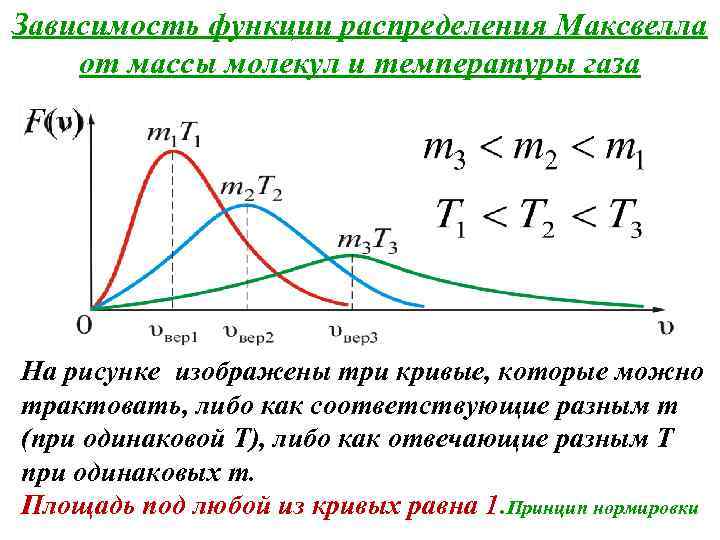 Зависимость функции распределения Максвелла от массы молекул и температуры газа На рисунке изображены три кривые, которые можно трактовать, либо как соответствующие разным m (при одинаковой Т), либо как отвечающие разным Т при одинаковых m. Площадь под любой из кривых равна 1. Принцип нормировки
Зависимость функции распределения Максвелла от массы молекул и температуры газа На рисунке изображены три кривые, которые можно трактовать, либо как соответствующие разным m (при одинаковой Т), либо как отвечающие разным Т при одинаковых m. Площадь под любой из кривых равна 1. Принцип нормировки
 Важно знать как будет изменяться положение максимума кривой: Максвелловский закон распределения по скоростям и все вытекающие следствия справедливы только для газа в равновесной системе. Закон статистический и выполняется тем лучше, чем больше число молекул.
Важно знать как будет изменяться положение максимума кривой: Максвелловский закон распределения по скоростям и все вытекающие следствия справедливы только для газа в равновесной системе. Закон статистический и выполняется тем лучше, чем больше число молекул.
 Распределение в поле сил тяжести. Барометрическая формула. Рассмотрим ещё один, очень важный закон. Атмосферное давление на какой-либо высоте h обусловлено весом выше лежащих слоёв газа. Пусть P – давление на высоте h, а – на высоте С увеличением высоты давление уменьшается (на рис. показана алгебраическая сумма )
Распределение в поле сил тяжести. Барометрическая формула. Рассмотрим ещё один, очень важный закон. Атмосферное давление на какой-либо высоте h обусловлено весом выше лежащих слоёв газа. Пусть P – давление на высоте h, а – на высоте С увеличением высоты давление уменьшается (на рис. показана алгебраическая сумма )
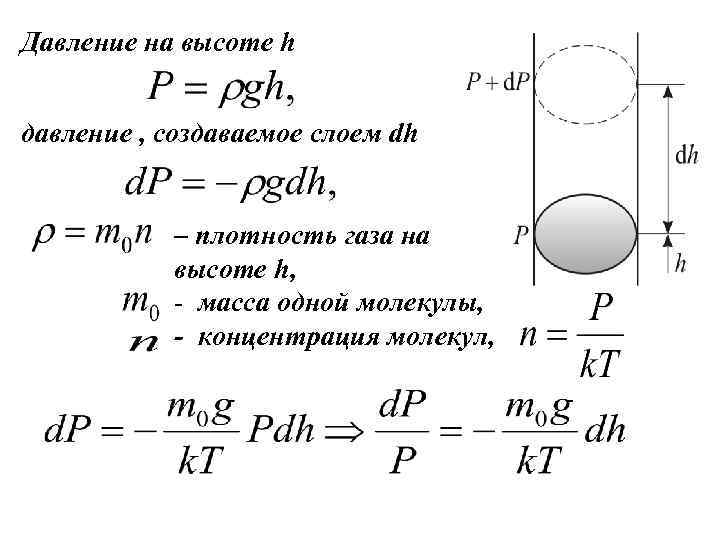 Давление на высоте h давление , создаваемое слоем dh – плотность газа на высоте h, - масса одной молекулы, - концентрация молекул,
Давление на высоте h давление , создаваемое слоем dh – плотность газа на высоте h, - масса одной молекулы, - концентрация молекул,
 Проинтегрируем последнее уравнение при (условие т/д равновесия) и. - давление при Потенцируем или Полученные формулы называются барометрической формулой
Проинтегрируем последнее уравнение при (условие т/д равновесия) и. - давление при Потенцируем или Полученные формулы называются барометрической формулой
 Из барометрической формулы следует, что P убывает с высотой тем быстрее, чем тяжелее газ (чем больше μ) и чем ниже температура (например, на больших высотах концентрация легких газов Не и Н 2 гораздо больше чем у поверхности Земли). На рисунке изображены две кривые, которые можно трактовать, либо как соответствующие разным μ (при одинаковой Т), либо как отвечающие разным Т при одинаковых μ.
Из барометрической формулы следует, что P убывает с высотой тем быстрее, чем тяжелее газ (чем больше μ) и чем ниже температура (например, на больших высотах концентрация легких газов Не и Н 2 гораздо больше чем у поверхности Земли). На рисунке изображены две кривые, которые можно трактовать, либо как соответствующие разным μ (при одинаковой Т), либо как отвечающие разным Т при одинаковых μ.
 Распределение Больцмана определяет распределение частиц в силовом поле в условиях теплового равновесия. Исходя из основного уравнения молекулярнокинетической теории: , заменим P и P 0 в барометрической формуле на n и n 0 и получим распределение Больцмана : где n 0 и n концентрации молекул на высоте h = 0 и h, соответственно.
Распределение Больцмана определяет распределение частиц в силовом поле в условиях теплового равновесия. Исходя из основного уравнения молекулярнокинетической теории: , заменим P и P 0 в барометрической формуле на n и n 0 и получим распределение Больцмана : где n 0 и n концентрации молекул на высоте h = 0 и h, соответственно.
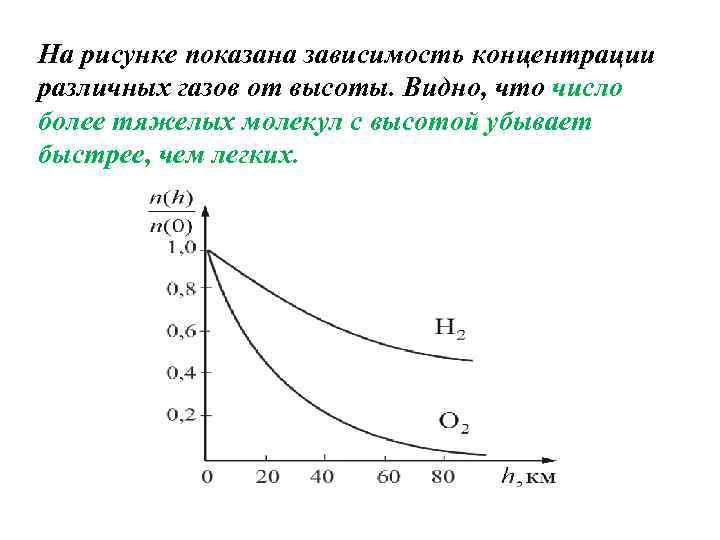 На рисунке показана зависимость концентрации различных газов от высоты. Видно, что число более тяжелых молекул с высотой убывает быстрее, чем легких.
На рисунке показана зависимость концентрации различных газов от высоты. Видно, что число более тяжелых молекул с высотой убывает быстрее, чем легких.
 Больцман Людвиг (1844 – 1906) – австрийский физиктеоретик, один из основоположников классической статистической физики. Основные работы в области кинетической теории газов, термодинамики и теории излучения. Вывел основное кинетическое уравнение газов, являющееся основой физической кинетики. Впервые применил к излучению принципы термодинамики.
Больцман Людвиг (1844 – 1906) – австрийский физиктеоретик, один из основоположников классической статистической физики. Основные работы в области кинетической теории газов, термодинамики и теории излучения. Вывел основное кинетическое уравнение газов, являющееся основой физической кинетики. Впервые применил к излучению принципы термодинамики.

 Так как – потенциальная энергия, следовательно, распределение Больцмана характеризует распределение частиц по значениям потенциальной энергии: – это закон распределения частиц по потенциальным энергиям – распределение Больцмана. Здесь n 0 – число молекул в единице объёма там, где. Больцман доказал, что формула справедлива не только в потенциальном поле сил гравитации, но и в любом потенциальном поле, для совокупности любых одинаковых частиц, находящихся в состоянии хаотического теплового движения.
Так как – потенциальная энергия, следовательно, распределение Больцмана характеризует распределение частиц по значениям потенциальной энергии: – это закон распределения частиц по потенциальным энергиям – распределение Больцмана. Здесь n 0 – число молекул в единице объёма там, где. Больцман доказал, что формула справедлива не только в потенциальном поле сил гравитации, но и в любом потенциальном поле, для совокупности любых одинаковых частиц, находящихся в состоянии хаотического теплового движения.
 Закон распределения Максвелла-Больцмана Распределение Максвелла и Больцмана можно объединить в один закон Максвелла-Больцмана. Число частиц, координаты которых лежат в объеме , то есть в интервалах Из них число молекул, скорости которых лежат в интервале
Закон распределения Максвелла-Больцмана Распределение Максвелла и Больцмана можно объединить в один закон Максвелла-Больцмана. Число частиц, координаты которых лежат в объеме , то есть в интервалах Из них число молекул, скорости которых лежат в интервале
 Окончательно: Функция распределения Максвелла-Больцмана:
Окончательно: Функция распределения Максвелла-Больцмана:


