Lection 10.ppt
- Количество слайдов: 21
 Лекция 10. Сплайсинг В 1977 г. Alec Jeffreys и Richard Flavell (Univ. of Amsterdam) обнаружили прерывистость глобинового гена. Сплайсинг – процесс вырезания фрагментов РНК и воссоединения разорванных концов. сплайсинг от англ. to splice – в морском языке «сращивать канаты» . Intron от intervening sequence. Exon от expression. У низших эукариот число и размер интронов меньше (у дрожжей на 6000 генов лишь 239 интронов), чем у высших эукариот (отдельные гены имеют 50 и более интронов, например дистрофин из 2400 тпн 98 % составляют интроны числом 78). Визуализация интрона в глобиновом гене. а) 15 S пре-РНК и ДНК; b) 10 S м. РНК и ДНК. Красная линия – РНК. Пре-РНК эквивалентна длине и последовательности ДНК глобинового гена. У м. РНК отсутствует фрагмент, присутствующий в гене ДНК. Следовательно 15 S пре-РНК процессируется, в результате удаляется внутренняя последовательность РНК и воссоединяются концы.
Лекция 10. Сплайсинг В 1977 г. Alec Jeffreys и Richard Flavell (Univ. of Amsterdam) обнаружили прерывистость глобинового гена. Сплайсинг – процесс вырезания фрагментов РНК и воссоединения разорванных концов. сплайсинг от англ. to splice – в морском языке «сращивать канаты» . Intron от intervening sequence. Exon от expression. У низших эукариот число и размер интронов меньше (у дрожжей на 6000 генов лишь 239 интронов), чем у высших эукариот (отдельные гены имеют 50 и более интронов, например дистрофин из 2400 тпн 98 % составляют интроны числом 78). Визуализация интрона в глобиновом гене. а) 15 S пре-РНК и ДНК; b) 10 S м. РНК и ДНК. Красная линия – РНК. Пре-РНК эквивалентна длине и последовательности ДНК глобинового гена. У м. РНК отсутствует фрагмент, присутствующий в гене ДНК. Следовательно 15 S пре-РНК процессируется, в результате удаляется внутренняя последовательность РНК и воссоединяются концы.
 Этапы процессинга β-глобиновой м. РНК. ген 1423 пн, два интрона (131 пн+ 851 пн = 65% длины гена) Транскрипция РНК-pol II. Кэпирование 5’-конца. Удаление 3’-конца и полиаденилирование. Эндонуклеолитическое расщепление. Соединение концов.
Этапы процессинга β-глобиновой м. РНК. ген 1423 пн, два интрона (131 пн+ 851 пн = 65% длины гена) Транскрипция РНК-pol II. Кэпирование 5’-конца. Удаление 3’-конца и полиаденилирование. Эндонуклеолитическое расщепление. Соединение концов.

 Типы интронов Нуклеотидная последовательность в области сайтов расщепления, получена на основе анализа большого числа пре-м. РНК и поэтому обозначена как consensus. Правило Шамбона : GT-AG, позволяет найти начало и конец интрона. Оранжевым обозначены инвариантные, а черным предпочтительные основания. N- любой нуклеотид, Y – пиримидин. Полипиримидиновый трэк вблизи 3’-сайта сплайсинга обычно содержит 10 -20 пиримидинов. Тип интрона Где встречаются Интроны GU-AG Интроны AU-AC Группа III Твинтроны Интроны пре-т. РНК Интроны архей Ядерная пре-м. РНК эукариотов Ядерная пре-р. РНК эукариотов, РНК органелл, некоторые РНК бактерий РНК-органелл, некоторые РНК прокариотов РНК органелл Ядерные пре-т. РНК эукариотов Различные РНК
Типы интронов Нуклеотидная последовательность в области сайтов расщепления, получена на основе анализа большого числа пре-м. РНК и поэтому обозначена как consensus. Правило Шамбона : GT-AG, позволяет найти начало и конец интрона. Оранжевым обозначены инвариантные, а черным предпочтительные основания. N- любой нуклеотид, Y – пиримидин. Полипиримидиновый трэк вблизи 3’-сайта сплайсинга обычно содержит 10 -20 пиримидинов. Тип интрона Где встречаются Интроны GU-AG Интроны AU-AC Группа III Твинтроны Интроны пре-т. РНК Интроны архей Ядерная пре-м. РНК эукариотов Ядерная пре-р. РНК эукариотов, РНК органелл, некоторые РНК бактерий РНК-органелл, некоторые РНК прокариотов РНК органелл Ядерные пре-т. РНК эукариотов Различные РНК
 Интроны типа I В пре-р. РНК микробных эукариот, например у ресничной инфузории Tetrahymena, в геномах митохондрий растений и грибов, хлоропластах растений в пре-м. РНК и пре-р. РНК, у цианобактерии Anabaena в гене т. РНК и в гене тимидилатсинтетазы бактериофага T 4 E. coli. Автокаталитический процесс самосплайсинга (selfsplicing), т. е. сама РНК обладает ферментативным действием (пример рибозима). Реакция идет по механизму трансэтерификации: O O 3’ R-OH + R’-O-P-OR’’ ↔R-O-P-O-R’’ + 3’ R’-OH OO- 3’-ОН группа гуанозина атакует фосфодиэфирную связь первого экзона с первым нуклеотидом интрона, расщепляет ее с переносом G на 5’-конец интрона. Затем 3’-ОН-группа на конце первого экзона атакует другой конец I, производя расщепление, соединение двух экзонов и высвобождение линейного интрона. В результате двух реакций трансэтерификации выщепляется I, т. е. молекула РНК подвергается самосплайсингу. In vitro достаточно – РНК, Mg 2+ и GMP (GDP или GTP).
Интроны типа I В пре-р. РНК микробных эукариот, например у ресничной инфузории Tetrahymena, в геномах митохондрий растений и грибов, хлоропластах растений в пре-м. РНК и пре-р. РНК, у цианобактерии Anabaena в гене т. РНК и в гене тимидилатсинтетазы бактериофага T 4 E. coli. Автокаталитический процесс самосплайсинга (selfsplicing), т. е. сама РНК обладает ферментативным действием (пример рибозима). Реакция идет по механизму трансэтерификации: O O 3’ R-OH + R’-O-P-OR’’ ↔R-O-P-O-R’’ + 3’ R’-OH OO- 3’-ОН группа гуанозина атакует фосфодиэфирную связь первого экзона с первым нуклеотидом интрона, расщепляет ее с переносом G на 5’-конец интрона. Затем 3’-ОН-группа на конце первого экзона атакует другой конец I, производя расщепление, соединение двух экзонов и высвобождение линейного интрона. В результате двух реакций трансэтерификации выщепляется I, т. е. молекула РНК подвергается самосплайсингу. In vitro достаточно – РНК, Mg 2+ и GMP (GDP или GTP).
 Действие самовырезания, присущее интронам I группы, сосредоточено в структуре спаренных оснований Структура спаренных оснований (вторичная структура) интрона пре-р. РНК Tetrahymena. Последовательность интрона показана заглавными буквами, а экзона – строчными. За счет дополнительных взаимодействий интрон свертывается в трехмерную структуру, посредством чего эти два сайта сплайсинга сводятся близко друг к другу. Трехмерная структура интрона Tetrahymena. Два экзона, ограничивающие интрон, обозначены белым. В результате фолдинга интрона два экзона располагаются рядом, что облегчает их сшивание после вырезания интрона.
Действие самовырезания, присущее интронам I группы, сосредоточено в структуре спаренных оснований Структура спаренных оснований (вторичная структура) интрона пре-р. РНК Tetrahymena. Последовательность интрона показана заглавными буквами, а экзона – строчными. За счет дополнительных взаимодействий интрон свертывается в трехмерную структуру, посредством чего эти два сайта сплайсинга сводятся близко друг к другу. Трехмерная структура интрона Tetrahymena. Два экзона, ограничивающие интрон, обозначены белым. В результате фолдинга интрона два экзона располагаются рядом, что облегчает их сшивание после вырезания интрона.
 Интроны типа II В геномах митохондрий грибов и хлоропластов растений в пре-м. РНК и пре-р. РНК, несколько известно у прокариотов. Гены имеют специфическую доменную структуру. Интроны принимают специфическую вторичную структуру. Концы I сближены. Первичная реакция трансэфирообразования стимулируется ОН-группой внутреннего А. Самосплайсинг происходит через образование «лассо» . Двухмерная структура интрона II. При укладке интрона образуется 6 доменов. Звездочкой отмечен А, выпячивающийся из VI домена и принимающий участие в образовании лассо. Два конца интрона располагаются строго друг напротив друга. 2’-ОН группа А* (I) атакует 5’-сайт сплайсинга, расщепляет РНК и образует необычную 2’-5’-фосфодиэфирную cвязь с первым нуклеотидом интрона. Эта структура называется «лассо» . 3’-конец экзона атакует 3’-сайт сплайсинга, расщепляя РНК и высвобождая I.
Интроны типа II В геномах митохондрий грибов и хлоропластов растений в пре-м. РНК и пре-р. РНК, несколько известно у прокариотов. Гены имеют специфическую доменную структуру. Интроны принимают специфическую вторичную структуру. Концы I сближены. Первичная реакция трансэфирообразования стимулируется ОН-группой внутреннего А. Самосплайсинг происходит через образование «лассо» . Двухмерная структура интрона II. При укладке интрона образуется 6 доменов. Звездочкой отмечен А, выпячивающийся из VI домена и принимающий участие в образовании лассо. Два конца интрона располагаются строго друг напротив друга. 2’-ОН группа А* (I) атакует 5’-сайт сплайсинга, расщепляет РНК и образует необычную 2’-5’-фосфодиэфирную cвязь с первым нуклеотидом интрона. Эта структура называется «лассо» . 3’-конец экзона атакует 3’-сайт сплайсинга, расщепляя РНК и высвобождая I.
 Интроны III группы также обнаруживают себя в геномах органелл, и они самовырезаются с помощью механизма, подобного для интронов II, но они меньше в размере и имеют свою отличительную вторичную структуру. Твинтроны – смешанные структуры, состоящие из двух и более интронов II и/или группы III. Простейшие твинтроны состоят из одного интрона, вложенного в другой, но более сложные содержат множеcтвенные вложенные интроны. Отдельные интроны, которые составляют твинтрон, обычно вырезаются в определенной последовательности. Интроны архей присутствуют в генах т. РНК и р. РНК. Они расщепляются рибонуклеазой, подобной той, что участвует в сплайсинге пре-т. РНК эукариотов.
Интроны III группы также обнаруживают себя в геномах органелл, и они самовырезаются с помощью механизма, подобного для интронов II, но они меньше в размере и имеют свою отличительную вторичную структуру. Твинтроны – смешанные структуры, состоящие из двух и более интронов II и/или группы III. Простейшие твинтроны состоят из одного интрона, вложенного в другой, но более сложные содержат множеcтвенные вложенные интроны. Отдельные интроны, которые составляют твинтрон, обычно вырезаются в определенной последовательности. Интроны архей присутствуют в генах т. РНК и р. РНК. Они расщепляются рибонуклеазой, подобной той, что участвует в сплайсинге пре-т. РНК эукариотов.
 Интроны ядерной пре-м. РНК класса GU-AG Обнаруживаются в клетках животных. Те же этапы, но требуются дополнительные факторы для сближения концов интрона и его выщепления. sn. RNPs (small nuclear ribonucleoprotein particles) - “snurps” (мя. РНП) – состоят из: U 1, U 2, U 5 и U 4/U 6 –мя. РНК-компоненты Sm – белки (во всех RNP), образуют core SR – белки Уникальные белки (в том числе геликазы) U-РНК называются из-за большого содержания урацила и его модифицированных форм. Нуклеотидные последовательности всех U-РНК позвоночных совпадают на 95%. Размер от 106 н (U 6) до 185 н (U 2). Функция: сплайсинг про-м. РНК (U 1, U 2, U 4, U 5, U 6), процессинг пре-р. РНК в ядрышках (U 3), полиаденилирование пре-м. РНК (U 11). У дрожжей выявлено 25 мя. РНК, у позвоночных – 15. Все мя. РНК эукариот консервативны (90%). Кодируются в I генов. Служат РНК-шаперонами, участвуют в фолдинге р. РНК. Spliceosoma – комплекс, состоящий из пре-м. РНК и различных sn. RNP. Комплекс собирается на пре-м. РНК, размер 25 х50 мкм (50 -60 S). Политенные хромосомы слюнной железы Drosophila melanogaster. Флюоресцентной меткой (красная) помечен белок sn. RNP. Метка накапливается в сайтах транскрипции. Электронная фотография сплайсосом. Каждый из этих комплексов состоит из нескольких субъединиц. На вставке видна тонкая нить РНК-филамента и маленькой частицы на конце.
Интроны ядерной пре-м. РНК класса GU-AG Обнаруживаются в клетках животных. Те же этапы, но требуются дополнительные факторы для сближения концов интрона и его выщепления. sn. RNPs (small nuclear ribonucleoprotein particles) - “snurps” (мя. РНП) – состоят из: U 1, U 2, U 5 и U 4/U 6 –мя. РНК-компоненты Sm – белки (во всех RNP), образуют core SR – белки Уникальные белки (в том числе геликазы) U-РНК называются из-за большого содержания урацила и его модифицированных форм. Нуклеотидные последовательности всех U-РНК позвоночных совпадают на 95%. Размер от 106 н (U 6) до 185 н (U 2). Функция: сплайсинг про-м. РНК (U 1, U 2, U 4, U 5, U 6), процессинг пре-р. РНК в ядрышках (U 3), полиаденилирование пре-м. РНК (U 11). У дрожжей выявлено 25 мя. РНК, у позвоночных – 15. Все мя. РНК эукариот консервативны (90%). Кодируются в I генов. Служат РНК-шаперонами, участвуют в фолдинге р. РНК. Spliceosoma – комплекс, состоящий из пре-м. РНК и различных sn. RNP. Комплекс собирается на пре-м. РНК, размер 25 х50 мкм (50 -60 S). Политенные хромосомы слюнной железы Drosophila melanogaster. Флюоресцентной меткой (красная) помечен белок sn. RNP. Метка накапливается в сайтах транскрипции. Электронная фотография сплайсосом. Каждый из этих комплексов состоит из нескольких субъединиц. На вставке видна тонкая нить РНК-филамента и маленькой частицы на конце.
 -U 1 sn. RNP атакует 5’-сайт I. Нуклеотидная последовательность U 1 комплементарна 5’-I. -U 2 sn. RNP связывается с пре-м. РНК, вызывая выпячивание А (место связывания лассо). -U 5 и U 4/U 6 sn. RNP связываются с пре-м. РНК (сопровождается вытеснением U 1), образуется сплайсосома. -Происходит взаимодействие и перестройка между пре-м. РНК и sn. RNP. -U 4 отрывается, а U 6 связывается с U 2 (другая часть U 6 связывается с 5’-I, вытесняя U 1). U 6 -рибозим, U 4 - ингибитор U 6 катализирует реакцию расщепления и удаления I. Белки sn. RNP необходимы для: - поддержания третичной структуры; - передачи изменения в конформации РНК; - транспорта м. РНК к ядерной оболочке; - для выбора места сплайсинга.
-U 1 sn. RNP атакует 5’-сайт I. Нуклеотидная последовательность U 1 комплементарна 5’-I. -U 2 sn. RNP связывается с пре-м. РНК, вызывая выпячивание А (место связывания лассо). -U 5 и U 4/U 6 sn. RNP связываются с пре-м. РНК (сопровождается вытеснением U 1), образуется сплайсосома. -Происходит взаимодействие и перестройка между пре-м. РНК и sn. RNP. -U 4 отрывается, а U 6 связывается с U 2 (другая часть U 6 связывается с 5’-I, вытесняя U 1). U 6 -рибозим, U 4 - ингибитор U 6 катализирует реакцию расщепления и удаления I. Белки sn. RNP необходимы для: - поддержания третичной структуры; - передачи изменения в конформации РНК; - транспорта м. РНК к ядерной оболочке; - для выбора места сплайсинга.
 Схожесть структуры РНК при сплайсинге, осуществляемом сплайсосомой на пре-м. РНК, и при самосплайсинге группы интронов II а) взаимодействие между интроном пре-м. РНК (фланкирован экзонами 1 и 2) и двумя sn. RNPs (U 2 и U 6), необходимыми для сплайсинга. b) Структура интрона группы II, демонстрирующая организацию части интрона важной для самосплайсинга. Очевидно сходство структуры интрона группы II (рис. b) с комбинацией молекул РНК (рис. a). Инвариантные остатки показаны буквами, а также консервативные пурины (r) и пиримидины (y), вариабильные остатки обозначены - n.
Схожесть структуры РНК при сплайсинге, осуществляемом сплайсосомой на пре-м. РНК, и при самосплайсинге группы интронов II а) взаимодействие между интроном пре-м. РНК (фланкирован экзонами 1 и 2) и двумя sn. RNPs (U 2 и U 6), необходимыми для сплайсинга. b) Структура интрона группы II, демонстрирующая организацию части интрона важной для самосплайсинга. Очевидно сходство структуры интрона группы II (рис. b) с комбинацией молекул РНК (рис. a). Инвариантные остатки показаны буквами, а также консервативные пурины (r) и пиримидины (y), вариабильные остатки обозначены - n.
 Процессинг 45 S пре-р. РНК Темным обозначены спейсерные участки.
Процессинг 45 S пре-р. РНК Темным обозначены спейсерные участки.
 Схема автосплайсинга 26 S р. РНК у тетрахимены и процесс образования рибозима
Схема автосплайсинга 26 S р. РНК у тетрахимены и процесс образования рибозима
 Химические модификации РНК у эукариотов Молекулы т. РНК и р. РНК эукариотов подвергаются химической модификации тех же типов, что и молекулы бактерий. В случае молекул т. РНК модифицирующие ферменты направляются к соответствующим нуклеотидам вторичной структурой т. РНК подобно тому, как эндонуклеазы, которые вырезают интроны т. РНК, используют вторичную структуру в качестве направляющей.
Химические модификации РНК у эукариотов Молекулы т. РНК и р. РНК эукариотов подвергаются химической модификации тех же типов, что и молекулы бактерий. В случае молекул т. РНК модифицирующие ферменты направляются к соответствующим нуклеотидам вторичной структурой т. РНК подобно тому, как эндонуклеазы, которые вырезают интроны т. РНК, используют вторичную структуру в качестве направляющей.
 Посттранскрипционные модификации пре-р. РНК Роль направляющих для химической модификации р. РНК эукариотов выполняют малые ядрышковые РНК (мяк. РНК). Эти молекулы имеют длину 70 -100 н и расположены в ядрышке, где происходит процессинг р. РНК. Обнаружено мало отдельных генов мяк. РНК, большая их часть задается последовательностями в пределах интронов других генов и высвобождается за счет разрезания интрона на куски после сплайсинга. Для каждой модификации – своя мяк. РНК. Пре-р. РНК отличаются большим количеством метилированных нуклеотидов и псевдоуридиновых остатков в заданной позиции (специфичность). Например: human pre-r. RNA – 106 метильных групп, 95 псевдоуридинов. Остаются после процессинга в р. РНК, т. РНК. Обеспечивают образование вторичной структуры и взаимодействие с другими молекулами. Вверху. Образование дуплекса РНК-РНК между U 20 -мяк. РНК и пре-р. РНК, в результате происходит метилирование рибозы. Метилируется нуклеотид, расположенный через 5 нуклеотидов после Box D (CUGA), сайта узнавания метилазой. Внизу. Образование дуплекса РНК-РНК между U 68 --мяк. РНК и пре-р. РНК и превращение U→Ψ в строго определенном месте выпетливания U 68 -мяк. РНК, направляющие эту реакцию, имеют общий АСА 3’-конец.
Посттранскрипционные модификации пре-р. РНК Роль направляющих для химической модификации р. РНК эукариотов выполняют малые ядрышковые РНК (мяк. РНК). Эти молекулы имеют длину 70 -100 н и расположены в ядрышке, где происходит процессинг р. РНК. Обнаружено мало отдельных генов мяк. РНК, большая их часть задается последовательностями в пределах интронов других генов и высвобождается за счет разрезания интрона на куски после сплайсинга. Для каждой модификации – своя мяк. РНК. Пре-р. РНК отличаются большим количеством метилированных нуклеотидов и псевдоуридиновых остатков в заданной позиции (специфичность). Например: human pre-r. RNA – 106 метильных групп, 95 псевдоуридинов. Остаются после процессинга в р. РНК, т. РНК. Обеспечивают образование вторичной структуры и взаимодействие с другими молекулами. Вверху. Образование дуплекса РНК-РНК между U 20 -мяк. РНК и пре-р. РНК, в результате происходит метилирование рибозы. Метилируется нуклеотид, расположенный через 5 нуклеотидов после Box D (CUGA), сайта узнавания метилазой. Внизу. Образование дуплекса РНК-РНК между U 68 --мяк. РНК и пре-р. РНК и превращение U→Ψ в строго определенном месте выпетливания U 68 -мяк. РНК, направляющие эту реакцию, имеют общий АСА 3’-конец.
 Альтернативный сплайсинг Типы альтернативного сплайсинга пре-м. РНК. А – альтернативные промоторы Б – альтернативные сайты полиаденилирования В – выбор различных экзонов. Темные участки – экзоны, светлые – интроны. Линиями соединены 5’ и 3’ –сайты сплайсинга. Три различных м. РНК, возникающие из одной молекулы. Предшественника у аденовирусов. Аномальный процессинг м. РНК β-глобина у больных талассемией. А – первичный транскрипт РНК нормального глобина; Б – мутация, приводящая к появлению нового сайта сплайсинга и удлинению экзона; В – мутация, приводящая к появлению дополнительного экзона между экзонами 2 и 3. Заштрихованные участки – новые экзонны. Мутантные сайты обозначены стрелками.
Альтернативный сплайсинг Типы альтернативного сплайсинга пре-м. РНК. А – альтернативные промоторы Б – альтернативные сайты полиаденилирования В – выбор различных экзонов. Темные участки – экзоны, светлые – интроны. Линиями соединены 5’ и 3’ –сайты сплайсинга. Три различных м. РНК, возникающие из одной молекулы. Предшественника у аденовирусов. Аномальный процессинг м. РНК β-глобина у больных талассемией. А – первичный транскрипт РНК нормального глобина; Б – мутация, приводящая к появлению нового сайта сплайсинга и удлинению экзона; В – мутация, приводящая к появлению дополнительного экзона между экзонами 2 и 3. Заштрихованные участки – новые экзонны. Мутантные сайты обозначены стрелками.


 Сплайсинг в мт. ДНК
Сплайсинг в мт. ДНК
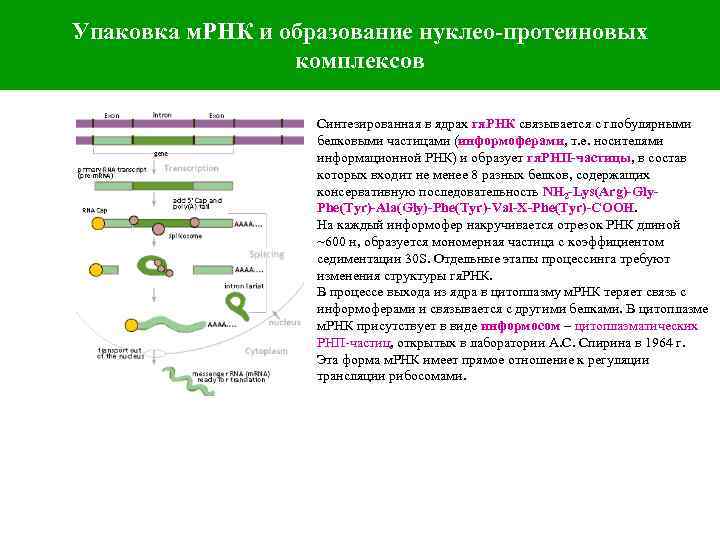 Упаковка м. РНК и образование нуклео-протеиновых комплексов Синтезированная в ядрах гя. РНК связывается с глобулярными белковыми частицами (информоферами, т. е. носителями информационной РНК) и образует гя. РНП-частицы, в состав которых входит не менее 8 разных белков, содержащих консервативную последовательность NH 2 -Lys(Arg)-Gly. Phe(Tyr)-Ala(Gly)-Phe(Tyr)-Val-X-Phe(Tyr)-CООН. На каждый информофер накручивается отрезок РНК длиной ~600 н, образуется мономерная частица с коэффициентом седиментации 30 S. Отдельные этапы процессинга требуют изменения структуры гя. РНК. В процессе выхода из ядра в цитоплазму м. РНК теряет связь с информоферами и связывается с другими белками. В цитоплазме м. РНК присутствует в виде информосом – цитоплазматических РНП-частиц, открытых в лаборатории А. С. Спирина в 1964 г. Эта форма м. РНК имеет прямое отношение к регуляции трансляции рибосомами.
Упаковка м. РНК и образование нуклео-протеиновых комплексов Синтезированная в ядрах гя. РНК связывается с глобулярными белковыми частицами (информоферами, т. е. носителями информационной РНК) и образует гя. РНП-частицы, в состав которых входит не менее 8 разных белков, содержащих консервативную последовательность NH 2 -Lys(Arg)-Gly. Phe(Tyr)-Ala(Gly)-Phe(Tyr)-Val-X-Phe(Tyr)-CООН. На каждый информофер накручивается отрезок РНК длиной ~600 н, образуется мономерная частица с коэффициентом седиментации 30 S. Отдельные этапы процессинга требуют изменения структуры гя. РНК. В процессе выхода из ядра в цитоплазму м. РНК теряет связь с информоферами и связывается с другими белками. В цитоплазме м. РНК присутствует в виде информосом – цитоплазматических РНП-частиц, открытых в лаборатории А. С. Спирина в 1964 г. Эта форма м. РНК имеет прямое отношение к регуляции трансляции рибосомами.
 Cхема скоординированного процессинга пре-м. РНК (транскрипция, кэпирование, полиаденилирование и сплайсинг). CTD – конец большой субъединицы РНК-pol. II служит в качестве подмостка, на котором организуются факторы процессинга пре-м. РНК, включая кэпирование, полиаденилирование и удаление интронов. Стрелками указаны потенциальные взаимодействия (физические и функциональные) между различными факторами. В дополнение к указанным РНК-pol II, по-видимому, дополнительно ассоциирует с транскрипционными факторами. Котранскрипционный процессинг пре-м. РНК. Электронная фотография транскриптов с прикрепленными к ним RNPs. Пунктирная линия – хроматин, сплошная линия – фибриллы РНК с белками, гранулы - RNPs, как видно они распределены вдоль транскрипта неслучайным образом, локализованы в сайтах, где проходит процессинг РНК. Процессинг пре-м. РНК. Результаты Norton blot гибридизации.
Cхема скоординированного процессинга пре-м. РНК (транскрипция, кэпирование, полиаденилирование и сплайсинг). CTD – конец большой субъединицы РНК-pol. II служит в качестве подмостка, на котором организуются факторы процессинга пре-м. РНК, включая кэпирование, полиаденилирование и удаление интронов. Стрелками указаны потенциальные взаимодействия (физические и функциональные) между различными факторами. В дополнение к указанным РНК-pol II, по-видимому, дополнительно ассоциирует с транскрипционными факторами. Котранскрипционный процессинг пре-м. РНК. Электронная фотография транскриптов с прикрепленными к ним RNPs. Пунктирная линия – хроматин, сплошная линия – фибриллы РНК с белками, гранулы - RNPs, как видно они распределены вдоль транскрипта неслучайным образом, локализованы в сайтах, где проходит процессинг РНК. Процессинг пре-м. РНК. Результаты Norton blot гибридизации.


