Lektsia__10-2011.ppt
- Количество слайдов: 19
 Лекция № 10 Окислительно-восстановительные реакции Окислительно восстановительная реакция как двойственный процесс. Понятие об окислителе и восстановителе. Окислительно восста новительная активность элементов и соединений. Методы подбора коэффициентов к окислительно восстановительным реакциям (методы электронного баланса и полуреакций). Определение возможности протекания окислительно восстановительных реакций.
Лекция № 10 Окислительно-восстановительные реакции Окислительно восстановительная реакция как двойственный процесс. Понятие об окислителе и восстановителе. Окислительно восста новительная активность элементов и соединений. Методы подбора коэффициентов к окислительно восстановительным реакциям (методы электронного баланса и полуреакций). Определение возможности протекания окислительно восстановительных реакций.
 Окислительно-восстановительная реакция как двойственный процесс • Если атом или ион элемента отдает электроны, то степень окисления элемента повышается, и он переходит в окисленную форму (Ок), если принимает электроны – то степень окисления элемента понижается, и элемент переходит в восстановленную форму (Вос). Обе формы составляют сопряженную окислительно-восстановительную пару.
Окислительно-восстановительная реакция как двойственный процесс • Если атом или ион элемента отдает электроны, то степень окисления элемента повышается, и он переходит в окисленную форму (Ок), если принимает электроны – то степень окисления элемента понижается, и элемент переходит в восстановленную форму (Вос). Обе формы составляют сопряженную окислительно-восстановительную пару.
 • Окислитель – это вещество, которое принимает электроны и при этом восстанавливается. • Восстановитель – это вещество, которое отдает электроны и при этом окисляется. Cl 2 + 2 I– 2 Cl– + I 2 Ок 1 + Вос1 Вос2 + Ок 2 (здесь Cl 2 – окислитель, I– – восстановитель)
• Окислитель – это вещество, которое принимает электроны и при этом восстанавливается. • Восстановитель – это вещество, которое отдает электроны и при этом окисляется. Cl 2 + 2 I– 2 Cl– + I 2 Ок 1 + Вос1 Вос2 + Ок 2 (здесь Cl 2 – окислитель, I– – восстановитель)
 • 1. Метод электронного баланса HN 5+O 3 + H 2 S 2– N 2+O + S 0 + H 2 O N 5+ + 3 e N 2+ 2 О-ль 6 2– – 2 e S 0 3 В-ль S 2 HNO 3 + 3 H 2 S 2 NO + 3 S + 4 H 2 O
• 1. Метод электронного баланса HN 5+O 3 + H 2 S 2– N 2+O + S 0 + H 2 O N 5+ + 3 e N 2+ 2 О-ль 6 2– – 2 e S 0 3 В-ль S 2 HNO 3 + 3 H 2 S 2 NO + 3 S + 4 H 2 O
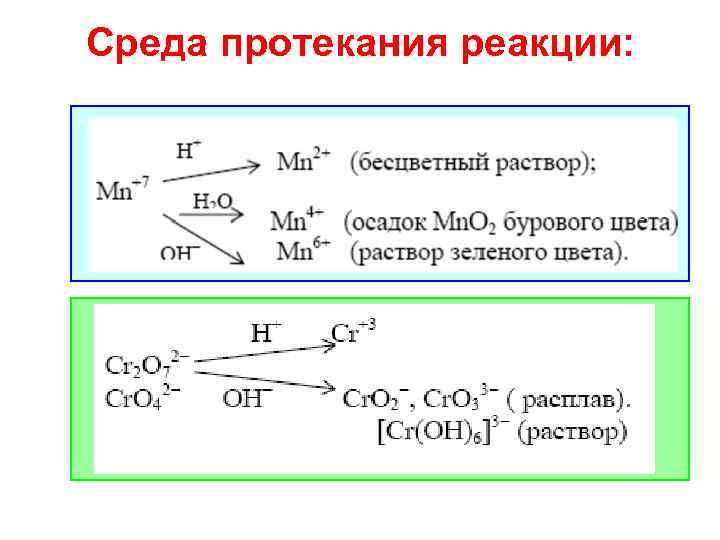 Cреда протекания реакции:
Cреда протекания реакции:
![1)[O 2 -]исх. в-в > [O 2 -]кон. в-в а) кислая среда: [O 2 1)[O 2 -]исх. в-в > [O 2 -]кон. в-в а) кислая среда: [O 2](https://present5.com/presentation/141344298_132726599/image-6.jpg) 1)[O 2 -]исх. в-в > [O 2 -]кон. в-в а) кислая среда: [O 2 -] + 2 H+ = H 2 O б) щелочная и нейтральная среды: [O 2 -] + H 2 O = 2 OH− 2) [O 2−]исх. в-в < [O 2−]кон. в-в а) кислая и нейтральная среды: Н 2 О = [О 2−] + 2 Н+ б) щелочная среда: 2 ОН- = [О 2−] + Н 2 О
1)[O 2 -]исх. в-в > [O 2 -]кон. в-в а) кислая среда: [O 2 -] + 2 H+ = H 2 O б) щелочная и нейтральная среды: [O 2 -] + H 2 O = 2 OH− 2) [O 2−]исх. в-в < [O 2−]кон. в-в а) кислая и нейтральная среды: Н 2 О = [О 2−] + 2 Н+ б) щелочная среда: 2 ОН- = [О 2−] + Н 2 О
 • 2. Метод электронно-ионного баланса • В кислой среде: KMn. O 4 + Na 2 SO 3 +H 2 SO 4 → Mn. SO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O K++Mn. O 4 -+2 Na+ + SO 32 -+ 2 H++SO 42 - →Mn 2++ SO 42 - + 2 Na++ SO 42 - +2 K++ SO 42 - + H 2 O о-ль в-ль Mn. O 4 -+ 8 H++5 e→Mn 2++4 H 2 O восст-е 2 SO 32 - +H 2 O -2 e →SO 42 -+ 2 H+ окис-е 5 6 3 2 Mn. O 42 - +16 H++5 SO 32 -+ 5 H 2 O → 2 Mn 2++8 H 2 O +5 SO 42 - +10 H+ 2 KMn. O 4+5 Na 2 SO 3+3 H 2 SO 4 → 2 Mn. SO 4+5 Na 2 SO 4+K 2 SO 4+3 H 2 O
• 2. Метод электронно-ионного баланса • В кислой среде: KMn. O 4 + Na 2 SO 3 +H 2 SO 4 → Mn. SO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O K++Mn. O 4 -+2 Na+ + SO 32 -+ 2 H++SO 42 - →Mn 2++ SO 42 - + 2 Na++ SO 42 - +2 K++ SO 42 - + H 2 O о-ль в-ль Mn. O 4 -+ 8 H++5 e→Mn 2++4 H 2 O восст-е 2 SO 32 - +H 2 O -2 e →SO 42 -+ 2 H+ окис-е 5 6 3 2 Mn. O 42 - +16 H++5 SO 32 -+ 5 H 2 O → 2 Mn 2++8 H 2 O +5 SO 42 - +10 H+ 2 KMn. O 4+5 Na 2 SO 3+3 H 2 SO 4 → 2 Mn. SO 4+5 Na 2 SO 4+K 2 SO 4+3 H 2 O
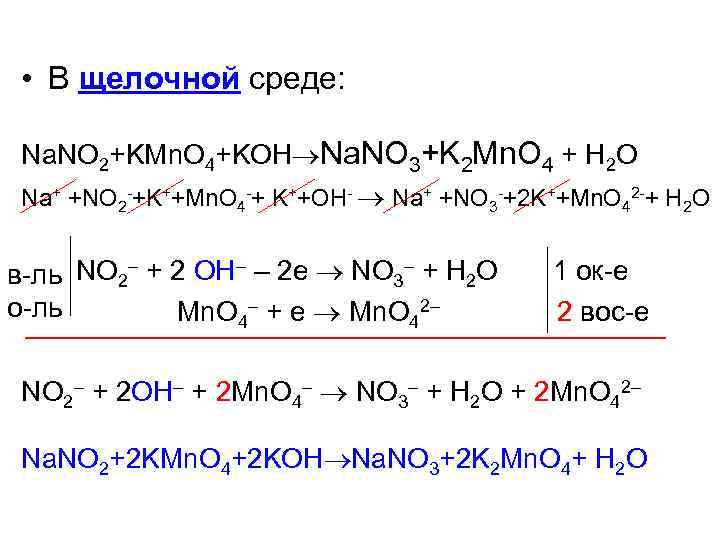 • В щелочной среде: Na. NO 2+KMn. O 4+KOH Na. NO 3+K 2 Mn. O 4 + H 2 O Na+ +NO 2 -+K++Mn. O 4 -+ K++OH- Na+ +NO 3 -+2 K++Mn. O 42 -+ H 2 O NO 2– + 2 OH– – 2 e NO 3– + H 2 O 1 ок-е в-ль о-ль Mn. O 4– + e Mn. O 42– 2 вос-е NO 2– + 2 OH– + 2 Mn. O 4– NO 3– + H 2 O + 2 Mn. O 42– Na. NO 2+2 KMn. O 4+2 KOH Na. NO 3+2 K 2 Mn. O 4+ H 2 O
• В щелочной среде: Na. NO 2+KMn. O 4+KOH Na. NO 3+K 2 Mn. O 4 + H 2 O Na+ +NO 2 -+K++Mn. O 4 -+ K++OH- Na+ +NO 3 -+2 K++Mn. O 42 -+ H 2 O NO 2– + 2 OH– – 2 e NO 3– + H 2 O 1 ок-е в-ль о-ль Mn. O 4– + e Mn. O 42– 2 вос-е NO 2– + 2 OH– + 2 Mn. O 4– NO 3– + H 2 O + 2 Mn. O 42– Na. NO 2+2 KMn. O 4+2 KOH Na. NO 3+2 K 2 Mn. O 4+ H 2 O
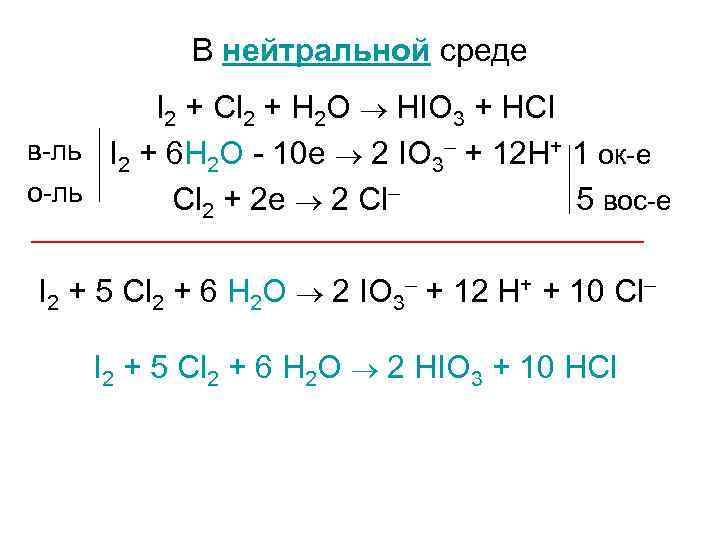 В нейтральной среде I 2 + Cl 2 + H 2 O HIO 3 + HCl в-ль 2 + 6 H 2 O - 10 e 2 IO 3– + 12 H+ 1 ок-е I о-ль Cl 2 + 2 e 2 Cl– 5 вос-е I 2 + 5 Cl 2 + 6 H 2 O 2 IO 3– + 12 H+ + 10 Cl– I 2 + 5 Cl 2 + 6 H 2 O 2 HIO 3 + 10 HCl
В нейтральной среде I 2 + Cl 2 + H 2 O HIO 3 + HCl в-ль 2 + 6 H 2 O - 10 e 2 IO 3– + 12 H+ 1 ок-е I о-ль Cl 2 + 2 e 2 Cl– 5 вос-е I 2 + 5 Cl 2 + 6 H 2 O 2 IO 3– + 12 H+ + 10 Cl– I 2 + 5 Cl 2 + 6 H 2 O 2 HIO 3 + 10 HCl
 ВАЖНЕЙШИЕ ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ • Окислители: HNO 3, H 2 SO 4, HCl. O 4, KMn. O 4, K 2 Cr 2 O 7, О 2, F 2 • Восстановители: Na, Mg, Al, Zn, NH 3, H 2 S, Na 2 S 2 O 3, галогеноводороды • И окислители и восстановители: • HCl. O, H 2 O 2, H 2 SO 3, HNO 2 и др.
ВАЖНЕЙШИЕ ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ • Окислители: HNO 3, H 2 SO 4, HCl. O 4, KMn. O 4, K 2 Cr 2 O 7, О 2, F 2 • Восстановители: Na, Mg, Al, Zn, NH 3, H 2 S, Na 2 S 2 O 3, галогеноводороды • И окислители и восстановители: • HCl. O, H 2 O 2, H 2 SO 3, HNO 2 и др.
 • Окислительно-восстановительные реакции разделяются на три основных типа: 1) межмолекулярные: Zn 0 + K 2 Cr 2+6 O 7 + H 2 SO 4 Zn+2 SO 4+Cr 2+3(SO 4)3+ K 2 SO 4 + H 2 O 2) внутримолекулярные: 2 KN+5 O 3 -2 2 KN+3 O 2 + O 20 3) реакции диспропорционирования: Cl 20 + H 2 O ↔ HCl-1 + HCl+1 O
• Окислительно-восстановительные реакции разделяются на три основных типа: 1) межмолекулярные: Zn 0 + K 2 Cr 2+6 O 7 + H 2 SO 4 Zn+2 SO 4+Cr 2+3(SO 4)3+ K 2 SO 4 + H 2 O 2) внутримолекулярные: 2 KN+5 O 3 -2 2 KN+3 O 2 + O 20 3) реакции диспропорционирования: Cl 20 + H 2 O ↔ HCl-1 + HCl+1 O
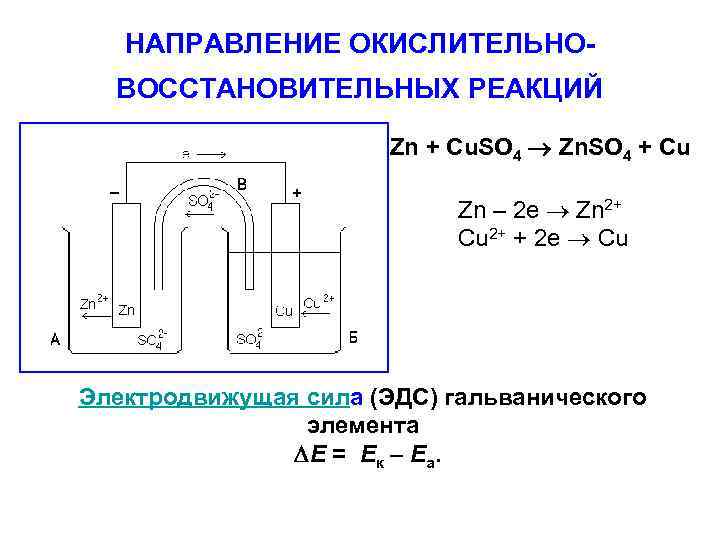 НАПРАВЛЕНИЕ ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Zn + Cu. SO 4 Zn. SO 4 + Cu Zn – 2 e Zn 2+ Cu 2+ + 2 e Cu Электродвижущая сила (ЭДС) гальванического элемента E = Eк – Eа.
НАПРАВЛЕНИЕ ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Zn + Cu. SO 4 Zn. SO 4 + Cu Zn – 2 e Zn 2+ Cu 2+ + 2 e Cu Электродвижущая сила (ЭДС) гальванического элемента E = Eк – Eа.
 Два случая формирования потенциала: а – активный металл, отрицательный потенциал; б – малоактивный металл, положительный потенциал φа φк
Два случая формирования потенциала: а – активный металл, отрицательный потенциал; б – малоактивный металл, положительный потенциал φа φк
 • За нуль принят потенциал стандартного водородного электрода, который состоит из платиновой пластинки, покрытой платиновой чернью и частично погруженной в раствор кислоты с активной концентрацией ионов водорода, равной 1 моль/л. Электрод омывается газообразным водородом под давлением 1, 013× 105 Па (1 атмосфера), что приводит к образованию системы: 2 H+ + 2 e ↔ H 2 φ0(2 H+/H 2)=0 А (–) Pt(H 2)|2 H+||Cu 2+|Cu (+) К E= φ0(Cu 2+/Cu) – φ0(2 H+/H 2) Е 0 = E = φ0(Cu 2+/Cu) = 0, 34 В Е 0 = ΔЕ = φ0 ок – φ0 восст
• За нуль принят потенциал стандартного водородного электрода, который состоит из платиновой пластинки, покрытой платиновой чернью и частично погруженной в раствор кислоты с активной концентрацией ионов водорода, равной 1 моль/л. Электрод омывается газообразным водородом под давлением 1, 013× 105 Па (1 атмосфера), что приводит к образованию системы: 2 H+ + 2 e ↔ H 2 φ0(2 H+/H 2)=0 А (–) Pt(H 2)|2 H+||Cu 2+|Cu (+) К E= φ0(Cu 2+/Cu) – φ0(2 H+/H 2) Е 0 = E = φ0(Cu 2+/Cu) = 0, 34 В Е 0 = ΔЕ = φ0 ок – φ0 восст
 • ряд напряжений : K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au усиление восстановительной способности металлов Величина электродного потенциала зависит от концентрации ионов металла в растворе его соли [Men+], их заряда (n) и температуры (Т), что выражается уравнением Нернста: F – число Фарадея (F=96485 96500 Кл/моль); при Т=298 К
• ряд напряжений : K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au усиление восстановительной способности металлов Величина электродного потенциала зависит от концентрации ионов металла в растворе его соли [Men+], их заряда (n) и температуры (Т), что выражается уравнением Нернста: F – число Фарадея (F=96485 96500 Кл/моль); при Т=298 К
 Основные следствия из ряда напряжений: • а) Каждый металл вытесняет из солей все другие, расположенные в ряду напряжений правее него. • б) Все металлы, расположенные левее водорода, вытесняют его из кислот, расположенные правее – не вытесняют. • в) Чем дальше друг от друга стоят два металла, тем большую ЭДС имеет построенный из них гальванический элемент.
Основные следствия из ряда напряжений: • а) Каждый металл вытесняет из солей все другие, расположенные в ряду напряжений правее него. • б) Все металлы, расположенные левее водорода, вытесняют его из кислот, расположенные правее – не вытесняют. • в) Чем дальше друг от друга стоят два металла, тем большую ЭДС имеет построенный из них гальванический элемент.

 2 I- + 2 Fe 3+ → I 2 + 2 Fe 2+ φ0(Fe 3+/Fe 2+) = +0. 771 В φ0(I 20 /I-) = +0. 536 В E 0 = φ0 ок – φ0 восст= +0. 771 - 0. 536 = 0. 235 В E 0 > 0 ΔG < 0 процесс идет в прямом направлении 2 Аg+2 Н+=2 Ag++Н 2↑; E 0 = φ0 ок – φ0 восст= 0. - 0. 80 = -0. 80 В E 0 < 0 ΔG >> 0 процесс не идет в прямом направлении
2 I- + 2 Fe 3+ → I 2 + 2 Fe 2+ φ0(Fe 3+/Fe 2+) = +0. 771 В φ0(I 20 /I-) = +0. 536 В E 0 = φ0 ок – φ0 восст= +0. 771 - 0. 536 = 0. 235 В E 0 > 0 ΔG < 0 процесс идет в прямом направлении 2 Аg+2 Н+=2 Ag++Н 2↑; E 0 = φ0 ок – φ0 восст= 0. - 0. 80 = -0. 80 В E 0 < 0 ΔG >> 0 процесс не идет в прямом направлении
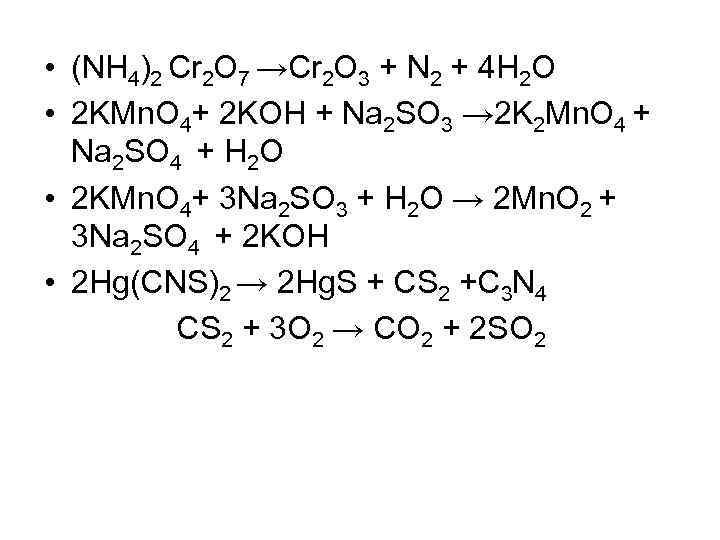 • (NH 4)2 Cr 2 O 7 →Cr 2 O 3 + N 2 + 4 H 2 O • 2 KMn. O 4+ 2 KOH + Na 2 SO 3 → 2 K 2 Mn. O 4 + Na 2 SO 4 + H 2 O • 2 KMn. O 4+ 3 Na 2 SO 3 + H 2 O → 2 Mn. O 2 + 3 Na 2 SO 4 + 2 KOH • 2 Hg(CNS)2 → 2 Hg. S + CS 2 +C 3 N 4 CS 2 + 3 O 2 → CO 2 + 2 SO 2
• (NH 4)2 Cr 2 O 7 →Cr 2 O 3 + N 2 + 4 H 2 O • 2 KMn. O 4+ 2 KOH + Na 2 SO 3 → 2 K 2 Mn. O 4 + Na 2 SO 4 + H 2 O • 2 KMn. O 4+ 3 Na 2 SO 3 + H 2 O → 2 Mn. O 2 + 3 Na 2 SO 4 + 2 KOH • 2 Hg(CNS)2 → 2 Hg. S + CS 2 +C 3 N 4 CS 2 + 3 O 2 → CO 2 + 2 SO 2


