Слайд_к_л_10.ppt
- Количество слайдов: 47

Лекция № 10 Элементы VIIIB подгруппы Железо, кобальт, никель
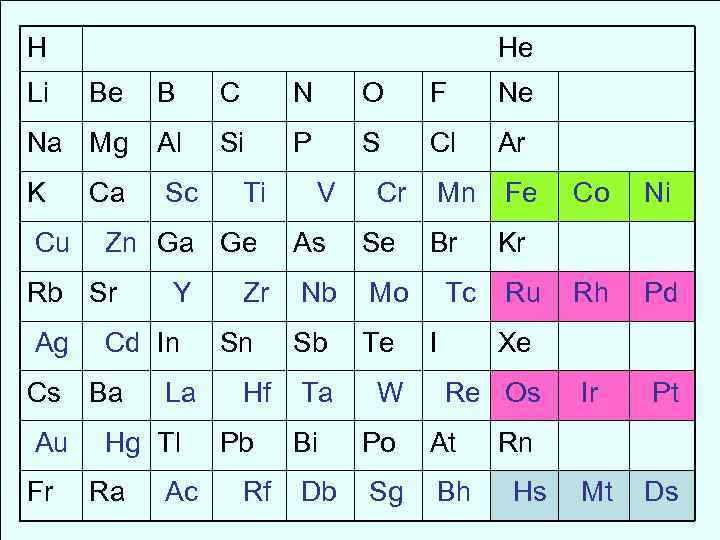
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Ac Rf Db Sg Bh Hs Mt Ds

Платиновые металлы Ru, Rh, Pd — лёгкие ПМ Os, Ir, Pt — тяжёлые ПМ (с. Os = 22, 5 г/см 3) Содержание в земной коре ~ 10– 7% ПМ добывают попутно при производстве Cu и Ni Относятся к благородным металлам ПМ — активные комплексообразователи Используются в электроизмерительной технике, как катализаторы, легирующие добавки к сплавам и т. п.
![Семейство железа Fe Co Ni [Ar] 3 d 64 s 2 3 d Семейство железа Fe Co Ni [Ar] 3 d 64 s 2 3 d](https://present5.com/presentation/3/26150394_165585498.pdf-img/26150394_165585498.pdf-4.jpg)
Семейство железа Fe Co Ni [Ar] 3 d 64 s 2 3 d 74 s 2 3 d 84 s 2 нарастание устойчивости высшей степени окисления понижение устойчивой степени окисления II, III, (VI) II, III II, (III) В обычных комплексных соединениях VIII Os Os. O 4 О высшей степени окисления
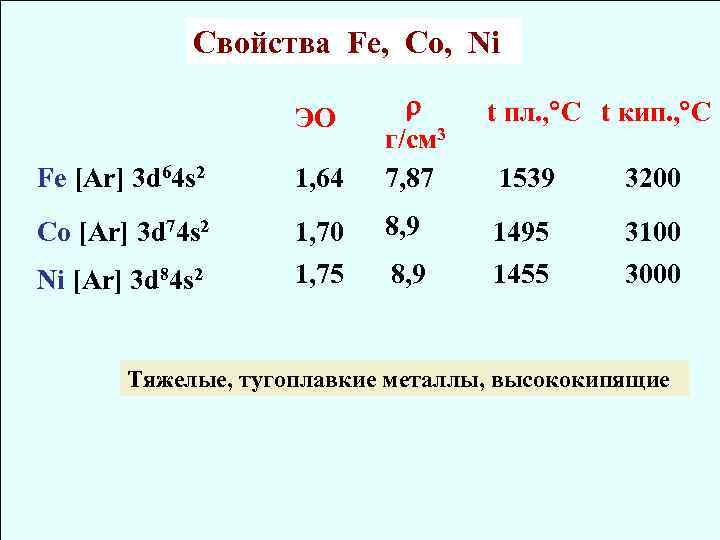
Свойства Fe, Co, Ni ЭО t пл. , C t кип. , C г/cм 3 Fe [Ar] 3 d 64 s 2 1, 64 7, 87 1539 3200 Co [Ar] 3 d 74 s 2 1, 70 8, 9 1495 3100 Ni [Ar] 3 d 84 s 2 1, 75 8, 9 1455 3000 Тяжелые, тугоплавкие металлы, высококипящие
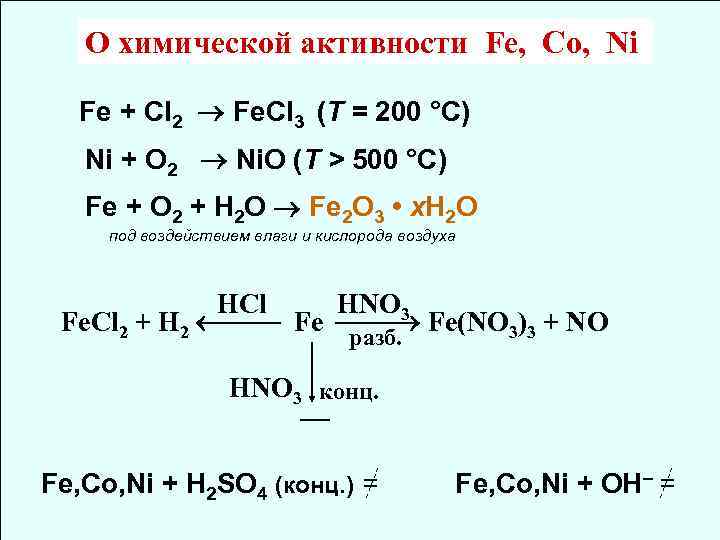
О химической активности Fe, Co, Ni Fe + Сl 2 Fe. Cl 3 (T = 200 °С) Ni + O 2 Ni. O (T > 500 °С) Fe + O 2 + H 2 O Fe 2 O 3 • x. H 2 O под воздействием влаги и кислорода воздуха HCl HNO 3 Fe. Cl 2 + H 2 Fe Fe(NO 3)3 + NO разб. HNO 3 конц. Fe, Co, Ni + H 2 SO 4 (конц. ) = Fe, Co, Ni + OH– =
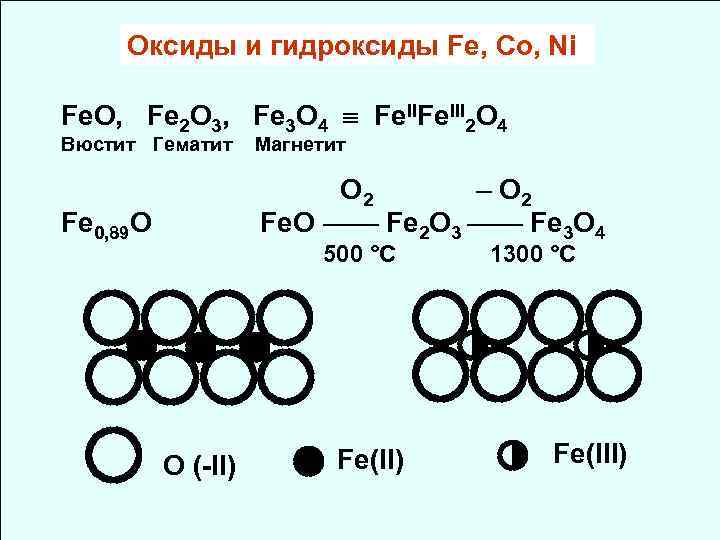
Оксиды и гидроксиды Fe, Co, Ni Fe. O, Fe 2 O 3, Fe 3 O 4 Fe. III 2 O 4 Вюстит Гематит Магнетит O 2 – O 2 Fe 0, 89 O Fe. O —— Fe 2 O 3 —— Fe 3 O 4 500 °C 1300 °C ◯◯◯◯ ●●● ◑ ◑ ◯◯◯◯ ◯ ● ◑O (-II) Fe(II) Fe(III)

Co. O + Mx. Oy : Co(Al. O 2)2 Co 2 Sn. O 4 Co. Zn. O 2
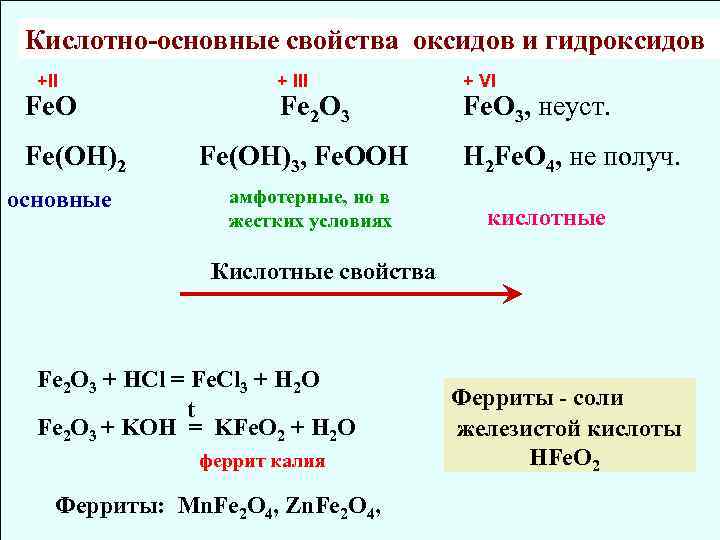
Кислотно-основные свойcтва оксидов и гидроксидов +II + III + VI Fe. O Fe 2 O 3 Fe. O 3, неуст. Fe(OH)2 Fe(OH)3, Fe. OOH H 2 Fe. O 4, не получ. основные амфотерные, но в жестких условиях кислотные Кислотные свойства Fe 2 O 3 + HCl = Fe. Cl 3 + H 2 O Ферриты - соли t Fe 2 O 3 + KOH = KFe. O 2 + H 2 O железистой кислоты феррит калия HFe. O 2 Ферриты: Mn. Fe 2 O 4, Zn. Fe 2 O 4,

Восстановительные свойства Fe 2+ … Со 2+ … Ni 2+ Восстановительные свойства Fe 2+- энергичный Ni 2+, Со 2+ - слабые восстановитель восстановители Сила окислителя Fe(OH)2 + O 2 + H 2 O Fe. OOH сила вос-ля Co(OH)2 + H 2 O 2 Co. OOH Ni(OH)2 +Br 2 +Na. OH Ni. OOH +Na. Br+…

Важнейшие соединения железа Fe. II Fe. SO 4 • 7 H 2 O (NH 4)2 SO 4 • Fe. SO 4 • 6 H 2 O — соль Мора Соли Fe(II) — активные восстановители, легко окисляются и переходят в Fe(III) Fe. SO 4 + Cl 2 = Fe. Cl 3 + Fe 2(SO 4)3 Fe. SO 4+ KMn. O 4 + H 2 SO 4 Fe 2(SO 4)3+ Mn. SO 4 + …

Fe. III Соли Fe(III) в р-рах сильно гидролизованы Fe 3+ + H 2 O Fe. OH 2+ + H+ [Fe(H 2 O)6]3+ + 2 H 2 O [Fe(H 2 O)5 OH]2+ + Н 5 О 2+ (H + • 2 H 2 O) 2[Fe(H 2 O)5 OH]2+ [(H 2 O)4 Fe(OH)2 Fe(H 2 O)4]4+ + 2 H 2 O Мостиковые лиганды многоядерного КС
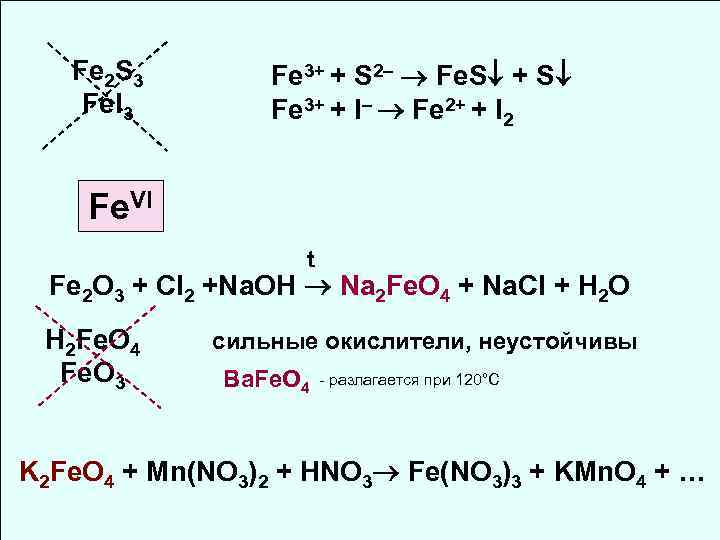
Fe 2 S 3 Fe 3+ + S 2– Fe. S + S Fe. I 3 Fe 3+ + I– Fe 2+ + I 2 Fe. VI t Fe 2 O 3 + Cl 2 +Na. OH Na 2 Fe. O 4 + Na. Cl + H 2 O H 2 Fe. O 4 сильные окислители, неустойчивы Fe. O 3 Ba. Fe. O 4 - разлагается при 120°С K 2 Fe. O 4 + Mn(NO 3)2 + HNO 3 Fe(NO 3)3 + KMn. O 4 + …

Комплексные соединения Fe, Co, Ni Fe Амминокомплексы нехарактерны Ацидокомплексы: Fe 3+ + 6 SCN– ⇄ [Fe(SCN)6]3 6 F– + [Fe(SCN)6]3 = [Fe. F 6]3 + 6 SCN– Kн(1) > Kн(2)
![K 4[Fe. II(CN)6] K 3[Fe. III(CN)6] Жёлтая кровяная соль Красная кровяная соль Yellow K 4[Fe. II(CN)6] K 3[Fe. III(CN)6] Жёлтая кровяная соль Красная кровяная соль Yellow](https://present5.com/presentation/3/26150394_165585498.pdf-img/26150394_165585498.pdf-15.jpg)
K 4[Fe. II(CN)6] K 3[Fe. III(CN)6] Жёлтая кровяная соль Красная кровяная соль Yellow — четыре Red — три Fe. Cl 3 Fe. Cl 2 KFe. IIIFe. II(CN)6 Берлинская лазурь (турнбулева синь) Желтая кровяная Красная кровяная соль используется соль используется для обнаружения для обнаружения ионо Fe(III) ионов Fe(II)
![Co H 2 O [Co(H 2 O)6]2+ + 6 SCN– ⇄ [Co(SCN)4]2– +6 H Co H 2 O [Co(H 2 O)6]2+ + 6 SCN– ⇄ [Co(SCN)4]2– +6 H](https://present5.com/presentation/3/26150394_165585498.pdf-img/26150394_165585498.pdf-16.jpg)
Co H 2 O [Co(H 2 O)6]2+ + 6 SCN– ⇄ [Co(SCN)4]2– +6 H 2 O C 2 H 5 OH O 2 медленно [Co(NH 3)6]2+ [Co(NH 3)6]3+ Н 2 О 2 быстро Со. Сl 2 + KNO 2 + HCl K 3[Co(NO 2)6] + NO + … Для обнаружения ионов калия
![Ni Na 2[Ni(CN)4] [Ni(NH 3)6]Br 2 Диамагнетик Парамагнетик Квадратная Октаэдрическая структура dsp 2 sp Ni Na 2[Ni(CN)4] [Ni(NH 3)6]Br 2 Диамагнетик Парамагнетик Квадратная Октаэдрическая структура dsp 2 sp](https://present5.com/presentation/3/26150394_165585498.pdf-img/26150394_165585498.pdf-17.jpg)
Ni Na 2[Ni(CN)4] [Ni(NH 3)6]Br 2 Диамагнетик Парамагнетик Квадратная Октаэдрическая структура dsp 2 sp 3 d 2 H 3 C — C — CH 3 ║ ║ H—O—N N—O—H Диметилглиоксим (HD)
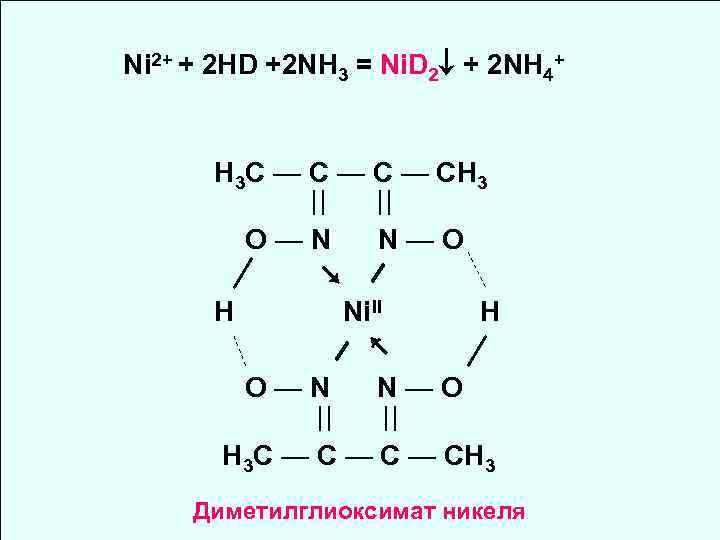
Ni 2+ + 2 HD +2 NH 3 = Ni. D 2 + 2 NH 4+ H 3 C — C — CH 3 O—N N—O ↘ H Ni. II H ↖ O—N N—O H 3 C — C — CH 3 Диметилглиоксимат никеля
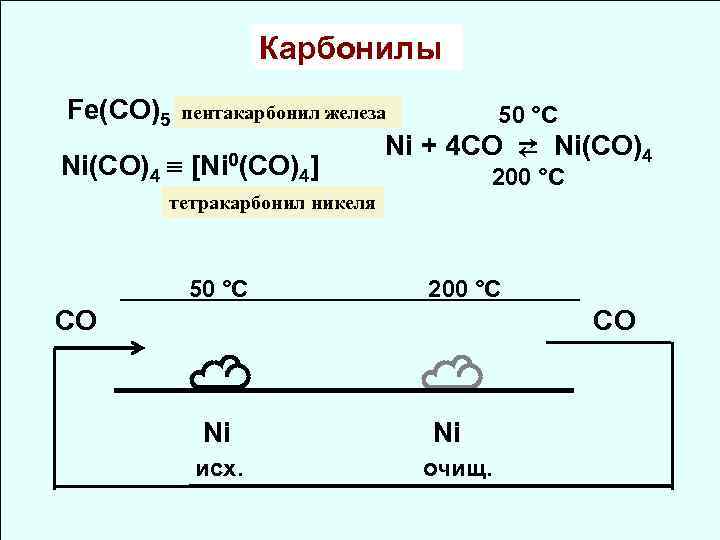
Карбонилы Fe(CO)5 пентакарбонил железа 50 °C Ni + 4 CO ⇄ Ni(CO)4 [Ni 0(CO) 4] 200 °C тетракарбонил никеля 50 °C 200 °C CO СО ☁ Ni исх. очищ.

Дополнительный материал о производстве чугуна, стали, никеля и кобальта смотрите на сайте кафедры. Лекция № 10 Fe, Co, Ni

Лекция № 10 ЖЕЛЕЗО, КОБАЛЬТ, НИКЕЛЬ

Fe Природные руды: Fe 2 O 3 -гематит; Fe. O·Cr 2 O 3 - хромистый железняк Fe. S 2 – пирит (железный колчедан) Cu. Fe. S 2 – халькопирит Черные металлы – это сплавы железа с другими элементами и в первую очередь с углеродом Черные металлы делятся на три группы: железо (техническое) – до 0, 02 % C, сталь – 0, 02 -2, 14 % C и чугун – 2, 14 -7 % C

Черная металлургия – отрасль промышленности, которая занимается извлечением железа из руд и переработкой черных металлов Рудная база черной металлургии: Красные железняки – минерал –гематит – Fe 2 O 3 Магнитные железняки – минерал- магнетит –Fe 3 O 4 Бурые железняки – минерал – гидроксид железа – Fe 2 O 3 · n. H 2 O Сидериты – минерал – Fe. CO 3 Пустая порода: Si. O 2, Al 2 O 3, Ca. O, Mg. O Полезные примеси: Mn, V, Cr, Ni и др. Вредные примеси: S, P, As, Zn.

ПОЛУЧЕНИЕ ЖЕЛЕЗА Современное производство железа включает в себя четыре стадии: I стадия: подготовка железных руд к плавке, II стадия : доменное производство, III стадия: сталеплавильное производство, IV стадия: получение различных марок стали I стадия Подготовка железных руд к плавке включает следующие операции: дробление, измельчение, грохочение, классификация, обогащение, усреднение, окускование. Cамым распространенным способом обогащения железных руд является электромагнитное, реже гравитационное, очень редко флотация. В результате обогащения содержание железа увеличивается в 2 раза (с 33 до 65 %), а количество пустой породы уменьшается в 5 раз.

II стадия – доменное производство Доменная печь – основной агрегат для извлечения железа из железной руды. Шихта доменной печи: железорудный материал, кокс (топливо), флюс (Сa. CO 3) Доменный процесс относится к типу противоточных: сверху вниз опускаются шихтовые материалы, а снизу вверх поднимается горячий газ, который нагревает шихту и одновременно участвует в восстановительных процессах.

Доменная печь (К) – колошник; (Ш) – шахта; (Р) – распар; (З) – заплечики; (Ф) – фурменные отверстия; (Л) – летка; (Г) - горн 1 – скипы; 2 – засыпной аппарат; 3 – огнеупорный кирпич; 4 – система охлаждения; 5 – воздухопровод; 6 – шлак; 7 – чугун; 8 – чугуновозный ковш; 9 – шлаковозный ковш

Химические процессы в доменной печи Главным химическим процессом является восстановление оксидов железа. Из трех реагентов-восстановителей: C, CO и Н 2 основным является СО. Процесс восстановления железа из оксидов протекает ступенчато путем перехода от высших оксидов к низшим по схеме: Fe 2 O 3 Fe 3 O 4 Fe. O Fe (выше 570 ºС) или Fe 2 O 3 Fe 3 O 4 Fe (ниже 570 ºС. При температурах 500 – 1000ºС последовательно идут следующие реакции: 3 Fe 2 O 3 + CO = 2 Fe 3 O 4 + Q 3 Fe 2 O 3 + H 2 = 2 Fe 3 O 4 + H 2 O -Q Fe 3 O 4 + CO = 3 Fe. O + CO 2 -Q Fe 3 O 4 + H 2 = 3 Fe. O + H 2 O - Q Fe. O + CO = Fe + CO 2 +Q Fe. O + H 2 = Fe + H 2 O - Q При температурах 1200 -1300ºС идет реакция прямого восстановления: Fe. O + C = Fe +CO -Q

Восстановление оксидов попутных элементов: Восстановление оксида марганца: Mn. O + C = Mn + CO - Q Восстановление оксида фосфора: P 2 O 5 + 5 C = 2 P + 5 CO - Q Восстановление оксида кремния: Si. O 2 + 2 C = Si + 2 CO - Q Диссоциация карбонатных соединений: Ca. CO 3 = Ca. O + CO 2 - Q Образование чугуна (науглероживание железа): 3 Fe + 2 CO = Fe 3 C + CO 2 карбид железа Cодержание углерода в чугуне в виде карбида железа и твердых частиц графита может колебаться от 2 до 7 %. Кроме углерода в чугуне содержатся другие примеси: cилициды, сульфиды, фосфиды железа и др. Чугун имеет ограниченную область применения, так как он хрупок, не обладает пластичностью, имеет низкую ударную прочность
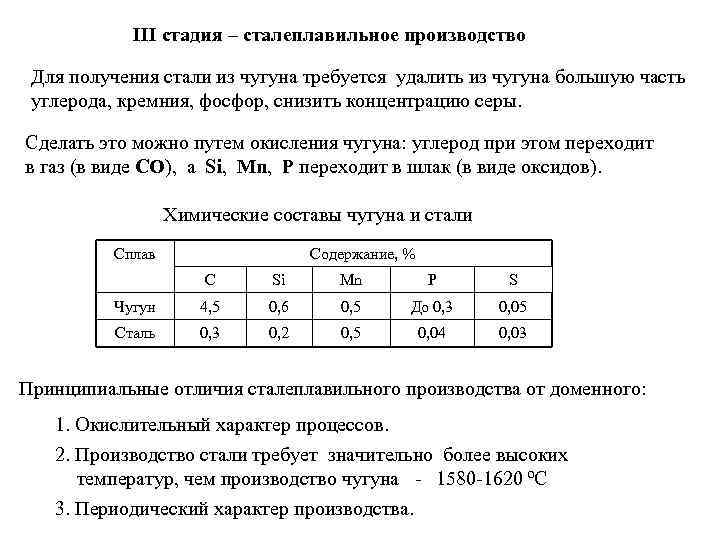
III стадия – сталеплавильное производство Для получения стали из чугуна требуется удалить из чугуна большую часть углерода, кремния, фосфор, снизить концентрацию серы. Cделать это можно путем окисления чугуна: углерод при этом переходит в газ (в виде СО), а Si, Mn, P переходит в шлак (в виде оксидов). Химические составы чугуна и стали Сплав Содержание, % C Si Mn P S Чугун 4, 5 0, 6 0, 5 До 0, 3 0, 05 Сталь 0, 3 0, 2 0, 5 0, 04 0, 03 Принципиальные отличия сталеплавильного производства от доменного: 1. Окислительный характер процессов. 2. Производство стали требует значительно более высоких температур, чем производство чугуна - 1580 -1620 ºC 3. Периодический характер производства.

Основные агрегаты производства стали: конвертер, мартеновская печь, электропечь. Характер основных химических процессов одинаков для всех трех агрегатов. При плавлении шихты образуется жидкая металлическая ванна и покрывающий ее расплавленный шлак. Главным периодом процесса является окислительный, в ходе которого удаляется (выгорает) избыточное количество углерода. Обезуглероживание стали происходит путем окисления карбида железа и твердого углерода (графита). Воздух или кислород подается напосредственно в металл. Основные реакции при плавлении шихты Fe 3 C + H 2 O = 3 Fe + CO + H 2 C +H 2 O = CO +H 2 (800 -1000 ºС) 2 Fe 3 C + O 2 = 6 Fe + 2 CO 2 С + О 2 = 2 СО (600 -700 ºС) Fe 3 C + 3 O 2 = Fe 3 O 4 + CO 2 (600 -700 ºС) 2 C + CO 2 = 2 CO Fe 3 C +СO 2 = 3 Fe + 2 CO C + 2 H 2 = CH 4 (600 ºC) Fe 3 C + 2 H 2 = 3 Fe + CH 4

Газы (окислители), вызывающие обезуглероживание стали – Н 2 О, CO 2, O 2 и Н 2. Наиболее сильным обезуглероживающим воздействием обладает Н 2 О, а наиболее слабым – Н 2. Одновременно окисляются примеси чугуна: [Si] + O 2 = (Si. O 2) + Q; [Mn] + O 2 = (Mn. O) + Q; [P] + O 2 = (P 2 O 5) + Q После операции плавления шихты проводится операция раскисления стали, которая служит для удаления избыточного кислорода. В качестве раскислителей служат элементы, обладающие более высоким сродством к кислороду, чем железо или углерод. Такими элементами- раскислителями могут быть: Mn; Si; Al, а также Ni; Zr; Ca. Продуктами раскисления являются твердые частички Si. O 2; Mno; Al 2 O 3, которые переходят в шлак.

Для получения высококачественной стали осуществляют ее легирование, т. е. добавляют в нее в небольших количествах легирующие элементы - V; Ti; Mn; Cr; Ni. В большинстве случаев их вводят в виде ферросплавов. Легирующие добавки связывают вредные вещества (сера, фосфор и др. ) и уводят их в шлак, повышая качество стали. Добавки марганца, хрома, молибдена повышают прочность стали. Стали, легированные кобальтом и никелем, называются самозакаливающимися, отличаются высокой твердостью.
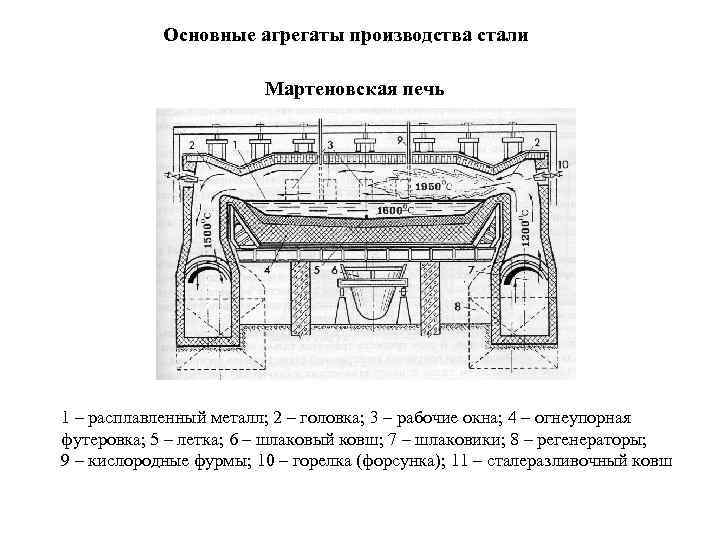
Основные агрегаты производства стали Мартеновская печь 1 – расплавленный металл; 2 – головка; 3 – рабочие окна; 4 – огнеупорная футеровка; 5 – летка; 6 – шлаковый ковш; 7 – шлаковики; 8 – регенераторы; 9 – кислородные фурмы; 10 – горелка (форсунка); 11 – сталеразливочный ковш
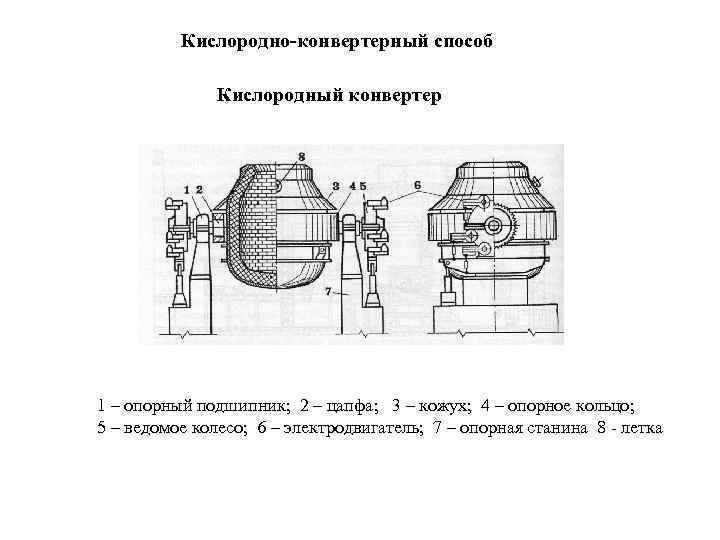
Кислородно-конвертерный способ Кислородный конвертер 1 – опорный подшипник; 2 – цапфа; 3 – кожух; 4 – опорное кольцо; 5 – ведомое колесо; 6 – электродвигатель; 7 – опорная станина 8 - летка
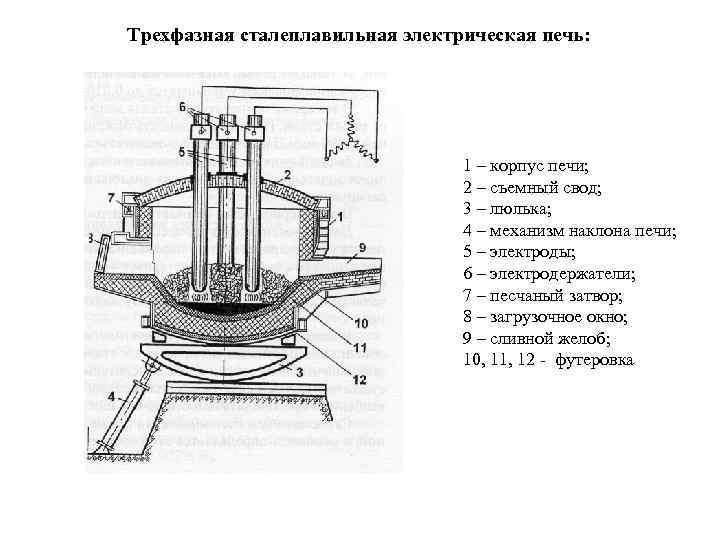
Трехфазная сталеплавильная электрическая печь: 1 – корпус печи; 2 – cъемный свод; 3 – люлька; 4 – механизм наклона печи; 5 – электроды; 6 – электродержатели; 7 – песчаный затвор; 8 – загрузочное окно; 9 – сливной желоб; 10, 11, 12 - футеровка

Ni ПОЛУЧЕНИЕ НИКЕЛЯ Производство никеля относится к цветной металлургии Рудная база никеля Природные руды делятся на сульфидные и гидросиликатные (окисленные). В окисленных рудах никель находится в виде силикатов типа: m(Ni. O; Mg. O)·n. Si. O 2·p. H 2 O. В рудах присутствуют Со; Cr и металлы платиновой группы. В пустой породе содержатся железо, алюминий, магний и др. Сульфидные руды – это комплексные руды, как правило медно- никелевые. В них содержатся минералы: халькопирит Cu. Fe. S 2, магнитный колчедан Fe. S, пентландит состава (Fe, Ni)9 S 8, миллерит Ni. S. Также в них есть Au, Ag, Pt, Ir, Ru, Os, Te, Pb.

Переработка окисленных руд 1. Плавка в шахтной печи. Цель – перевод никеля в штейн, а пустой породы в шлак. Основной процесс, протекающий в шахтной печи – это восстановительно-сульфидирующая плавка: Ni. Si. O 3 + Ca. S Ni. S (или Ni 3 S 2) + Ca. Si. O 3 Ni. Si. O 3 + Fe. S Ni. S (или Ni 3 S 2) + Fe. Si. O 3 Плавка проводится при температуре 1450 -1500 ºС. Топливом служит кокс, в качестве сульфидизатора используют пирит (Fe. S 2) или гипс (Ca. SO 4· 2 H 2 O), которые разлагаются в печи с образованием Ca. S и Fe. S. Cплав сульфидов железа и никеля образует штейн, а окислы переходят в шлак. Cодержание никеля в штейне по сравнению исходной рудой повышается с 0, 9 -1, 5 % до 16 -20 %.

2. Конвертирование штейнов. Главной задачей конвертирования является полное удаление из штейна железа путем перевода его в шлак. Конвертирование заключается в продувке штейна воздухом при добавлении в конвертер кварца. Основными реакциями являются реакции окисления сульфида железа и перевода окислов железа в шлак: 2 Fe + O 2 + Si. O 2 = Fe 2 Si. O 4 3 Fe + SO 2 = 2 Fe. O + Fe. S 2 Fe. S + 3 O 2 + Si. O 2 = Fe 2 Si. O 4 + 2 SO 2 В результате конвертерной продувки получается белый штейн или файнштейн, который представляет собой сплав Ni 3 S 2 и Ni с небольшим количеством примесей. Cодержание никеля в файнштейне составляет около 78 %.

3. Окислительный обжиг файнштейна Ni 3 S 2 Ni. O Главная задача окислительного обжига – перевести сульфид в оксид никеля или (закись никеля). Обжиг проводят в печах кипящего слоя (КС) при температуре 1000 -1050 ºС при большом избытке воздуха. 4. Восстановительная плавка Ni. O + C = Ni + CO Для получения никеля из закиси никеля проводят восстановительную плавку в электрических печах. В качестве восстановителя используется древесный уголь или кокс. Для удаления серы и шлакования примесей в печь добавляют известь. Получающийся расплав с содержанием никеля не менее 98, 3 % и меди не более 0, 6 % гранулируют в воде.

Переработка сульфидных медно-никелевых руд Принципиальная технологическая схема обогащение плавка конвертирование руда концентрат штейн файнштейн отделение меди обжиг восстановительная плавка Ni 3 S 2 Ni. O Ni 1. Обогащение. Для отделения Cu –Ni- минералов от пустой породы руду измельчают и обогащают методом флотации. До обогащения руда содержала Ni – 0, 3 -1, 5 % ; Cu – 0, 2 -2, 5 %. После обогащения в полученном концентрате Ni – 3, 6 -6, 5 % ; Cu – 3, 0 -6, 0 %. 2. Плавка концентрата проводится для удаления серы в виде сернистого газа. В процессе плавки сульфиды никеля и меди переходят в штейн, железо переходит в шлак. Плавка проводится в шахтных, отражательных или электродуговых печах. Содержание меди и никеля в штейне достигает 15 -25 %.

3. Конвертирование. Плавка на файнштейн, осуществляется в конвертере. Продувая воздух через расплав, выжигают и переводят в шлак большую часть примесей, главным образом легкоокисляющееся железо. Содержание сульфидов в файнштейне достигает 80 %. 4. Отделение меди от никеля. Существует несколько способов, например разделение флотацией. В результате получают медный концентрат, содержащий Сu – 70 -73 % , и никелевый концентрат с содержанием Ni - 75 - 78 %. Медный концентрат перерабатывается на получение меди. 5. Обжиг и восстановительная плавка. 2 Ni 3 S 2 + 7 O 2 = 6 Ni. O + 4 SO 2 2 Ni. O + CO +H 2 = 2 Ni + CO 2 + H 2 O t = 350 ºC
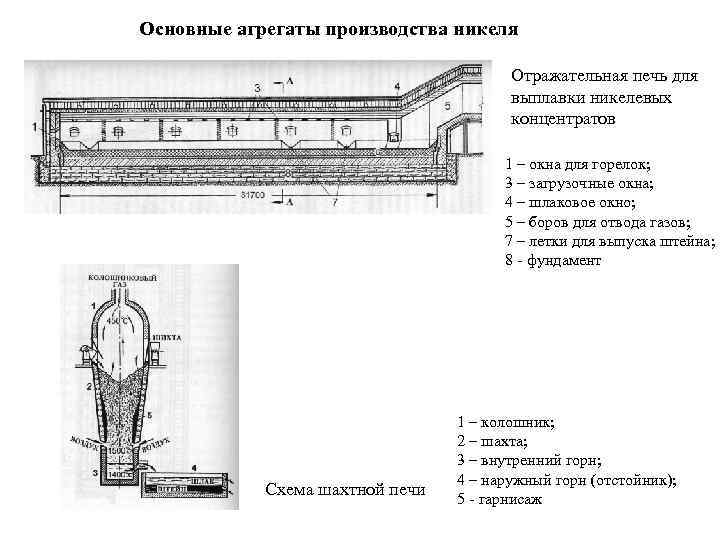
Основные агрегаты производства никеля Отражательная печь для выплавки никелевых концентратов 1 – окна для горелок; 3 – загрузочные окна; 4 – шлаковое окно; 5 – боров для отвода газов; 7 – летки для выпуска штейна; 8 - фундамент 1 – колошник; 2 – шахта; 3 – внутренний горн; 4 – наружный горн (отстойник); Схема шахтной печи 5 - гарнисаж

Со Производство кобальта, также как и никеля , относится к цветной металлургии. Рудная база кобальта Кобальт присутствует обычно как примесь в минералах никеля. Это серо - или мышьякосодержащие минералы - пентландит (Fe, Ni)9 S 8; никелин Ni. As. Cобственные минералы кобальта: кобальтин – Со. Аs. S; смальтит - Со. As Металлический кобальт получают путем пирометаллургического передела с последующей гидрометаллургической переработкой.

Принципиальная схема производства кобальта обжиг обработка HCl очистка от Fe руда Co. O р-р Co. Cl 2 кокс окисление Со. II до Co. III прокалка восстановление Co(OH)3 Co 3 O 4 Co хлорная известь кокс I стадия – обжиг – сульфид кобальта переходит в оксид (с примесью оксидов других металлов). Примеси мышьяка и серы улетучиваются в форме As 2 O 3 и SO 2. II стадия – смесь оксидов обрабатывают соляной кислотой, чтобы перевести кобальт и сопутствующие элементы-металлы в раствор в виде хлоридов.

III стадия – очистка раствора от железа – через раствор пропускают Сl 2 чтобы окислить. Fe. II до Fe. III, а затем нейтрализуют его карбонатом кальция. В результате гидролиза солей железа (III) выпадает осадок гидроксида и основных хлоридов железа(III), который отделяют фильтрованием. IV стадия – окисление Со. II до Со. III путем добавления белильной (хлорной) извести. Кобальт (III) образует осадок малорастворимого гидроксида Со(ОН)3: 2 Co. Cl 2 + Ca. OCl 2 + 2 Ca(OH)2 + H 2 O = 2 Co(OH)3 + 3 Ca. Cl 2 белильная известь

t V стадия – прокалка Co(OH)3: Co(OH)3 Co 3 O 4 + H 2 O VI стадия – восстановление кобальта коксом или древесным углем: Co 3 O 4 + 4 C = 3 Co + 4 CO Образующийся порошкообразный металлический кобальт прессуют и сплавляют в электропечи для получения монолита.

Сплавы на основе кобальта и никеля Кобальтсодержащие сплавы. Виталиум (65 % Co, 25 % Cr, 3 % Ni, 4 % Mo) – химически инертный Стеллит (35 -55 % Co, 20 -35 % Cr, 9 -15 % Fe, 2 % C) - cверхтвердый Самарий-кобальтовый сплав – мощные магниты Никельсодержащие сплавы. Нихром (67, 5 Ni, 16 % Fe, 15 % Cr, 1, 5 % Mn) – высокая жаростойкость Константан (40 % Ni, 60 % Cr) и хромель (89 % Ni, 10 % Cr, 1 % Co) – для изготовления термопар Монель-металл (68 % Ni, 2, 5 % Fe, 28 % Cr, 1, 5 % Mn) - высокопрочный Мельхиор (18 -20 % Ni, остальное - Cu) – столовые приборы, приборы точной механики Никельсодержащие стали (5 -10 % Ni, 18 -25 % Cr, 0, 14 % C) - нержавеющие
Слайд_к_л_10.ppt