Lek_10khim2.pptx
- Количество слайдов: 18
 Лекция № 10 1. Химические системы, превращения и процессы. 2. Энергетика химических процессов. Тепловой эффект реакции. Закон Гесса. 3. Закон сохранения массы в химических системах.
Лекция № 10 1. Химические системы, превращения и процессы. 2. Энергетика химических процессов. Тепловой эффект реакции. Закон Гесса. 3. Закон сохранения массы в химических системах.
 1. Химические системы, превращения, процессы. Хим. система – это совокупность хим. веществ, находящихся во взаимодействии. Хим. реакция – это превращение одних веществ в другие, отличные по хим. составу и (или) строению. Химический процесс– совокупность физических и химических явлений, направленных на получение целевого продукта. Он складывается из трех основных стадий:
1. Химические системы, превращения, процессы. Хим. система – это совокупность хим. веществ, находящихся во взаимодействии. Хим. реакция – это превращение одних веществ в другие, отличные по хим. составу и (или) строению. Химический процесс– совокупность физических и химических явлений, направленных на получение целевого продукта. Он складывается из трех основных стадий:
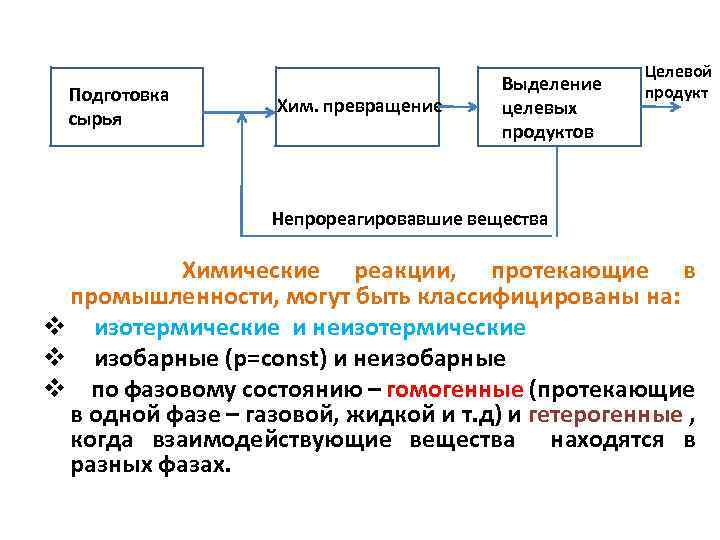 Подготовка ПП сырья Хим. превращение Хим Выделение ьб целевых продуктов Целевой продукт Непрореагировавшие вещества Химические реакции, протекающие в промышленности, могут быть классифицированы на: v изотермические и неизотермические v изобарные (р=const) и неизобарные v по фазовому состоянию – гомогенные (протекающие в одной фазе – газовой, жидкой и т. д) и гетерогенные , когда взаимодействующие вещества находятся в разных фазах.
Подготовка ПП сырья Хим. превращение Хим Выделение ьб целевых продуктов Целевой продукт Непрореагировавшие вещества Химические реакции, протекающие в промышленности, могут быть классифицированы на: v изотермические и неизотермические v изобарные (р=const) и неизобарные v по фазовому состоянию – гомогенные (протекающие в одной фазе – газовой, жидкой и т. д) и гетерогенные , когда взаимодействующие вещества находятся в разных фазах.
 v По порядку реакции т. е. по сумме показателей степеней концентраций реагирующих веществ в уравнении скорости реакции. v По механизму различают реакции: - простые А В - последовательные А В D - параллельные А В В D - обратимые А В и необратимые v В зависимости от наличия катализаторов – каталитические и некаталитические. v По тепловому эффекту – экзотермические и эндотермические.
v По порядку реакции т. е. по сумме показателей степеней концентраций реагирующих веществ в уравнении скорости реакции. v По механизму различают реакции: - простые А В - последовательные А В D - параллельные А В В D - обратимые А В и необратимые v В зависимости от наличия катализаторов – каталитические и некаталитические. v По тепловому эффекту – экзотермические и эндотермические.
 Хим. системы создаются за счет хим. связей – совокупности сил, действующих между атомами или группой атомов. В молекулах различают три основных типа хим связей: Ø Ковалентная – образуется за счет общих электронных пар; Ø Ионная – хим. связь между заряженными частицами – ионами; Ø Металлическая –хим. связь, основанная на обобществлении валентных электронов, которые принадлежат всем атомам в кристалле хим. системы.
Хим. системы создаются за счет хим. связей – совокупности сил, действующих между атомами или группой атомов. В молекулах различают три основных типа хим связей: Ø Ковалентная – образуется за счет общих электронных пар; Ø Ионная – хим. связь между заряженными частицами – ионами; Ø Металлическая –хим. связь, основанная на обобществлении валентных электронов, которые принадлежат всем атомам в кристалле хим. системы.
 2. Энергетика химических процессов. Тепловой эффект реакции. Закон Гесса. С точки зрения термодинамики энергетическое состояние системы характеризуют следующие параметры: P – давление T– V– U– H– S– G- температура объем внутренняя энергия энтальпия вещества энтропия энергия Гиббса
2. Энергетика химических процессов. Тепловой эффект реакции. Закон Гесса. С точки зрения термодинамики энергетическое состояние системы характеризуют следующие параметры: P – давление T– V– U– H– S– G- температура объем внутренняя энергия энтальпия вещества энтропия энергия Гиббса
 Внутренняя энергия вещества (U) – это энергия теплового (поступательного, вращательного и колебательного) движения молекул и потенциальная энергия их взаимодействия. 1 начало термодинамики: (Количество теплоты, сообщенное телу, идет на увеличение его внутренней энергии и совершение работы).
Внутренняя энергия вещества (U) – это энергия теплового (поступательного, вращательного и колебательного) движения молекул и потенциальная энергия их взаимодействия. 1 начало термодинамики: (Количество теплоты, сообщенное телу, идет на увеличение его внутренней энергии и совершение работы).
![Для изобарного процесса (p=const): Функция энтальпия или теплосодержание [к. Дж/моль]. Отличительной чертой хим. реакций Для изобарного процесса (p=const): Функция энтальпия или теплосодержание [к. Дж/моль]. Отличительной чертой хим. реакций](https://present5.com/presentation/64122165_133235780/image-8.jpg) Для изобарного процесса (p=const): Функция энтальпия или теплосодержание [к. Дж/моль]. Отличительной чертой хим. реакций является глубокое изменение системы взаимодействующих веществ, сопровождающееся выделением или поглощением энергии.
Для изобарного процесса (p=const): Функция энтальпия или теплосодержание [к. Дж/моль]. Отличительной чертой хим. реакций является глубокое изменение системы взаимодействующих веществ, сопровождающееся выделением или поглощением энергии.
 Раздел химической термодинамики, изучающий тепловые эффекты химических реакций и процессов, называется термохимией. Из 1 начала термодинамики следует, что теплота поглощенная или выделившаяся в процессе т. е. тепловой эффект (при P=const) равна изменению энтальпии системы.
Раздел химической термодинамики, изучающий тепловые эффекты химических реакций и процессов, называется термохимией. Из 1 начала термодинамики следует, что теплота поглощенная или выделившаяся в процессе т. е. тепловой эффект (при P=const) равна изменению энтальпии системы.
 В термохимии приняты знаки, противоположные используемым в термодинамике (ТД). Теплота, выделенная системой, считается положительной. При этом с точки зрения ТД система теряет энергию т. е. Q > 0 , ∆H < 0 - реакция экзотермическая. Полученная системой теплота считается отрицательной: Q < 0 , ∆H > 0 - реакция эндотермическая
В термохимии приняты знаки, противоположные используемым в термодинамике (ТД). Теплота, выделенная системой, считается положительной. При этом с точки зрения ТД система теряет энергию т. е. Q > 0 , ∆H < 0 - реакция экзотермическая. Полученная системой теплота считается отрицательной: Q < 0 , ∆H > 0 - реакция эндотермическая
 Для практических расчетов очень важно, что тепловой эффект реакции не зависит от промежуточных стадий, а зависит лишь от начального и конечного состояний системы. Этот закон открыл в 1840 г. русский академик Гесс. Закон представляет собой химическое выражение первого начала ТД. Например, CO 2 можно получить двумя способами: 1) 2) С + О 2 = СО 2 + ∆H 1 С + О 2 = СО + ∆H 2 СО + О 2 = СО 2 + ∆H 3
Для практических расчетов очень важно, что тепловой эффект реакции не зависит от промежуточных стадий, а зависит лишь от начального и конечного состояний системы. Этот закон открыл в 1840 г. русский академик Гесс. Закон представляет собой химическое выражение первого начала ТД. Например, CO 2 можно получить двумя способами: 1) 2) С + О 2 = СО 2 + ∆H 1 С + О 2 = СО + ∆H 2 СО + О 2 = СО 2 + ∆H 3
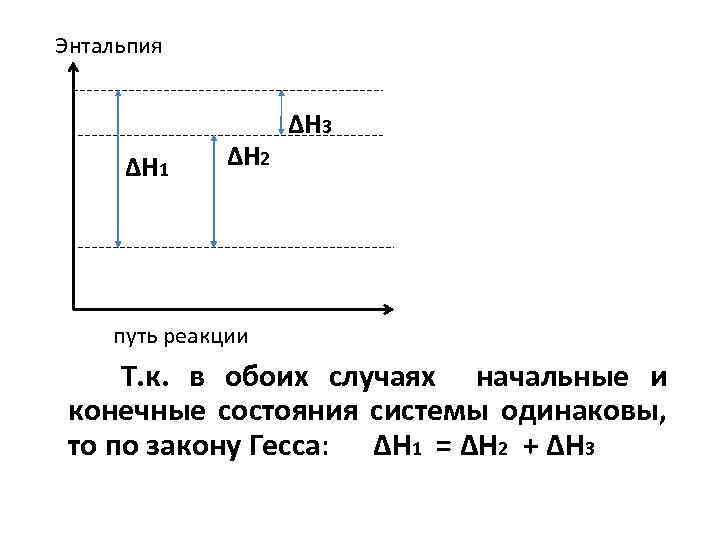 Энтальпия ∆H 1 ∆H 2 ∆H 3 путь реакции Т. к. в обоих случаях начальные и конечные состояния системы одинаковы, то по закону Гесса: ∆H 1 = ∆H 2 + ∆H 3
Энтальпия ∆H 1 ∆H 2 ∆H 3 путь реакции Т. к. в обоих случаях начальные и конечные состояния системы одинаковы, то по закону Гесса: ∆H 1 = ∆H 2 + ∆H 3
 Тепловой эффект реакции может быть найден через энтальпии образования веществ (справочная величина). - стандартная энтальпия образования вещества i. (т. е. при Т=298 К, Р= 1 атм).
Тепловой эффект реакции может быть найден через энтальпии образования веществ (справочная величина). - стандартная энтальпия образования вещества i. (т. е. при Т=298 К, Р= 1 атм).
 Для полной характеристики состояния хим. системы требуется учесть еще энтропийный фактор – Энергетика хим. превращения определяется энергией Гиббса:
Для полной характеристики состояния хим. системы требуется учесть еще энтропийный фактор – Энергетика хим. превращения определяется энергией Гиббса:
 Энергия Гиббса характеризует динамику, направленность хим процесса. Если возможно самопроизвольное протекание реакции. - реакция невозможна. - система в равновесии.
Энергия Гиббса характеризует динамику, направленность хим процесса. Если возможно самопроизвольное протекание реакции. - реакция невозможна. - система в равновесии.
 3. Закон сохранения массы в хим. системах. Закон сохранения массы широко используется при составлении материальных балансов. Материальный баланс рассчитывается для отдельного аппарата, стадии и всего процесса. По материальному балансу можно определить расход сырья для обеспечения заданной производительности.
3. Закон сохранения массы в хим. системах. Закон сохранения массы широко используется при составлении материальных балансов. Материальный баланс рассчитывается для отдельного аппарата, стадии и всего процесса. По материальному балансу можно определить расход сырья для обеспечения заданной производительности.
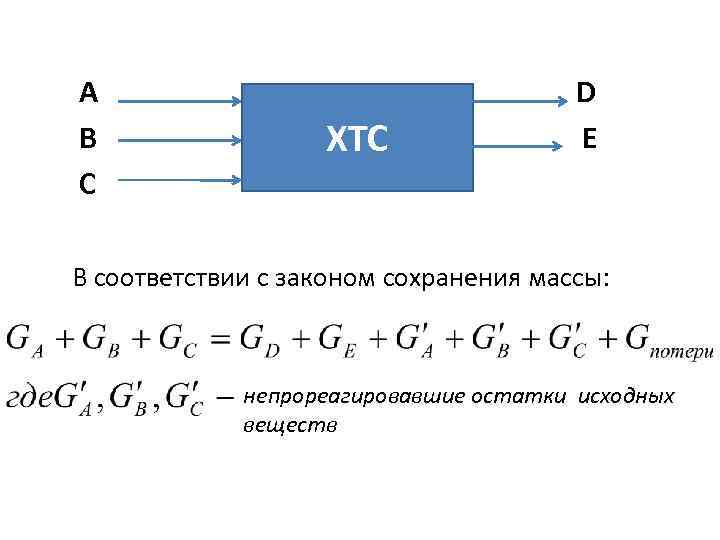 А В С ХТС D E В соответствии с законом сохранения массы: непрореагировавшие остатки исходных веществ
А В С ХТС D E В соответствии с законом сохранения массы: непрореагировавшие остатки исходных веществ
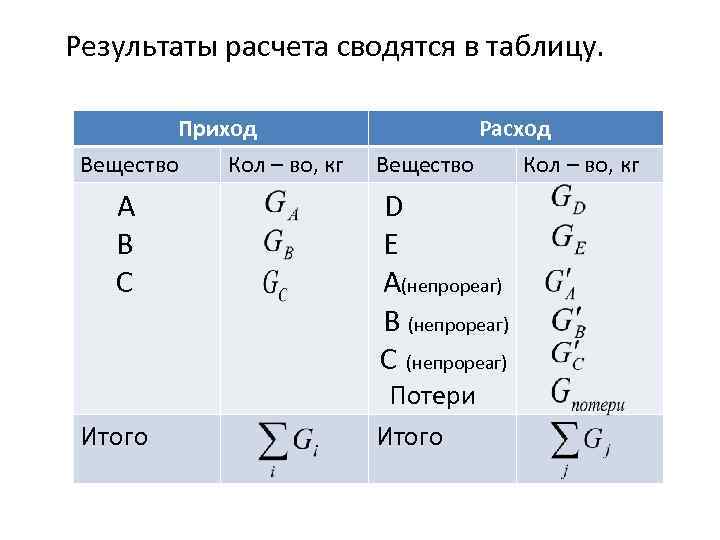 Результаты расчета сводятся в таблицу. Приход Вещество Кол – во, кг А В С Итого Расход Вещество Кол – во, кг D E A(непрореаг) В (непрореаг) С (непрореаг) Потери Итого
Результаты расчета сводятся в таблицу. Приход Вещество Кол – во, кг А В С Итого Расход Вещество Кол – во, кг D E A(непрореаг) В (непрореаг) С (непрореаг) Потери Итого


