
Лекция 1 Введение Белки. Часть 1

• Биохимия – наука о жизни на молекулярном уровне. • Биохимия изучает химические компоненты живых организмов, а также реакции и процессы (совокупность реакций), протекающие в них. • Все земные живые организмы обладают наследственной информацией и выполняют работу направленную на самоподдержание и размножение с использованием энергии полученной из внешней среды. • Минимальная единица жизни, способная к самовоспроизведению – клетка.
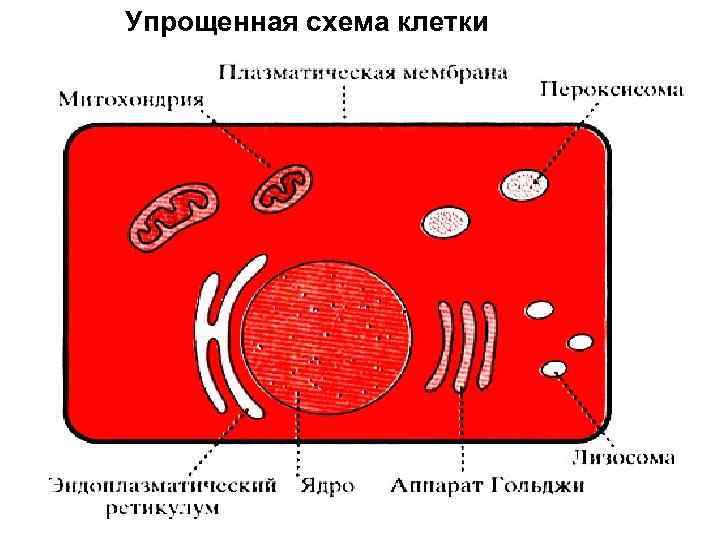
Упрощенная схема клетки
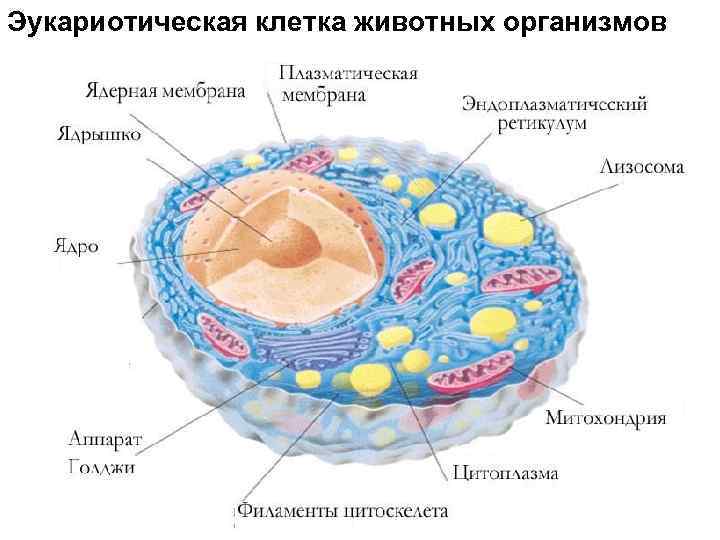
Эукариотическая клетка животных организмов
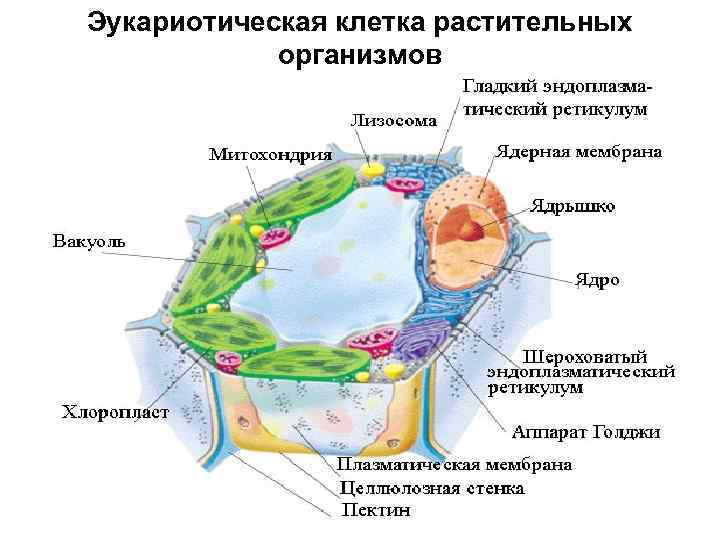
Эукариотическая клетка растительных организмов
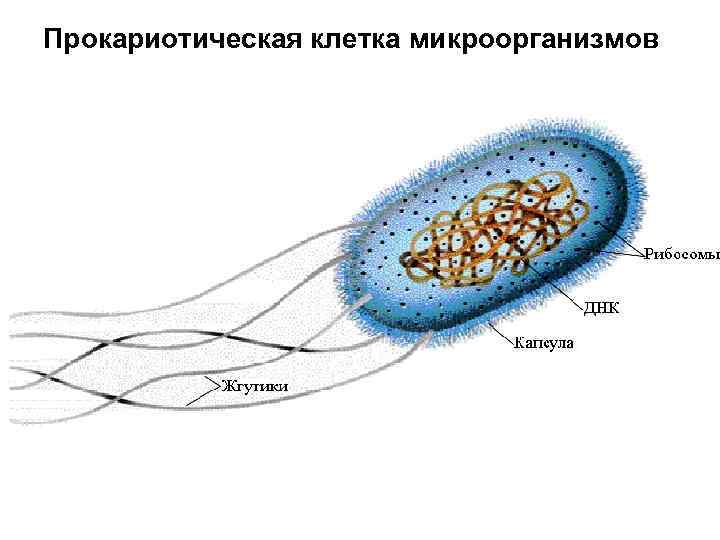
Прокариотическая клетка микроорганизмов

Основные классы биомолекул Белки Proteins Углеводы Carbohydrates Липиды Lipids Нуклеиновые кислоты Nucleic Acids Lipids Большинство биомолекул – соединения углерода с водородом, кислородом, азотом, фосфором или серой Макроэлементы: С, H, O, N, P, S Микроэлементы: Fe, Cu, Ca, K, Na, Mg, Se, Co …
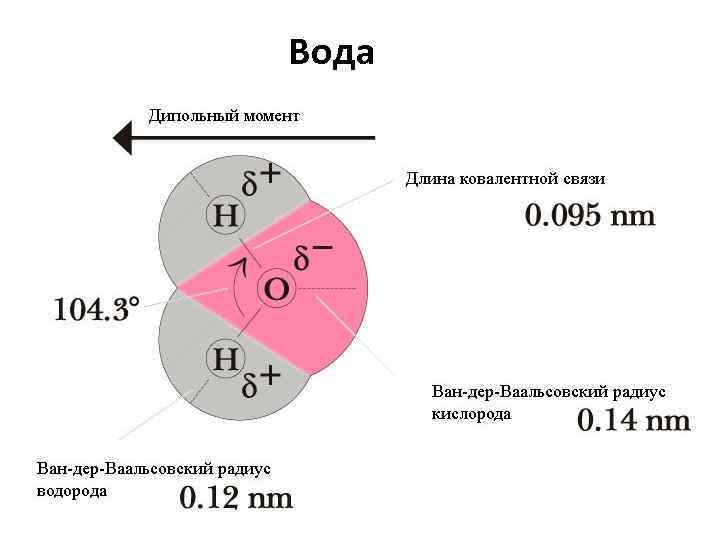
Вода
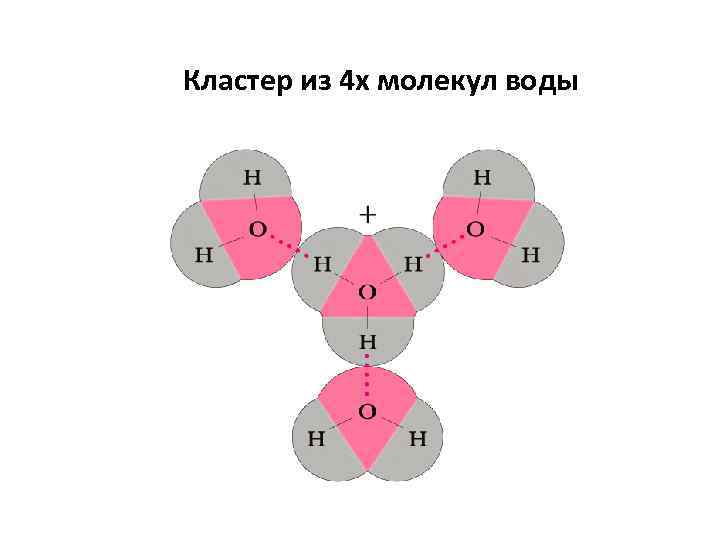
Кластер из 4 х молекул воды

Водородные связи (Н-связи) Атом водорода, связанный с сильно электроотрицательным элементом (азотом, кислородом, фтором и др. ), испытывает недостаток электронов и поэтому способен взаимодействовать с неподеленной парой электронов другого электроотрицательного атома этой же или другой молекулы. В результате возникает водородная связь, которая графически обозначается тремя точками: Эта связь значительно слабее других химических связей (энергия ее образования 10 -40 к. Дж/моль) и в основном определяется электростатическим и донорно-акцепторным взаимодействиями.
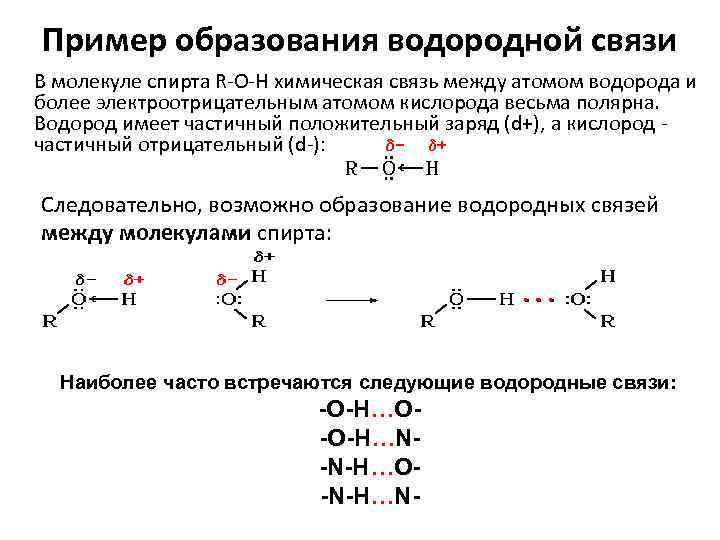
Пример образования водородной связи В молекуле спирта R-O-H химическая связь между атомом водорода и более электроотрицательным атомом кислорода весьма полярна. Водород имеет частичный положительный заряд (d+), а кислород - частичный отрицательный (d-): Следовательно, возможно образование водородных связей между молекулами спирта: Наиболее часто встречаются следующие водородные связи: -O-H…O-O-H…N-N-H…O-N-H…N-


Ионная связь Химическая связь, основанная на электростатическом притяжении ионов, называется ионной связью. Пример: Na+ Cl – Δχ = 3, 0(Cl) - 0, 9(Na) = 2, 1 Атом Na (1 электрон на внешнем уровне) и атом Cl (7 внешних электронов) превращаются в ионы Na+ и Cl- с завершенными внешними электронными оболочками (по 8 электронов), между которыми возникает электростатическое притяжение, т. е. ионная связь.
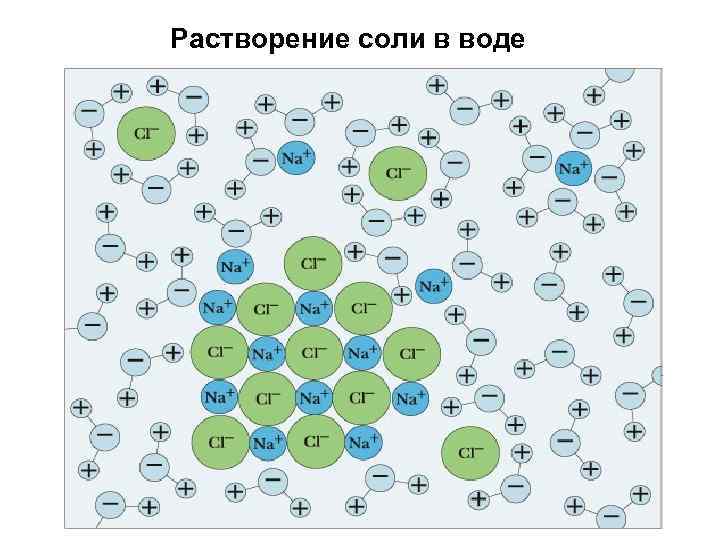
Растворение соли в воде

Ван-дер-ваальсовы силы (Van-der-Vaalse force) – это силы притяжения, возникающие между электрически нейтральными атомами и молекулами. Они обусловлены движением электронов в атомах, и в 10. . . 20 раз слабее, чем силы притяжения между ионами. Гекконы на вертикальной стене (средневековая гравюра)
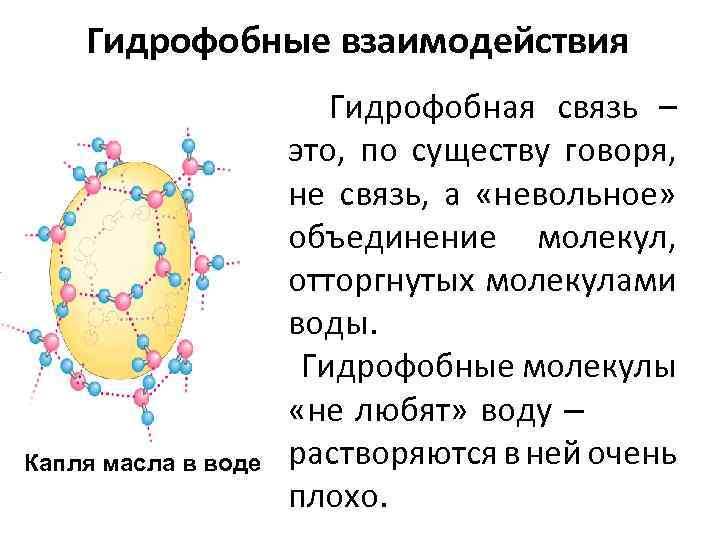
Гидрофобные взаимодействия Капля масла в воде Гидрофобная связь – это, по существу говоря, не связь, а «невольное» объединение молекул, отторгнутых молекулами воды. Гидрофобные молекулы «не любят» воду – растворяются в ней очень плохо.

Ковалентная связь Связь, образованная путем обобществления пары электронов связываемых атомов, называется ковалентной Ковалентная связь и, соответственно, молекула могут быть неполярными, когда оба связанных атома имеют одинаковое сродство к электрону, например Н : Н. Такая связь обладает максимальной прочностью. Она может быть полярной, когда электронная пара вследствие большего сродства к электрону одного из атомов оттянута в его сторону: H-Cl



Белки. Часть 1 Белки участвуют во всех биологических процессах, выполняя разнообразные функции. Каждый белок имеет уникальную, свойственную лишь ему структуру и в такой же мере уникальную функцию. Белки — и молекулярные машины, и строительные блоки, и оружие живой клетки. Белки - это высокомолекулярные соединения (полимеры), состоящие из L-α-аминокислот - мономерных звеньев, соединенных между собой пептидными (ковалентными) связями. Белки вирусов, бактерий, растений, животных и человека состоят из 20 L-α–аминокислот. Их общий признак наличие аминогруппы — NН 2 и карбоксильной группы — СООН у α углеродного атома. Кроме NН 2 и СООН у каждой аминокислоты имеется свой собственный радикал R.
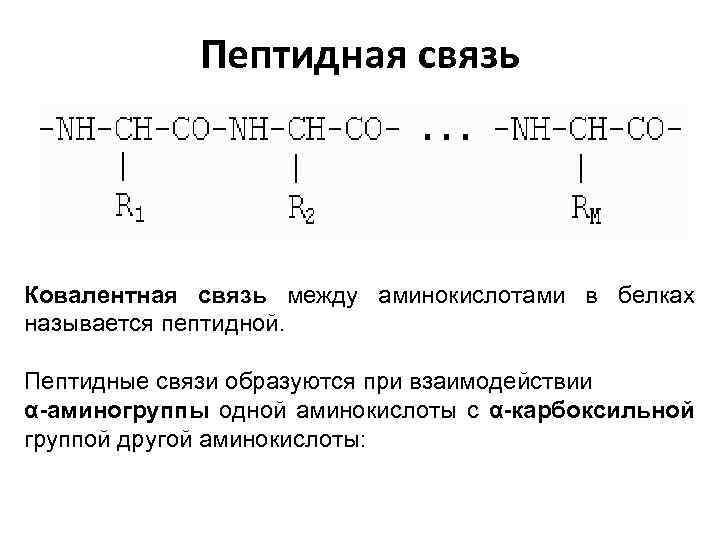
Пептидная связь Ковалентная связь между аминокислотами в белках называется пептидной. Пептидные связи образуются при взаимодействии α-аминогруппы одной аминокислоты с α-карбоксильной группой другой аминокислоты:
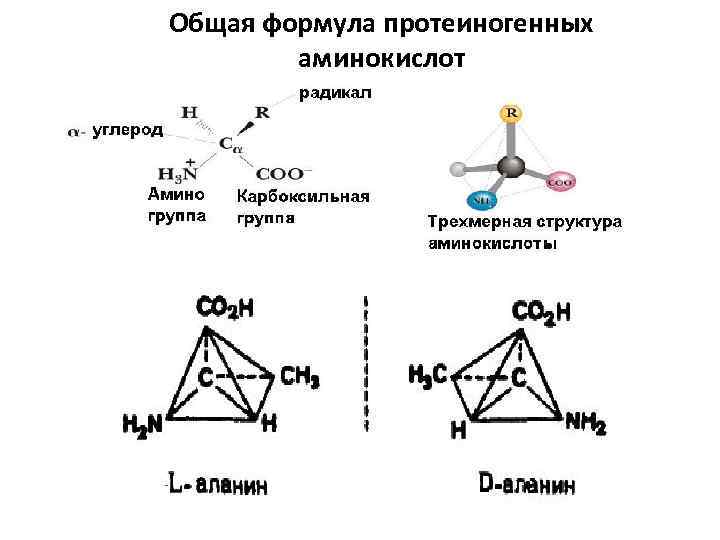
Общая формула протеиногенных аминокислот

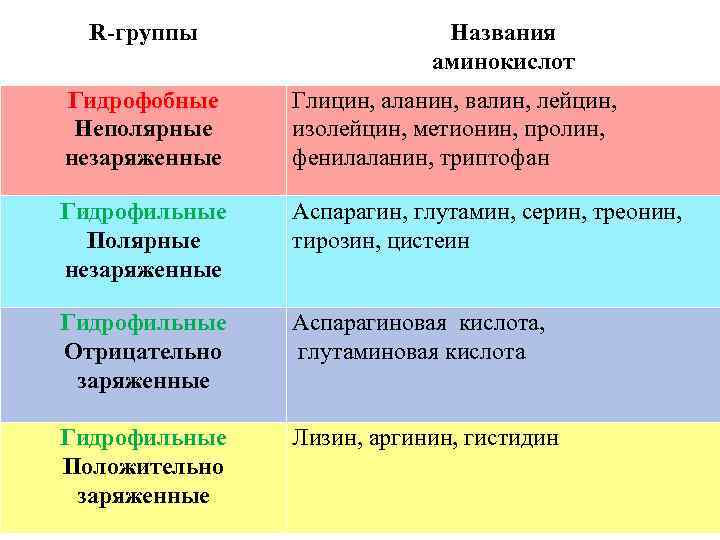
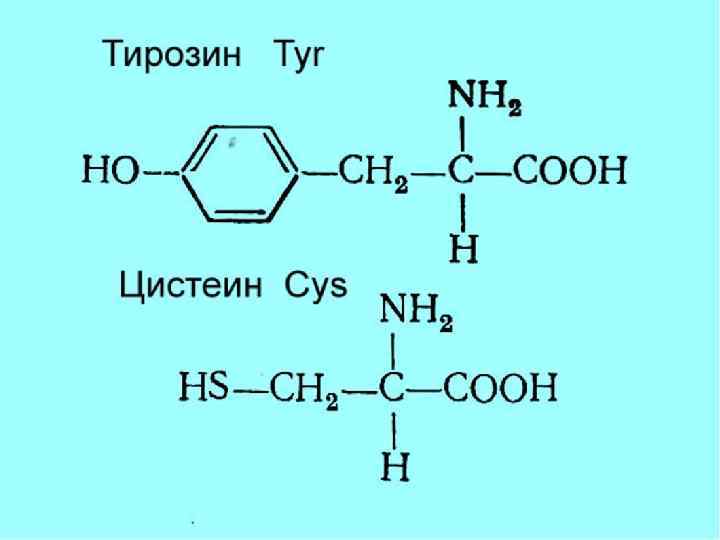
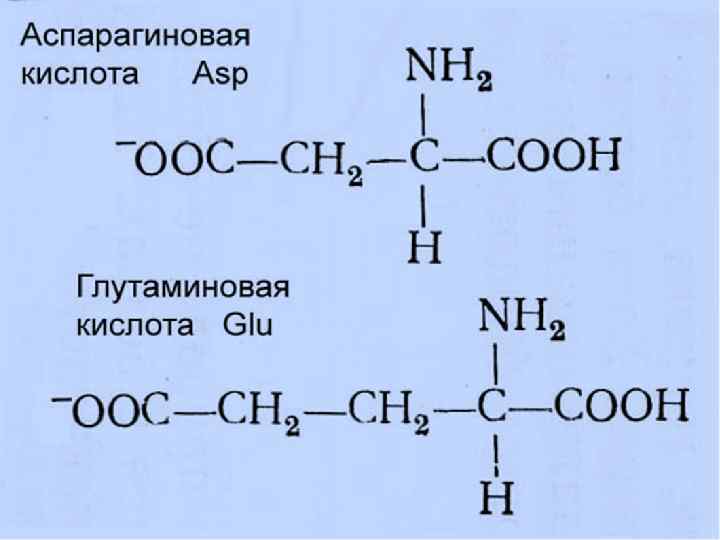
R-группы Названия аминокислот Гидрофобные Неполярные незаряженные Глицин, аланин, валин, лейцин, изолейцин, метионин, пролин, фенилаланин, триптофан Гидрофильные Полярные незаряженные Аспарагин, глутамин, серин, треонин, тирозин, цистеин Гидрофильные Отрицательно заряженные Аспарагиновая кислота, глутаминовая кислота Гидрофильные Положительно заряженные Лизин, аргинин, гистидин







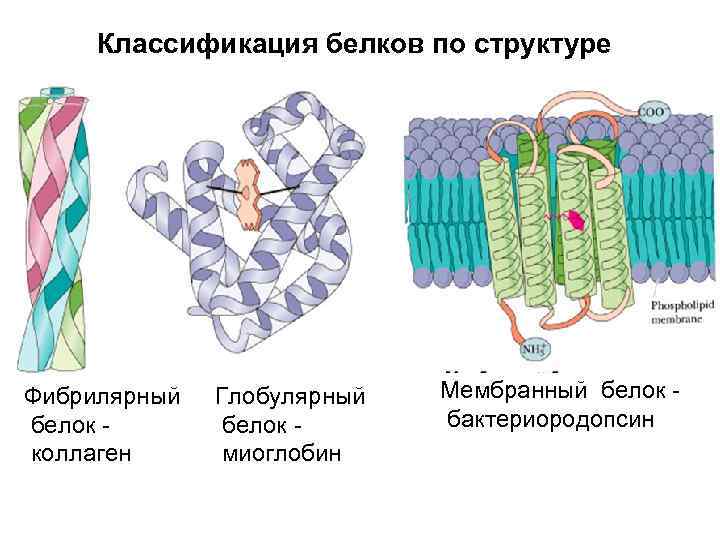
Классификация белков по структуре Фибрилярный белок - коллаген Глобулярный белок - миоглобин Мембранный белок - бактериородопсин

Уровни организации белковых молекул Первичная структура – аминокислотная последовательность Вторичная структура – a-спираль и b-структура (складка) Третичная структура – глобула, сложенная одной цепью, Четвертичная структура – молекула, образованная двумя (или больше) полипептидными цепями Домен (в глобулярных белках)– субглобула в большом белке
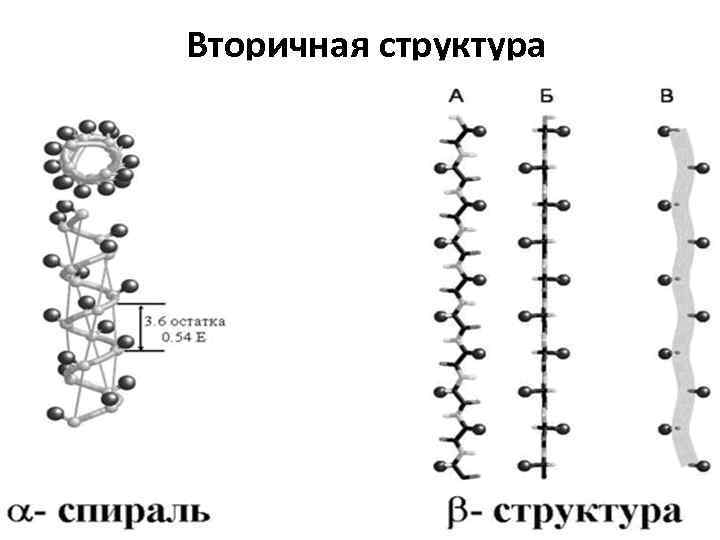
Вторичная структура

Фибриллярные белки играют в основном структурную роль. Они образуют микрофиламенты, микротрубочки и фибриллы. Волосы, шелк и другие защитные покровы образованы фибриллярными белками. Они армируют мембраны и поддерживают структуру клеток и тканей. Коллаген — белок соединительной ткани.
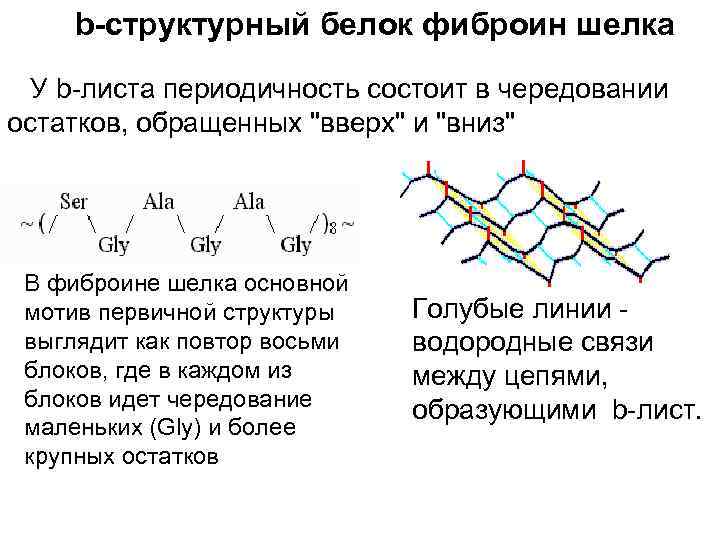
b-структурный белок фиброин шелка У b-листа периодичность состоит в чередовании остатков, обращенных "вверх" и "вниз" В фиброине шелка основной мотив первичной структуры выглядит как повтор восьми блоков, где в каждом из блоков идет чередование маленьких (Gly) и более крупных остатков Голубые линии - водородные связи между цепями, образующими b-лист.

a-структурные фибриллярные белки В кератине или тропомиозине спирали охватывают всю белковую цепь. Такие структуры содержатся также в шелке – но не обычном шелке тутового шелкопряда, а шелке пчел и муравьев. Слипаясь, отдельные цепи образуют суперспираль.
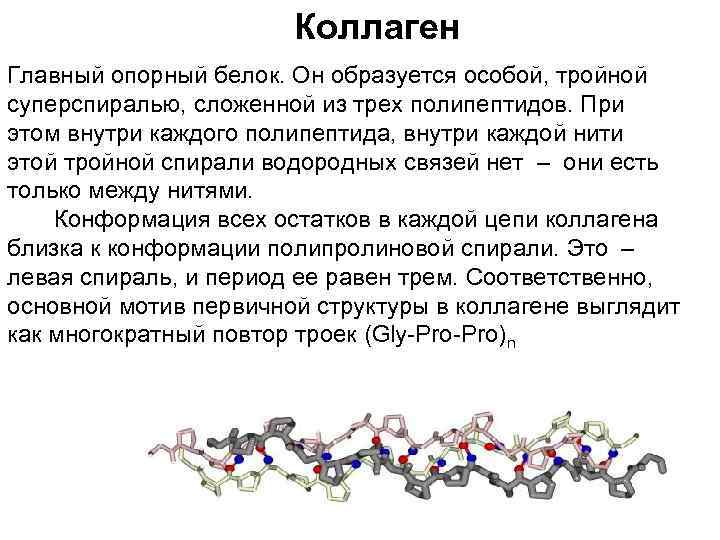
Коллаген Главный опорный белок. Он образуется особой, тройной суперспиралью, сложенной из трех полипептидов. При этом внутри каждого полипептида, внутри каждой нити этой тройной спирали водородных связей нет – они есть только между нитями. Конформация всех остатков в каждой цепи коллагена близка к конформации полипролиновой спирали. Это – левая спираль, и период ее равен трем. Соответственно, основной мотив первичной структуры в коллагене выглядит как многократный повтор троек (Gly-Pro)n
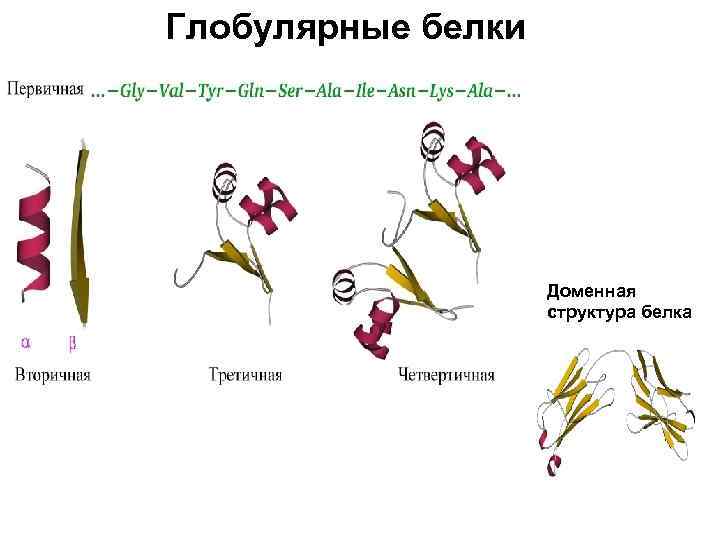
Глобулярные белки Доменная структура белка
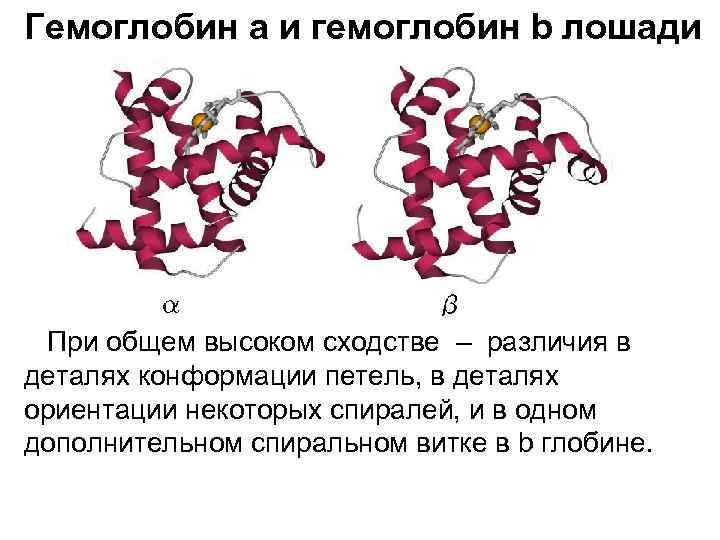
Гемоглобин a и гемоглобин b лошади При общем высоком сходстве – различия в деталях конформации петель, в деталях ориентации некоторых спиралей, и в одном дополнительном спиральном витке в b глобине.
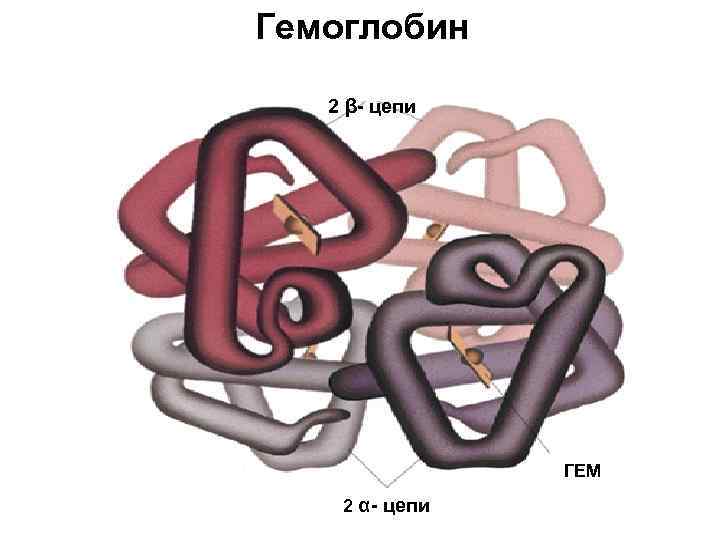
Гемоглобин 2 β- цепи ГЕМ 2 α- цепи
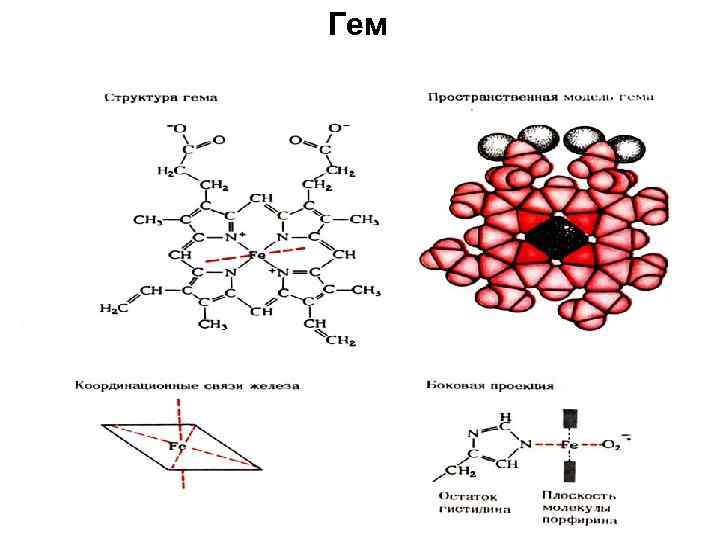
Гем

Ретинол-связывающий белок имеет структуру ортогонально упакованного b-листа. На схеме b-тяжи изображены стрелками. "Меандр" получается потому, что соседние по цепи b-тяжи являются соседями на поверхности цилиндра; они связаны водородными связями. Ретинол окрашен в фиолетовый цвет. Цветная кодировка прослеживает ход цепи по b-цилиндру. Цифры на топологической схеме указывают порядок структурных сегментов в цепи.
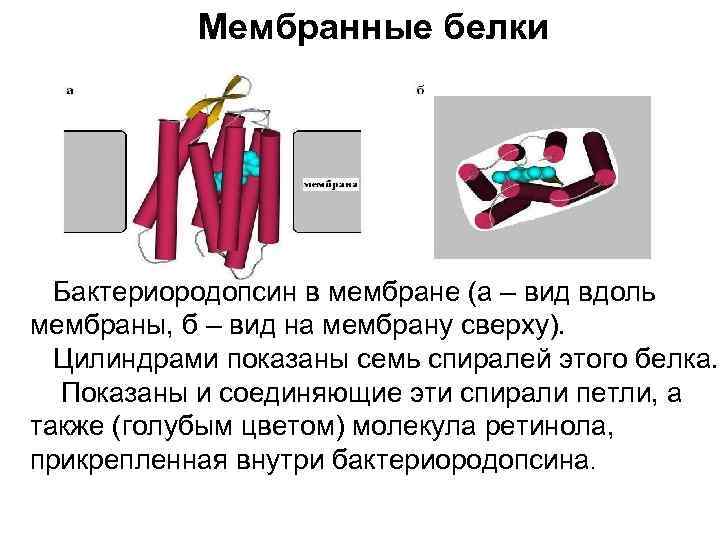
Мембранные белки Бактериородопсин в мембране (а – вид вдоль мембраны, б – вид на мембрану сверху). Цилиндрами показаны семь спиралей этого белка. Показаны и соединяющие эти спирали петли, а также (голубым цветом) молекула ретинола, прикрепленная внутри бактериородопсина.
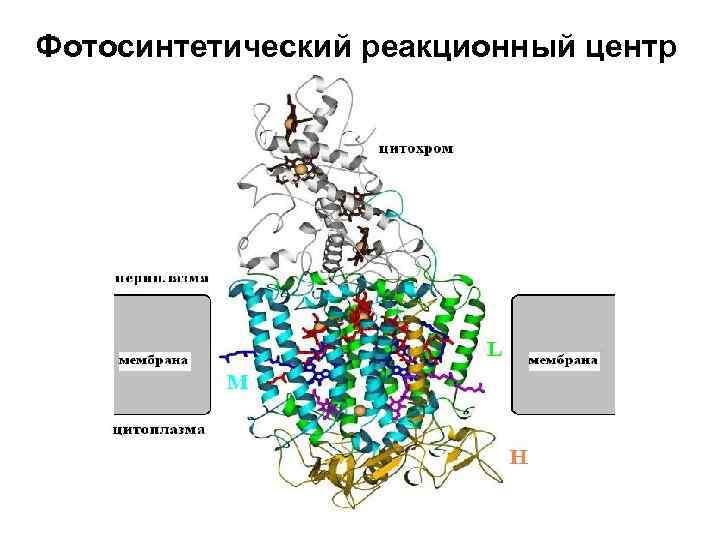
Фотосинтетический реакционный центр