Лекции_ методы анализа_1_заочное.ppt
- Количество слайдов: 29

Лекция 1. Весовые и объемные методы анализа в мониторинге объектов ОС Page 1

ВЕСОВОЙ (ИЛИ ГРАВИМЕТРИЧЕСКИЙ) МЕТОД АНАЛИЗА Это метод количественного анализа компонента, основанный на выделении исследуемого компонента из природной воды с последующим измерением массы исследуемого компонента в виде вещества, определенного состава. СПОСОБЫ ВЫДЕЛЕНИЯ ВЕЩЕСТВ: Метод осаждения с последующей фильтрацией, Метод выделения (выпаривание, экстракция ), Метод отгонки. Используется уравнение химической реакции: а. А +в. В Аа. Вв (Аа. Вв – гравиметрическая определенного состава. форма, строго Page 2

• Метод отличается высокой точностью, однако характеризуется длительностью и большой трудоемкостью. • Остается эталоном, методической основой при разработке и аттестации других методов. • Используется для определения содержания взвешенных веществ в воде и воздухе, нефтепродуктов при их высоком содержании. • В качестве арбитражного метода применяется при определении концентрации сульфатов в воде. Page 3

• Метод осаждения • Суть метода: проводят химическую реакцию между исследуемым компонентом и осадителем, полученный осадок отфильтровывают, высушивают, прокаливают и взвешивают. • SO 42 - + Ba 2+ t Ba. SO 4 • Метод выделения • • Суть метода: проводят химическую реакцию для выделения исследуемого компонента в элементарном виде с последующим взвешиванием. • Определение содержания медного купороса в образце: Cu 2+ + H 2 Cu + 2 H+ • Page 4

Метод отгонки • Суть метода: проводят химическую реакцию для выделения исследуемого компонента в виде летучего соединения (действием кислоты или высокой температуры). • Три вариации метода: • 1. Определяемый компонент выделяют в виде летучего соединения и поглощают поглотителем. Расчет ведут по изменению массы поглотителя. • Ca. CO 3 CO 2 • 2. Определяемый компонент отгоняют в виде летучего соединения и отгон (дистиллят) охлаждают и взвешивают (определяют объем). Расчет ведут по массе (объему). Фенолы, спирты и пр. • 3. Анализируемое вещество взвешивают, отгоняют определяемый компонент и вновь взвешивают. Расчет ведут по уменьшению массы анализируемого образца. • Si. О 2 + HF Si. F 4 + 2 H 2 O Page 5

Применение весового (гравиметрического) метода анализа • Арбитражный метод определения сульфатов, магния, кремнекислоты, нефтепродуктов, жиров, ВВ в воде и воздухе. • Определение гигроскопической влаги в почве. • Содержание сухого вещества в плодах, овощах. • Определение кристаллизационной воды в солях. • Определение зольности топлива. • Определение содержания веществ в минералах. • И т. д. Page 6

ОБЪЕМНЫЙ (ТИТРИМЕТРИЧЕСКИЙ) МЕТОД АНАЛИЗА компонентов ОС Титриметрический анализ (титрование) – это метод количественного анализа, основанный на измерении объема реактива известной концентрации, расходуемого для реакции с определяемым веществом. Методы основаны на взаимодействии исследуемого компонента с реактивом, который добавляется в пробу воды в виде раствора определенной концентрации (титрованный раствор) до того момента, когда количество прибавленного реактива не станет эквивалентно количеству определяемого компонента в растворе. Page 7

ОБЪЕМНЫЙ (ТИТРИМЕТРИЧЕСКИЙ) МЕТОД АНАЛИЗА ПРИРОДНЫХ ВОД Этот момент называется точкой эквивалентности, а процедура ее установления – титрованием. Точку эквивалентности устанавливают по изменению цвета индикаторов, которые подбирают таким образом, чтобы изменение его цвета совпадало с точкой эквивалентности. Основные преимущества объемного анализа: простота, быстрота определения, широкие возможности использования разнообразных химических свойств веществ. Объемный анализ является основным при определении макрокомпонентов (главных ионов) природных вод. Page 8

ЗАКОН ЭКВИВАЛЕНТНОСТИ Все вещества вступают в реакции друг с другом в эквивалентном соотношении (один эквивалент одного вещества реагирует строго с одним эквивалентом другого вещества): N 1 V 1 =N 2 V 2, где N 1 – эквивалентная (нормальная) концентрация раствора одного из реагирующих веществ, N 2 – эквивалентная (нормальная) концентрация раствора второго вещества, V 1 – объем раствора первого из реагирующих веществ, V 1 – объем раствора второго из реагирующих веществ. Page 9

ОБЩАЯ ФОРМУЛА РАСЧЕТА МАССОВОЙ КОНЦЕНТРАЦИИ ВЕЩЕСТВ В ОБЪЕМНОМ АНАЛИЗЕ: Э∙N∙n∙ 1000 c(x) = ---------, V где с(х) – массовая концентрация вещества, мг/л; Э – молярная масса эквивалента определяемого вещества, г/моль; N - молярная концентрация эквивалента титрующего раствора, моль/л; n – объем титрующего вещества, установленный в процессе титрования, мл; V – объем пробы, взятой для анализа, мл; 1000 – коэффициент пересчета на 1 л. Page 10
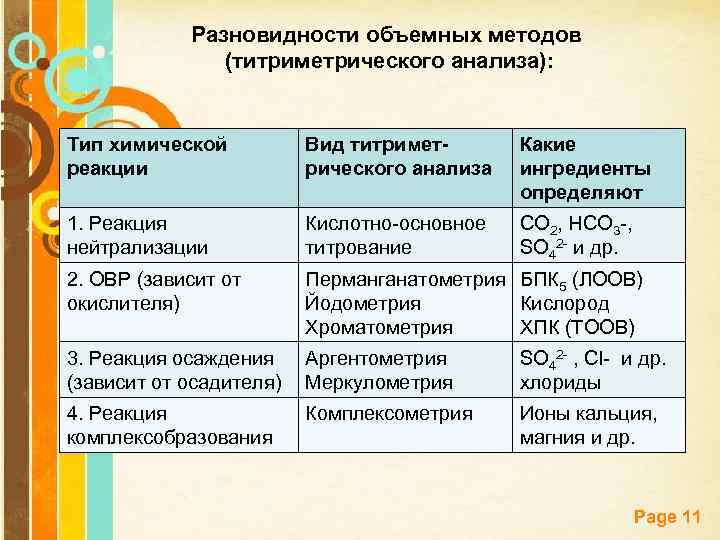
Разновидности объемных методов (титриметрического анализа): Тип химической реакции Вид титриметрического анализа Какие ингредиенты определяют 1. Реакция нейтрализации Кислотно-основное титрование CO 2, HCO 3 -, SO 42 - и др. 2. ОВР (зависит от окислителя) Перманганатометрия БПК 5 (ЛООВ) Йодометрия Кислород Хроматометрия ХПК (ТООВ) 3. Реакция осаждения (зависит от осадителя) Аргентометрия Меркулометрия SO 42 - , Cl- и др. хлориды 4. Реакция комплексобразования Комплексометрия Ионы кальция, магния и др. Page 11

ТИПЫ ОБЪЕМНОГО АНАЛИЗА по способу выполнения титрования: 1. Прямое титрование (к определяемому веществу добавляют рабочий раствор - титрант) 2. Обратное титрование (к определяемому веществу добавляют сначала избыток реагента, а затем титруют остаток реагента, не вступившего в реакцию, рабочим раствором). 3. Заместительное титрование (к определяемому веществу добавляют сначала избыток реагента, а затем титруют рабочим раствором) один из продуктов реакции). Page 12

Лекция 2. Электрохимические методы анализа в мониторинге объектов ОС Page 13

Электрохимические методы анализа, совокупность методов качественного и количественного анализа, основанных на электрохимических явлениях, происходящих в исследуемой среде или на границе раздела фаз и связанных с изменением структуры, химического состава или концентрации анализируемого вещества. Электродный процесс (электрохимическая реакция) – гетерогенная реакция, протекающая между компонентами электропроводящих фаз (электрод – раствор), в ходе которой ионы или электроны проходят через границу раздела фаз, и на межфазной границе устанавливается разность электрических потенциалов, называемая электродным потенциалом (Е). Page 14
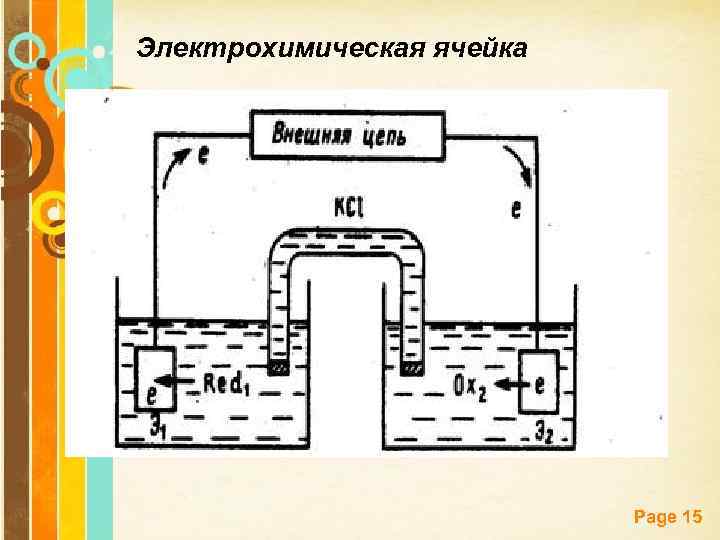
Электрохимическая ячейка Page 15

Электрохимические методы анализа можно классифицировать в зависимости от процессов, происходящих на электродах, на пять основных групп: 1. потенциометрия, 2. вольтамперометрия, 3. кулонометрия, 4. кондуктометрия , 5. диэлектрометрия. Чувствительность ЭХМ составляет 10 -15 - 10 -7 % (массовая доля), погрешность 0, 5 -5%. Page 16

Потенциометрия объединяет методы, основанные на измерении ЭДС обратимых электрохимических цепей, когда потенциал рабочего электрода близок к равновесному значению. Вольтамперометрия основана на исследовании зависимости тока поляризации от напряжения, прикладываемого к электрохимической ячейке, когда потенциал рабочего электрода значительно отличается от равновесного значения. По разнообразию методов вольтамперометрия — самая многочисленная группа из всех электрохимических методов анализа, широко используемая для определения веществ в растворах и расплавах (например, полярография, амперометрия). Page 17

Кулонометрия - методы анализа, основанные на измерении количества вещества, выделяющегося на электроде в процессе электрохимической реакции в соответствии с Фарадея законами. Измеряют электропроводность электролитов (водных и неводных растворов, коллоидных систем, расплавов, твёрдых веществ). Кондуктометрический анализ основан на изменении концентрации вещества или химического состава среды в межэлектродном пространстве; он не связан с потенциалом электрода, который обычно близок к равновесному значению. Диэлектрометрия объединяет методы анализа, основанные на измерении диэлектрической проницаемости вещества, обусловленной ориентацией в электрическом поле частиц (молекул, ионов), обладающих дипольным моментом. Page 18

Потенциометрические методы основаны на измерении потенциала электрода, погруженного в анализируемый раствор, изменяющегося в результате химических реакций и зависящий от to и концентрации раствора. В потенциометрии обычно применяют гальванический элемент, состоящий из двух электродов, погруженных в один и тот же раствор. Электрод, потенциал которого зависит от концентрации определяемого компонента, называют индикаторным электродом, второй – электродом сравнения с постоянным потенциалом. Основное уравнение потенциометрии – уравнение Нернста: Page 19
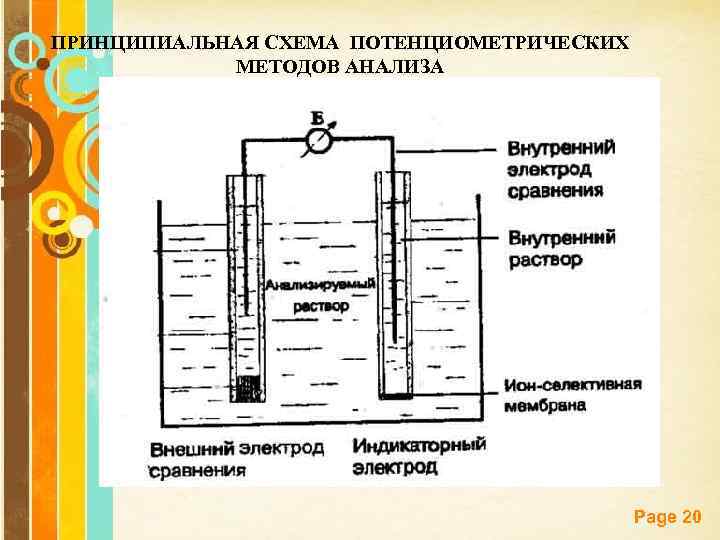
ПРИНЦИПИАЛЬНАЯ СХЕМА ПОТЕНЦИОМЕТРИЧЕСКИХ МЕТОДОВ АНАЛИЗА Page 20
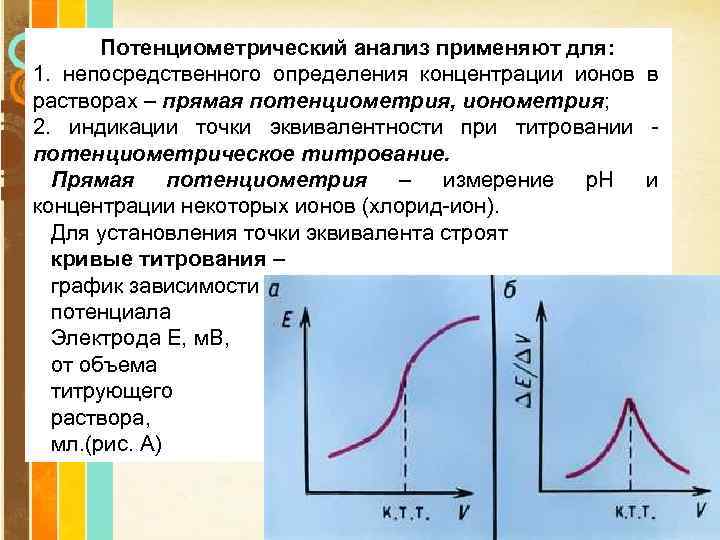
Потенциометрический анализ применяют для: 1. непосредственного определения концентрации ионов в растворах – прямая потенциометрия, ионометрия; 2. индикации точки эквивалентности при титровании - потенциометрическое титрование. Прямая потенциометрия – измерение р. Н и концентрации некоторых ионов (хлорид-ион). Для установления точки эквивалента строят кривые титрования – график зависимости потенциала Электрода E, м. B, от объема титрующего раствора, мл. (рис. А) Page 21

Достоинства потенциометрических методов - быстрота и простота; - используя микроэлектроды, можно определять компоненты в очень маленьких по объему пробах, до десятых долей миллилитра; - дает возможность проводить анализы в мутных и окрашенных растворах, вязких пастах, исключая процедуры фильтрования и перегонки; - проба остается неиспорченной и пригодна для других анализов; - возможность полной и частичной автоматизации. Page 22

ПОЛЯРОГРАФИЧЕСКИЙ АНАЛИЗ – ВИД АМПЕРОМЕТРИИ Полярографический метод основан на измерении силы тока, изменяющегося в процессе электролиза, в условиях, когда один из электродов (катод) имеет очень малую поверхность (поляризующийся электрод), а другой (анод) - большую (неполяризующийся электрод). Полярографические методы отличаются достаточно высокой точностью и чувствительностью. Широко применяются для определения концентраций тяжелых металлов, при совместном присутствии. Page 23
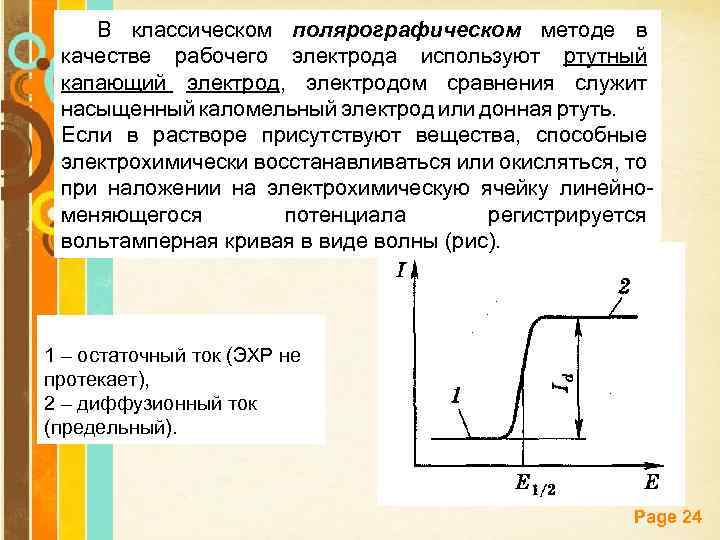
В классическом полярографическом методе в качестве рабочего электрода используют ртутный капающий электрод, электродом сравнения служит насыщенный каломельный электрод или донная ртуть. Если в растворе присутствуют вещества, способные электрохимически восстанавливаться или окисляться, то при наложении на электрохимическую ячейку линейноменяющегося потенциала регистрируется вольтамперная кривая в виде волны (рис). 1 – остаточный ток (ЭХР не протекает), 2 – диффузионный ток (предельный). Page 24

Вольтамперная кривая (или полярограмма) содержит ценную аналитическую информацию: качественной характеристикой электрохимически восстанавливающегося вещества (деполяризатора) является потенциал полуволны (Е 1/2) – потенциал, при котором ток равен половине величины диффузионного тока. Потенциал полуволны Е 1/2 не зависит от силы тока и концентрации восстанавливающегося иона, зависит от его природы. Определение Е 1/2 составляет основу качественного полярографического анализа. Page 25
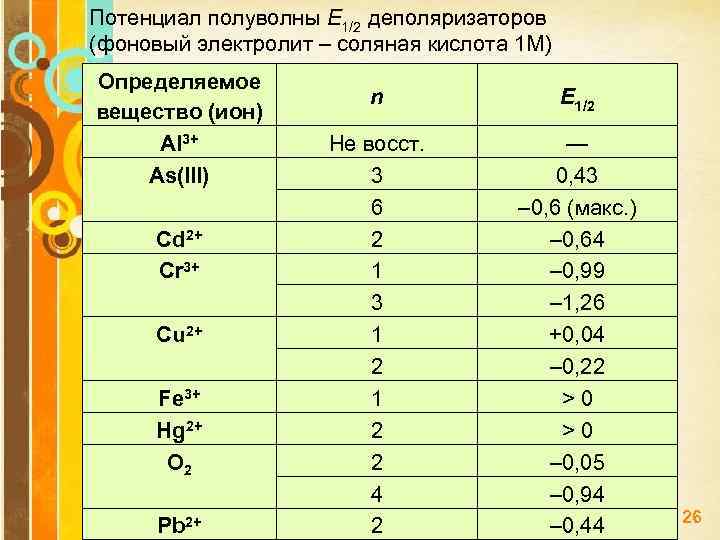
Потенциал полуволны Е 1/2 деполяризаторов (фоновый электролит – соляная кислота 1 М) Определяемое вещество (ион) Аl 3+ As(III) Сd 2+ Сr 3+ Cu 2+ Fe 3+ Hg 2+ O 2 Рb 2+ n He восст. 3 6 2 1 3 1 2 2 4 2 Е 1/2 — 0, 43 – 0, 6 (макс. ) – 0, 64 – 0, 99 – 1, 26 +0, 04 – 0, 22 > 0 – 0, 05 – 0, 94 – 0, 44 Page 26
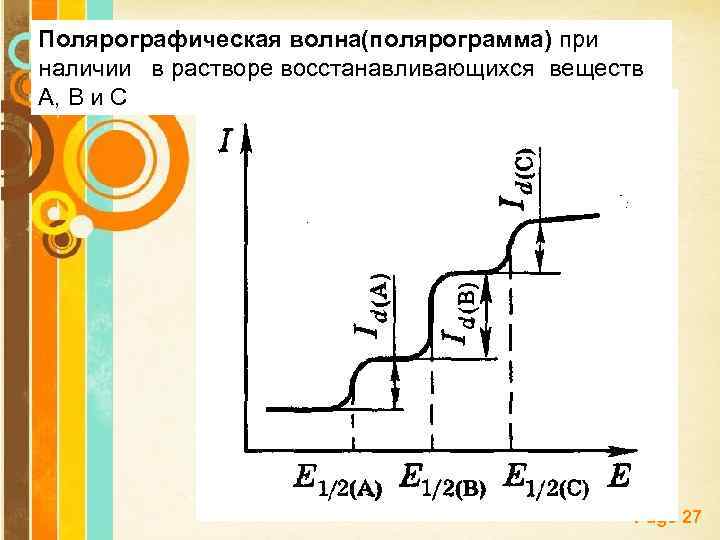
Полярографическая волна(полярограмма) при наличии в растворе восстанавливающихся веществ А, В и С Page 27

Применение полярографического анализа Полярография может быть использована: • для определения примесей в металлах, сплавах, полупроводниках, химических реактивах; • для контроля чистоты воздуха, воды, пищевых продуктов и медицинских препаратов; • для проведения биохимических исследований; • для изучения электродных, абсорбционных, окислительно-восстановительных процессов. Достоинства: • Исследование широкого ряда электродных процессов. • Возможность снятия полярограмм в виде, удобном для последующей обработки. . Page 28

Спасибо за внимание! Page 29
Лекции_ методы анализа_1_заочное.ppt