Лекция-1.Стех.соотн.ppt
- Количество слайдов: 28
 Лекция № 1 Тема лекции: Введение. Стехиометрические соотношения в химии Темы для самостоятельного изучения: 1. 2. Зонная теория кристаллов. Металлические, ковалентные, ионные, молекулярные кристаллы. Растворы. Твердые, жидкие и газовые растворы. Способы выражения концентраций растворов. Рекомендуемая литература 1. Н. С. Ахметов. Общая и неорганическая химия. 7 -ое изд. -М. : Высшая школа. , 2006 -743 с. 2. Глинка Н. Л. Общая химия (любое издание). 1
Лекция № 1 Тема лекции: Введение. Стехиометрические соотношения в химии Темы для самостоятельного изучения: 1. 2. Зонная теория кристаллов. Металлические, ковалентные, ионные, молекулярные кристаллы. Растворы. Твердые, жидкие и газовые растворы. Способы выражения концентраций растворов. Рекомендуемая литература 1. Н. С. Ахметов. Общая и неорганическая химия. 7 -ое изд. -М. : Высшая школа. , 2006 -743 с. 2. Глинка Н. Л. Общая химия (любое издание). 1
 Современную науку можно определить, как "способ познания реального мира, включающего в себя как ощущаемую органами чувств человека реальность, так и реальность невидимую, способ познания, основанный на построении проверяемых моделей этой реальности" (Уильям Хетчер) Три уровня научных моделей мира 1. Эмпирический материал (экспериментальные данные) 2. Идеализированные образы (физические модели) 3. Математическое описание (формулы и уравнения) 2
Современную науку можно определить, как "способ познания реального мира, включающего в себя как ощущаемую органами чувств человека реальность, так и реальность невидимую, способ познания, основанный на построении проверяемых моделей этой реальности" (Уильям Хетчер) Три уровня научных моделей мира 1. Эмпирический материал (экспериментальные данные) 2. Идеализированные образы (физические модели) 3. Математическое описание (формулы и уравнения) 2
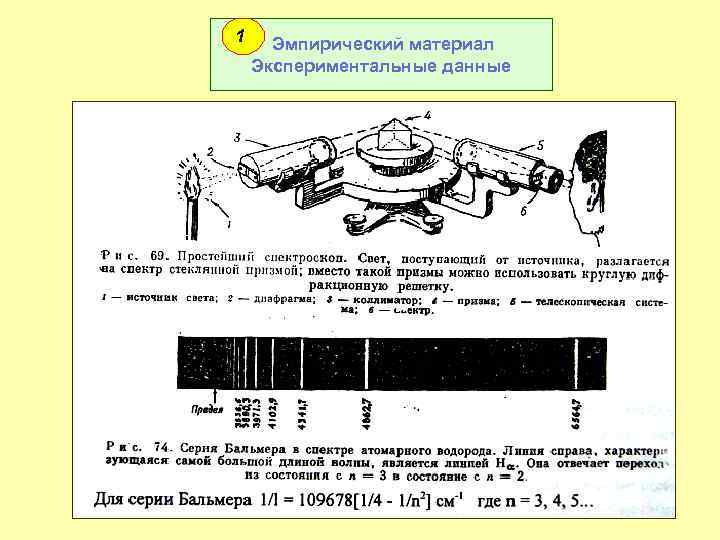 1 Эмпирический материал Экспериментальные данные 3
1 Эмпирический материал Экспериментальные данные 3
 Химические элементы открытые с помощью простейшего микроскопа 4
Химические элементы открытые с помощью простейшего микроскопа 4
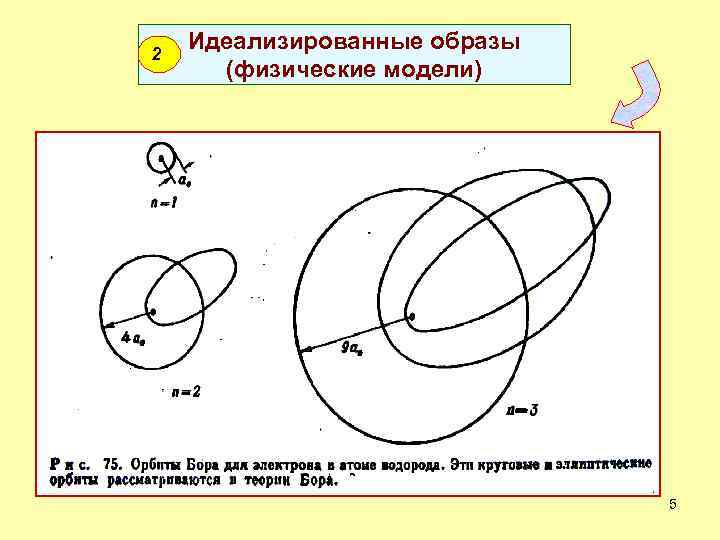 2 Идеализированные образы (физические модели) 5
2 Идеализированные образы (физические модели) 5
 3 Математическое описание (формулы и уравнения) 6
3 Математическое описание (формулы и уравнения) 6
 • Химия – наука о превращениях веществ, связанных с изменением электронного окружения атомных ядер Д. И. Менделеев*: "Ближайший предмет химии составляет изучение ØОднородных веществ, из сложения которых составлены все тела мира, Øпревращений их друг в друга и Øявлений, сопровождающих такие превращения. " *Менделеев Д. Основы Химии 6 -е издание С-Пб, тип. В. Демакова, 1895. – 780 с. , с. 2 7
• Химия – наука о превращениях веществ, связанных с изменением электронного окружения атомных ядер Д. И. Менделеев*: "Ближайший предмет химии составляет изучение ØОднородных веществ, из сложения которых составлены все тела мира, Øпревращений их друг в друга и Øявлений, сопровождающих такие превращения. " *Менделеев Д. Основы Химии 6 -е издание С-Пб, тип. В. Демакова, 1895. – 780 с. , с. 2 7
 • Простые вещества образованы атомами одного химического элемента и потому являются формой его существования в свободном состоянии, например, сера S, железо Fe, озон O 3, алмаз Cn. • Сложные вещества образованы разными элементами и могут иметь состав постоянный (стехиометрические соединения или дальтониды) или меняющийся в некоторых пределах (нестехиометрические соединения или бертоллиды) 8
• Простые вещества образованы атомами одного химического элемента и потому являются формой его существования в свободном состоянии, например, сера S, железо Fe, озон O 3, алмаз Cn. • Сложные вещества образованы разными элементами и могут иметь состав постоянный (стехиометрические соединения или дальтониды) или меняющийся в некоторых пределах (нестехиометрические соединения или бертоллиды) 8
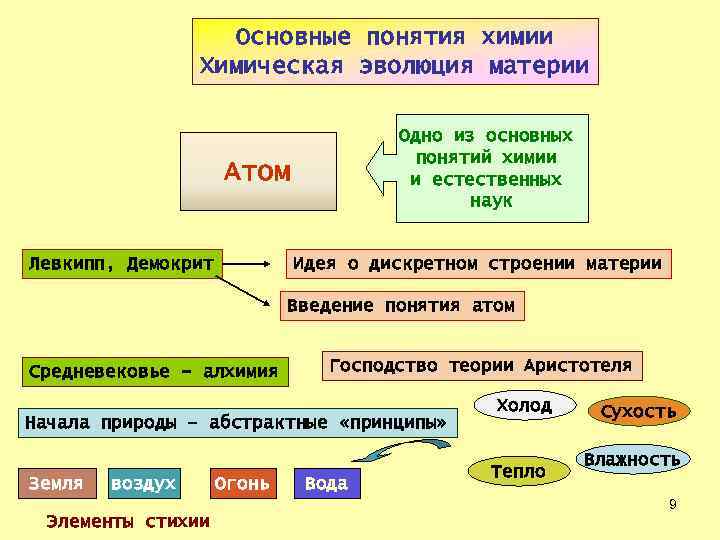 Основные понятия химии Химическая эволюция материи Одно из основных понятий химии и естественных наук Атом Левкипп, Демокрит Идея о дискретном строении материи Введение понятия атом Средневековье - алхимия Господство теории Аристотеля Начала природы – абстрактные «принципы» Земля воздух Огонь Вода Холод Тепло Сухость Влажность 9 Элементы стихии
Основные понятия химии Химическая эволюция материи Одно из основных понятий химии и естественных наук Атом Левкипп, Демокрит Идея о дискретном строении материи Введение понятия атом Средневековье - алхимия Господство теории Аристотеля Начала природы – абстрактные «принципы» Земля воздух Огонь Вода Холод Тепло Сухость Влажность 9 Элементы стихии
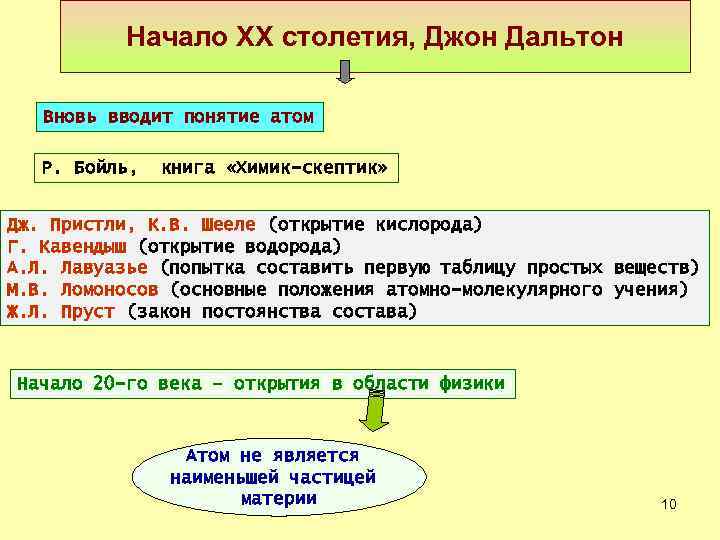 Начало XX столетия, Джон Дальтон Вновь вводит понятие атом Р. Бойль, книга «Химик-скептик» Дж. Пристли, К. В. Шееле (открытие кислорода) Г. Кавендыш (открытие водорода) А. Л. Лавуазье (попытка составить первую таблицу простых веществ) М. В. Ломоносов (основные положения атомно-молекулярного учения) Ж. Л. Пруст (закон постоянства состава) Начало 20 -го века – открытия в области физики Атом не является наименьшей частицей материи 10
Начало XX столетия, Джон Дальтон Вновь вводит понятие атом Р. Бойль, книга «Химик-скептик» Дж. Пристли, К. В. Шееле (открытие кислорода) Г. Кавендыш (открытие водорода) А. Л. Лавуазье (попытка составить первую таблицу простых веществ) М. В. Ломоносов (основные положения атомно-молекулярного учения) Ж. Л. Пруст (закон постоянства состава) Начало 20 -го века – открытия в области физики Атом не является наименьшей частицей материи 10
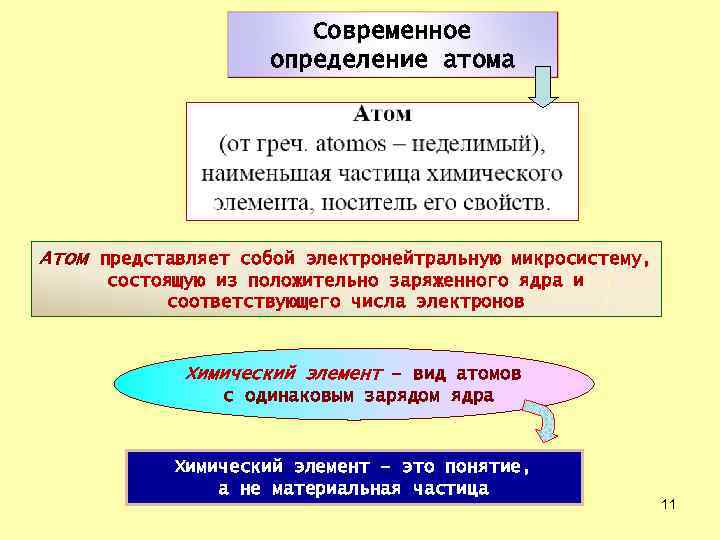 Современное определение атома Атом представляет собой электронейтральную микросистему, состоящую из положительно заряженного ядра и соответствующего числа электронов Химический элемент – вид атомов с одинаковым зарядом ядра Химический элемент – это понятие, а не материальная частица 11
Современное определение атома Атом представляет собой электронейтральную микросистему, состоящую из положительно заряженного ядра и соответствующего числа электронов Химический элемент – вид атомов с одинаковым зарядом ядра Химический элемент – это понятие, а не материальная частица 11
![Основные понятия Электрон [др. греч. ηλεκτρον – янтарь (хорошо электризуется при трении)] – стабильная Основные понятия Электрон [др. греч. ηλεκτρον – янтарь (хорошо электризуется при трении)] – стабильная](https://present5.com/presentation/42123542_127334712/image-12.jpg) Основные понятия Электрон [др. греч. ηλεκτρον – янтарь (хорошо электризуется при трении)] – стабильная элементарная частица, имеющая массу покоя, равную 9, 109 ⋅ 10– 31 кг = 5, 486 ⋅ 10– 4 а. е. м. , и несущая элементарный отрицательный заряд, равный 1, 6 ⋅ 10– 19 Кл. Заряд электрона принимают за – 1 и заряды всех остальных частиц выражают в этих единицах. Электроны входят в состав всех атомов Протон (греч. πρωτοσ – первый) – элементарная частица, являющаяся составной частью ядер атомов всех химических элементов, обладает массой покоя mp =1, 672 ⋅ 10– 27 кг = 1, 007 а. е. м. и элементарным положительным электрическим зарядом, равным по величине заряду электрона, т. е. 1, 6 ⋅ 10– 19 Кл. определяет порядковый номер химического элемента Число протонов в ядре Порядковый N элемента 12
Основные понятия Электрон [др. греч. ηλεκτρον – янтарь (хорошо электризуется при трении)] – стабильная элементарная частица, имеющая массу покоя, равную 9, 109 ⋅ 10– 31 кг = 5, 486 ⋅ 10– 4 а. е. м. , и несущая элементарный отрицательный заряд, равный 1, 6 ⋅ 10– 19 Кл. Заряд электрона принимают за – 1 и заряды всех остальных частиц выражают в этих единицах. Электроны входят в состав всех атомов Протон (греч. πρωτοσ – первый) – элементарная частица, являющаяся составной частью ядер атомов всех химических элементов, обладает массой покоя mp =1, 672 ⋅ 10– 27 кг = 1, 007 а. е. м. и элементарным положительным электрическим зарядом, равным по величине заряду электрона, т. е. 1, 6 ⋅ 10– 19 Кл. определяет порядковый номер химического элемента Число протонов в ядре Порядковый N элемента 12
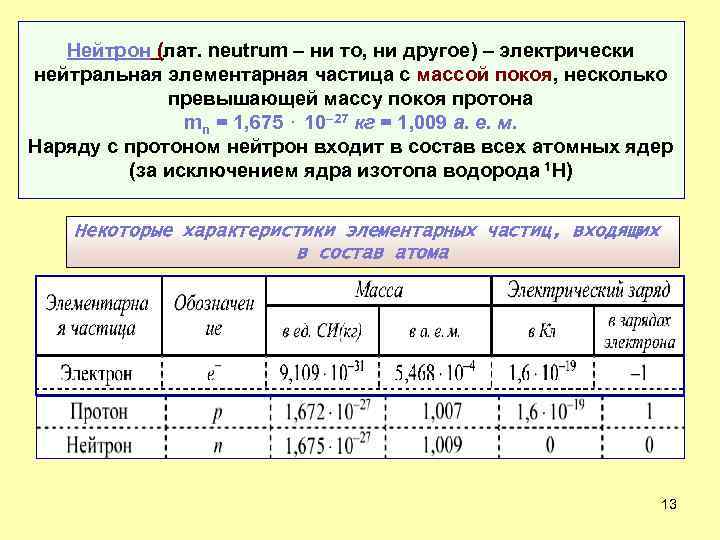 Нейтрон (лат. neutrum – ни то, ни другое) – электрически нейтральная элементарная частица с массой покоя, несколько превышающей массу покоя протона mn = 1, 675 ⋅ 10– 27 кг = 1, 009 а. е. м. Наряду с протоном нейтрон входит в состав всех атомных ядер (за исключением ядра изотопа водорода 1 Н) Некоторые характеристики элементарных частиц, входящих в состав атома 13
Нейтрон (лат. neutrum – ни то, ни другое) – электрически нейтральная элементарная частица с массой покоя, несколько превышающей массу покоя протона mn = 1, 675 ⋅ 10– 27 кг = 1, 009 а. е. м. Наряду с протоном нейтрон входит в состав всех атомных ядер (за исключением ядра изотопа водорода 1 Н) Некоторые характеристики элементарных частиц, входящих в состав атома 13
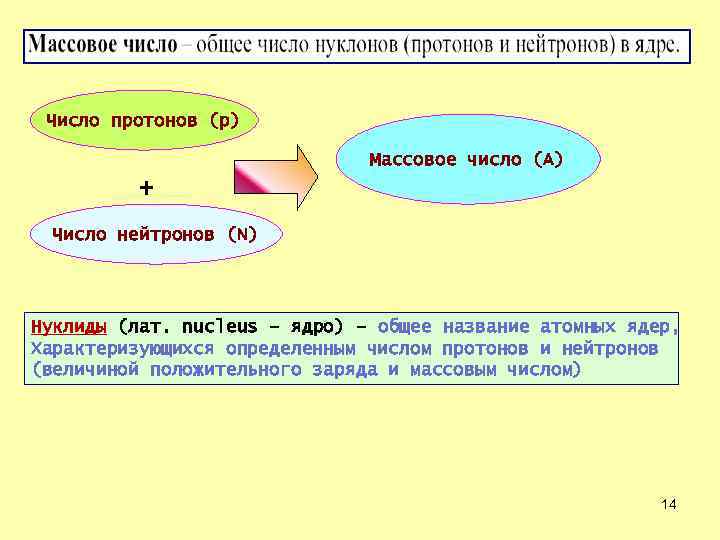 Число протонов (р) Массовое число (А) + Число нейтронов (N) Нуклиды (лат. nucleus – ядро) – общее название атомных ядер, Характеризующихся определенным числом протонов и нейтронов (величиной положительного заряда и массовым числом) 14
Число протонов (р) Массовое число (А) + Число нейтронов (N) Нуклиды (лат. nucleus – ядро) – общее название атомных ядер, Характеризующихся определенным числом протонов и нейтронов (величиной положительного заряда и массовым числом) 14
 Изотопы (греч. ισοζ – одинаковый + τοποζ – место) – нуклиды, имеющие одинаковое число протонов, но различающиеся массовыми числами Изотопы – нуклиды, занимающие одно и то же место в Периодической системе, т. е. атомы одного и того же химического элемента. Например: 2211 Na, 2311 Na , 2411 Na – изотопы натрия. Изобары (греч. ιζο – равный + βαροσ – вес) – нуклиды, имеющие одинаковые массовые числа, но различное число протонов (т. е. относящиеся к различным химическим элементам), например, 90 Sr, 90 Y, 90 Zr. Изотоны – нуклиды с одинаковым числом нейтронов. 15
Изотопы (греч. ισοζ – одинаковый + τοποζ – место) – нуклиды, имеющие одинаковое число протонов, но различающиеся массовыми числами Изотопы – нуклиды, занимающие одно и то же место в Периодической системе, т. е. атомы одного и того же химического элемента. Например: 2211 Na, 2311 Na , 2411 Na – изотопы натрия. Изобары (греч. ιζο – равный + βαροσ – вес) – нуклиды, имеющие одинаковые массовые числа, но различное число протонов (т. е. относящиеся к различным химическим элементам), например, 90 Sr, 90 Y, 90 Zr. Изотоны – нуклиды с одинаковым числом нейтронов. 15
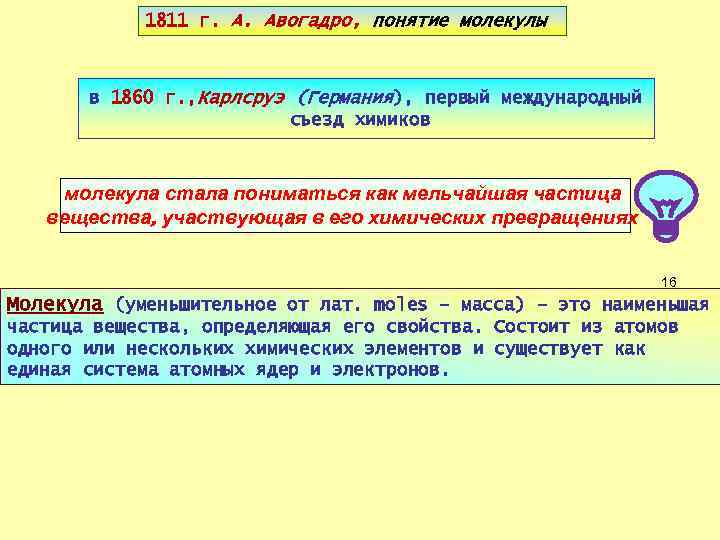 1811 г. А. Авогадро, понятие молекулы в 1860 г. , Карлсруэ (Германия), первый международный съезд химиков молекула стала пониматься как мельчайшая частица вещества, участвующая в его химических превращениях 16 Молекула (уменьшительное от лат. moles – масса) – это наименьшая частица вещества, определяющая его свойства. Состоит из атомов одного или нескольких химических элементов и существует как единая система атомных ядер и электронов.
1811 г. А. Авогадро, понятие молекулы в 1860 г. , Карлсруэ (Германия), первый международный съезд химиков молекула стала пониматься как мельчайшая частица вещества, участвующая в его химических превращениях 16 Молекула (уменьшительное от лат. moles – масса) – это наименьшая частица вещества, определяющая его свойства. Состоит из атомов одного или нескольких химических элементов и существует как единая система атомных ядер и электронов.
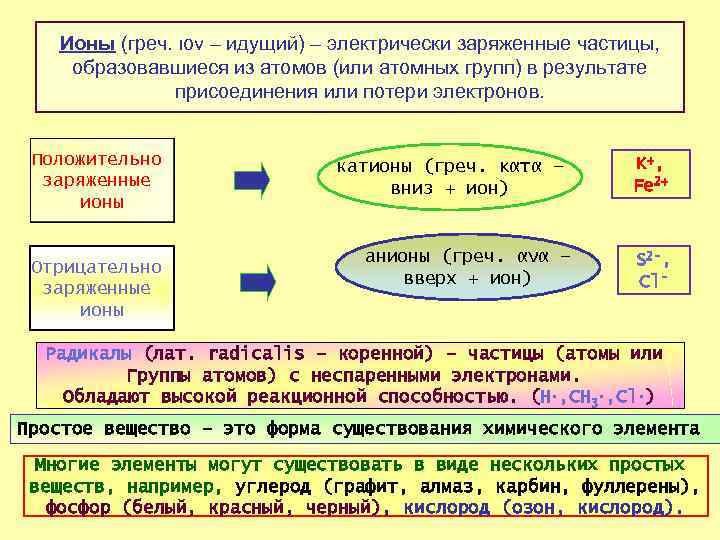 Ионы (греч. ιον – идущий) – электрически заряженные частицы, образовавшиеся из атомов (или атомных групп) в результате присоединения или потери электронов. Положительно заряженные ионы Отрицательно заряженные ионы катионы (греч. κατα – вниз + ион) анионы (греч. ανα – вверх + ион) K+, Fe 2+ S 2 -, Cl- Радикалы (лат. radicalis – коренной) – частицы (атомы или Группы атомов) с неспаренными электронами. Обладают высокой реакционной способностью. (H. , CH 3. , Cl. ) Простое вещество – это форма существования химического элемента Многие элементы могут существовать в виде нескольких простых веществ, например, углерод (графит, алмаз, карбин, фуллерены), 17 фосфор (белый, красный, черный), кислород (озон, кислород).
Ионы (греч. ιον – идущий) – электрически заряженные частицы, образовавшиеся из атомов (или атомных групп) в результате присоединения или потери электронов. Положительно заряженные ионы Отрицательно заряженные ионы катионы (греч. κατα – вниз + ион) анионы (греч. ανα – вверх + ион) K+, Fe 2+ S 2 -, Cl- Радикалы (лат. radicalis – коренной) – частицы (атомы или Группы атомов) с неспаренными электронами. Обладают высокой реакционной способностью. (H. , CH 3. , Cl. ) Простое вещество – это форма существования химического элемента Многие элементы могут существовать в виде нескольких простых веществ, например, углерод (графит, алмаз, карбин, фуллерены), 17 фосфор (белый, красный, черный), кислород (озон, кислород).
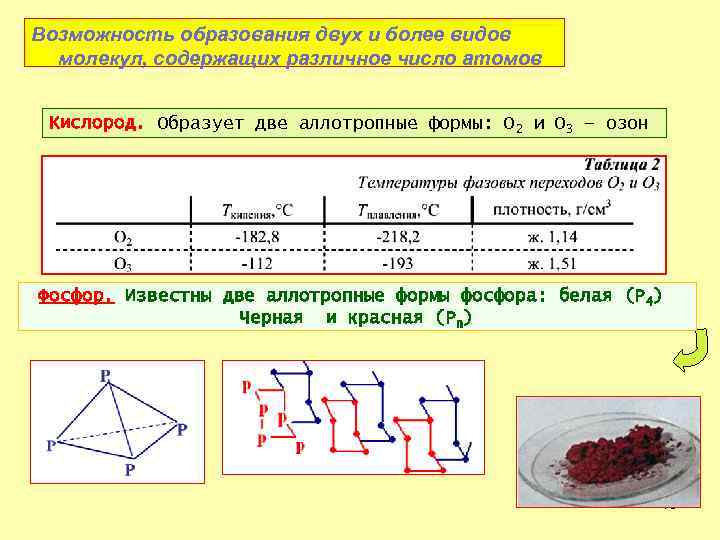 Возможность образования двух и более видов молекул, содержащих различное число атомов Кислород. Образует две аллотропные формы: O 2 и O 3 – озон Фосфор. Известны две аллотропные формы фосфора: белая (Р 4) Черная и красная (Рn) 18
Возможность образования двух и более видов молекул, содержащих различное число атомов Кислород. Образует две аллотропные формы: O 2 и O 3 – озон Фосфор. Известны две аллотропные формы фосфора: белая (Р 4) Черная и красная (Рn) 18
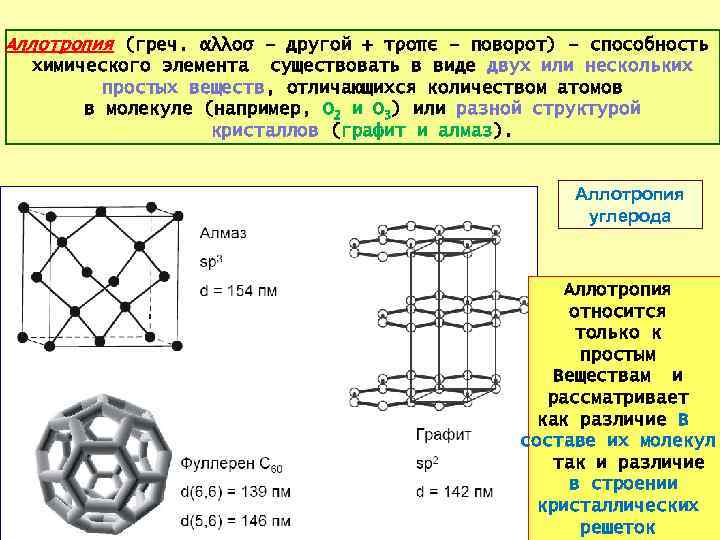 Аллотрoпия (греч. αλλοσ – другой + τροπε – поворот) – способность химического элемента существовать в виде двух или нескольких простых веществ, отличающихся количеством атомов в молекуле (например, O 2 и O 3) или разной структурой кристаллов (графит и алмаз). Аллотропия углерода Аллотропия относится только к простым Веществам и рассматривает как различие В составе их молекул, так и различие в строении 19 кристаллических решеток
Аллотрoпия (греч. αλλοσ – другой + τροπε – поворот) – способность химического элемента существовать в виде двух или нескольких простых веществ, отличающихся количеством атомов в молекуле (например, O 2 и O 3) или разной структурой кристаллов (графит и алмаз). Аллотропия углерода Аллотропия относится только к простым Веществам и рассматривает как различие В составе их молекул, так и различие в строении 19 кристаллических решеток
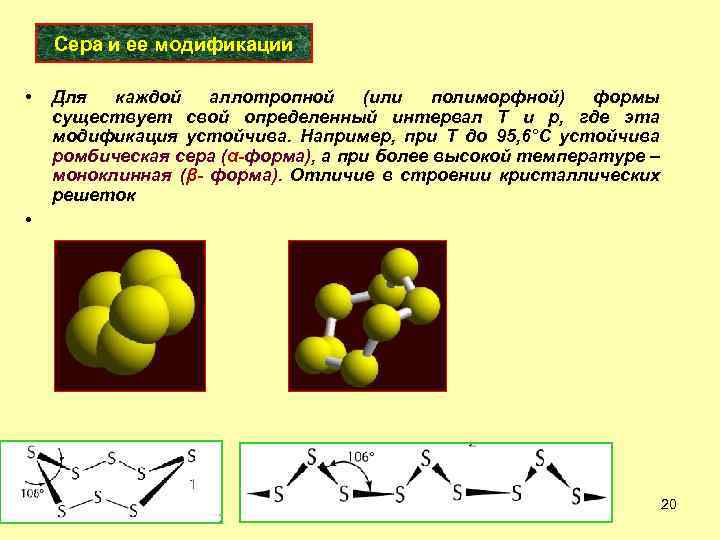 Сера и ее модификации • Для каждой аллотропной (или полиморфной) формы существует свой определенный интервал Т и р, где эта модификация устойчива. Например, при Т до 95, 6°С устойчива ромбическая сера (α-форма), а при более высокой температуре – моноклинная (β- форма). Отличие в строении кристаллических решеток • 20
Сера и ее модификации • Для каждой аллотропной (или полиморфной) формы существует свой определенный интервал Т и р, где эта модификация устойчива. Например, при Т до 95, 6°С устойчива ромбическая сера (α-форма), а при более высокой температуре – моноклинная (β- форма). Отличие в строении кристаллических решеток • 20
 Изоморфизм (греч. ιζο – равный, подобный + μορϕε – форма) – способность сходных по составу веществ образовывать смешанные кристаллы, в которых близкие по размеру атомы, ионы или атомные группировки случайным образом замещают друга. Например В кристаллах алюмокалиевых квасцов KAl(SO 4)2 ⋅ 12 H 2 O ионы калия могут быть замещены ионами рубидия или аммония, а ионы Al 3+ ионами Cr 3+ или Fe 3+ К+ изоморфны Rb+ или NH 4+, а Al 3+ изоморфны Cr 3+ или Fe 3+ 21
Изоморфизм (греч. ιζο – равный, подобный + μορϕε – форма) – способность сходных по составу веществ образовывать смешанные кристаллы, в которых близкие по размеру атомы, ионы или атомные группировки случайным образом замещают друга. Например В кристаллах алюмокалиевых квасцов KAl(SO 4)2 ⋅ 12 H 2 O ионы калия могут быть замещены ионами рубидия или аммония, а ионы Al 3+ ионами Cr 3+ или Fe 3+ К+ изоморфны Rb+ или NH 4+, а Al 3+ изоморфны Cr 3+ или Fe 3+ 21
 Количественные соотношения в химии • для выражения масс атомов и молекул используют единицу измерения – атомную единицу массы (а. е. м. ) За атомную единицу массы принята 1 / 12 массы нуклида углерода 12 C. Масса нуклида в единицах СИ = 1, 9927 ⋅ 10– 26 кг Относительная атомная масса Ar (устаревший термин – атомный вес) – масса атома, выраженная в атомных единицах массы (а. е. м. ). За относительную атомную массу элемента принимают среднее значение относительной атомной массы природной смеси его изотопов с учетом их содержания в земных условиях. Именно эти значения и приведены в Периодической системе 22
Количественные соотношения в химии • для выражения масс атомов и молекул используют единицу измерения – атомную единицу массы (а. е. м. ) За атомную единицу массы принята 1 / 12 массы нуклида углерода 12 C. Масса нуклида в единицах СИ = 1, 9927 ⋅ 10– 26 кг Относительная атомная масса Ar (устаревший термин – атомный вес) – масса атома, выраженная в атомных единицах массы (а. е. м. ). За относительную атомную массу элемента принимают среднее значение относительной атомной массы природной смеси его изотопов с учетом их содержания в земных условиях. Именно эти значения и приведены в Периодической системе 22
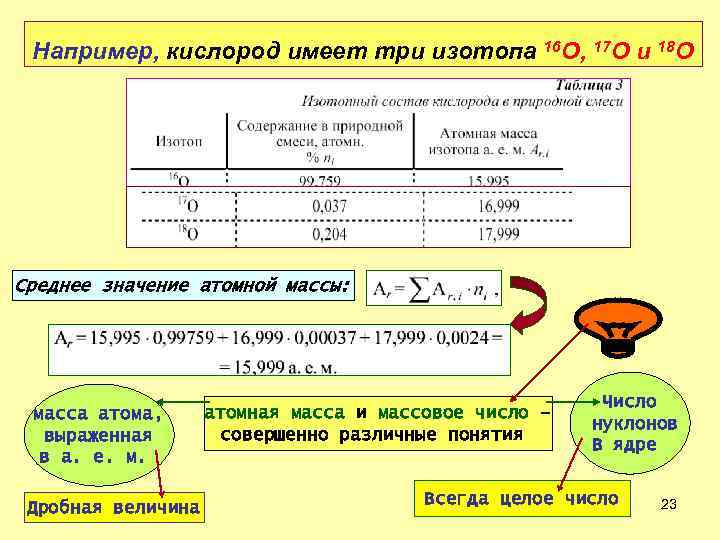 Например, кислород имеет три изотопа 16 O, 17 O и 18 O Среднее значение атомной массы: масса атома, выраженная в а. е. м. Дробная величина атомная масса и массовое число – совершенно различные понятия Число нуклонов В ядре Всегда целое число 23
Например, кислород имеет три изотопа 16 O, 17 O и 18 O Среднее значение атомной массы: масса атома, выраженная в а. е. м. Дробная величина атомная масса и массовое число – совершенно различные понятия Число нуклонов В ядре Всегда целое число 23
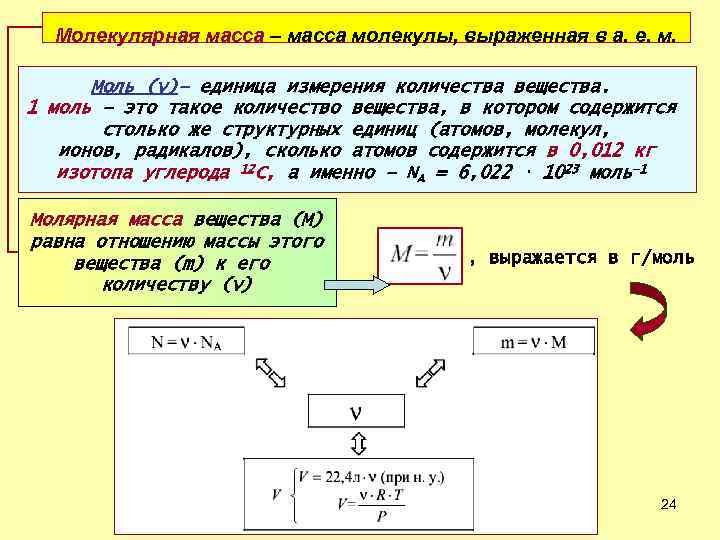 Молекулярная масса – масса молекулы, выраженная в а. е. м. Моль (ν)– единица измерения количества вещества. 1 моль – это такое количество вещества, в котором содержится столько же структурных единиц (атомов, молекул, ионов, радикалов), сколько атомов содержится в 0, 012 кг изотопа углерода 12 C, а именно – NA = 6, 022 ⋅ 1023 моль– 1 Молярная масса вещества (М) равна отношению массы этого вещества (m) к его количеству (ν) , выражается в г/моль 24
Молекулярная масса – масса молекулы, выраженная в а. е. м. Моль (ν)– единица измерения количества вещества. 1 моль – это такое количество вещества, в котором содержится столько же структурных единиц (атомов, молекул, ионов, радикалов), сколько атомов содержится в 0, 012 кг изотопа углерода 12 C, а именно – NA = 6, 022 ⋅ 1023 моль– 1 Молярная масса вещества (М) равна отношению массы этого вещества (m) к его количеству (ν) , выражается в г/моль 24
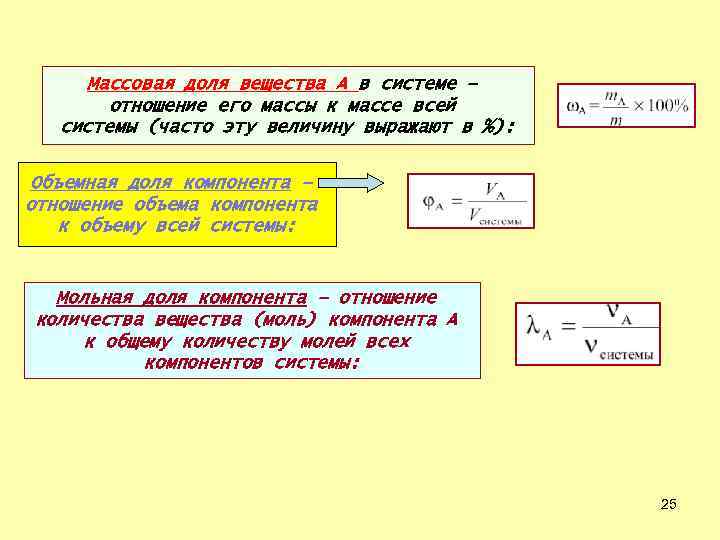 Массовая доля вещества A в системе – отношение его массы к массе всей системы (часто эту величину выражают в %): Объемная доля компонента – отношение объема компонента к объему всей системы: Мольная доля компонента – отношение количества вещества (моль) компонента A к общему количеству молей всех компонентов системы: 25
Массовая доля вещества A в системе – отношение его массы к массе всей системы (часто эту величину выражают в %): Объемная доля компонента – отношение объема компонента к объему всей системы: Мольная доля компонента – отношение количества вещества (моль) компонента A к общему количеству молей всех компонентов системы: 25
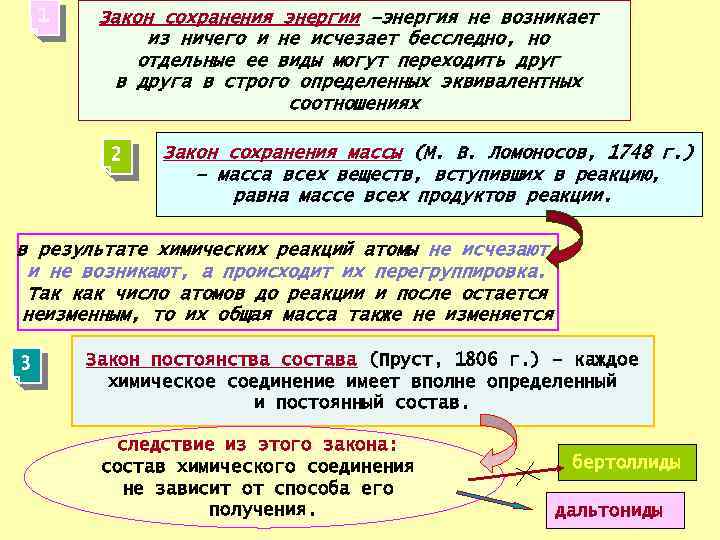 1 Закон сохранения энергии –энергия не возникает из ничего и не исчезает бесследно, но отдельные ее виды могут переходить друг в друга в строго определенных эквивалентных соотношениях 2 Закон сохранения массы (М. В. Ломоносов, 1748 г. ) – масса всех веществ, вступивших в реакцию, равна массе всех продуктов реакции. в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка. Так как число атомов до реакции и после остается неизменным, то их общая масса также не изменяется 3 Закон постоянства состава (Пруст, 1806 г. ) – каждое химическое соединение имеет вполне определенный и постоянный состав. следствие из этого закона: состав химического соединения не зависит от способа его получения. бертоллиды дальтониды26
1 Закон сохранения энергии –энергия не возникает из ничего и не исчезает бесследно, но отдельные ее виды могут переходить друг в друга в строго определенных эквивалентных соотношениях 2 Закон сохранения массы (М. В. Ломоносов, 1748 г. ) – масса всех веществ, вступивших в реакцию, равна массе всех продуктов реакции. в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка. Так как число атомов до реакции и после остается неизменным, то их общая масса также не изменяется 3 Закон постоянства состава (Пруст, 1806 г. ) – каждое химическое соединение имеет вполне определенный и постоянный состав. следствие из этого закона: состав химического соединения не зависит от способа его получения. бертоллиды дальтониды26
 4 Закон кратных отношений (Дальтон) – если два элемента обр-ют между собой несколько соединений, то массовые количества одного элемента, соединяющиеся с одним и тем же массовым кол-вом другого, относятся между собой как небольшие целые числа. 5 Закон Авогадро (1811 г. ) – в равных объемах различных идеальных газов при одинаковых условиях (Т и р) содержится одинаковое число молекул. Следствия из закона Авогадро 1 1 моль любого идеального газа при одинаковых условиях (Т и Р) занимает один и тот же объем 2 Плотности идеальных газов при одинаковых условиях (Т и Р) прямо пропорциональны их молярным массам: 27
4 Закон кратных отношений (Дальтон) – если два элемента обр-ют между собой несколько соединений, то массовые количества одного элемента, соединяющиеся с одним и тем же массовым кол-вом другого, относятся между собой как небольшие целые числа. 5 Закон Авогадро (1811 г. ) – в равных объемах различных идеальных газов при одинаковых условиях (Т и р) содержится одинаковое число молекул. Следствия из закона Авогадро 1 1 моль любого идеального газа при одинаковых условиях (Т и Р) занимает один и тот же объем 2 Плотности идеальных газов при одинаковых условиях (Т и Р) прямо пропорциональны их молярным массам: 27
 Для газов вводят понятие относительной плотности одного газа по другому. DA(X) – относительная плотность газа Х по газу А: 28
Для газов вводят понятие относительной плотности одного газа по другому. DA(X) – относительная плотность газа Х по газу А: 28


