для студентов.ppt
- Количество слайдов: 71
 Лекция 1
Лекция 1
 Профилактические вакцины Цель: профилактика Вакцина используется для вакцинации здоровых людей с целью «представить» организму возбудитель заболевания в неопасном виде Особенность: Иммунная система вакцинируемого еще не «знакома» с данным антигеном Решение: профилактическая вакцина должна содержать структуры, аналогичные компонентам возбудителя заболевания и имитировать антигенное действие возбудителей.
Профилактические вакцины Цель: профилактика Вакцина используется для вакцинации здоровых людей с целью «представить» организму возбудитель заболевания в неопасном виде Особенность: Иммунная система вакцинируемого еще не «знакома» с данным антигеном Решение: профилактическая вакцина должна содержать структуры, аналогичные компонентам возбудителя заболевания и имитировать антигенное действие возбудителей.
 Антигенное действие возбудителей (гуморальный иммунный ответ) Вакцины должны имитировать антигенное действие возбудителей бактерии Возбудители заболеваний являются источником антигенов и активируют различные звенья иммунитета Гуморальный (антительный) ответ вирусы Чужеродные белки антитела грибы Протективный эффект антител: • • • Связывание и нейтрализация антигена Антитело-зависимая цитотоксичность Активация системы комплемента
Антигенное действие возбудителей (гуморальный иммунный ответ) Вакцины должны имитировать антигенное действие возбудителей бактерии Возбудители заболеваний являются источником антигенов и активируют различные звенья иммунитета Гуморальный (антительный) ответ вирусы Чужеродные белки антитела грибы Протективный эффект антител: • • • Связывание и нейтрализация антигена Антитело-зависимая цитотоксичность Активация системы комплемента
 Антигенное действие возбудителей (клеточный иммунный ответ) Лизис мишеней бактерии Клеточный (активация Т-киллеров) Источники антигенов вирусы ЦТЛ грибы Чужеродные белки Клеточный (активация Т-хелперов) Т-хелперы Цитокины
Антигенное действие возбудителей (клеточный иммунный ответ) Лизис мишеней бактерии Клеточный (активация Т-киллеров) Источники антигенов вирусы ЦТЛ грибы Чужеродные белки Клеточный (активация Т-хелперов) Т-хелперы Цитокины
 Требования к вакцинам • Вакцина должна быть безопасной. • Вакцина должна индуцировать протективный иммунитет с минимальными побочными эффектами для большинства получивших ее. То есть вакцины должны генерировать длительно сохраняющуюся иммунологическую память на соответствующий антиген • Вакцина должна быть иммуногенной, т. е. должна вызывать достаточно сильный иммунный ответ. • Вакцина должна индуцировать "правильный" (необходимый) тип иммунного ответа. Когда микроорганизмы проникают в организм человека, они могут вызвать заболевание разными путями, и разные отдела иммунной системы отвечают за эффективную борьбу с ними. Вакцины должны стимулировать специфический иммунный ответ, который эффективно защитит от инфекции. • Вакцины должны быть стабильны в течение срока хранения. • Должна быть экономическая выгода создания вакцин
Требования к вакцинам • Вакцина должна быть безопасной. • Вакцина должна индуцировать протективный иммунитет с минимальными побочными эффектами для большинства получивших ее. То есть вакцины должны генерировать длительно сохраняющуюся иммунологическую память на соответствующий антиген • Вакцина должна быть иммуногенной, т. е. должна вызывать достаточно сильный иммунный ответ. • Вакцина должна индуцировать "правильный" (необходимый) тип иммунного ответа. Когда микроорганизмы проникают в организм человека, они могут вызвать заболевание разными путями, и разные отдела иммунной системы отвечают за эффективную борьбу с ними. Вакцины должны стимулировать специфический иммунный ответ, который эффективно защитит от инфекции. • Вакцины должны быть стабильны в течение срока хранения. • Должна быть экономическая выгода создания вакцин
 Разновидности вакцин по способу получения • Вакцины на основе целых бактерий/вирусов – живые аттенуированные – убитые • Синтетические • Генно-инженерные – рекомбинантные субъединичные – Рекомбинантные живые – ДНК-вакцины – Трансгенные растительные
Разновидности вакцин по способу получения • Вакцины на основе целых бактерий/вирусов – живые аттенуированные – убитые • Синтетические • Генно-инженерные – рекомбинантные субъединичные – Рекомбинантные живые – ДНК-вакцины – Трансгенные растительные
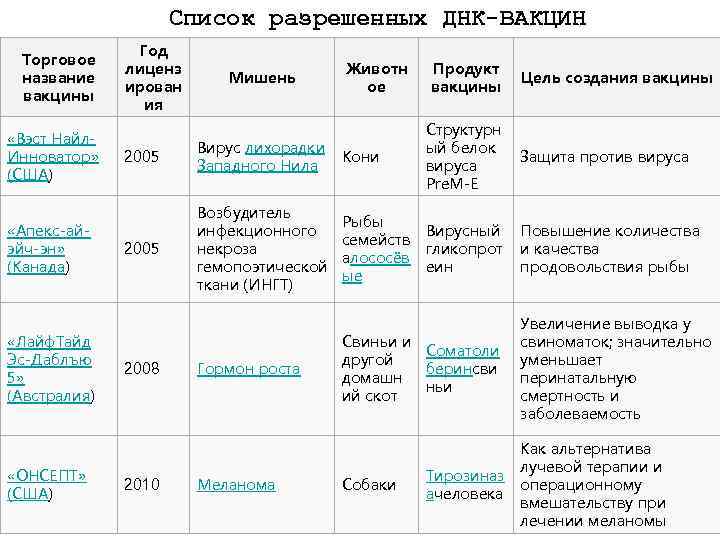 Список разрешенных ДНК-ВАКЦИН Торговое название вакцины «Вэст Найл. Инноватор» (США) «Апекс-айэйч-эн» (Канада) «Лайф. Тайд Эс-Даблъю 5» (Австралия) Год лиценз ирован ия Мишень Животн ое Продукт вакцины 2005 Вирус лихорадки Кони Западного Нила Структурн ый белок вируса Pre. M-E 2005 Возбудитель инфекционного некроза гемопоэтической ткани (ИНГТ) Вирусный гликопрот еин 2008 Гормон роста Рыбы семейств алососёв ые Свиньи и Соматоли другой беринсви домашн ньи ий скот Распределение открытых клинических исследований «ОНСЕПТ» ДНК-вакцин в зависимости от заболевания по Тирозиназ 2010 Меланома Собаки (США) ачеловека состоянию на 2011 год. Общее количество испытаний — 43 Цель создания вакцины Защита против вируса Повышение количества и качества продовольствия рыбы Увеличение выводка у свиноматок; значительно уменьшает перинатальную смертность и заболеваемость Как альтернатива лучевой терапии и операционному вмешательству при лечении меланомы
Список разрешенных ДНК-ВАКЦИН Торговое название вакцины «Вэст Найл. Инноватор» (США) «Апекс-айэйч-эн» (Канада) «Лайф. Тайд Эс-Даблъю 5» (Австралия) Год лиценз ирован ия Мишень Животн ое Продукт вакцины 2005 Вирус лихорадки Кони Западного Нила Структурн ый белок вируса Pre. M-E 2005 Возбудитель инфекционного некроза гемопоэтической ткани (ИНГТ) Вирусный гликопрот еин 2008 Гормон роста Рыбы семейств алососёв ые Свиньи и Соматоли другой беринсви домашн ньи ий скот Распределение открытых клинических исследований «ОНСЕПТ» ДНК-вакцин в зависимости от заболевания по Тирозиназ 2010 Меланома Собаки (США) ачеловека состоянию на 2011 год. Общее количество испытаний — 43 Цель создания вакцины Защита против вируса Повышение количества и качества продовольствия рыбы Увеличение выводка у свиноматок; значительно уменьшает перинатальную смертность и заболеваемость Как альтернатива лучевой терапии и операционному вмешательству при лечении меланомы
 Лекция 2
Лекция 2
 Презентация антигена в комплексе с МНС 1 и 2 класса transporters associated with antigen processing-1 and -2).
Презентация антигена в комплексе с МНС 1 и 2 класса transporters associated with antigen processing-1 and -2).
 АПК • дендритные клетки • Макрофаги • B-лимфоциты Особые рецепторы, распознающие этот «узор» на поверхности патогена, - PRR (Pattern Recognition Receptors - паттернраспознающие рецепторы) - позволяют клеткам врождённого иммунитета обнаруживать микробные клетки. TLR (Toll-Like Receptor - Toll-подобный рецептор
АПК • дендритные клетки • Макрофаги • B-лимфоциты Особые рецепторы, распознающие этот «узор» на поверхности патогена, - PRR (Pattern Recognition Receptors - паттернраспознающие рецепторы) - позволяют клеткам врождённого иммунитета обнаруживать микробные клетки. TLR (Toll-Like Receptor - Toll-подобный рецептор
 ТАРГЕТИНГ К АПК ТАРГЕТИНГ В ЯДРО • Сигнал ядерной локализации NSLPeptide PKKKRKVEDPYC • Или соединение с последовательностью ядерной локализации вируса SV 40 ТАРГЕТИНГ ДЛЯ СЕКРЕЦИИ Способствует включение лидерной последовательности TPA (Тканевого активатора плазминогена) ТАРГЕТИНГ ДЛЯ ПРЕЗЕНТАЦИИ С МНСI Присоединение к антигену убиквитина Присоединения последовательностей для TAP переносчиков ТАРГЕТИНГ ДЛЯ ПРЕЗЕНТАЦИИ С МНСII Присоединение последовательности LAMP (Lysosomal associated membrane protein type 1)
ТАРГЕТИНГ К АПК ТАРГЕТИНГ В ЯДРО • Сигнал ядерной локализации NSLPeptide PKKKRKVEDPYC • Или соединение с последовательностью ядерной локализации вируса SV 40 ТАРГЕТИНГ ДЛЯ СЕКРЕЦИИ Способствует включение лидерной последовательности TPA (Тканевого активатора плазминогена) ТАРГЕТИНГ ДЛЯ ПРЕЗЕНТАЦИИ С МНСI Присоединение к антигену убиквитина Присоединения последовательностей для TAP переносчиков ТАРГЕТИНГ ДЛЯ ПРЕЗЕНТАЦИИ С МНСII Присоединение последовательности LAMP (Lysosomal associated membrane protein type 1)
 Усиление действия вакцин на примере ДНКвакцин • Другим подходом к повышению иммуногенности ДНК-вакцин является одновременное введение ДНК, кодирующей цитокины, обосновываемое тем, что более мощный иммунный ответ возможен в случае презентации антигена в благоприятном цитокинном микроокружении. Поэтому цитокины, стимулирующие опосредуемый Тх1 иммунный ответ, в том числе гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), интерферон-гамма (ИФН-гамма), интерлейкин-2 (ИЛ-2), интерлейкин-12 (ИЛ 12) и интерлекин-18 (ИЛ-18), активно изучались на доклинических моделях инфекционных заболеваний и опухолей • Использование хемокинов. Это достигалось либо путем слияния генов антигена и воспалительных хемокинов, либо путем одновременного введения генов антигена и хемокинов • введение антиапоптотических генов, способствующих выживанию ДНКтрансформированных ДК и совместное введение кодирующей антиген ДНК и растворимого белка, кодируемого геном активатором лимфоцитов-3 (lymphocyte activating gene-3, LAG 3)
Усиление действия вакцин на примере ДНКвакцин • Другим подходом к повышению иммуногенности ДНК-вакцин является одновременное введение ДНК, кодирующей цитокины, обосновываемое тем, что более мощный иммунный ответ возможен в случае презентации антигена в благоприятном цитокинном микроокружении. Поэтому цитокины, стимулирующие опосредуемый Тх1 иммунный ответ, в том числе гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), интерферон-гамма (ИФН-гамма), интерлейкин-2 (ИЛ-2), интерлейкин-12 (ИЛ 12) и интерлекин-18 (ИЛ-18), активно изучались на доклинических моделях инфекционных заболеваний и опухолей • Использование хемокинов. Это достигалось либо путем слияния генов антигена и воспалительных хемокинов, либо путем одновременного введения генов антигена и хемокинов • введение антиапоптотических генов, способствующих выживанию ДНКтрансформированных ДК и совместное введение кодирующей антиген ДНК и растворимого белка, кодируемого геном активатором лимфоцитов-3 (lymphocyte activating gene-3, LAG 3)
 Усиление действия вакцин на примере ДНКвакцин • Иммуностимулирующее действие бактериальных Cp. G динуклеотидов. Cp. G - это сокращение для цитозина и гуанина , разделенных фосфатом, связывающим эти два нуклеотида вместе в ДНК. Cp. G-островки (Cp. G islands, Cp. G-последовательности) - протяженные участки ДНК с повышенным содержанием Cp. G динуклеотидов (кластеры Cp. G). У бактерий, а также ДНК-вирусов, эти мотивы являются неметилированным. неметилированные Cp. G-мотивы воспринимаются человеческим организмом как патагенассоциированные молекулярные паттерны (ПАМП) (PAMP, pathogen-associated molecular patterns). ПАМП-соединения распознаются толл-подобными рецепторами. Связывание рецептора с неметилированными Cp. G-мотивами запускает каскад реакций, в результате которого индуцируется синтез провоспалительных цитокинов — интерферона-1 и IL-12 • Адсорбция ДНК на катионные микрочастицы из поли(DL-лактид-когликолида), ПЛГ – poly(DLlactide-co-glycolide), PLG – обеспечивает медленное высвобождение ДНК и приводит к формированию более мощного иммунного ответа, чем использование депротеинизированной ДНК
Усиление действия вакцин на примере ДНКвакцин • Иммуностимулирующее действие бактериальных Cp. G динуклеотидов. Cp. G - это сокращение для цитозина и гуанина , разделенных фосфатом, связывающим эти два нуклеотида вместе в ДНК. Cp. G-островки (Cp. G islands, Cp. G-последовательности) - протяженные участки ДНК с повышенным содержанием Cp. G динуклеотидов (кластеры Cp. G). У бактерий, а также ДНК-вирусов, эти мотивы являются неметилированным. неметилированные Cp. G-мотивы воспринимаются человеческим организмом как патагенассоциированные молекулярные паттерны (ПАМП) (PAMP, pathogen-associated molecular patterns). ПАМП-соединения распознаются толл-подобными рецепторами. Связывание рецептора с неметилированными Cp. G-мотивами запускает каскад реакций, в результате которого индуцируется синтез провоспалительных цитокинов — интерферона-1 и IL-12 • Адсорбция ДНК на катионные микрочастицы из поли(DL-лактид-когликолида), ПЛГ – poly(DLlactide-co-glycolide), PLG – обеспечивает медленное высвобождение ДНК и приводит к формированию более мощного иммунного ответа, чем использование депротеинизированной ДНК
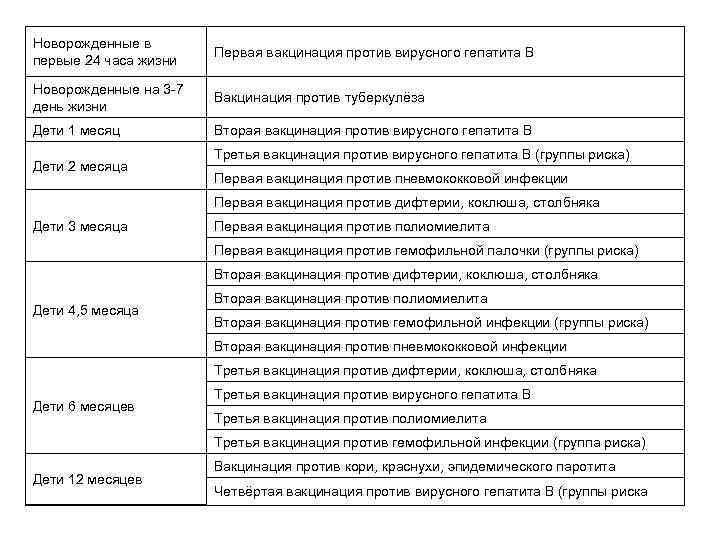 Новорожденные в первые 24 часа жизни Первая вакцинация против вирусного гепатита В Новорожденные на 3 -7 день жизни Вакцинация против туберкулёза Дети 1 месяц Вторая вакцинация против вирусного гепатита В Дети 2 месяца Третья вакцинация против вирусного гепатита В (группы риска) Первая вакцинация против пневмококковой инфекции Первая вакцинация против дифтерии, коклюша, столбняка Дети 3 месяца Первая вакцинация против полиомиелита Первая вакцинация против гемофильной палочки (группы риска) Вторая вакцинация против дифтерии, коклюша, столбняка Дети 4, 5 месяца Вторая вакцинация против полиомиелита Вторая вакцинация против гемофильной инфекции (группы риска) Вторая вакцинация против пневмококковой инфекции Третья вакцинация против дифтерии, коклюша, столбняка Дети 6 месяцев Третья вакцинация против вирусного гепатита В Третья вакцинация против полиомиелита Третья вакцинация против гемофильной инфекции (группа риска) Дети 12 месяцев Вакцинация против кори, краснухи, эпидемического паротита Четвёртая вакцинация против вирусного гепатита B (группы риска
Новорожденные в первые 24 часа жизни Первая вакцинация против вирусного гепатита В Новорожденные на 3 -7 день жизни Вакцинация против туберкулёза Дети 1 месяц Вторая вакцинация против вирусного гепатита В Дети 2 месяца Третья вакцинация против вирусного гепатита В (группы риска) Первая вакцинация против пневмококковой инфекции Первая вакцинация против дифтерии, коклюша, столбняка Дети 3 месяца Первая вакцинация против полиомиелита Первая вакцинация против гемофильной палочки (группы риска) Вторая вакцинация против дифтерии, коклюша, столбняка Дети 4, 5 месяца Вторая вакцинация против полиомиелита Вторая вакцинация против гемофильной инфекции (группы риска) Вторая вакцинация против пневмококковой инфекции Третья вакцинация против дифтерии, коклюша, столбняка Дети 6 месяцев Третья вакцинация против вирусного гепатита В Третья вакцинация против полиомиелита Третья вакцинация против гемофильной инфекции (группа риска) Дети 12 месяцев Вакцинация против кори, краснухи, эпидемического паротита Четвёртая вакцинация против вирусного гепатита B (группы риска
 Дети 15 месяцев Ревакцинация против пневмококковой инфекции Первая ревакцинация против дифтерии, коклюша, столбняка Дети 18 месяцев Первая ревакцинация против полиомиелита Ревакцинация против гемофильной инфекции (группы риска) Дети 20 месяцев Вторая ревакцинация против полиомиелита Дети 6 лет Ревакцинация против кори, краснухи, эпидемического паротита Дети 6 -7 лет Дети 14 лет Взрослые 18 лет Вторая ревакцинация против дифтерии, столбняка Ревакцинация против туберкулёза Третья ревакцинация против дифтерии, столбняка Третья ревакцинация против полиомиелита Ревакцинация против дифтерии, столбняка - каждые 10 лет от момента последней ревакцинации Дети от 1 года до 18 лет, взрослые от 18 до 55 лет, не привитые ранее Вакцинация против вирусного гепатита В Дети от 1 года до 18 лет, женщины от 18 до 25 лет (включительно), не болевшие, не привитые, привитые однократно против краснухи, не имеющие сведений о прививках против краснухи Вакцинация против краснухи Дети от 1 года до 18 лет включительно и взрослые в возрасте до 35 лет (включительно), не болевшие, не привитые, привитые однократно, не имеющие сведений о прививках против кори Вакцинация против кори Дети с 6 месяцев; учащиеся 1 -11 классов; обучающиеся в профессиональных образовательных организациях и образовательных организациях высшего образования; взрослые работающие по отдельным профессиям и должностям (работники медицинских и образовательных организаций, транспорта и пр. Вакцинация против гриппа
Дети 15 месяцев Ревакцинация против пневмококковой инфекции Первая ревакцинация против дифтерии, коклюша, столбняка Дети 18 месяцев Первая ревакцинация против полиомиелита Ревакцинация против гемофильной инфекции (группы риска) Дети 20 месяцев Вторая ревакцинация против полиомиелита Дети 6 лет Ревакцинация против кори, краснухи, эпидемического паротита Дети 6 -7 лет Дети 14 лет Взрослые 18 лет Вторая ревакцинация против дифтерии, столбняка Ревакцинация против туберкулёза Третья ревакцинация против дифтерии, столбняка Третья ревакцинация против полиомиелита Ревакцинация против дифтерии, столбняка - каждые 10 лет от момента последней ревакцинации Дети от 1 года до 18 лет, взрослые от 18 до 55 лет, не привитые ранее Вакцинация против вирусного гепатита В Дети от 1 года до 18 лет, женщины от 18 до 25 лет (включительно), не болевшие, не привитые, привитые однократно против краснухи, не имеющие сведений о прививках против краснухи Вакцинация против краснухи Дети от 1 года до 18 лет включительно и взрослые в возрасте до 35 лет (включительно), не болевшие, не привитые, привитые однократно, не имеющие сведений о прививках против кори Вакцинация против кори Дети с 6 месяцев; учащиеся 1 -11 классов; обучающиеся в профессиональных образовательных организациях и образовательных организациях высшего образования; взрослые работающие по отдельным профессиям и должностям (работники медицинских и образовательных организаций, транспорта и пр. Вакцинация против гриппа
 ИММУНОПРОФИЛАКТИКА ГЕПАТИТА В Вирусный гепатит В относится к наиболее опасным возбудителям, приводящим к развитию хронического гепатита, цирроза и первичного рака печени. Гепатит В является самой частой причиной заболеваний печени. В мире насчитывается около 350 млн. носителей вируса гепатита В, из которых 250 тыс. ежегодно умирают от заболеваний печени. В нашей стране ежегодно регистрируется 50 тыс. новых случаев заболевания и насчитывается 5 млн. хронических носителей. Вакцинация от гепатита В происходит по схеме 0 -1 -6 месяцев для детей В России разрешены к применению отечественная рекомбинантная дрожжевая вакцина против гепатита В фирмы «Комбиотех ЛТД» , зарубежные вакцины производства фирмы «Мерк Шарп и Доум» – «H – B – Vax II» , фирмы «Смит— Кляйн Бичом» – «Энджерикс В» и производства Республики Куба – «Rec – HBs. Ag» . Вакцины хранят при температуре от + 2 до + 3 °C. . Вакцины нельзя замораживать. Прививка защищает примерно на 10 лет, по истечении которых необходимо провести ревакцинацию. Через полгода после процедуры, рекомендуется сдавать кровь на анализ, чтобы проверить, дала ли она эффект. Ведь может случиться так, что после прививки гепатита В по какой-то причине иммунитет не формируется. Например, если вакцину хранили неправильно. Поэтому необходимо еще раз сдать анализы. Если иммунный ответ к вирусу гепатита В ослабел, значит, нужно сделать еще одну прививку
ИММУНОПРОФИЛАКТИКА ГЕПАТИТА В Вирусный гепатит В относится к наиболее опасным возбудителям, приводящим к развитию хронического гепатита, цирроза и первичного рака печени. Гепатит В является самой частой причиной заболеваний печени. В мире насчитывается около 350 млн. носителей вируса гепатита В, из которых 250 тыс. ежегодно умирают от заболеваний печени. В нашей стране ежегодно регистрируется 50 тыс. новых случаев заболевания и насчитывается 5 млн. хронических носителей. Вакцинация от гепатита В происходит по схеме 0 -1 -6 месяцев для детей В России разрешены к применению отечественная рекомбинантная дрожжевая вакцина против гепатита В фирмы «Комбиотех ЛТД» , зарубежные вакцины производства фирмы «Мерк Шарп и Доум» – «H – B – Vax II» , фирмы «Смит— Кляйн Бичом» – «Энджерикс В» и производства Республики Куба – «Rec – HBs. Ag» . Вакцины хранят при температуре от + 2 до + 3 °C. . Вакцины нельзя замораживать. Прививка защищает примерно на 10 лет, по истечении которых необходимо провести ревакцинацию. Через полгода после процедуры, рекомендуется сдавать кровь на анализ, чтобы проверить, дала ли она эффект. Ведь может случиться так, что после прививки гепатита В по какой-то причине иммунитет не формируется. Например, если вакцину хранили неправильно. Поэтому необходимо еще раз сдать анализы. Если иммунный ответ к вирусу гепатита В ослабел, значит, нужно сделать еще одну прививку
 ИММУНОПРОФИЛАКТИКА ТУБЕРКУЛЕЗА По данным Всемирной организации здравоохранения (ВОЗ), в мире ежегодно регистрируется около 8 -10 млн. новых случаев туберкулеза и 3 млн. случаев смерти от него. Туберкулез уносит больше жизней, чем любая другая инфекция. На фоне социально-экономического кризиса в России, сопровождающегося значительным снижением уровня жизни населения, ростом безработицы и социально дезадаптированного контингента, туберкулез становится угрожающей медико-социальной проблемой. Возбудители – микобактерии туберкулеза (МБТ) были открыты Робертом Кохом в 1882 году и представляют собой изогнутые палочки, размером от 1 до 10 микрон, относящиеся к группе микобактерий Чаще всего микобактерии туберкулеза передаются воздушно-капельным путем. Иммунизация против туберкулеза осуществляется вакциной БЦЖ (bacillus Calmette-Guerin» (BCG), названную так по фамилиям создателей) , которая относится живым, ослабленным вакцинам . Эффективность вакцины БЦЖ является предметов многочисленных споров. Однако точно известно, что вакцина обладает значительной эффективностью у детей, и хорошо предохраняет от развития тяжелых форм заболевания. Обязательная повсеместная вакцинация против туберкулеза принята не во всех странах; это решение зависит от уровня заболеваемости туберкулезом в стране. В России этот уровень настолько высок, что повсеместная вакцинация считается необходимой и обязательной.
ИММУНОПРОФИЛАКТИКА ТУБЕРКУЛЕЗА По данным Всемирной организации здравоохранения (ВОЗ), в мире ежегодно регистрируется около 8 -10 млн. новых случаев туберкулеза и 3 млн. случаев смерти от него. Туберкулез уносит больше жизней, чем любая другая инфекция. На фоне социально-экономического кризиса в России, сопровождающегося значительным снижением уровня жизни населения, ростом безработицы и социально дезадаптированного контингента, туберкулез становится угрожающей медико-социальной проблемой. Возбудители – микобактерии туберкулеза (МБТ) были открыты Робертом Кохом в 1882 году и представляют собой изогнутые палочки, размером от 1 до 10 микрон, относящиеся к группе микобактерий Чаще всего микобактерии туберкулеза передаются воздушно-капельным путем. Иммунизация против туберкулеза осуществляется вакциной БЦЖ (bacillus Calmette-Guerin» (BCG), названную так по фамилиям создателей) , которая относится живым, ослабленным вакцинам . Эффективность вакцины БЦЖ является предметов многочисленных споров. Однако точно известно, что вакцина обладает значительной эффективностью у детей, и хорошо предохраняет от развития тяжелых форм заболевания. Обязательная повсеместная вакцинация против туберкулеза принята не во всех странах; это решение зависит от уровня заболеваемости туберкулезом в стране. В России этот уровень настолько высок, что повсеместная вакцинация считается необходимой и обязательной.
 ИММУНОПРОФИЛАКТИКА ПОЛИОМИЕЛИТА • Полиомиелит поражает, в основном, детей в возрасте Полиомиели т (от др. -греч. πολιός — серый и µυελός — до 5 лет. спинной мозг) — детский спинномозговой паралич, острое, • В одном из 200 случаев инфицирования развивается высококонтагиозное инфекционное заболевание, необратимый паралич (обычно ног). 5 -10% из числа обусловленное поражением серого вещества спинного мозга таких парализованных людей умирают из-за полиовирусом и характеризующееся преимущественно наступающего паралича дыхательных мышц. патологией нервной системы Передается воздушно • С 1988 года число случаев заболевания капельным, фекально-оральным и невральными путями, полиомиелитом уменьшилось более чем на 99%: по характеризующееся лихорадкой, развитием серозного оценкам, с 350 000 случаев до 406 случаев, менингита, реже – вялых парезов и параличей конечностей. зарегистрированных в 2013 году. Такое уменьшение стало результатом глобальных усилий по ликвидации этой болезни. • В 2014 году лишь три страны (Афганистан, Нигерия и Пакистан) в мире остаются эндемичными по полиомиелиту, в то время как в 1988 году число таких стран превышало 125. • До тех пор пока в мире остается хоть один инфицированный ребенок, риску заражения полиомиелитом подвергаются дети во всех странах. Неспособность ликвидировать полиомиелит в этих остающихся устойчивых очагах может привести к тому, что через 10 лет в мире будет ежегодно происходить до 200 000 новых случаев заболевания.
ИММУНОПРОФИЛАКТИКА ПОЛИОМИЕЛИТА • Полиомиелит поражает, в основном, детей в возрасте Полиомиели т (от др. -греч. πολιός — серый и µυελός — до 5 лет. спинной мозг) — детский спинномозговой паралич, острое, • В одном из 200 случаев инфицирования развивается высококонтагиозное инфекционное заболевание, необратимый паралич (обычно ног). 5 -10% из числа обусловленное поражением серого вещества спинного мозга таких парализованных людей умирают из-за полиовирусом и характеризующееся преимущественно наступающего паралича дыхательных мышц. патологией нервной системы Передается воздушно • С 1988 года число случаев заболевания капельным, фекально-оральным и невральными путями, полиомиелитом уменьшилось более чем на 99%: по характеризующееся лихорадкой, развитием серозного оценкам, с 350 000 случаев до 406 случаев, менингита, реже – вялых парезов и параличей конечностей. зарегистрированных в 2013 году. Такое уменьшение стало результатом глобальных усилий по ликвидации этой болезни. • В 2014 году лишь три страны (Афганистан, Нигерия и Пакистан) в мире остаются эндемичными по полиомиелиту, в то время как в 1988 году число таких стран превышало 125. • До тех пор пока в мире остается хоть один инфицированный ребенок, риску заражения полиомиелитом подвергаются дети во всех странах. Неспособность ликвидировать полиомиелит в этих остающихся устойчивых очагах может привести к тому, что через 10 лет в мире будет ежегодно происходить до 200 000 новых случаев заболевания.
 ИММУНОПРОФИЛАКТИКА КОКЛЮША, ДИФТЕРИИ И СТОЛБНЯКА АКДС – адсорбированной коклюшно—дифтерийной—столбнячной вакциной, Коклюш опасен не столько своим проявлением сколько осложнениями. которая включает в себя убитые бактерии коклюша и два анатоксина – Осложнения коклюша дифтерийный и столбнячный; • Эмфизема легких; • Эмфизема средостения и подкожной клетчатки; Дифтерия – острое инфекционное заболевание, вызванное • Ателектазы легких; Corynebcterium diphtheria (палочка Лефлера), • Коклюшная пневмония; проявляющееся воспалением ротоглотки с образованием • фибриновых Нарушение ритма дыхания (задержки и остановки – апноэ); плёнок в виде белого налёта и с тяжёлой • Нарушение мозгового кровообращения; сопутствующей общей интоксикацией • Кровотечения (из носа, заднеглоточного пространства, бронхов, Столбняк – особо тяжёлая, острая, сапрозоонозная наружного слухового прохода); (обитатель почв) бактериальная инфекция с контактным • Кровоизлияния (под кожу, в слизистые оболочки, склеры и сетчатку механизмом передачи, характеризующаяся приступами глаза, головной мозг, субарахноидальные и внутрижелудочковые, генерализованных судорог на фоне мышечного эпидуральные гематомы спинного мозга); гипертонуса. Возбудитель столбняка – бактерия Clostridium • Грыжи (пупочная, паховая); tetani. Главная отличительная особенность возбудителя – • Выпадение слизистой прямой кишки; наличие самого сильного в мире экзотоксина, по силе он • Надрыв или язвочка уздечки языка; уступает лишь ботулиновому токсину. Его минимальная • Разрывы диафрагмы. смертельная доза – 2 нг/кг. задержка психомоторного развития вплоть до возникновения умственной отсталости различной степени тяжести, неврозы, эпилептиформные Коклюш (Pertussis) – острое инфекционное заболевание, вызываемое Bordetella припадки, разнообразные речевые расстройства; слепота, глухота. pertussis; передается воздушно-капельным путем, ведущий клинический синдром – приступообразный судорожный кашель.
ИММУНОПРОФИЛАКТИКА КОКЛЮША, ДИФТЕРИИ И СТОЛБНЯКА АКДС – адсорбированной коклюшно—дифтерийной—столбнячной вакциной, Коклюш опасен не столько своим проявлением сколько осложнениями. которая включает в себя убитые бактерии коклюша и два анатоксина – Осложнения коклюша дифтерийный и столбнячный; • Эмфизема легких; • Эмфизема средостения и подкожной клетчатки; Дифтерия – острое инфекционное заболевание, вызванное • Ателектазы легких; Corynebcterium diphtheria (палочка Лефлера), • Коклюшная пневмония; проявляющееся воспалением ротоглотки с образованием • фибриновых Нарушение ритма дыхания (задержки и остановки – апноэ); плёнок в виде белого налёта и с тяжёлой • Нарушение мозгового кровообращения; сопутствующей общей интоксикацией • Кровотечения (из носа, заднеглоточного пространства, бронхов, Столбняк – особо тяжёлая, острая, сапрозоонозная наружного слухового прохода); (обитатель почв) бактериальная инфекция с контактным • Кровоизлияния (под кожу, в слизистые оболочки, склеры и сетчатку механизмом передачи, характеризующаяся приступами глаза, головной мозг, субарахноидальные и внутрижелудочковые, генерализованных судорог на фоне мышечного эпидуральные гематомы спинного мозга); гипертонуса. Возбудитель столбняка – бактерия Clostridium • Грыжи (пупочная, паховая); tetani. Главная отличительная особенность возбудителя – • Выпадение слизистой прямой кишки; наличие самого сильного в мире экзотоксина, по силе он • Надрыв или язвочка уздечки языка; уступает лишь ботулиновому токсину. Его минимальная • Разрывы диафрагмы. смертельная доза – 2 нг/кг. задержка психомоторного развития вплоть до возникновения умственной отсталости различной степени тяжести, неврозы, эпилептиформные Коклюш (Pertussis) – острое инфекционное заболевание, вызываемое Bordetella припадки, разнообразные речевые расстройства; слепота, глухота. pertussis; передается воздушно-капельным путем, ведущий клинический синдром – приступообразный судорожный кашель.
 ИММУНОПРОФИЛАКТИКА КОРИПАРОТИТА-КРАСНУХИ Краснуха (лат. rubella) обычно неопасное Корь – острая, сильно заразная вирусная Эпидемический паротит (Parotitis Epidemica) – заболевание, затрагивающее в основном детей, инфекция, встречающаяся только у человека, острое инфекционное заболевание; однако оно может спровоцировать серьёзные передающаяся воздушно-капельным путём, общей характеризуется лихорадкой, врожденные пороки, если женщина заражается в вызывающая генерализованное поражение желез интоксикацией, начале беременности поражением слюнных слизистых ротовой полости, ротоглотки, (особенно околоушных), реже – других железистых Опасность вируса краснухи в том, что он практически дыхательных путей и глаз и сопровождающееся Вирус кори – РНК содержащий органов (репродуктивных, поджелудочной железы), вирус, относится к семейству всегда передается от матери плоду и повреждает его. пятнисто-папулёзной сыпью на коже а В зависимости от срока беременности, на котором также ЦНС (менингит, менингоэнцефалит). В парамиксовирусов и полностью (экзантема) и слизистых рта (энантема), с основном эпидемическим паротитом болеют дети в происходит заражение, у плода c различной типичен для этого семейства – сопутствующей тяжёлой интоксикацией крупных размеров и неправильной возрасте от 3 до 15 лет, хотя иногда заболевание вероятностью (в I триместре вероятность достигает сферической формы встречается и у взрослых (16– 30 лет). Заражение 90%, во втором - до 75%, в третьем - 50%) происходит воздушно-капельным путём (при кашле, формируются множественные пороки развития. В развивающихся странах корь убивает больше детей, чем любая другая чихании, разговоре) от больного человека. Наиболее характерными являются поражение органа вакциноуправляемая инфекция. В 2001 г. насчитывалось 30– 40 млн случаев Возбудитель эпидемического паротита РНКзрения (катаракта, глаукома, помутнение роговицы), кори в мире, из них 777 000 — с летальным исходом. В России начавшийся содержащий вирус из семейства парамиксовирусов органа слуха (глухота), сердца (врожденные пороки). в конце 80 -х годов подъём заболеваемости корью достиг максимума к 1993 г. (Paramyxoviridae). Он чувствителен к факторам Также к синдрому врожденной краснухи относят Заболеваемость составила 50 случаев на 100 000 населения. Большая внешней среды, но длительно сохраняется при дефекты формирования костей черепа, головного часть заболевших (30— 50%) состояла из лиц в возрасте 15— 20 лет. низких температурах. Вакцинация проводится мозга (малый размер мозга, умственная отсталость), Благодаря принятым мерам по иммунопрофилактике кори заболеваемость ослабленной живой вакциной, которую вводят внутренних органов (желтуха, увеличение печени, упала в 1996 г. до самого низкого уровня за весь период регистрации кори. подкожно, под лопатку. миокардит и др. ) и костей (участки разрежения В 2001 г. прививка от кори охватывала около 95% населения, а уровень костной ткани длинных трубчатых костей). В 15% заболеваемости был 1, 45 на 100 тыс населения случаев краснуха у беременных приводит к выкидышам
ИММУНОПРОФИЛАКТИКА КОРИПАРОТИТА-КРАСНУХИ Краснуха (лат. rubella) обычно неопасное Корь – острая, сильно заразная вирусная Эпидемический паротит (Parotitis Epidemica) – заболевание, затрагивающее в основном детей, инфекция, встречающаяся только у человека, острое инфекционное заболевание; однако оно может спровоцировать серьёзные передающаяся воздушно-капельным путём, общей характеризуется лихорадкой, врожденные пороки, если женщина заражается в вызывающая генерализованное поражение желез интоксикацией, начале беременности поражением слюнных слизистых ротовой полости, ротоглотки, (особенно околоушных), реже – других железистых Опасность вируса краснухи в том, что он практически дыхательных путей и глаз и сопровождающееся Вирус кори – РНК содержащий органов (репродуктивных, поджелудочной железы), вирус, относится к семейству всегда передается от матери плоду и повреждает его. пятнисто-папулёзной сыпью на коже а В зависимости от срока беременности, на котором также ЦНС (менингит, менингоэнцефалит). В парамиксовирусов и полностью (экзантема) и слизистых рта (энантема), с основном эпидемическим паротитом болеют дети в происходит заражение, у плода c различной типичен для этого семейства – сопутствующей тяжёлой интоксикацией крупных размеров и неправильной возрасте от 3 до 15 лет, хотя иногда заболевание вероятностью (в I триместре вероятность достигает сферической формы встречается и у взрослых (16– 30 лет). Заражение 90%, во втором - до 75%, в третьем - 50%) происходит воздушно-капельным путём (при кашле, формируются множественные пороки развития. В развивающихся странах корь убивает больше детей, чем любая другая чихании, разговоре) от больного человека. Наиболее характерными являются поражение органа вакциноуправляемая инфекция. В 2001 г. насчитывалось 30– 40 млн случаев Возбудитель эпидемического паротита РНКзрения (катаракта, глаукома, помутнение роговицы), кори в мире, из них 777 000 — с летальным исходом. В России начавшийся содержащий вирус из семейства парамиксовирусов органа слуха (глухота), сердца (врожденные пороки). в конце 80 -х годов подъём заболеваемости корью достиг максимума к 1993 г. (Paramyxoviridae). Он чувствителен к факторам Также к синдрому врожденной краснухи относят Заболеваемость составила 50 случаев на 100 000 населения. Большая внешней среды, но длительно сохраняется при дефекты формирования костей черепа, головного часть заболевших (30— 50%) состояла из лиц в возрасте 15— 20 лет. низких температурах. Вакцинация проводится мозга (малый размер мозга, умственная отсталость), Благодаря принятым мерам по иммунопрофилактике кори заболеваемость ослабленной живой вакциной, которую вводят внутренних органов (желтуха, увеличение печени, упала в 1996 г. до самого низкого уровня за весь период регистрации кори. подкожно, под лопатку. миокардит и др. ) и костей (участки разрежения В 2001 г. прививка от кори охватывала около 95% населения, а уровень костной ткани длинных трубчатых костей). В 15% заболеваемости был 1, 45 на 100 тыс населения случаев краснуха у беременных приводит к выкидышам
 Пневмококковая инфекция Возбудитель – пневмококк или Streptococcus pneumoniae, грамположительный (кокк, окруженный полисахаридной оболочкой, которая содержит антифагин. Именно антифагин препятствует уничтожению (фагоцитированию) пневмококков лейкоцитами. Такая оболочка позволяет ускользать пневмококку от иммунной системы маленького ребенка от 0 до 2 х лет. Иммунные клетки взрослого человека уже справляются с нейтрализацией пневмококка. Именно эта особенность и является причиной распространенности пневмококковой инфекции у детей раннего возраста. Проявления болезни: 1) Пневмококковая пневмония (воспаление легких) 2) Пневмококковый менингит (воспаление мягкой мозговой оболочки) 3) Пневмококковый отит (воспаление среднего уха) 4) Пневмококковый сепсис (заражение крови)
Пневмококковая инфекция Возбудитель – пневмококк или Streptococcus pneumoniae, грамположительный (кокк, окруженный полисахаридной оболочкой, которая содержит антифагин. Именно антифагин препятствует уничтожению (фагоцитированию) пневмококков лейкоцитами. Такая оболочка позволяет ускользать пневмококку от иммунной системы маленького ребенка от 0 до 2 х лет. Иммунные клетки взрослого человека уже справляются с нейтрализацией пневмококка. Именно эта особенность и является причиной распространенности пневмококковой инфекции у детей раннего возраста. Проявления болезни: 1) Пневмококковая пневмония (воспаление легких) 2) Пневмококковый менингит (воспаление мягкой мозговой оболочки) 3) Пневмококковый отит (воспаление среднего уха) 4) Пневмококковый сепсис (заражение крови)
 Гемофильная инфекция (ХИБ - инфекция) В календарь введена новая прививка – ХИБ по сокращению от первых букв Haemophilus influenzae тип b, Гемофильная палочка типа b Гемофильная инфекция вызывается H. influenzae – грамотрицательными палочковидные или кокковидные клетки размером 0, 2 -0, 3 Х 0, 5 -2 мкм. Этот микроб, опасен в основном детям, причем до 5 -7 летнего возраста, когда иммунная защита организма еще слаба и легко развиваются серьезные инфекции. Она, наряду с менингококком, очень часто является причиной менингитов у детей, на ее счету примерно треть от всех детских пневмоний, практически каждое третье ОРЗ, бронхит или отит – это заслуга этой коварной палочки. У детей гемофильная инфекция проявляется гнойным менингитом, средним отитом, различными заболеваниями дыхательных путей (пневмония, бронхит, эпиглоттит), конъюнктивитом, эндокардитом, остеомиелитом и др. Анализ данных по многим странам (США, Великобритания, Франция, Канада, Финляндия и др. ), где прививают данную вакцину, за 10 лет показал снижение заболеваемости в 4 -10 раз, по сравнению с не привитыми детьми, особенно в группе посещающих детские сады.
Гемофильная инфекция (ХИБ - инфекция) В календарь введена новая прививка – ХИБ по сокращению от первых букв Haemophilus influenzae тип b, Гемофильная палочка типа b Гемофильная инфекция вызывается H. influenzae – грамотрицательными палочковидные или кокковидные клетки размером 0, 2 -0, 3 Х 0, 5 -2 мкм. Этот микроб, опасен в основном детям, причем до 5 -7 летнего возраста, когда иммунная защита организма еще слаба и легко развиваются серьезные инфекции. Она, наряду с менингококком, очень часто является причиной менингитов у детей, на ее счету примерно треть от всех детских пневмоний, практически каждое третье ОРЗ, бронхит или отит – это заслуга этой коварной палочки. У детей гемофильная инфекция проявляется гнойным менингитом, средним отитом, различными заболеваниями дыхательных путей (пневмония, бронхит, эпиглоттит), конъюнктивитом, эндокардитом, остеомиелитом и др. Анализ данных по многим странам (США, Великобритания, Франция, Канада, Финляндия и др. ), где прививают данную вакцину, за 10 лет показал снижение заболеваемости в 4 -10 раз, по сравнению с не привитыми детьми, особенно в группе посещающих детские сады.
 Грипп Ежегодно в мире гриппом болеют от 3 до 5 млн. человек. Эпидемии гриппа возникают с периодичностью 1– 3 года, но эпидемические вспышки отмечаются ежегодно и наносят большой ущерб здоровью населения, приводят к огромным финансовым затратам на лечение и реабилитацию больных Вирусы гриппа относятся к семейству Orthomyxoviridae и делятся на три рода: вирус гриппа А, вирус гриппа B и вирус гриппа C.
Грипп Ежегодно в мире гриппом болеют от 3 до 5 млн. человек. Эпидемии гриппа возникают с периодичностью 1– 3 года, но эпидемические вспышки отмечаются ежегодно и наносят большой ущерб здоровью населения, приводят к огромным финансовым затратам на лечение и реабилитацию больных Вирусы гриппа относятся к семейству Orthomyxoviridae и делятся на три рода: вирус гриппа А, вирус гриппа B и вирус гриппа C.
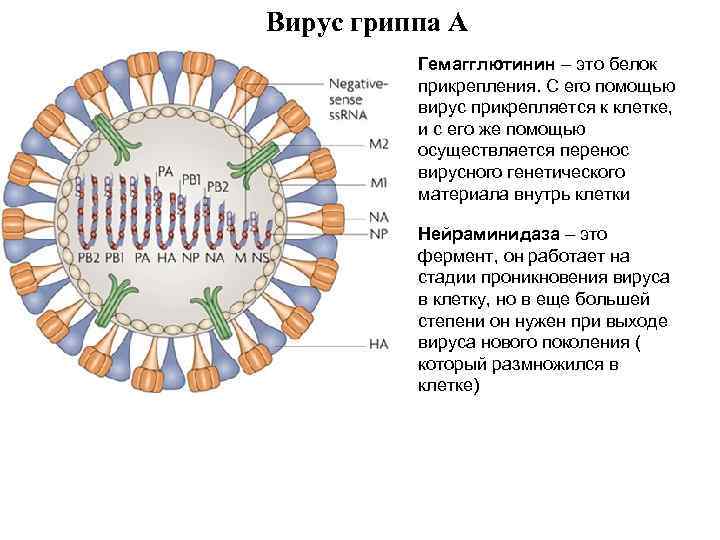 Вирус гриппа А Гемагглютинин – это белок прикрепления. С его помощью вирус прикрепляется к клетке, и с его же помощью осуществляется перенос вирусного генетического материала внутрь клетки Нейраминидаза – это фермент, он работает на стадии проникновения вируса в клетку, но в еще большей степени он нужен при выходе вируса нового поколения ( который размножился в клетке)
Вирус гриппа А Гемагглютинин – это белок прикрепления. С его помощью вирус прикрепляется к клетке, и с его же помощью осуществляется перенос вирусного генетического материала внутрь клетки Нейраминидаза – это фермент, он работает на стадии проникновения вируса в клетку, но в еще большей степени он нужен при выходе вируса нового поколения ( который размножился в клетке)
 Реассортация
Реассортация
 Известные пандемии гриппа Пандемией (от греч. pandemía — весь народ) называют вспышку заболевания, охватившую весь мир. За последние сто лет пандемия гриппа происходила пять раз: в 1918, 1957, 1968, 1977 и в 2009 году. Из двух миллиардов людей, живших тогда на планете, от «испанки» погибло, по самым осторожным оценкам, сорок миллионов – каждый пятидесятый! После этого вирус H 1 N 1 ещё долго циркулировал по планете, но пандемий больше не вызывал – ведь у каждого переболевшего формировался стойкий иммунитет
Известные пандемии гриппа Пандемией (от греч. pandemía — весь народ) называют вспышку заболевания, охватившую весь мир. За последние сто лет пандемия гриппа происходила пять раз: в 1918, 1957, 1968, 1977 и в 2009 году. Из двух миллиардов людей, живших тогда на планете, от «испанки» погибло, по самым осторожным оценкам, сорок миллионов – каждый пятидесятый! После этого вирус H 1 N 1 ещё долго циркулировал по планете, но пандемий больше не вызывал – ведь у каждого переболевшего формировался стойкий иммунитет
 Лекция 3
Лекция 3
 Терапевтические вакцины Цель: терапия Вакцина используется для вакцинации больных людей с целью активировать иммунитет на борьбу с инфекцией Особенность: Иммунная система вакцинируемого уже «знакома» с данным антигеном, но эффективность ее действия снижена (заболевание приобретает хронический характер) Решение: терапевтическая вакцина модифицирует действие иммунной системы больного, причем как адресно, так и в целом. Содержит ряд иммуномодулирующих агентов и может содержать доминантные антигенные участки возбудителя
Терапевтические вакцины Цель: терапия Вакцина используется для вакцинации больных людей с целью активировать иммунитет на борьбу с инфекцией Особенность: Иммунная система вакцинируемого уже «знакома» с данным антигеном, но эффективность ее действия снижена (заболевание приобретает хронический характер) Решение: терапевтическая вакцина модифицирует действие иммунной системы больного, причем как адресно, так и в целом. Содержит ряд иммуномодулирующих агентов и может содержать доминантные антигенные участки возбудителя
 Противоопухолевые вакцины
Противоопухолевые вакцины
 Т-киллеры
Т-киллеры
 NK-киллеры
NK-киллеры
 ГУМОРАЛЬНЫЙ ПРОТИВООПУХОЛЕВЫЙ ИММУНИТЕТ В противоположность клеточному цитотоксическому иммунитету гуморальные антитела не обеспечивают значительную защиту против опухолевого роста. Большинство антител не распознают ТАА. Тем не менее, гуморальные антитела, реагирующие с опухолевыми клетками in vitro, обнаружены в сыворотке больных с различными неопластическими процессами, включая лимфому Беркитта, злокачественную меланому, остеосаркому, нейробластому, рак легкого, молочной железы и ЖКТ. Цитотоксические антитела направлены против поверхностных антигенов опухолевых клеток. Эти антитела способны приводить в действие противоопухолевые эффекты посредством фиксации комплемента или служат флагом для деструкции опухолевых клеток Тлимфоцитами (антител-зависимая клеточно-опосредованная цитотоксичность). Другая популяция гуморальных антител, называемая усиливающими антителами (блокирующие антитела), способна больше поддерживать, чем ингибировать опухолевый рост. Механизмы и значимость такого иммунологического усиления не понятны.
ГУМОРАЛЬНЫЙ ПРОТИВООПУХОЛЕВЫЙ ИММУНИТЕТ В противоположность клеточному цитотоксическому иммунитету гуморальные антитела не обеспечивают значительную защиту против опухолевого роста. Большинство антител не распознают ТАА. Тем не менее, гуморальные антитела, реагирующие с опухолевыми клетками in vitro, обнаружены в сыворотке больных с различными неопластическими процессами, включая лимфому Беркитта, злокачественную меланому, остеосаркому, нейробластому, рак легкого, молочной железы и ЖКТ. Цитотоксические антитела направлены против поверхностных антигенов опухолевых клеток. Эти антитела способны приводить в действие противоопухолевые эффекты посредством фиксации комплемента или служат флагом для деструкции опухолевых клеток Тлимфоцитами (антител-зависимая клеточно-опосредованная цитотоксичность). Другая популяция гуморальных антител, называемая усиливающими антителами (блокирующие антитела), способна больше поддерживать, чем ингибировать опухолевый рост. Механизмы и значимость такого иммунологического усиления не понятны.
 Иммуноредактирование
Иммуноредактирование
 http: //biomolecula. ru/content/1499 Ключевую роль в этом перепрограммировании играют Хуже того: под NF-k. B. С помщью которых, опухоль белки семейства действием веществ, выделяемых опухолевыми агрессивных М 1 -макрофагов в невольных превращает клетками, активные М 1 -макрофаги «перепрограммируются» в М 2 -тип, перестают пособников своего собственного развития: М 2 -тип синтезировать антиопухолевые цитокины, такие как макрофагов, воспринимая опухоль как поврежденный интерлейкин-12 (IL 12) или программу восстановления, участок ткани, включают фактор некроза опухолей (TNF) и начинают выделять факторы роста среду однако секретируемые ими в окружающую только молекулы, ускоряющие рост опухоли и прорастание добавляют ресурсы для роста опухоли. На этом цикл кровеносных сосудов, которые будут обеспечивать замыкается — растущая опухоль привлекает новые ее питание, например фактор роста опухолей (TGFb) макрофаги, которые перепрограммируются и фактор роста сосудов (VGF). и стимулируют ее рост вместо уничтожения.
http: //biomolecula. ru/content/1499 Ключевую роль в этом перепрограммировании играют Хуже того: под NF-k. B. С помщью которых, опухоль белки семейства действием веществ, выделяемых опухолевыми агрессивных М 1 -макрофагов в невольных превращает клетками, активные М 1 -макрофаги «перепрограммируются» в М 2 -тип, перестают пособников своего собственного развития: М 2 -тип синтезировать антиопухолевые цитокины, такие как макрофагов, воспринимая опухоль как поврежденный интерлейкин-12 (IL 12) или программу восстановления, участок ткани, включают фактор некроза опухолей (TNF) и начинают выделять факторы роста среду однако секретируемые ими в окружающую только молекулы, ускоряющие рост опухоли и прорастание добавляют ресурсы для роста опухоли. На этом цикл кровеносных сосудов, которые будут обеспечивать замыкается — растущая опухоль привлекает новые ее питание, например фактор роста опухолей (TGFb) макрофаги, которые перепрограммируются и фактор роста сосудов (VGF). и стимулируют ее рост вместо уничтожения.
 Нейтрофилы (полиморфноядерные нейтрофильные гранулоциты), клетки Cмена противоопухолевого действия нейтрофилов на проопухолевое врожденного звена иммунной системы, обеспечивают наиболее быстрые может быть следствием влияния биологически активных веществ, защитные реакции организма в ответ на проникновение в организм чужеродных продуцируемых опухолевыми клетками антигенов и появление собственных дефектных клеток организма. Опухолевые клетки секретируют широкий спектр цитокинов: идентифицировано около 80 первыми (уже на 10 -е сут после инокуляции различных цитокинов, которые обладают Показано, что нейтрофилы ангиогенными и иммуносупрессорными свойствами опухолевых клеток) мигрируют к опухоли на ранних стадиях ее формирования, Широкий спектр продуцируемых опухолью цитокинов и факторов роста усиленно инфильтрируют очаги опухолевого роста и становятся активными создает и поддерживает определенное микроокружение развивающейся компонентами стромы По отношению к опухоли нейтрофилы способны опухоли проявлять как противо-, так и проопухолевую активность Среди протеолитических ферментов, секретируемых инфильтрирующими опухоль нейтрофилами, особое значение имеют матриксные металлопротеиназы (ММП)-9 и -13, которые активно преобразуют межклеточный матрикс
Нейтрофилы (полиморфноядерные нейтрофильные гранулоциты), клетки Cмена противоопухолевого действия нейтрофилов на проопухолевое врожденного звена иммунной системы, обеспечивают наиболее быстрые может быть следствием влияния биологически активных веществ, защитные реакции организма в ответ на проникновение в организм чужеродных продуцируемых опухолевыми клетками антигенов и появление собственных дефектных клеток организма. Опухолевые клетки секретируют широкий спектр цитокинов: идентифицировано около 80 первыми (уже на 10 -е сут после инокуляции различных цитокинов, которые обладают Показано, что нейтрофилы ангиогенными и иммуносупрессорными свойствами опухолевых клеток) мигрируют к опухоли на ранних стадиях ее формирования, Широкий спектр продуцируемых опухолью цитокинов и факторов роста усиленно инфильтрируют очаги опухолевого роста и становятся активными создает и поддерживает определенное микроокружение развивающейся компонентами стромы По отношению к опухоли нейтрофилы способны опухоли проявлять как противо-, так и проопухолевую активность Среди протеолитических ферментов, секретируемых инфильтрирующими опухоль нейтрофилами, особое значение имеют матриксные металлопротеиназы (ММП)-9 и -13, которые активно преобразуют межклеточный матрикс
 Ускользание опухоли от иммунного ответа 1. Опухольассоциированные антигены (ОАА) обладают слабой иммуногенностью в отличие от антигенов бактерий или вирусов, обнаруживающих более выраженные различия, то есть более сильные антигенные свойства, которые используются при создании эффективных (антибактериальных, противовирусных) вакцин. 2. в формирующейся опухоли действует механизм отбора клеток, способных наиболее эффективно противодействовать системе иммунного надзора, что поддерживает выживание злокачественно трансформированных клеток и таким образом содействует формированию их клона. 3. растущая опухоль угнетающе влияет на иммунитет и оказывает общее токсическое действие на организм больного • индукция опухолевым антигеном образования антител, «защищающих» злокачественные клетки от действия цитотоксических Т-лимфоцитов; • выделение опухолевыми клетками растворимых форм мембранных антигенов или синтез секреторных вариантов антигенов, «перехватывающих» эффекторы иммунной системы;
Ускользание опухоли от иммунного ответа 1. Опухольассоциированные антигены (ОАА) обладают слабой иммуногенностью в отличие от антигенов бактерий или вирусов, обнаруживающих более выраженные различия, то есть более сильные антигенные свойства, которые используются при создании эффективных (антибактериальных, противовирусных) вакцин. 2. в формирующейся опухоли действует механизм отбора клеток, способных наиболее эффективно противодействовать системе иммунного надзора, что поддерживает выживание злокачественно трансформированных клеток и таким образом содействует формированию их клона. 3. растущая опухоль угнетающе влияет на иммунитет и оказывает общее токсическое действие на организм больного • индукция опухолевым антигеном образования антител, «защищающих» злокачественные клетки от действия цитотоксических Т-лимфоцитов; • выделение опухолевыми клетками растворимых форм мембранных антигенов или синтез секреторных вариантов антигенов, «перехватывающих» эффекторы иммунной системы;
 Ускользание опухоли от иммунного ответа 4. утрата опухолевыми клетками некоторых типов молекул главного комплекса гистосовместимости (HLA) 1 -го класса, необходимых для распознавания антигенных пептидов опухолевых клеток цитотоксическими Т-лимфоцитами 5. отсутствие экспрессии на опухолевых клетках кофакторных молекул CD 80 (В 7 -1) и CD 86 (В 7 -2), которые разпознаются корецептором CD 28. Без сигнала, поступающего с корецептора, вместо активации развивается анергия Т-лимфоцитов; Перечисленные факторы обусловливают недостаточность противоопухолевого иммунитета, а именно: ускользание злокачественных клеток от иммунного надзора и повышение их устойчивости к действию механизмов иммунитета по мере увеличения массы опухоли.
Ускользание опухоли от иммунного ответа 4. утрата опухолевыми клетками некоторых типов молекул главного комплекса гистосовместимости (HLA) 1 -го класса, необходимых для распознавания антигенных пептидов опухолевых клеток цитотоксическими Т-лимфоцитами 5. отсутствие экспрессии на опухолевых клетках кофакторных молекул CD 80 (В 7 -1) и CD 86 (В 7 -2), которые разпознаются корецептором CD 28. Без сигнала, поступающего с корецептора, вместо активации развивается анергия Т-лимфоцитов; Перечисленные факторы обусловливают недостаточность противоопухолевого иммунитета, а именно: ускользание злокачественных клеток от иммунного надзора и повышение их устойчивости к действию механизмов иммунитета по мере увеличения массы опухоли.
 ВИДЫ ПРОТИВООПУХОЛЕВЫХ ВАКЦИН • Из цельных опухолевых клеток • Аутологичные • Аллогенные • Геномодифицированные вакцины • Ганглиозидные вакцины. • • Вакцины на основе синтетических пептидов • ДНК-вакцины • Вакцины на основе рекомбинантных вирусов • Вакцины на основе дендритных клеток • Аутологичные белки теплового шока
ВИДЫ ПРОТИВООПУХОЛЕВЫХ ВАКЦИН • Из цельных опухолевых клеток • Аутологичные • Аллогенные • Геномодифицированные вакцины • Ганглиозидные вакцины. • • Вакцины на основе синтетических пептидов • ДНК-вакцины • Вакцины на основе рекомбинантных вирусов • Вакцины на основе дендритных клеток • Аутологичные белки теплового шока
 Аутологичные вакцины Основное преимущество аутологичных вакцин заключается в том, что они менее, такие клеткам проходят уже соответствующими Тем не идентичны вакцины опухоли с II и III фазу структурами, активирующими клеточный иммунныймеланоме, с клинических испытаний, в частности при ответ. Поэтому исчезают проблемы несовпаденияэффектом определенным положительным антигенного профиля вакцины и опухоли и аллергических реакций на чужеродные неопухолеспецифичные антигены, вакцины что снижает риск связанных с Аутологичные клеточные разрабатываются этим осложнений, так же как хирургического извлечения компанией AVAX Inc. После и снижает риск контаминации патогенными вирусами и внутриклеточными паразитами. Кроме злокачественной опухоли пациента опухолевые клетки того, такие клетки достаточно долго могут химическим в находиться обрабатывают динитрофенилом (ДНФ), организме, что известным развития иммунного ответа веществом, важно для как гаптен, связывающимся с поверхностью клетки и усиливающим иммунный ответ. Недостатки Обработанные ДНФ клетки смешивают с адъювантом, К позволяющим увеличить их иммуногенную опухолевых сожалению, антигенный профиль клеток, эффективность, и полученных из разных мест (основная опухоль, метастазы, вводят обратно пациенту. лимфоузлы) может существенно различаться. К тому же не всегда есть возможность получить достаточное количество опухолевого материала от больного, а в случае наличия такой возможности сложностью является получение однородной стандартизованной популяции опухолевых клеток, пригодных для получения вакцины. Такие вакцины являются фактически индивидуальными, и стоимость их существенно возрастает. .
Аутологичные вакцины Основное преимущество аутологичных вакцин заключается в том, что они менее, такие клеткам проходят уже соответствующими Тем не идентичны вакцины опухоли с II и III фазу структурами, активирующими клеточный иммунныймеланоме, с клинических испытаний, в частности при ответ. Поэтому исчезают проблемы несовпаденияэффектом определенным положительным антигенного профиля вакцины и опухоли и аллергических реакций на чужеродные неопухолеспецифичные антигены, вакцины что снижает риск связанных с Аутологичные клеточные разрабатываются этим осложнений, так же как хирургического извлечения компанией AVAX Inc. После и снижает риск контаминации патогенными вирусами и внутриклеточными паразитами. Кроме злокачественной опухоли пациента опухолевые клетки того, такие клетки достаточно долго могут химическим в находиться обрабатывают динитрофенилом (ДНФ), организме, что известным развития иммунного ответа веществом, важно для как гаптен, связывающимся с поверхностью клетки и усиливающим иммунный ответ. Недостатки Обработанные ДНФ клетки смешивают с адъювантом, К позволяющим увеличить их иммуногенную опухолевых сожалению, антигенный профиль клеток, эффективность, и полученных из разных мест (основная опухоль, метастазы, вводят обратно пациенту. лимфоузлы) может существенно различаться. К тому же не всегда есть возможность получить достаточное количество опухолевого материала от больного, а в случае наличия такой возможности сложностью является получение однородной стандартизованной популяции опухолевых клеток, пригодных для получения вакцины. Такие вакцины являются фактически индивидуальными, и стоимость их существенно возрастает. .
 Аллогенные вакцины Смесь клеточных линий от нескольких сходных опухолей может содержать достаточно широкий спектр опухолевых антигенов. Такой вариант вакцин позволяет существенно повысить вероятность совпадения антигенов вакцины и больного. Преимущество этих вакцин состоит в том, что они не требуют взятия опухолевых клеток у пациента и возможно получение достаточного их количества для нескольких иммунизаций Onyvax Ltd Cell Vaccines решает эту проблему одновременным введением множества опухолевых антигенов. Эти вакцины производят Определенным препятствием при использовании аллогенных из нескольких иммортализованных клеточных линий, которые клеток является различие HLA-антигенов (МНС 1 типа) пациента и представляют различные может вызывать не только реакции по типу клеток вакцины, что стадии дифференцировки опухолей. За счет этого увеличивается эффективность вакцины и снижается вероятность отторжения трансплантата, но и существенно влиять на развития побочных эффектов по сравнению с недифференцированной эффективность вакцинотерапии. Так, например, Melacine (Сorixa по стадиям терапией - вакцина, состоящая из лизата аллогенных corp. , Canada) Примером аллогенной вакцины является поливалентная меланомных клеточных линий, оказывает противоопухолевый клеточная вакцина (PCMV). эффект лишь у 5– 10% больных меланомой. Цельноклеточные вакцины прошли клинические испытания. Melacine® (Corixa Corporation) состоит из лизированных клеток двух клеточных линий меланомы человека и запатентованного адъюванта. Она одобрена к применению при метастатической меланоме в Канаде
Аллогенные вакцины Смесь клеточных линий от нескольких сходных опухолей может содержать достаточно широкий спектр опухолевых антигенов. Такой вариант вакцин позволяет существенно повысить вероятность совпадения антигенов вакцины и больного. Преимущество этих вакцин состоит в том, что они не требуют взятия опухолевых клеток у пациента и возможно получение достаточного их количества для нескольких иммунизаций Onyvax Ltd Cell Vaccines решает эту проблему одновременным введением множества опухолевых антигенов. Эти вакцины производят Определенным препятствием при использовании аллогенных из нескольких иммортализованных клеточных линий, которые клеток является различие HLA-антигенов (МНС 1 типа) пациента и представляют различные может вызывать не только реакции по типу клеток вакцины, что стадии дифференцировки опухолей. За счет этого увеличивается эффективность вакцины и снижается вероятность отторжения трансплантата, но и существенно влиять на развития побочных эффектов по сравнению с недифференцированной эффективность вакцинотерапии. Так, например, Melacine (Сorixa по стадиям терапией - вакцина, состоящая из лизата аллогенных corp. , Canada) Примером аллогенной вакцины является поливалентная меланомных клеточных линий, оказывает противоопухолевый клеточная вакцина (PCMV). эффект лишь у 5– 10% больных меланомой. Цельноклеточные вакцины прошли клинические испытания. Melacine® (Corixa Corporation) состоит из лизированных клеток двух клеточных линий меланомы человека и запатентованного адъюванта. Она одобрена к применению при метастатической меланоме в Канаде
 Геномодифицированные вакцины Одним из вариантов биоиммунотерапии злокачественных Cell Genesys разрабатывает GVAX вакцины, состоящие из облучённых новообразований является вакцинотерапия с помощью опухолевых клеток аутологичного происхождения или полученные из облученных опухолевых клеток, трансфецированных различными опухолевых клеточных линий (аллогенные). Эти опухолевые клетки генами. генетически модифицировали, чтобы получить синтез ими 1) повышению эффективности презентации антигена для иммуностимулирующего гранулоцитарно-макрофагального Основным недостатком метода применения взаимодействия с Т-клетками; колониестимулирующего фактора (Г-КСФ), способного стимулировать 2) геномодифицированных аутологичных является трудоемкость, усилению костимуляции (мембранно-связывающие лиганды иммунный ответ в отношении как обнаружения, так и уничтожения и длительность процесса В 7) высокотехнологичность опухолевых клеток, возможно, оставшихся после аутологичные хирургического вакцины. Поэтому 3) приготовления обеспечению местного синтеза цитокинов (IL-2 и др. ) вмешательства и/или химио-радиотерапии. генами цитокинов IFN 4) геномодифицированые вакцины в ряде случаев стали заменять Трансфекция опухолевых клеток восстанавливает на основе аллогенных опухолевых или экспрессию главного комплекса вакцинами Охарактеризован клеток (обычно фибробласты). хемотаксис и гистосовместимостиген tag-7, усиливающий класса)оказалось первого класса (МНС I неопухолевых Это на этих способствующий созреванию аллогенные клеток. Предполагается, клетках, что не дает опухоли «уклоняться» от возможным, так как дендритных опухолевые клетки, иммунологического надзора хозяина что специфическое действие вакцины на основе опухолевых клеток, геномодифицированные ex vivo, привлекают и активируют АПК 5) Стимуляция противоопухолевого иммунитета наблюдается генетически модифицированных геном tag-7, основано на том, что in vivo при терапии меланомными клетками, опухолевые клетки аутологичными начинают секретировать белок tag 7, который трансфецированными геном интерлейкина-12, системы. Клетки, является хемоатрактантом для клеток иммунной гранулоцитарномакрофагальногок колониестимулирующеговакцины, процессируют фактора, интерлейкина привлеченные месту введения -2 или интерлейкина-4 опухолевые антигены, а их активация зрелых антигенпрезентирующих дендритных клеток контролируется белком tag 7.
Геномодифицированные вакцины Одним из вариантов биоиммунотерапии злокачественных Cell Genesys разрабатывает GVAX вакцины, состоящие из облучённых новообразований является вакцинотерапия с помощью опухолевых клеток аутологичного происхождения или полученные из облученных опухолевых клеток, трансфецированных различными опухолевых клеточных линий (аллогенные). Эти опухолевые клетки генами. генетически модифицировали, чтобы получить синтез ими 1) повышению эффективности презентации антигена для иммуностимулирующего гранулоцитарно-макрофагального Основным недостатком метода применения взаимодействия с Т-клетками; колониестимулирующего фактора (Г-КСФ), способного стимулировать 2) геномодифицированных аутологичных является трудоемкость, усилению костимуляции (мембранно-связывающие лиганды иммунный ответ в отношении как обнаружения, так и уничтожения и длительность процесса В 7) высокотехнологичность опухолевых клеток, возможно, оставшихся после аутологичные хирургического вакцины. Поэтому 3) приготовления обеспечению местного синтеза цитокинов (IL-2 и др. ) вмешательства и/или химио-радиотерапии. генами цитокинов IFN 4) геномодифицированые вакцины в ряде случаев стали заменять Трансфекция опухолевых клеток восстанавливает на основе аллогенных опухолевых или экспрессию главного комплекса вакцинами Охарактеризован клеток (обычно фибробласты). хемотаксис и гистосовместимостиген tag-7, усиливающий класса)оказалось первого класса (МНС I неопухолевых Это на этих способствующий созреванию аллогенные клеток. Предполагается, клетках, что не дает опухоли «уклоняться» от возможным, так как дендритных опухолевые клетки, иммунологического надзора хозяина что специфическое действие вакцины на основе опухолевых клеток, геномодифицированные ex vivo, привлекают и активируют АПК 5) Стимуляция противоопухолевого иммунитета наблюдается генетически модифицированных геном tag-7, основано на том, что in vivo при терапии меланомными клетками, опухолевые клетки аутологичными начинают секретировать белок tag 7, который трансфецированными геном интерлейкина-12, системы. Клетки, является хемоатрактантом для клеток иммунной гранулоцитарномакрофагальногок колониестимулирующеговакцины, процессируют фактора, интерлейкина привлеченные месту введения -2 или интерлейкина-4 опухолевые антигены, а их активация зрелых антигенпрезентирующих дендритных клеток контролируется белком tag 7.
 Опухолевые антигены Антигенные вакцины не содержат в своем составе целых 1. Прежде всего, это нормальные белки, кодируемые геномом клетки – клеток, а только антигены опухолевых клеток. Одна опухоль может опухолеассоциированные антигены. К антигенов. Некоторые быть представлена широким спектром ним можно отнести тканеспецифичные белки, всех опухолей определенного типа, а антигены представлены у присутствующие как на нормальных клетках, так и на опухолевых клетках, имеющих происхождение из этой некоторые антигены уникальны и могут быть обнаружены только у ткани (дифференцировочные антигены). Примером таких антигенов данного пациента. являются меланомные антигены (тирозиназа, gp 100, MART-1/Melan-A, Белки, экспрессируемые опухолевой клеткой и являющиеся TRP), которые являются белками, вовлеченными в синтез меланина. потенциальными антигенами, способными индуцировать адаптивный иммунный ответ, можно разделить на несколько групп 2. Широко распространен ряд антигенов, экспрессированых в нормальных тканях в минимальных уровнях, недостаточных для индукции специфического иммунного ответа и гиперэкспрессированных на опухолевых клетках, что позволяет использовать их в качестве мишеней для специфической иммунотерапии рака. Это – простатспецифические антигены (PSA/PSMA), уровень которых повышается при аденокарциноме простаты; муцин (MUC 1) – повышение уровня которого ассоциируется с раком молочной железы, толстой кишки, поджелудочной железы; HER-2/neu – обнаруживается при раке легких, яичников, молочной железы, простаты и толстой кишки
Опухолевые антигены Антигенные вакцины не содержат в своем составе целых 1. Прежде всего, это нормальные белки, кодируемые геномом клетки – клеток, а только антигены опухолевых клеток. Одна опухоль может опухолеассоциированные антигены. К антигенов. Некоторые быть представлена широким спектром ним можно отнести тканеспецифичные белки, всех опухолей определенного типа, а антигены представлены у присутствующие как на нормальных клетках, так и на опухолевых клетках, имеющих происхождение из этой некоторые антигены уникальны и могут быть обнаружены только у ткани (дифференцировочные антигены). Примером таких антигенов данного пациента. являются меланомные антигены (тирозиназа, gp 100, MART-1/Melan-A, Белки, экспрессируемые опухолевой клеткой и являющиеся TRP), которые являются белками, вовлеченными в синтез меланина. потенциальными антигенами, способными индуцировать адаптивный иммунный ответ, можно разделить на несколько групп 2. Широко распространен ряд антигенов, экспрессированых в нормальных тканях в минимальных уровнях, недостаточных для индукции специфического иммунного ответа и гиперэкспрессированных на опухолевых клетках, что позволяет использовать их в качестве мишеней для специфической иммунотерапии рака. Это – простатспецифические антигены (PSA/PSMA), уровень которых повышается при аденокарциноме простаты; муцин (MUC 1) – повышение уровня которого ассоциируется с раком молочной железы, толстой кишки, поджелудочной железы; HER-2/neu – обнаруживается при раке легких, яичников, молочной железы, простаты и толстой кишки
 Опухолевые антигены 4. Неоантигены, не экспрессирующиеся на клетках тканей, из 3. которых образуется опухоль, могут экспрессироваться на ранних Раковоэмбриональные антигены, присутствующие на других нормальных тканях. Появление таких антигенов является стадиях развития эмбриона и исчезающие позднее, могут вновь следствием реактивации генов, "молчащих" в нормальных клетках, появляться при некоторых опухолях. Так, раковоэмбриональный при их опухолевой трансформации. пищеварительном тракте, антиген (CEA), обнаруживаемый в Так, раково-тестикулярные К настоящему времени более 100 таких антигенных белков антигены (MAGE, BAGE, GAGE, LAGE, SAGE, NY-ESO и т. д. ) не поджелудочной железе и печени на 2– 6 -й неделе внутриутробного являются кандидатами для создания на их основе экспрессируются на при раке толстой кишки, легких, молочной развития, присутствует меланоцитах, но присутствуют на клетках противоопухолевых вакцин, и их количество непрерывно меланомы и нормальных клетках яичек и плаценты. Аналогично железы. растет. На сегодняшний день используются разные методы ганглиозидные антигены появляются на меланоцитах только после Альфа-фетопротеин, продуцируемый эмбриональными идентификации опухолевых антигенов, но наиболее успешным их неопластической трансформации всегда присутствует в печеночными клетками и желточным и мешком, присутствуют на является технология получения к. ДНК из опухолевых клеток, ее клетках спинного и головного мозга сыворотке крови взрослых в малых количествах и повышается при клонирование с последующим получением белков, первичном раке печени. выделить вирусные антигены - белки, 5. Отдельно этими генами, которые затем тестируются в кодируемых следует 6. Есть мутантные антигены, экспрессируемые клетками, в Уровень теломеразы, присутствующей в стволовых клетках и экспрессируемые на поверхности инфицированных клеток и качестве антигена для индукции адаптивного иммунного ответа которых произошло повреждения ДНК. Но такие исчезающей при их со злокачественной трансформацией клетки ассоциирующиеся дифференцировке, повышается в опухолевых на исходные опухолевые клетки. модифицированные молекулы (бета-катенин, CDK 4, P 53 и др. ) клетках, и, этиологии. К ним прежде всего относятся антигеном, при вирусной хотя этот фермент не является сильным белки (Е 6, Е 7) экспрессируются далеко не во всех опухолях определенных условиях также возможно индуцировать против него вируса папилломы человека, ассоциированного с раком шейки специфический иммунный ответ матки, вирусы Эпштейна–Барра, а также вирусы герпеса, гепатита В 7. Есть узко-специфичные, например антигены, связанные с и др. клональной перестройкой генов иммуноглобулинов и ассоциированные с индивидуальным иммунным портретом миелом и В-клеточных лимфом
Опухолевые антигены 4. Неоантигены, не экспрессирующиеся на клетках тканей, из 3. которых образуется опухоль, могут экспрессироваться на ранних Раковоэмбриональные антигены, присутствующие на других нормальных тканях. Появление таких антигенов является стадиях развития эмбриона и исчезающие позднее, могут вновь следствием реактивации генов, "молчащих" в нормальных клетках, появляться при некоторых опухолях. Так, раковоэмбриональный при их опухолевой трансформации. пищеварительном тракте, антиген (CEA), обнаруживаемый в Так, раково-тестикулярные К настоящему времени более 100 таких антигенных белков антигены (MAGE, BAGE, GAGE, LAGE, SAGE, NY-ESO и т. д. ) не поджелудочной железе и печени на 2– 6 -й неделе внутриутробного являются кандидатами для создания на их основе экспрессируются на при раке толстой кишки, легких, молочной развития, присутствует меланоцитах, но присутствуют на клетках противоопухолевых вакцин, и их количество непрерывно меланомы и нормальных клетках яичек и плаценты. Аналогично железы. растет. На сегодняшний день используются разные методы ганглиозидные антигены появляются на меланоцитах только после Альфа-фетопротеин, продуцируемый эмбриональными идентификации опухолевых антигенов, но наиболее успешным их неопластической трансформации всегда присутствует в печеночными клетками и желточным и мешком, присутствуют на является технология получения к. ДНК из опухолевых клеток, ее клетках спинного и головного мозга сыворотке крови взрослых в малых количествах и повышается при клонирование с последующим получением белков, первичном раке печени. выделить вирусные антигены - белки, 5. Отдельно этими генами, которые затем тестируются в кодируемых следует 6. Есть мутантные антигены, экспрессируемые клетками, в Уровень теломеразы, присутствующей в стволовых клетках и экспрессируемые на поверхности инфицированных клеток и качестве антигена для индукции адаптивного иммунного ответа которых произошло повреждения ДНК. Но такие исчезающей при их со злокачественной трансформацией клетки ассоциирующиеся дифференцировке, повышается в опухолевых на исходные опухолевые клетки. модифицированные молекулы (бета-катенин, CDK 4, P 53 и др. ) клетках, и, этиологии. К ним прежде всего относятся антигеном, при вирусной хотя этот фермент не является сильным белки (Е 6, Е 7) экспрессируются далеко не во всех опухолях определенных условиях также возможно индуцировать против него вируса папилломы человека, ассоциированного с раком шейки специфический иммунный ответ матки, вирусы Эпштейна–Барра, а также вирусы герпеса, гепатита В 7. Есть узко-специфичные, например антигены, связанные с и др. клональной перестройкой генов иммуноглобулинов и ассоциированные с индивидуальным иммунным портретом миелом и В-клеточных лимфом
 Антигенные вакцины 1. Для изготовления вакцин РМЖ применяется опухолевый антиген - онкопротеин HER 2, который способствует росту опухолей. После извлечения пептида из состава антигена, его смешивают с иммуноадъювантом гранулоцитмакрофаг колониестимулирующий фактор (GMCSF), Введение пептидной комбинации GM-CSF способствует активизации дендритных клеток в области инъекции, которые обрабатывают пептид таким образом, что он начинает лучше сочетаться с иммунной системой. Вакцина Е 75 (Neu. Vax) является наиболее исследуемой из всех пептидных вакцин производных от HER 2 – уже прошла 1 и 2 фазу клинических испытаний. И рекомендована для третьей фазы КИ. В котором примут участие 700 пациенток, Вакцина будет вводиться 1 раз в месяц в течение 6 месяцев, после чего она будет вводиться уже как регулярная прививка каждые 6 месяцев в течение 3 лет.
Антигенные вакцины 1. Для изготовления вакцин РМЖ применяется опухолевый антиген - онкопротеин HER 2, который способствует росту опухолей. После извлечения пептида из состава антигена, его смешивают с иммуноадъювантом гранулоцитмакрофаг колониестимулирующий фактор (GMCSF), Введение пептидной комбинации GM-CSF способствует активизации дендритных клеток в области инъекции, которые обрабатывают пептид таким образом, что он начинает лучше сочетаться с иммунной системой. Вакцина Е 75 (Neu. Vax) является наиболее исследуемой из всех пептидных вакцин производных от HER 2 – уже прошла 1 и 2 фазу клинических испытаний. И рекомендована для третьей фазы КИ. В котором примут участие 700 пациенток, Вакцина будет вводиться 1 раз в месяц в течение 6 месяцев, после чего она будет вводиться уже как регулярная прививка каждые 6 месяцев в течение 3 лет.
 Антигенные вакцины 2. Были проведены клинические исследования, в которых предпринимались попытки вакцинировать больных меланомой с помощью немутированных антигенов (MAGE, BAGE, RAGE), в том числе в комбинации с адьювантами. Одним из первых было проведено Потенциальные преимущества. Одним из преимуществ пептидных исследование синтетического иммуногенного пептида MAGE-3. Лечебный вакцин является их стоимость – они менее дорогостоящие, нежели эффект был зарегистрирован у 6 из 19 больных. дендритно-клеточные вакцины, изготавливаемые по индивидуальным 3. Ряд исследований был проведён по изучению пептидов, полученных из заказам. меланомного антигена gp 100. Первоначально лечение проводилось с Недостатки. Главным препятствием для их массового группа больных помощью нативного пептида, но в последующем другая использования является индивидуальный для каждой опухоли набор поверхностных получала лечение пептидом, в котором изменена одна аминокислота. Этот маркеров, что определяет необходимость в каждом случае тестировать пептид имеет более высокую аффинность к MHC, что позволяет опухоль на наличие тех или иных мишеней и определять предполагать большую индукцию Т-лимфоцитов. соответствующий антиген для включения его в состав вакцины. 4. На Кубе одобрена к применению первая в мировой истории лечебная вакцина против рака легких. Cima. Vax-EGF. Препарат является аналогом эпидермального фактора роста (EGF), необходимого для роста и распространения раковых клеток. При его применении иммунная система атакует клетки, вырабатывающие EGF, в результате чего рост опухоли значительно замедляется.
Антигенные вакцины 2. Были проведены клинические исследования, в которых предпринимались попытки вакцинировать больных меланомой с помощью немутированных антигенов (MAGE, BAGE, RAGE), в том числе в комбинации с адьювантами. Одним из первых было проведено Потенциальные преимущества. Одним из преимуществ пептидных исследование синтетического иммуногенного пептида MAGE-3. Лечебный вакцин является их стоимость – они менее дорогостоящие, нежели эффект был зарегистрирован у 6 из 19 больных. дендритно-клеточные вакцины, изготавливаемые по индивидуальным 3. Ряд исследований был проведён по изучению пептидов, полученных из заказам. меланомного антигена gp 100. Первоначально лечение проводилось с Недостатки. Главным препятствием для их массового группа больных помощью нативного пептида, но в последующем другая использования является индивидуальный для каждой опухоли набор поверхностных получала лечение пептидом, в котором изменена одна аминокислота. Этот маркеров, что определяет необходимость в каждом случае тестировать пептид имеет более высокую аффинность к MHC, что позволяет опухоль на наличие тех или иных мишеней и определять предполагать большую индукцию Т-лимфоцитов. соответствующий антиген для включения его в состав вакцины. 4. На Кубе одобрена к применению первая в мировой истории лечебная вакцина против рака легких. Cima. Vax-EGF. Препарат является аналогом эпидермального фактора роста (EGF), необходимого для роста и распространения раковых клеток. При его применении иммунная система атакует клетки, вырабатывающие EGF, в результате чего рост опухоли значительно замедляется.
 Вакцины на основе ганглиозидов Ганглиозиды – это гликолипидные антигены, экспрессируемые на поверхности опухолевых клеток и вызывающие образование антител. Вакцину на основе GM 2 проверяли в клинических Показано, что на поверхности меланомных клеток исследованиях. Первые 16 месяцев наблюдения не показали наиболее интенсивно экспрессируются ганглиозиды, содержащие увеличения выживаемости больных. Одной из причин нейтральные сахара и сиаловые кислоты: GM 3, GD 3 (основной отсутствия значимого лечебного эффекта, вероятно, меланомный ганглиозид), GD 2, GM 2 О-ацетилмеланомы могут является то, менее 20% клеточных линий GD 3. GM 2 является наиболее иммуногенным меланомным быть лизированы антителами к GM 2. Поэтому для получения ганглиозидом, значимого эффекта необходимо индуцирование по этой причине является обьектом клинически и большинства клинических исследований. Уже первые работы образование антител и против других ганглиозидов. Поэтому показали тесную связь между использования поливалентных очевидна целесообразность наличием в сыворотке больных антител и увеличением безрецидивной и общей выживаемости. вакцин на основе нескольких ганглиозидов Образование GM 2 Ig. M было обнаружено у 85% больных. В последующем была разработана новая форма вакцины на основе GM 2, связанной с адьювантом (GMK). Эта форма вакцины сопровождалась образованием антител у 100% больных
Вакцины на основе ганглиозидов Ганглиозиды – это гликолипидные антигены, экспрессируемые на поверхности опухолевых клеток и вызывающие образование антител. Вакцину на основе GM 2 проверяли в клинических Показано, что на поверхности меланомных клеток исследованиях. Первые 16 месяцев наблюдения не показали наиболее интенсивно экспрессируются ганглиозиды, содержащие увеличения выживаемости больных. Одной из причин нейтральные сахара и сиаловые кислоты: GM 3, GD 3 (основной отсутствия значимого лечебного эффекта, вероятно, меланомный ганглиозид), GD 2, GM 2 О-ацетилмеланомы могут является то, менее 20% клеточных линий GD 3. GM 2 является наиболее иммуногенным меланомным быть лизированы антителами к GM 2. Поэтому для получения ганглиозидом, значимого эффекта необходимо индуцирование по этой причине является обьектом клинически и большинства клинических исследований. Уже первые работы образование антител и против других ганглиозидов. Поэтому показали тесную связь между использования поливалентных очевидна целесообразность наличием в сыворотке больных антител и увеличением безрецидивной и общей выживаемости. вакцин на основе нескольких ганглиозидов Образование GM 2 Ig. M было обнаружено у 85% больных. В последующем была разработана новая форма вакцины на основе GM 2, связанной с адьювантом (GMK). Эта форма вакцины сопровождалась образованием антител у 100% больных
 Лекция 4
Лекция 4
 Рекомбинантные вирусы Проводятся клинические испытания векторных вакцин. Предполагается, что эффективный иммунный ответ можно получить, используя вектор экспрессии, кодирующий вирусные иммуногены так, что синтезируемые белки образуют вирусную частицу путём самосборки. Очевидно, что такие вирусы не будут содержать инфекционной нуклеиновой кислоты. Проводится ряд исследований с рекомбинантными вирусами, экспрессирующими опухолевые антигены CEA или PSA, в том числе с использованием иммуностимуляторных цитокинов. Использовались аденовирусы, вирусы оспы. Но высокое содержание антивирусных антител может ограничить использование этих векторов, особенно при неоднократном введении. Также проблемой может стать иммунодоминирование. Более сильный ответ может образоваться против вирусных антигенов, а не против менее иммуногенных опухолевых. Эффективность этих вакцин может быть увеличена добавлением генов, кодирующих иммуностимуляторные молекулы или цитокины. Такие векторы уже проходят клинические испытания.
Рекомбинантные вирусы Проводятся клинические испытания векторных вакцин. Предполагается, что эффективный иммунный ответ можно получить, используя вектор экспрессии, кодирующий вирусные иммуногены так, что синтезируемые белки образуют вирусную частицу путём самосборки. Очевидно, что такие вирусы не будут содержать инфекционной нуклеиновой кислоты. Проводится ряд исследований с рекомбинантными вирусами, экспрессирующими опухолевые антигены CEA или PSA, в том числе с использованием иммуностимуляторных цитокинов. Использовались аденовирусы, вирусы оспы. Но высокое содержание антивирусных антител может ограничить использование этих векторов, особенно при неоднократном введении. Также проблемой может стать иммунодоминирование. Более сильный ответ может образоваться против вирусных антигенов, а не против менее иммуногенных опухолевых. Эффективность этих вакцин может быть увеличена добавлением генов, кодирующих иммуностимуляторные молекулы или цитокины. Такие векторы уже проходят клинические испытания.
 Онколитические вирусы В настоящее время проводится исследование онколитических свойств различных семейств вирусов, таких как аденовирусы, реовирусы, вирусы Альтернативный метод включает вакцинных штаммов, болезни Ньюкастла и других. использование вирусов, обладающих повышенной тропностью к опухолевым Противоопухолевое вирусы (то клеткам. Онколитические действие онколитических вирусов реализуется за счет нескольких потенциальных механизмов: есть вирусы, способные распознавать и • прямого литического воздействия, возникающего в результате разрушать опухолевые клетки; лизис от репликации вирусов в малигнизированных клетках, греч. lysis «разложение, растворение, • индукции быть выделены из распад» ) могут синтеза белков, которые являются цитотоксическими к опухолевым клеткам природных источников, и их аффинность • разрушения опухолевых посредством индукции (умение распознавать конкретную клеток противоопухолевого иммунитета мишень) может быть повышена с • Вирусы, также, могут изменять антигенные характеристики опухолевых помощью методов генной инженерии. клеток, встраивая свои антигены в их мембраны, что делает клетку более доступной для действия эффекторов иммунной системы • способности вирусов, в частности, на примере онколитического аденовируса, индуцировать апоптоз в опухолевых клетках • Онколитические вирусы обладают способностью увеличивать чувствительность опухолевых клеток к химио- и лучевой терапии
Онколитические вирусы В настоящее время проводится исследование онколитических свойств различных семейств вирусов, таких как аденовирусы, реовирусы, вирусы Альтернативный метод включает вакцинных штаммов, болезни Ньюкастла и других. использование вирусов, обладающих повышенной тропностью к опухолевым Противоопухолевое вирусы (то клеткам. Онколитические действие онколитических вирусов реализуется за счет нескольких потенциальных механизмов: есть вирусы, способные распознавать и • прямого литического воздействия, возникающего в результате разрушать опухолевые клетки; лизис от репликации вирусов в малигнизированных клетках, греч. lysis «разложение, растворение, • индукции быть выделены из распад» ) могут синтеза белков, которые являются цитотоксическими к опухолевым клеткам природных источников, и их аффинность • разрушения опухолевых посредством индукции (умение распознавать конкретную клеток противоопухолевого иммунитета мишень) может быть повышена с • Вирусы, также, могут изменять антигенные характеристики опухолевых помощью методов генной инженерии. клеток, встраивая свои антигены в их мембраны, что делает клетку более доступной для действия эффекторов иммунной системы • способности вирусов, в частности, на примере онколитического аденовируса, индуцировать апоптоз в опухолевых клетках • Онколитические вирусы обладают способностью увеличивать чувствительность опухолевых клеток к химио- и лучевой терапии
 Онколитические вирусы Вирусы, применяемые для получения вирусных онколизатов, можно разделить Универсальность действия вирусных вакцин заключается в том, что на две группы. Первая группа включает вирусы, которые инфицируют и оказывая прямое цитопатическое действие на опухолевые клетки в лизируют опухолевые клетки - вирусы гриппа и осповакцины. процессе вирусной репликации, они также способны индуцировать Вторая - включает вирусы, которые размножаются в опухолевой клетке на противоопухолевое звено иммунитета Вирусы, размножаясь в опухолевых клеточной мембране. Ими являются вирус болезни Ньюкастла, РНКовый вирус клетках, индуцируют образование новых антигенов на поверхности С типа и вирус везикулярного стоматита. опухолевых клеток. Идеолог создания таких вакцин проф. Г. Я. Свет. В ранних работах вирусные онколизаты были использованы для терапии Молдавский назвал этот феномен "искусственной гетерогенизацией меланомы, лейкозов, саркомы, рака молочной железы и гинекологических опухолевых клеток под влиянием вирусной инфекции", а B. Stuck и соавт. опухолей. В настоящее время этот вид терапии применяется лишь для предложили термин "антигенная конверсия". Интресно, что мышиные больных, имеющих опухоли, традиционно именуемые иммуногенными: опухоли, гетерогенизированные вирусом, не растут у сингенных мышей. меланома, рак толстой кишки и рак яичников. Большие возможности для Защитный иммунитет против опухоли можно индуцировать у получения вирусных онколизатов открывает рекомбинантная биотехнология. нормальных животных введением вирусного онколизата - продукта Американские ученые, им удалось добиться устойчивой ремиссии опухоли вирусного онколизиса, приготовленного из той же самой опухоли. костного мозга у 49 -летней женщины после инъекции большой дозы модифицированных вирусов кори. В виде вакцина против кори. опухолевые Онковекс – Onco. Vex. Представляет собой противоопухолевую вакцину, клетки формируют на поверхности особые рецепторы, которые становятся предназначенную для предупреждения и терапии метастатической преградой для нашего иммунитета. Тем не менее, тот же самый рецептор (в меланомы. В состав вакцины входит онколитический вирус, нашем случае это CD 46) может послужить точкой входа для вакцины от кори. разработанный на основе модификации вируса герпеса человек Чем больше рецептора CD 46 находится на поверхности клетки, тем активнее она будет заражена измененным вирусом (вакциной). Это заражение впоследствии ведет к гибели опухолевой клетки. через испытания терапии вакциной от кори прошли около 100 человек без каких-либо отрицательных последствий для здоровья.
Онколитические вирусы Вирусы, применяемые для получения вирусных онколизатов, можно разделить Универсальность действия вирусных вакцин заключается в том, что на две группы. Первая группа включает вирусы, которые инфицируют и оказывая прямое цитопатическое действие на опухолевые клетки в лизируют опухолевые клетки - вирусы гриппа и осповакцины. процессе вирусной репликации, они также способны индуцировать Вторая - включает вирусы, которые размножаются в опухолевой клетке на противоопухолевое звено иммунитета Вирусы, размножаясь в опухолевых клеточной мембране. Ими являются вирус болезни Ньюкастла, РНКовый вирус клетках, индуцируют образование новых антигенов на поверхности С типа и вирус везикулярного стоматита. опухолевых клеток. Идеолог создания таких вакцин проф. Г. Я. Свет. В ранних работах вирусные онколизаты были использованы для терапии Молдавский назвал этот феномен "искусственной гетерогенизацией меланомы, лейкозов, саркомы, рака молочной железы и гинекологических опухолевых клеток под влиянием вирусной инфекции", а B. Stuck и соавт. опухолей. В настоящее время этот вид терапии применяется лишь для предложили термин "антигенная конверсия". Интресно, что мышиные больных, имеющих опухоли, традиционно именуемые иммуногенными: опухоли, гетерогенизированные вирусом, не растут у сингенных мышей. меланома, рак толстой кишки и рак яичников. Большие возможности для Защитный иммунитет против опухоли можно индуцировать у получения вирусных онколизатов открывает рекомбинантная биотехнология. нормальных животных введением вирусного онколизата - продукта Американские ученые, им удалось добиться устойчивой ремиссии опухоли вирусного онколизиса, приготовленного из той же самой опухоли. костного мозга у 49 -летней женщины после инъекции большой дозы модифицированных вирусов кори. В виде вакцина против кори. опухолевые Онковекс – Onco. Vex. Представляет собой противоопухолевую вакцину, клетки формируют на поверхности особые рецепторы, которые становятся предназначенную для предупреждения и терапии метастатической преградой для нашего иммунитета. Тем не менее, тот же самый рецептор (в меланомы. В состав вакцины входит онколитический вирус, нашем случае это CD 46) может послужить точкой входа для вакцины от кори. разработанный на основе модификации вируса герпеса человек Чем больше рецептора CD 46 находится на поверхности клетки, тем активнее она будет заражена измененным вирусом (вакциной). Это заражение впоследствии ведет к гибели опухолевой клетки. через испытания терапии вакциной от кори прошли около 100 человек без каких-либо отрицательных последствий для здоровья.
 ДНК-вакцины Метод основан на генерации иммунного ответа при введении ДНК, кодирующей опухолевые антигены. Конструкция ДНК-вакцин включает клонирование необходимого гена в бактериальную плазмиду под контролем вирусного промотора (например, цитомегаловирусного). В ядре клетки-мишени плазмиды существуют как циркулярные нерепликативные эписомы, которые не встраиваются в геном. В результате происходит длительная экспрессия закодированных белков в клетке-мишени При попадании внутрь организма, плазмиды захватываются клетками, преимущественно АПК. Внутри АПК происходит экспрессия онкоантигенов, которые затем предоставляются на поверхности в комплексе с белками MHC 1 и 2 класса. Клинический эффект ДНК иммунизации был получен в различных испытаниях. Так при лечении меланомы применялись вакцины против онкоантигенов gp 100, gp 75 и TRP-2. В случае с gp 100 наблюдалось уменьшение лёгочных метастазов на 50% и увеличение выживших пациентов на 50%. Вакцина против gp 75 давала значительную защиту от метастазов и 86% уменьшение образований в лёгких.
ДНК-вакцины Метод основан на генерации иммунного ответа при введении ДНК, кодирующей опухолевые антигены. Конструкция ДНК-вакцин включает клонирование необходимого гена в бактериальную плазмиду под контролем вирусного промотора (например, цитомегаловирусного). В ядре клетки-мишени плазмиды существуют как циркулярные нерепликативные эписомы, которые не встраиваются в геном. В результате происходит длительная экспрессия закодированных белков в клетке-мишени При попадании внутрь организма, плазмиды захватываются клетками, преимущественно АПК. Внутри АПК происходит экспрессия онкоантигенов, которые затем предоставляются на поверхности в комплексе с белками MHC 1 и 2 класса. Клинический эффект ДНК иммунизации был получен в различных испытаниях. Так при лечении меланомы применялись вакцины против онкоантигенов gp 100, gp 75 и TRP-2. В случае с gp 100 наблюдалось уменьшение лёгочных метастазов на 50% и увеличение выживших пациентов на 50%. Вакцина против gp 75 давала значительную защиту от метастазов и 86% уменьшение образований в лёгких.
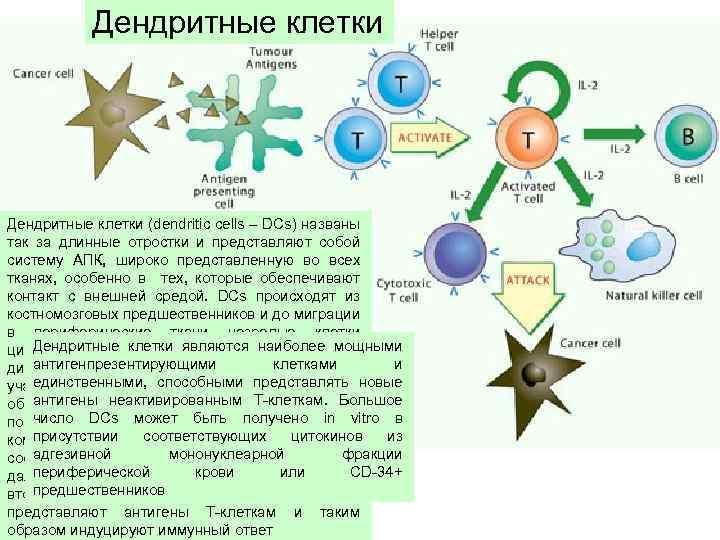 Дендритные клетки (dendritic cells – DCs) названы так за длинные отростки и представляют собой систему АПК, широко представленную во всех тканях, особенно в тех, которые обеспечивают контакт с внешней средой. DCs происходят из костномозговых предшественников и до миграции в периферические ткани незрелые клетки Дендритные клетки являются наиболее мощными циркулируют в кровяном русле. В тканях DCs антигенпрезентирующими клетками и дифференцируются и активизируются, принимая единственными, способными представлять новые участие в процессинге тканевых антигенов, антигены их презентацию на своей обеспечивая неактивированным Т-клеткам. Большое число DCs может молекулами главного поверхности вместе с быть получено in vitro в присутствии соответствующих цитокинов из комплекса гистосовместимости (MHC). При адгезивной мононуклеарной фракции соответствующей стимуляции происходит периферической крови или CD-34+ дальнейшее созревание DCs и они мигрируют во предшественников вторичные лимфоидные органы, где представляют антигены Т-клеткам и таким образом индуцируют иммунный ответ
Дендритные клетки (dendritic cells – DCs) названы так за длинные отростки и представляют собой систему АПК, широко представленную во всех тканях, особенно в тех, которые обеспечивают контакт с внешней средой. DCs происходят из костномозговых предшественников и до миграции в периферические ткани незрелые клетки Дендритные клетки являются наиболее мощными циркулируют в кровяном русле. В тканях DCs антигенпрезентирующими клетками и дифференцируются и активизируются, принимая единственными, способными представлять новые участие в процессинге тканевых антигенов, антигены их презентацию на своей обеспечивая неактивированным Т-клеткам. Большое число DCs может молекулами главного поверхности вместе с быть получено in vitro в присутствии соответствующих цитокинов из комплекса гистосовместимости (MHC). При адгезивной мононуклеарной фракции соответствующей стимуляции происходит периферической крови или CD-34+ дальнейшее созревание DCs и они мигрируют во предшественников вторичные лимфоидные органы, где представляют антигены Т-клеткам и таким образом индуцируют иммунный ответ
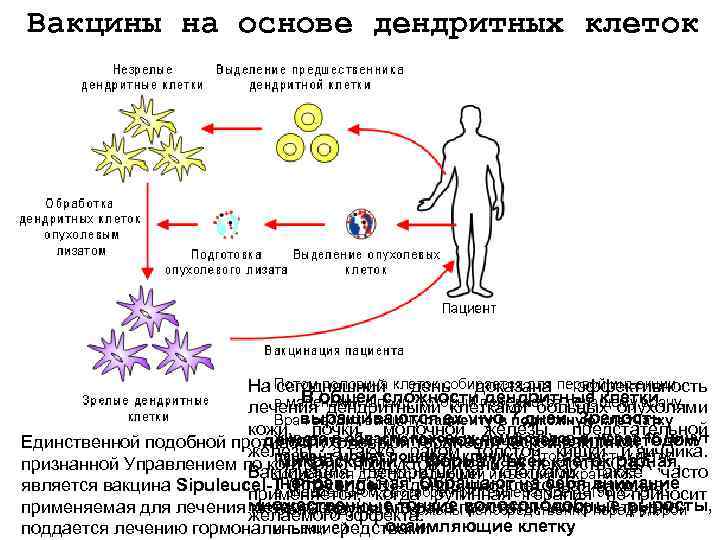 Вакцины на основе дендритных клеток Потом половина клеток собирается для первой инъекции На сегодняшний день доказана эффективность В общей сложности дендритные клетки в маленький шприц, который передается лечащему врачу. лечения дендритными клетками больных опухолями выращиваются ex vivo 7 дней. Зрелость Врач вводит вакцину пациенту в подкожную клетчатку кожи, почки, молочной железы, предстательной живота в область паховых лимфоузлов и, через 15 минут дендритных клеток можно определить методом Единственной подобной противоопухолевыой терапевтической вакциной, железы, а также раком толстой кишки и яичника. пациент может покинуть клинику. Вторая часть клеток микроскопии — форма у всех клеток разная, признанной Управлением по контролю продуктов питания и лекарств США , Вакцинация дендритными клетками также часто собирается для последующей инъекции и хранится неправильная. Обращают на себя внимание является вакцина Sipuleucel-T (Provenge®)– дендритно-клеточная вакцина, в специальном растворе при температуре — 196°С. Эти применяется, когда рутинная терапия не приносит множественные тонкие волосоподобные выросты, применяемая для лечения метастазирующего рака простаты, который трудно клетки будут разморожены непосредственно перед второй желаемого эффекта. окаймляющие клетку инъекцией поддается лечению гормональными средствами
Вакцины на основе дендритных клеток Потом половина клеток собирается для первой инъекции На сегодняшний день доказана эффективность В общей сложности дендритные клетки в маленький шприц, который передается лечащему врачу. лечения дендритными клетками больных опухолями выращиваются ex vivo 7 дней. Зрелость Врач вводит вакцину пациенту в подкожную клетчатку кожи, почки, молочной железы, предстательной живота в область паховых лимфоузлов и, через 15 минут дендритных клеток можно определить методом Единственной подобной противоопухолевыой терапевтической вакциной, железы, а также раком толстой кишки и яичника. пациент может покинуть клинику. Вторая часть клеток микроскопии — форма у всех клеток разная, признанной Управлением по контролю продуктов питания и лекарств США , Вакцинация дендритными клетками также часто собирается для последующей инъекции и хранится неправильная. Обращают на себя внимание является вакцина Sipuleucel-T (Provenge®)– дендритно-клеточная вакцина, в специальном растворе при температуре — 196°С. Эти применяется, когда рутинная терапия не приносит множественные тонкие волосоподобные выросты, применяемая для лечения метастазирующего рака простаты, который трудно клетки будут разморожены непосредственно перед второй желаемого эффекта. окаймляющие клетку инъекцией поддается лечению гормональными средствами
 Вакцины на основе белков теплового шока Одним из важных свойств БТШ является открытая в последние Вакцины на основе белков теплового шока показали свою десятилетия их способность многократно повышать иммуногенность эффективность и перспективность при лечении меланомы, антигенных пептидов, связанных с ними: попав во внеклеточное почечной карциномы, рака желудка, молочной железы, рака пространство, комплексы БТШ с пептидами (БТШ-ПК) захватываются поджелудочной железы и рака прямой кишки. Также существуют антигенпрезентирующими клетками и вызывают эффективный разработки вакцин против инфекций, ассоциированных с иммунный ответ. Это свойство позволяет использовать очищенные опухолевыми заболеваниями (вирус папилломы человека при БТШ-ПК для лечения и профилактики инфекционных и раке шейки матки у женщин). онкологических заболеваний При введении в организм В 2008 г. биотехнологическая компания Antigenics сообщила о государственной больного, комплекс HSPрегистрации в Российской Федерации пептид захватывается препарата Oncophage® (витеспен, HSPPC-96) для лечения пациентов с раком АПК, на поверхности почки с риском рецидивирования. Вакцина представляет собой белок теплового которых существуют шока, выделенный из опухоли определенного пациента и направленный именно специальные рецепторы к против нее. Препарат Oncophage проходил испытания в качестве вакцины для HSP. Например, CD 40, профилактики рецидивов рака почек, точнее от гипернефромы. CD 91. CD 80, Существуют попытки использования БТШ при создании вакцин. В основном, разработки ведутся на базе hsp 70, hsp 90, gp 96 и кальретикулина
Вакцины на основе белков теплового шока Одним из важных свойств БТШ является открытая в последние Вакцины на основе белков теплового шока показали свою десятилетия их способность многократно повышать иммуногенность эффективность и перспективность при лечении меланомы, антигенных пептидов, связанных с ними: попав во внеклеточное почечной карциномы, рака желудка, молочной железы, рака пространство, комплексы БТШ с пептидами (БТШ-ПК) захватываются поджелудочной железы и рака прямой кишки. Также существуют антигенпрезентирующими клетками и вызывают эффективный разработки вакцин против инфекций, ассоциированных с иммунный ответ. Это свойство позволяет использовать очищенные опухолевыми заболеваниями (вирус папилломы человека при БТШ-ПК для лечения и профилактики инфекционных и раке шейки матки у женщин). онкологических заболеваний При введении в организм В 2008 г. биотехнологическая компания Antigenics сообщила о государственной больного, комплекс HSPрегистрации в Российской Федерации пептид захватывается препарата Oncophage® (витеспен, HSPPC-96) для лечения пациентов с раком АПК, на поверхности почки с риском рецидивирования. Вакцина представляет собой белок теплового которых существуют шока, выделенный из опухоли определенного пациента и направленный именно специальные рецепторы к против нее. Препарат Oncophage проходил испытания в качестве вакцины для HSP. Например, CD 40, профилактики рецидивов рака почек, точнее от гипернефромы. CD 91. CD 80, Существуют попытки использования БТШ при создании вакцин. В основном, разработки ведутся на базе hsp 70, hsp 90, gp 96 и кальретикулина
 — вакцина на основе бактерий Streptococcus pyogenes группы А и Serratia marcescens, которая была создана в конце XIX века американским хирургом-онкологом Вильямом Коли[en] (1862— 1936) для лечения людей больных онкологическими болезнями. Также известна как «вакцина Коли» «токсины Коли» или «флюиды Коли В 1891 году Вильям Коли установил взаимосвязь между перенесённой инфекцией (скралатина, рожа), вызванной S. pyogenes и регрессией опухоли у пациентов В 1893 году он создал вакцину на основе S. pyogenes для лечения больных саркомой. Позже в состав вакцины были добавлены бактерии S. marcescens, которые усилили её противораковые свойства. К 1893 году Вильям Коли испытал вакцину на 10 пациентах, большинство из которых полностью излечились. К 1916 году Коли задокументировал более 80 случаев в монографиях. К концу карьеры Вильям Коли опубликовал более 150 статей, пролечил около 896 пациентов, половина из которых полностью излечилась от злокачественных опухолей
— вакцина на основе бактерий Streptococcus pyogenes группы А и Serratia marcescens, которая была создана в конце XIX века американским хирургом-онкологом Вильямом Коли[en] (1862— 1936) для лечения людей больных онкологическими болезнями. Также известна как «вакцина Коли» «токсины Коли» или «флюиды Коли В 1891 году Вильям Коли установил взаимосвязь между перенесённой инфекцией (скралатина, рожа), вызванной S. pyogenes и регрессией опухоли у пациентов В 1893 году он создал вакцину на основе S. pyogenes для лечения больных саркомой. Позже в состав вакцины были добавлены бактерии S. marcescens, которые усилили её противораковые свойства. К 1893 году Вильям Коли испытал вакцину на 10 пациентах, большинство из которых полностью излечились. К 1916 году Коли задокументировал более 80 случаев в монографиях. К концу карьеры Вильям Коли опубликовал более 150 статей, пролечил около 896 пациентов, половина из которых полностью излечилась от злокачественных опухолей
 • Канадская биотехнологическая компания MBVax Bioscience производит «флюиды Коли» В России на основе идей Вильяма Коли к. б. н. А. А. Моровой и известным российским для доклинических исследований ученым д. м. н. академиком РАМН и РАНВ. А. Черешневым также велась разработка • Частная компания Coley Pharmaceutical Group провела клинические испытания с противоопухолевого препарата. использованием некоторых фрагментов ДНК-последовательностей бактерий, которые А. В. Черешневым и А. А. Моровой в подтверждение выдвинутой гипотезе был могут отвечать за противораковый эффект «вакцины Коли» . Данная компания была предложен и апробирован с 1974 года метод биотерапии с применением живой вакцины куплена компанией Pfizer в декабре 2008 года. Компании Pfizer и Sanofi-Aventis «Пиротат» на основе штамма Гуров, которая вводится внутрикожно при строгой заинтересованы в разработке современного состава «вакцины Вильяма Коли» дозировке и по определенным лечебным схемам. При значительной опухолевой • Большое развитие идеи Вильяма Коли получили в Японии, где была создана вакцина на нагрузке лечение состоит из предварительного этапа биотерапии с последующим основе непатогенного типа Streptococcus pyogenes, штамм Su (бета-гемолитический оперативным вмешательством, после чего вновь следует этап биотерапии. Авторы стрептококк группы A). отмечают, что на начальных стадиях онкологического заболевания и предопухолевом состоянии одной только биотерапии было достаточно для нормализации всех функций организма. Но попытки остановить опухолевый процесс, перешедший в третью и четвертую стадию, чаще всего, оканчивались неудачей. При следующих заболеваниях наблюдалась полная ремиссия (излечение): • Мелонома (маланобластома), в том числе третья стадия • Лимфома Ходжкина (лимфогрануломатоз), в том числе третья стадия • Генитальный рак со множественными метастазами в органах • Рак легкого • Лечение метастазов в легких, печени, кишечнике (основной узел был удален до биотерапии) Авторы рекомендуют биотерапию для профилактики онкологических заболеваний за счет стимуляции естественного противоракового иммунитета (способность иммунных клеток человека распознавать и уничтожать трансформированные клетки
• Канадская биотехнологическая компания MBVax Bioscience производит «флюиды Коли» В России на основе идей Вильяма Коли к. б. н. А. А. Моровой и известным российским для доклинических исследований ученым д. м. н. академиком РАМН и РАНВ. А. Черешневым также велась разработка • Частная компания Coley Pharmaceutical Group провела клинические испытания с противоопухолевого препарата. использованием некоторых фрагментов ДНК-последовательностей бактерий, которые А. В. Черешневым и А. А. Моровой в подтверждение выдвинутой гипотезе был могут отвечать за противораковый эффект «вакцины Коли» . Данная компания была предложен и апробирован с 1974 года метод биотерапии с применением живой вакцины куплена компанией Pfizer в декабре 2008 года. Компании Pfizer и Sanofi-Aventis «Пиротат» на основе штамма Гуров, которая вводится внутрикожно при строгой заинтересованы в разработке современного состава «вакцины Вильяма Коли» дозировке и по определенным лечебным схемам. При значительной опухолевой • Большое развитие идеи Вильяма Коли получили в Японии, где была создана вакцина на нагрузке лечение состоит из предварительного этапа биотерапии с последующим основе непатогенного типа Streptococcus pyogenes, штамм Su (бета-гемолитический оперативным вмешательством, после чего вновь следует этап биотерапии. Авторы стрептококк группы A). отмечают, что на начальных стадиях онкологического заболевания и предопухолевом состоянии одной только биотерапии было достаточно для нормализации всех функций организма. Но попытки остановить опухолевый процесс, перешедший в третью и четвертую стадию, чаще всего, оканчивались неудачей. При следующих заболеваниях наблюдалась полная ремиссия (излечение): • Мелонома (маланобластома), в том числе третья стадия • Лимфома Ходжкина (лимфогрануломатоз), в том числе третья стадия • Генитальный рак со множественными метастазами в органах • Рак легкого • Лечение метастазов в легких, печени, кишечнике (основной узел был удален до биотерапии) Авторы рекомендуют биотерапию для профилактики онкологических заболеваний за счет стимуляции естественного противоракового иммунитета (способность иммунных клеток человека распознавать и уничтожать трансформированные клетки
 Вакцина «Имурон» (БЦЖ) применяется для иммунопрофилактики рака мочевого пузыря. Предназначена для предупреждения рецидивов поверхностного рака мочевого пузыря после оперативного удаления (трансуретральная резекция) опухолей, а также для лечения рака in situ и поверхностных опухолей мочевого пузыря размерами менее 1 см, оперативное удаление которых не представляется возможным. Препарат рассчитан на неспецифическую стимуляцию клеточного иммунитета.
Вакцина «Имурон» (БЦЖ) применяется для иммунопрофилактики рака мочевого пузыря. Предназначена для предупреждения рецидивов поверхностного рака мочевого пузыря после оперативного удаления (трансуретральная резекция) опухолей, а также для лечения рака in situ и поверхностных опухолей мочевого пузыря размерами менее 1 см, оперативное удаление которых не представляется возможным. Препарат рассчитан на неспецифическую стимуляцию клеточного иммунитета.
 Новообразования, ассоциируемые с инфекцией микроорганизмами Локализация новообразований Желудок: Аденокарцинома Лимфома Наружные половые органы Печень: Гепатокарцинома Ассоциируемый патоген Доля (%)* Helicobakter pylori 55 Вирус папиломы человека Вирус гепатита В Вирус гепатита С 65** 87*** 73 27 • Вакцина против бактерий Helikobacter pylori, вызывающих язвы двенадцатиперстной кишки и гастрит, препятствует развитию рака желудка. • Разработана вакцина против вируса папилломы человека. Инфекция, вызванная этим вирусом, передается половым путем и влечет за собой большой риск развития рака шейки матки. В настоящее время профилактическая вакцина против ВПЧ в виде двух разновидностей уже в торговой сети — Гардасил и Церварикс
Новообразования, ассоциируемые с инфекцией микроорганизмами Локализация новообразований Желудок: Аденокарцинома Лимфома Наружные половые органы Печень: Гепатокарцинома Ассоциируемый патоген Доля (%)* Helicobakter pylori 55 Вирус папиломы человека Вирус гепатита В Вирус гепатита С 65** 87*** 73 27 • Вакцина против бактерий Helikobacter pylori, вызывающих язвы двенадцатиперстной кишки и гастрит, препятствует развитию рака желудка. • Разработана вакцина против вируса папилломы человека. Инфекция, вызванная этим вирусом, передается половым путем и влечет за собой большой риск развития рака шейки матки. В настоящее время профилактическая вакцина против ВПЧ в виде двух разновидностей уже в торговой сети — Гардасил и Церварикс
 Остатки от 2 лекции
Остатки от 2 лекции
 ВАКЦИНАЦИЯ С ЦЕЛЬЮ ИММУНОРЕАБИЛИТАЦИИ Вакцинация с целью иммунореабилитации - новый раздел педиатрии. Существуют Рибомунил - комплексный препарат, содержащий рибосомальные фракции препараты, действующие как вакцина и как иммуномодулятор. Они влияют как на бактерий, наиболее часто осложняющих вирусные заболевания дыхательных ИРС® 19 представляет собой спрей для интраназального введения, неспецифические системы защиты, так и селективно, приводя к выработке путей и ЛОР-органов. Вакцинальный эффект рибомунила обусловлен содержит лизаты бактерий, наиболее часто вызывающих инфекции специфического иммунитета против конкретных инфекционных агентов присутствием рибосомальных фракций Klebsiella pneumoniae, Streptococcus верхних дыхательных путей: Streptococcus pneumoniae type I, Streptococcus Рибомунил назначают для профилактики и лечения рецедивирующих Имудон® - иммуномодулирующий препарат местного действия, pneumoniae, Streptococcus pyogenes и Haemophilus influenzae, а также pneumoniae type II, Streptococcus pneumoniae type III, Streptococcus инфекций верхних дыхательных путей (ринит, синусит, ангина, фарингит, содержит смесь 13 лизатов бактерий, наиболее часто вызывающих селективными мембранными фракциями, протеогликанами Klebsiella pneumoniae type V, Streptococcus pneumoniae type VIII, Streptococcus ларингит); профилактики и лечения инфекций нижних дыхательных путей воспалительные процессы в глотке и полости рта, а также необходимые pneumoniae. В отличие от других бактериальных иммуномодуляторов, рибомунил pneumoniae type XII, Haemophilus influenzae type B, Klebsiella pneumoniae, (трахеит, острый и хронический бронхит, респираторные заболевания у для устранения дисбиоза ротоглотки (лактобактерии S. pyogenes, S. не относится к лизатам. Входящие в состав этого препарата бактериальные Staphylococcus aureus, Acinelobacter calcoaceticus baumannii variety, детей с бронхиальной астмой) у часто и длительно болеющих детей; faecium, S. faecalis, S. sanguis, S. aureus, K. pneumoniae, C. рибосомы обладают более высокими антигенными свойствами соответствующих Moraxella catarrhalis, Neisseria flava, Neisseria subflava, Streptococcus сезонной профилактики ОРЗ в организованных детских коллективах. . pseudodiphtericum, F. Fusiformis, Candiia Albicans). микроорганизмов, что и обеспечивает эффективную специфическую pyogenes A, Streptococcus dysgalacliae C, Streptococcus G, Enterococcus Применение рибомунила позволяет добиться выраженного общего и Показаниями для назначения Имудона® являются острые, иммунизацию (вакцинацию) с доказанным повышением титров специфических faecium, Enterococcus faecalis. местного иммунного ответа в виде длительного повышения уровня s. Ig. A и рецидивирующие и хронические заболевания полости рта (гингивит, антител в сыворотке крови. Неантигенные структуры бактериальных мембран При местной иммунизации ИРС® 19 антигенные детерминанты антителообразующих клеток, активации цитотоксических и киллерных стоматит, глоссит, пародонтоз) и глотки (тонзиллит, (протеогликаны) Klebsiella pneumoniae оказывают иммуномодулирующее стимулируют в собственной пластинке слизистой оболочки субпопуляций Т-лимфоцитов, нормализации показателей клеточной фарингит). действие на неспецифическое звено иммунного ответа, а также являются производство антител, которые далее выделяются слизистой активации. Рибомунил формирует длительную иммунную память в адъювантами, потенцирующими специфическую иммунизацию. оболочкой в просвет дыхательных путей и образуют на ее поверхности отношении основных возбудителей респираторных инфекций, иммунный барьер, защищающий от проникновения патогенных сохраняющуюся до 2 -2, 5 лет. Рибомунил активирует выработку микроорганизмов; достигается двойное увеличение степени интерферона, фагоцитарную активность и подвижность макрофагов. фагоцитоза, повышается уровень лизоцима, секреторного Ig. A, комплемента, опсонинов, пропердина и эндогенного интерферона.
ВАКЦИНАЦИЯ С ЦЕЛЬЮ ИММУНОРЕАБИЛИТАЦИИ Вакцинация с целью иммунореабилитации - новый раздел педиатрии. Существуют Рибомунил - комплексный препарат, содержащий рибосомальные фракции препараты, действующие как вакцина и как иммуномодулятор. Они влияют как на бактерий, наиболее часто осложняющих вирусные заболевания дыхательных ИРС® 19 представляет собой спрей для интраназального введения, неспецифические системы защиты, так и селективно, приводя к выработке путей и ЛОР-органов. Вакцинальный эффект рибомунила обусловлен содержит лизаты бактерий, наиболее часто вызывающих инфекции специфического иммунитета против конкретных инфекционных агентов присутствием рибосомальных фракций Klebsiella pneumoniae, Streptococcus верхних дыхательных путей: Streptococcus pneumoniae type I, Streptococcus Рибомунил назначают для профилактики и лечения рецедивирующих Имудон® - иммуномодулирующий препарат местного действия, pneumoniae, Streptococcus pyogenes и Haemophilus influenzae, а также pneumoniae type II, Streptococcus pneumoniae type III, Streptococcus инфекций верхних дыхательных путей (ринит, синусит, ангина, фарингит, содержит смесь 13 лизатов бактерий, наиболее часто вызывающих селективными мембранными фракциями, протеогликанами Klebsiella pneumoniae type V, Streptococcus pneumoniae type VIII, Streptococcus ларингит); профилактики и лечения инфекций нижних дыхательных путей воспалительные процессы в глотке и полости рта, а также необходимые pneumoniae. В отличие от других бактериальных иммуномодуляторов, рибомунил pneumoniae type XII, Haemophilus influenzae type B, Klebsiella pneumoniae, (трахеит, острый и хронический бронхит, респираторные заболевания у для устранения дисбиоза ротоглотки (лактобактерии S. pyogenes, S. не относится к лизатам. Входящие в состав этого препарата бактериальные Staphylococcus aureus, Acinelobacter calcoaceticus baumannii variety, детей с бронхиальной астмой) у часто и длительно болеющих детей; faecium, S. faecalis, S. sanguis, S. aureus, K. pneumoniae, C. рибосомы обладают более высокими антигенными свойствами соответствующих Moraxella catarrhalis, Neisseria flava, Neisseria subflava, Streptococcus сезонной профилактики ОРЗ в организованных детских коллективах. . pseudodiphtericum, F. Fusiformis, Candiia Albicans). микроорганизмов, что и обеспечивает эффективную специфическую pyogenes A, Streptococcus dysgalacliae C, Streptococcus G, Enterococcus Применение рибомунила позволяет добиться выраженного общего и Показаниями для назначения Имудона® являются острые, иммунизацию (вакцинацию) с доказанным повышением титров специфических faecium, Enterococcus faecalis. местного иммунного ответа в виде длительного повышения уровня s. Ig. A и рецидивирующие и хронические заболевания полости рта (гингивит, антител в сыворотке крови. Неантигенные структуры бактериальных мембран При местной иммунизации ИРС® 19 антигенные детерминанты антителообразующих клеток, активации цитотоксических и киллерных стоматит, глоссит, пародонтоз) и глотки (тонзиллит, (протеогликаны) Klebsiella pneumoniae оказывают иммуномодулирующее стимулируют в собственной пластинке слизистой оболочки субпопуляций Т-лимфоцитов, нормализации показателей клеточной фарингит). действие на неспецифическое звено иммунного ответа, а также являются производство антител, которые далее выделяются слизистой активации. Рибомунил формирует длительную иммунную память в адъювантами, потенцирующими специфическую иммунизацию. оболочкой в просвет дыхательных путей и образуют на ее поверхности отношении основных возбудителей респираторных инфекций, иммунный барьер, защищающий от проникновения патогенных сохраняющуюся до 2 -2, 5 лет. Рибомунил активирует выработку микроорганизмов; достигается двойное увеличение степени интерферона, фагоцитарную активность и подвижность макрофагов. фагоцитоза, повышается уровень лизоцима, секреторного Ig. A, комплемента, опсонинов, пропердина и эндогенного интерферона.
 СОСТАВ ВАКЦИН В состав вакцин, помимо антигенов, обеспечивающих развитие специфической невосприимчивости, входят вещества, вносимые в препарат с целью обеспечения стабильности его антигенных свойств (стабилизаторы), В качестве стабилизаторов используются исключительно для поддержания стерильности (консерванты) и повышения иммуногенности вещества, В качестве адъювантов чаще используют алюминия (адъюванты). на которые имеются фармакопейные статьи: сахароза, лактоза, альбумин человека, натрия глутамат. Их присутствие в гидроксид или алюминия фосфат. К числу других препарате не влияет на его реактогенность. можно отнести стимуляторов антителообразования Назначение консервантов - химических веществ, обладающих имуноадъювант полиоксидоний, который входит в состав бактерицидными свойствами, - состоит в сохранении стерильности отечественной инактивированной тривалентной инактивированных вакцин. Наиболее распространенным консервантом гриппозной полимер-субъединичной вакцины «Гриппол» . как в России, так и за рубежом является мертиолат (тиомерсал), Введение в вакцину гриппол иммуномодулятора представляющий собой органическую соль ртути, не содержащую, полиоксидония позволяет в 3 раза снизить количество естественно, свободной ртути. Мертиолата в препаратах АКДС-вакцины, основного антигена гемагтлютинина в вакцинирующей анатоксинов, вакцине против гепатита В и энтеральной дозе. Перспективными адъювантами при других сорбированных препаратах не более 50 холерный токсин и Поскольку мертиолат иммунизации являются мкг в 1 дозе. лабильный неблагоприятно влияет на антигены инактивированных полиовирусов, в токсин E. coli, стимулирующие образование секреторных зарубежных препаратах инактивированной полиомиелитной вакцины в Ig. A-антител. качестве консерванта используют 2 -феноксиэтанол
СОСТАВ ВАКЦИН В состав вакцин, помимо антигенов, обеспечивающих развитие специфической невосприимчивости, входят вещества, вносимые в препарат с целью обеспечения стабильности его антигенных свойств (стабилизаторы), В качестве стабилизаторов используются исключительно для поддержания стерильности (консерванты) и повышения иммуногенности вещества, В качестве адъювантов чаще используют алюминия (адъюванты). на которые имеются фармакопейные статьи: сахароза, лактоза, альбумин человека, натрия глутамат. Их присутствие в гидроксид или алюминия фосфат. К числу других препарате не влияет на его реактогенность. можно отнести стимуляторов антителообразования Назначение консервантов - химических веществ, обладающих имуноадъювант полиоксидоний, который входит в состав бактерицидными свойствами, - состоит в сохранении стерильности отечественной инактивированной тривалентной инактивированных вакцин. Наиболее распространенным консервантом гриппозной полимер-субъединичной вакцины «Гриппол» . как в России, так и за рубежом является мертиолат (тиомерсал), Введение в вакцину гриппол иммуномодулятора представляющий собой органическую соль ртути, не содержащую, полиоксидония позволяет в 3 раза снизить количество естественно, свободной ртути. Мертиолата в препаратах АКДС-вакцины, основного антигена гемагтлютинина в вакцинирующей анатоксинов, вакцине против гепатита В и энтеральной дозе. Перспективными адъювантами при других сорбированных препаратах не более 50 холерный токсин и Поскольку мертиолат иммунизации являются мкг в 1 дозе. лабильный неблагоприятно влияет на антигены инактивированных полиовирусов, в токсин E. coli, стимулирующие образование секреторных зарубежных препаратах инактивированной полиомиелитной вакцины в Ig. A-антител. качестве консерванта используют 2 -феноксиэтанол
 Реакция на прививки Местная реакция: q Слабая (гиперемия, инфильтрат до 2, 5 см в диаметре) q Средняя (2, 6 -5, 0 см) q Сильная (> 5, 0 см с лимфаденитом) Развиваются в первые сутки. Держатся 2 -3 дня. Общая реакция: q Слабая – TºС до 37, 5ºС q Средняя – TºС до 38, 6ºС q Сильная – TºС более 38, 8ºС Нарушение общего состояния. Дальнейшее применение вакцины невозможно, если при ее использовании отмечены средние и сильные реакции у
Реакция на прививки Местная реакция: q Слабая (гиперемия, инфильтрат до 2, 5 см в диаметре) q Средняя (2, 6 -5, 0 см) q Сильная (> 5, 0 см с лимфаденитом) Развиваются в первые сутки. Держатся 2 -3 дня. Общая реакция: q Слабая – TºС до 37, 5ºС q Средняя – TºС до 38, 6ºС q Сильная – TºС более 38, 8ºС Нарушение общего состояния. Дальнейшее применение вакцины невозможно, если при ее использовании отмечены средние и сильные реакции у
 Поствакцинальные осложнения q q q I. Осложнения с поражением ЦНС Упорный пронзительный крик Энцефалитическая реакция: q Судорожный синдром без повышения температуры тела q Судорожный синдром на фоне гипертермии Энцефалопатия Поствакцинальный энцефалит II. Осложнения аллергического характера Местные реакции аллергического типа (отек и гиперемия мягких тканей) Аллергические сыпи Аллергические отеки Астматический синдром. Синдром крупа Геморрагический синдром Токсико-аллергическое состояние Коллаптоидное состояние Анафилактический шок III. Сочетанное течение вакцинального процесса и присоединившейся острой интеркуррентной инфекции с осложнениями и без них. IV. Обострение хронических болезней и активация латентной инфекции (Роль прививки – провоцирующая). V. Внезапная смерть.
Поствакцинальные осложнения q q q I. Осложнения с поражением ЦНС Упорный пронзительный крик Энцефалитическая реакция: q Судорожный синдром без повышения температуры тела q Судорожный синдром на фоне гипертермии Энцефалопатия Поствакцинальный энцефалит II. Осложнения аллергического характера Местные реакции аллергического типа (отек и гиперемия мягких тканей) Аллергические сыпи Аллергические отеки Астматический синдром. Синдром крупа Геморрагический синдром Токсико-аллергическое состояние Коллаптоидное состояние Анафилактический шок III. Сочетанное течение вакцинального процесса и присоединившейся острой интеркуррентной инфекции с осложнениями и без них. IV. Обострение хронических болезней и активация латентной инфекции (Роль прививки – провоцирующая). V. Внезапная смерть.
 Сроки развития серьезных вакцинальных осложнений Осложнение Вакцинация Сроки АКДС, АДС, ЖКВ, ВГВ, ИПВ 4 часа Коллаптоидное состояние (снижение мышечного тонуса, побледнение, потеря сознания или сонливость, сердечно-сосудистая или дыхательная недостаточность) АКДС 3 дня Энцефалопатия (нарушение функций ЦНС, повышение внутричерепного давления, нарушение сознания более 6 часов, судороги, медленные волны на ЭЭГ) АКДС, АДС ЖКВ, ЖПВ 3 дня 5 -15 дней Резидуальные судорожные состояния (эпизод судорог при температуре ниже 39, 0˚С, если они отсутствовали до и повторились в течение 1 года после прививки) АКДС, АДС ЖКВ, ЖПВ 3 дня 5 -15 дней Анафилактический шок
Сроки развития серьезных вакцинальных осложнений Осложнение Вакцинация Сроки АКДС, АДС, ЖКВ, ВГВ, ИПВ 4 часа Коллаптоидное состояние (снижение мышечного тонуса, побледнение, потеря сознания или сонливость, сердечно-сосудистая или дыхательная недостаточность) АКДС 3 дня Энцефалопатия (нарушение функций ЦНС, повышение внутричерепного давления, нарушение сознания более 6 часов, судороги, медленные волны на ЭЭГ) АКДС, АДС ЖКВ, ЖПВ 3 дня 5 -15 дней Резидуальные судорожные состояния (эпизод судорог при температуре ниже 39, 0˚С, если они отсутствовали до и повторились в течение 1 года после прививки) АКДС, АДС ЖКВ, ЖПВ 3 дня 5 -15 дней Анафилактический шок
 Сроки развития серьезных вакцинальных осложнений Осложнение Вакцинация Сроки Тромбоцитопеническая пурпура ЖКВ, Краснушная, Тривакцина 7 -30 дней Хронический артрит Краснушная, Тривакцина 42 дня АС, АДС-М 2 -28 -й день Неврит плечевого нерва Паралитический полиомиелит (ВАП) q. У привитого здорового q. У привитого иммунодефицитного q. У контактного лица ОПВ 30 дней 6 мес. любой
Сроки развития серьезных вакцинальных осложнений Осложнение Вакцинация Сроки Тромбоцитопеническая пурпура ЖКВ, Краснушная, Тривакцина 7 -30 дней Хронический артрит Краснушная, Тривакцина 42 дня АС, АДС-М 2 -28 -й день Неврит плечевого нерва Паралитический полиомиелит (ВАП) q. У привитого здорового q. У привитого иммунодефицитного q. У контактного лица ОПВ 30 дней 6 мес. любой
 Сравнительные данные о частоте осложнений при заболевании некоторыми целевыми инфекциями и при вакцинации против них Осложнения Вакцины БЦЖ Виды осложнений При заболевании (на 100 тыс. случаев) При вакцинации (на 100 тыс. случаев) 0, 1 Остеит (остеомиелит) 0, 1 -30 Гнойный лимфаденит АКДС Диссеминированный туберкулез 100 -4300 Стойкие церебральные нарушения (коклюш) 600 -2000 0, 2 -0, 6 Энцефалит (энцефалопатия) 900 -4000 0, 1 -3, 0 Судороги 100 -8000 0, 3 -90, 0 Шок Летальный исход 0, 5 -30, 0 100 -4000 0, 2
Сравнительные данные о частоте осложнений при заболевании некоторыми целевыми инфекциями и при вакцинации против них Осложнения Вакцины БЦЖ Виды осложнений При заболевании (на 100 тыс. случаев) При вакцинации (на 100 тыс. случаев) 0, 1 Остеит (остеомиелит) 0, 1 -30 Гнойный лимфаденит АКДС Диссеминированный туберкулез 100 -4300 Стойкие церебральные нарушения (коклюш) 600 -2000 0, 2 -0, 6 Энцефалит (энцефалопатия) 900 -4000 0, 1 -3, 0 Судороги 100 -8000 0, 3 -90, 0 Шок Летальный исход 0, 5 -30, 0 100 -4000 0, 2
 Сравнительные данные о частоте осложнений при заболевании некоторыми целевыми инфекциями и при вакцинации против них Осложнения Вакцины Живая коревая вакцина Виды осложнений При заболевании (на 100 тыс. случаев) При вакцинации (на 100 тыс. случаев) Энцефалит (энцефалопатия) 50 -400 0, 1 Подострый склерозирующий панэнцефалит 0, 5 -2, 0 0, 05 -0, 1 Пневмония 3800 -7300 Судороги 500 -1000 0, 02 -190 Летальный исход 10 -10 000 0, 02 -0, 3 500 0, 1 Полиомиелит Паралитическая ная оральная форма живая полиомиелита вакцина
Сравнительные данные о частоте осложнений при заболевании некоторыми целевыми инфекциями и при вакцинации против них Осложнения Вакцины Живая коревая вакцина Виды осложнений При заболевании (на 100 тыс. случаев) При вакцинации (на 100 тыс. случаев) Энцефалит (энцефалопатия) 50 -400 0, 1 Подострый склерозирующий панэнцефалит 0, 5 -2, 0 0, 05 -0, 1 Пневмония 3800 -7300 Судороги 500 -1000 0, 02 -190 Летальный исход 10 -10 000 0, 02 -0, 3 500 0, 1 Полиомиелит Паралитическая ная оральная форма живая полиомиелита вакцина
 Хронические соматические болезни, для которых доказана ассоциация с микроорганизмами Патология Сердечно-сосудистая Болезнь Микроорганизм Вирус Коксаки В Вирус гепатита С Атеросклероз Репродукции Вирус гриппа Миокардит Обмена Вирус гриппа Инсульт Желудочно-кишечная Инфаркт Chlamydia pneumoniae Гастриты Язва желудка Язва двенадцатиперстной кишки Helicobacter pylori Диабет I типа (инсулинзависимый) Вирус краснухи Вирус паротита Вирус Коксаки В Орхит Вирус паротита
Хронические соматические болезни, для которых доказана ассоциация с микроорганизмами Патология Сердечно-сосудистая Болезнь Микроорганизм Вирус Коксаки В Вирус гепатита С Атеросклероз Репродукции Вирус гриппа Миокардит Обмена Вирус гриппа Инсульт Желудочно-кишечная Инфаркт Chlamydia pneumoniae Гастриты Язва желудка Язва двенадцатиперстной кишки Helicobacter pylori Диабет I типа (инсулинзависимый) Вирус краснухи Вирус паротита Вирус Коксаки В Орхит Вирус паротита
 Новообразования, ассоциируемые с инфекцией микроорганизмами Локализация новообразований Ассоциируемый патоген Доля (%)* Желудок: Аденокарцинома Helicobakter pylori Лимфома Наружные половые органы Вирус папиломы человека Печень: Вирус гепатита В Вирус гепатита С Гепатокарцинома 55 65** 87*** 73 27 * Опухолей, ассоциированных с патогенами ** В развитых странах *** В развивающихся странах
Новообразования, ассоциируемые с инфекцией микроорганизмами Локализация новообразований Ассоциируемый патоген Доля (%)* Желудок: Аденокарцинома Helicobakter pylori Лимфома Наружные половые органы Вирус папиломы человека Печень: Вирус гепатита В Вирус гепатита С Гепатокарцинома 55 65** 87*** 73 27 * Опухолей, ассоциированных с патогенами ** В развитых странах *** В развивающихся странах
 Вакцины с доказанной или предполагаемой способностью предупреждать развитие так называемых неинфекционных болезней Вакцина против Патология Эффект Гриппа Инсульт Инфаркт Доказан в период эпидемиологического подъема гриппа Гепатита В Гепатокарцинома Получены предварительные данные. Изучение продолжается Краснухи Ранний детский диабет Предполагается Паротита Мужское бесплодие Предполагается Вируса папиломы Рак шейки матки Проводятся клинические испытания
Вакцины с доказанной или предполагаемой способностью предупреждать развитие так называемых неинфекционных болезней Вакцина против Патология Эффект Гриппа Инсульт Инфаркт Доказан в период эпидемиологического подъема гриппа Гепатита В Гепатокарцинома Получены предварительные данные. Изучение продолжается Краснухи Ранний детский диабет Предполагается Паротита Мужское бесплодие Предполагается Вируса папиломы Рак шейки матки Проводятся клинические испытания
 Перспективы инженерии вакцин профилактических вакцин: терапевтических вакцин: - расширение спектра - развитие эффективных белков/эпитопов, входящих в -мультивалентных вакцин состав вакцины; -снижение стоимости вакцин -использование для широкого применения иммунодоминантных эпитопов, цитокинов и костимуляторных молекул - минимальные требования при хранении и доставке вакцин - комбинирование вакцин с другими лекарствами.
Перспективы инженерии вакцин профилактических вакцин: терапевтических вакцин: - расширение спектра - развитие эффективных белков/эпитопов, входящих в -мультивалентных вакцин состав вакцины; -снижение стоимости вакцин -использование для широкого применения иммунодоминантных эпитопов, цитокинов и костимуляторных молекул - минимальные требования при хранении и доставке вакцин - комбинирование вакцин с другими лекарствами.


