Лекция 1. АМУ.ppt
- Количество слайдов: 22
 Лекция 1 Предмет изучения химии. Атомно-молекулярное учение.
Лекция 1 Предмет изучения химии. Атомно-молекулярное учение.

 Химия наука о веществах, их строении, свойствах и взаимопревращениях. Вещество совокупность атомов и молекул, находящихся в определенном агрегатном состоянии n форма материи, обладающая массой покоя n
Химия наука о веществах, их строении, свойствах и взаимопревращениях. Вещество совокупность атомов и молекул, находящихся в определенном агрегатном состоянии n форма материи, обладающая массой покоя n
 «Если бы в результате какой-то мировой катастрофы все накопленные научные знания оказались бы уничтоженными и к грядущим поколениям живых существ перешла бы только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это – атомная гипотеза … все тела состоят из атомов – маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому. В одной этой фразе … содержится невероятное количество информации о мире, стоит лишь приложить к ней немного воображения и чуть соображения. . . » Ричард Фейнман
«Если бы в результате какой-то мировой катастрофы все накопленные научные знания оказались бы уничтоженными и к грядущим поколениям живых существ перешла бы только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это – атомная гипотеза … все тела состоят из атомов – маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому. В одной этой фразе … содержится невероятное количество информации о мире, стоит лишь приложить к ней немного воображения и чуть соображения. . . » Ричард Фейнман
 Атомистика - учение о прерывном строении материи основные этапы развития: -атомистика древних материалистов - до XVII в. -механистическая атомистика – XVII-XVIII вв. -химическая атомистика - XIX в. -современная физическая атомистика – XX в.
Атомистика - учение о прерывном строении материи основные этапы развития: -атомистика древних материалистов - до XVII в. -механистическая атомистика – XVII-XVIII вв. -химическая атомистика - XIX в. -современная физическая атомистика – XX в.
 Демокрит (460 -370 гг. до н. э. ) впервые употребил понятие атом (от греч. аtomos-неделимый) Каждый атом непроницаем и неделим, потому что не содержит пустот. Атомы могут лишь двигаться и сталкиваться друг с другом, иногда образуя соединения, когда им случается иметь пригодные к тому формы.
Демокрит (460 -370 гг. до н. э. ) впервые употребил понятие атом (от греч. аtomos-неделимый) Каждый атом непроницаем и неделим, потому что не содержит пустот. Атомы могут лишь двигаться и сталкиваться друг с другом, иногда образуя соединения, когда им случается иметь пригодные к тому формы.
 Атомистика древних материалистов • • • все состоит из атомов атомы физически неделимы между атомами в материи существует пустое пространство атомы неразрушимы и существуют вечно атомы всегда находятся в движении существует бесконечное количество как самих атомов, так и их разновидностей – атомы различаются формой и размерами
Атомистика древних материалистов • • • все состоит из атомов атомы физически неделимы между атомами в материи существует пустое пространство атомы неразрушимы и существуют вечно атомы всегда находятся в движении существует бесконечное количество как самих атомов, так и их разновидностей – атомы различаются формой и размерами
 Механистическая атомистика Роберт Бойль (25. 01. 1627 -30. 12. 1691) определил элементы как «первоначальные и простые вполне не смешенные тела, которые не составлены друг из друга, но представляют собой те составные части , из которых составлены все так называемые смешенные тела и на которые последние могут быть в конце концов разложены» .
Механистическая атомистика Роберт Бойль (25. 01. 1627 -30. 12. 1691) определил элементы как «первоначальные и простые вполне не смешенные тела, которые не составлены друг из друга, но представляют собой те составные части , из которых составлены все так называемые смешенные тела и на которые последние могут быть в конце концов разложены» .
 Закон Бойля–Мариотта 1662 1676 При постоянной температуре объём газа обратно пропорционален его давлению P 1 V 1 = P 2 V 2
Закон Бойля–Мариотта 1662 1676 При постоянной температуре объём газа обратно пропорционален его давлению P 1 V 1 = P 2 V 2
 Атомно-молекулярное учение М. В. Ломоносова «Элементы математической химии» , 1741 г. 1. 2. 3. 4. Все вещества состоят из молекул. Молекулы состоят из атомов. Молекулы простых веществ состоят из одинаковых атомов, сложных – из различных. Молекулы и атомы находятся в непрерывном движении.
Атомно-молекулярное учение М. В. Ломоносова «Элементы математической химии» , 1741 г. 1. 2. 3. 4. Все вещества состоят из молекул. Молекулы состоят из атомов. Молекулы простых веществ состоят из одинаковых атомов, сложных – из различных. Молекулы и атомы находятся в непрерывном движении.
 Атомистическая теория Джона Дальтона «Новая система химической философии» , 1808 г. 1. 2. 3. Атомы представляют собой мельчайшие частицы вещества, которые невозможно разделить на составные части, превратить друг в друга или уничтожить. При химических реакциях атомы соединяются друг с другом в простых целочисленных отношениях. При разложении соединения из него получаются исходные атомы в неизменном виде, которые могут затем образовывать тоже самое или другое соединение.
Атомистическая теория Джона Дальтона «Новая система химической философии» , 1808 г. 1. 2. 3. Атомы представляют собой мельчайшие частицы вещества, которые невозможно разделить на составные части, превратить друг в друга или уничтожить. При химических реакциях атомы соединяются друг с другом в простых целочисленных отношениях. При разложении соединения из него получаются исходные атомы в неизменном виде, которые могут затем образовывать тоже самое или другое соединение.
 Атомистическая теория Джона Дальтона «Новая система химической философии» , 1808 г. 4. 5. Все атомы одного элемента совершенно одинаковы и имеют одинаковый вес. Атомы различных элементов имеют различные веса. Относительные веса элементов, которые соединяются друг с другом, непосредственно связаны с весами атомов. Так, если 1 г серы соединяется с 2 г меди, то это означает, что каждый атом меди весит вдвое больше атома серы.
Атомистическая теория Джона Дальтона «Новая система химической философии» , 1808 г. 4. 5. Все атомы одного элемента совершенно одинаковы и имеют одинаковый вес. Атомы различных элементов имеют различные веса. Относительные веса элементов, которые соединяются друг с другом, непосредственно связаны с весами атомов. Так, если 1 г серы соединяется с 2 г меди, то это означает, что каждый атом меди весит вдвое больше атома серы.
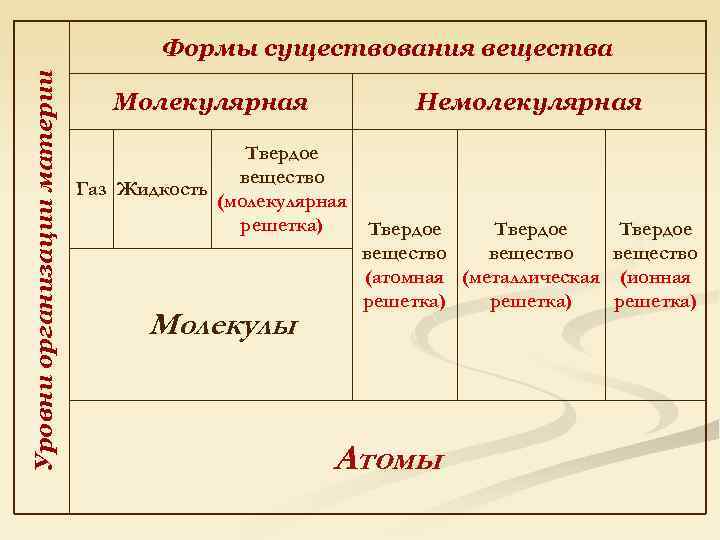 Уровни организации материи Формы существования вещества Молекулярная Немолекулярная Твердое вещество Газ Жидкость (молекулярная решетка) Молекулы Твердое вещество (атомная (металлическая (ионная решетка) Атомы
Уровни организации материи Формы существования вещества Молекулярная Немолекулярная Твердое вещество Газ Жидкость (молекулярная решетка) Молекулы Твердое вещество (атомная (металлическая (ионная решетка) Атомы
 Основные законы атомномолекулярного учения n n Закон сохранения массы Закон постоянства состава Закон объёмных отношений Закон Авогадро
Основные законы атомномолекулярного учения n n Закон сохранения массы Закон постоянства состава Закон объёмных отношений Закон Авогадро
 Основные законы атомно-молекулярного учения. Закон сохранения массы (закон Ломоносова-Лавуазье) Общая масса веществ, вступающих в химическую реакцию, равна общей массе продуктов реакции.
Основные законы атомно-молекулярного учения. Закон сохранения массы (закон Ломоносова-Лавуазье) Общая масса веществ, вступающих в химическую реакцию, равна общей массе продуктов реакции.
 Все перемены в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимается, столько же присовокупиться к другому. Так, ежели где убудет несколько материи, то умножится в другом месте… Михайло Ломоносов, 1760 г.
Все перемены в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимается, столько же присовокупиться к другому. Так, ежели где убудет несколько материи, то умножится в другом месте… Михайло Ломоносов, 1760 г.
 Основные законы атомно-молекулярного учения. Закон сохранения массы (закон Ломоносова-Лавуазье) Общая масса веществ, вступающих в химическую реакцию, равна общей массе продуктов реакции. • • • Михаил Васильевич Ломоносов, 1748 -1756 Антуан Лоран Лавуазье, 1789 Альберт Эйнштейн, 1905
Основные законы атомно-молекулярного учения. Закон сохранения массы (закон Ломоносова-Лавуазье) Общая масса веществ, вступающих в химическую реакцию, равна общей массе продуктов реакции. • • • Михаил Васильевич Ломоносов, 1748 -1756 Антуан Лоран Лавуазье, 1789 Альберт Эйнштейн, 1905
 Основные законы атомно-молекулярного учения. Закон постоянства состава, 1806 г. Соединения содержат элементы в строго определенных весовых пропорциях, независимо от способа получения. Жозеф Луи Пруст (1754 -1826)
Основные законы атомно-молекулярного учения. Закон постоянства состава, 1806 г. Соединения содержат элементы в строго определенных весовых пропорциях, независимо от способа получения. Жозеф Луи Пруст (1754 -1826)
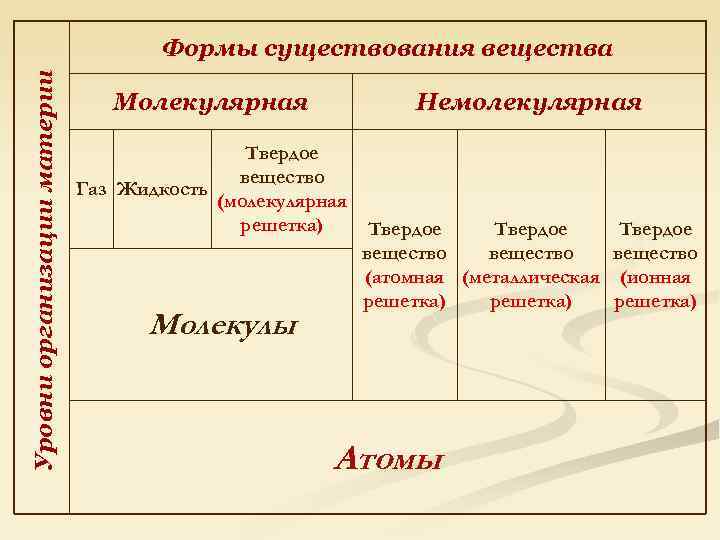 Уровни организации материи Формы существования вещества Молекулярная Немолекулярная Твердое вещество Газ Жидкость (молекулярная решетка) Молекулы Твердое вещество (атомная (металлическая (ионная решетка) Атомы
Уровни организации материи Формы существования вещества Молекулярная Немолекулярная Твердое вещество Газ Жидкость (молекулярная решетка) Молекулы Твердое вещество (атомная (металлическая (ионная решетка) Атомы
 Основные законы атомно-молекулярного учения. Закон объёмных отношений (закон Гей-Люссака, 1808 г. ) Джозеф Луи Гей-Люссак (1778 -1850) При неизменных температуре и давлении объёмы реагирующих газов относятся друг к другу, а также к объёмам образующихся газообразных продуктов, как небольшие целые числа.
Основные законы атомно-молекулярного учения. Закон объёмных отношений (закон Гей-Люссака, 1808 г. ) Джозеф Луи Гей-Люссак (1778 -1850) При неизменных температуре и давлении объёмы реагирующих газов относятся друг к другу, а также к объёмам образующихся газообразных продуктов, как небольшие целые числа.
 Основные законы атомно-молекулярного учения. Закон Авогадро, 1811 г. В равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое количество молекул. Амедео. Авогадро (1776 -1856)
Основные законы атомно-молекулярного учения. Закон Авогадро, 1811 г. В равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое количество молекул. Амедео. Авогадро (1776 -1856)
 Атомно-молекулярная теория I Всемирный химический конгресс, 1860 г 1. 2. 3. 4. Станислао Канниццаро (1826 -1910) Все вещества состоят из молекул. Молекула – наименьшая частица вещества, обладающая его химическими свойствами. Молекулы состоят из атомов. Атом – наименьшая частица элемента в химическом соединении. Различным элементам соответствуют различные атомы. Молекулы и атомы находятся в непрерывном движении. При химических реакциях молекулы одних веществ превращаются в молекулы других веществ. Атомы в химических реакциях не изменяются.
Атомно-молекулярная теория I Всемирный химический конгресс, 1860 г 1. 2. 3. 4. Станислао Канниццаро (1826 -1910) Все вещества состоят из молекул. Молекула – наименьшая частица вещества, обладающая его химическими свойствами. Молекулы состоят из атомов. Атом – наименьшая частица элемента в химическом соединении. Различным элементам соответствуют различные атомы. Молекулы и атомы находятся в непрерывном движении. При химических реакциях молекулы одних веществ превращаются в молекулы других веществ. Атомы в химических реакциях не изменяются.


