ORGAN_himia1.pptx
- Количество слайдов: 32
 Лекция № 1 Основы строения органических соединений. Органическая химия соединения углерода в настоящее время их насчитывается более 7. млн. и классифицируется с учетом строения углеродной цепи( углеродного скелета и присутствующих в молекуле функциональных групп). По строению углеродной цепи органические соединения делятся на 2 типа – ациклические и циклические. Ациклические соединения жирного ряда с открытой( не замкнутой) углеродной цепью. Их основу составляют алифатические углеводороды. Алифатические углеводороды содержат только атомы углерода или водорода и могут быть насыщенными, предельными( алканы ) не насыщенными не предельные( алкены, алкадиены, алкины )
Лекция № 1 Основы строения органических соединений. Органическая химия соединения углерода в настоящее время их насчитывается более 7. млн. и классифицируется с учетом строения углеродной цепи( углеродного скелета и присутствующих в молекуле функциональных групп). По строению углеродной цепи органические соединения делятся на 2 типа – ациклические и циклические. Ациклические соединения жирного ряда с открытой( не замкнутой) углеродной цепью. Их основу составляют алифатические углеводороды. Алифатические углеводороды содержат только атомы углерода или водорода и могут быть насыщенными, предельными( алканы ) не насыщенными не предельные( алкены, алкадиены, алкины )
 Для их изображения используют так называемые структурные формулы. Структурной формулой называют изображение при помощи химических символов последовательности связей атомов в молекуле. Структурная формула может быть графической и отражать строение молекулы на плоскости без учета пространственного строения и стереометрической. Циклические соединения – соединения с замкнутой цепью. В зависимости от природы атомов составляющих цикл их делят на карбоциклические и гетероциклические.
Для их изображения используют так называемые структурные формулы. Структурной формулой называют изображение при помощи химических символов последовательности связей атомов в молекуле. Структурная формула может быть графической и отражать строение молекулы на плоскости без учета пространственного строения и стереометрической. Циклические соединения – соединения с замкнутой цепью. В зависимости от природы атомов составляющих цикл их делят на карбоциклические и гетероциклические.
 Кормбоциклические соединения содержат в цикле только атомы углерода и делятся на 2 существенно различающиеся по химическим свойствам группы: алифатические циклические (алициклические) и ароматические основу которых составляют соответствующие ароматические углеводороды. Простейшим представителем насыщенных алициклических углеводородов служит цикло пропан содержащий трехчленный цикл. Число атомов углерода в циклах может быть различным. Известны большие циклы состоящие из 30 и более атомов углерода. Ароматические углеводороды(арены) содержат бензольное кольцо(бензол). Нафталин и фенантрен относят к полициклическим аренам они содержат конденсированные кольца. Гетеро циклические соединения содержат в цикле кроме атомов углерода один или несколько атомов других элементов, гетеро атомов ( О 2 N 2 S) гетероциклические соединения могут быть: насыщенными ненасыщенными а и ароматическими. Все органические соединения можно рассматривать как углеводороды указанного строения или производные углеводородов полученные путем введения в них функциональных групп
Кормбоциклические соединения содержат в цикле только атомы углерода и делятся на 2 существенно различающиеся по химическим свойствам группы: алифатические циклические (алициклические) и ароматические основу которых составляют соответствующие ароматические углеводороды. Простейшим представителем насыщенных алициклических углеводородов служит цикло пропан содержащий трехчленный цикл. Число атомов углерода в циклах может быть различным. Известны большие циклы состоящие из 30 и более атомов углерода. Ароматические углеводороды(арены) содержат бензольное кольцо(бензол). Нафталин и фенантрен относят к полициклическим аренам они содержат конденсированные кольца. Гетеро циклические соединения содержат в цикле кроме атомов углерода один или несколько атомов других элементов, гетеро атомов ( О 2 N 2 S) гетероциклические соединения могут быть: насыщенными ненасыщенными а и ароматическими. Все органические соединения можно рассматривать как углеводороды указанного строения или производные углеводородов полученные путем введения в них функциональных групп
 Функциональная группа это заместители не углеводороного характера, определяющие принадлежность веществ к определенному классу и одновременно его типичные химические св ва. В зависимости от природы функциональных групп производные углеводородов делят на классы. Соединения каждого класса можно расположить в виде гомологического ряда. Понятие о гомологичных рядах Гомологичный ряд группа родственных органических соединений, обладающая одинаковыми свойствами и однотипной структурой, каждый последующий член которой отличается от предыдущего на одну метиловую группу –СН 2 (гомологическая разность). Любой (кроме первого) член гомологического ряда можно рассматривать как производное от более простого, чаще всего от первого начального соединения в которое введены заместители углеводородные радикалы и функциональные группы.
Функциональная группа это заместители не углеводороного характера, определяющие принадлежность веществ к определенному классу и одновременно его типичные химические св ва. В зависимости от природы функциональных групп производные углеводородов делят на классы. Соединения каждого класса можно расположить в виде гомологического ряда. Понятие о гомологичных рядах Гомологичный ряд группа родственных органических соединений, обладающая одинаковыми свойствами и однотипной структурой, каждый последующий член которой отличается от предыдущего на одну метиловую группу –СН 2 (гомологическая разность). Любой (кроме первого) член гомологического ряда можно рассматривать как производное от более простого, чаще всего от первого начального соединения в которое введены заместители углеводородные радикалы и функциональные группы.
 Взаимное влияние атомов в органических молекулах. Сопряжение. Ароматичность. Электронные эффекты заместителей. 1)На реакционную способность органических соединений существенное влияние оказывает возможность перераспределения (делокализация) электронной плотности в молекулах, приводящее к стабилизации молекулы. Это явление получило название СОПРЯЖЕНИЕ. 2) Сопряжение – это явление выравнивания связей и зарядов в реальной молекуле, по сравнению с идеальной, но несуществующей структурой.
Взаимное влияние атомов в органических молекулах. Сопряжение. Ароматичность. Электронные эффекты заместителей. 1)На реакционную способность органических соединений существенное влияние оказывает возможность перераспределения (делокализация) электронной плотности в молекулах, приводящее к стабилизации молекулы. Это явление получило название СОПРЯЖЕНИЕ. 2) Сопряжение – это явление выравнивания связей и зарядов в реальной молекуле, по сравнению с идеальной, но несуществующей структурой.
 Различают π, π сопряжение и p, π сопряжение. Они имеют место, как в открытых , так и в замкнутых системах. π, π – сопряжение – это система с чередующимися двойными и одинарными связями. Минимальным фрагментом такой системы является С=С–С=С р, π – сопряженная система, это система, в которой рядом с π связью имеется гетероатом (х) с неподеленной электронной парой. С=С-Ẍ I. Сопряжение системы с открытой цепью сопряжения.
Различают π, π сопряжение и p, π сопряжение. Они имеют место, как в открытых , так и в замкнутых системах. π, π – сопряжение – это система с чередующимися двойными и одинарными связями. Минимальным фрагментом такой системы является С=С–С=С р, π – сопряженная система, это система, в которой рядом с π связью имеется гетероатом (х) с неподеленной электронной парой. С=С-Ẍ I. Сопряжение системы с открытой цепью сопряжения.
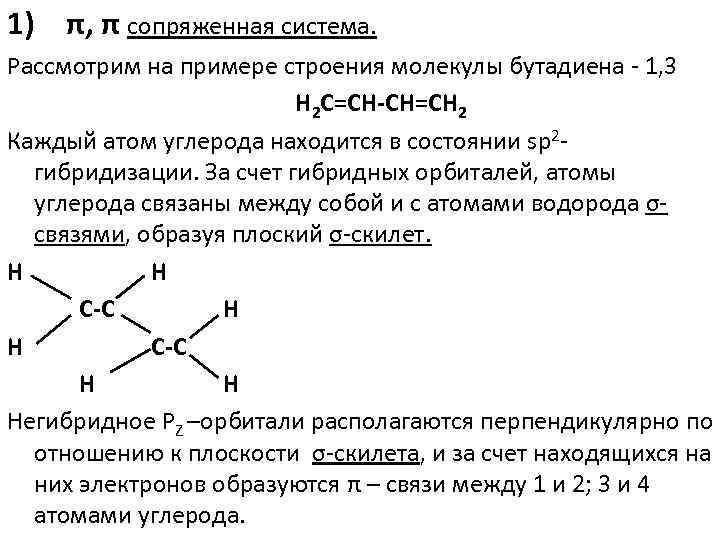 1) π, π сопряженная система. Рассмотрим на примере строения молекулы бутадиена 1, 3 Н 2 С=СН-СН=СН 2 Каждый атом углерода находится в состоянии sp 2 гибридизации. За счет гибридных орбиталей, атомы углерода связаны между собой и с атомами водорода σ связями, образуя плоский σ скилет. Н Н С-С Н Н Негибридное РZ –орбитали располагаются перпендикулярно по отношению к плоскости σ скилета, и за счет находящихся на них электронов образуются π – связи между 1 и 2; 3 и 4 атомами углерода.
1) π, π сопряженная система. Рассмотрим на примере строения молекулы бутадиена 1, 3 Н 2 С=СН-СН=СН 2 Каждый атом углерода находится в состоянии sp 2 гибридизации. За счет гибридных орбиталей, атомы углерода связаны между собой и с атомами водорода σ связями, образуя плоский σ скилет. Н Н С-С Н Н Негибридное РZ –орбитали располагаются перпендикулярно по отношению к плоскости σ скилета, и за счет находящихся на них электронов образуются π – связи между 1 и 2; 3 и 4 атомами углерода.
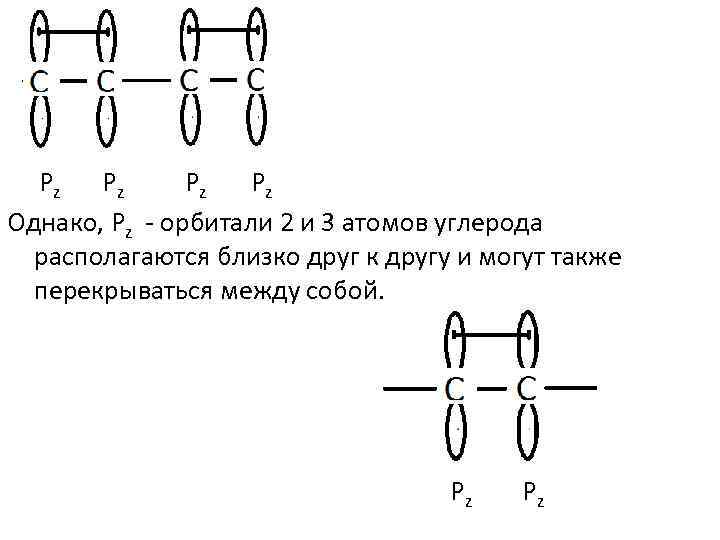 Р z Рz Рz Рz Однако, Рz орбитали 2 и 3 атомов углерода располагаются близко друг к другу и могут также перекрываться между собой. Pz Pz
Р z Рz Рz Рz Однако, Рz орбитали 2 и 3 атомов углерода располагаются близко друг к другу и могут также перекрываться между собой. Pz Pz
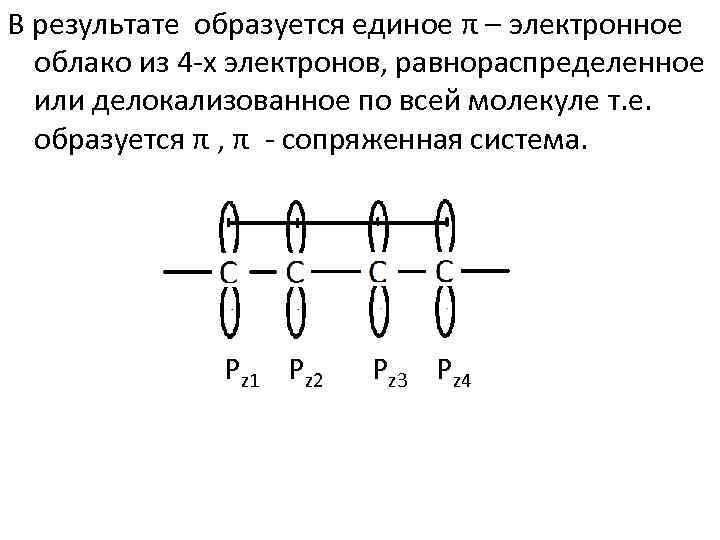 В результате образуется единое π – электронное облако из 4 х электронов, равнораспределенное или делокализованное по всей молекуле т. е. образуется π , π сопряженная система. Pz 1 Pz 2 Pz 3 Pz 4
В результате образуется единое π – электронное облако из 4 х электронов, равнораспределенное или делокализованное по всей молекуле т. е. образуется π , π сопряженная система. Pz 1 Pz 2 Pz 3 Pz 4
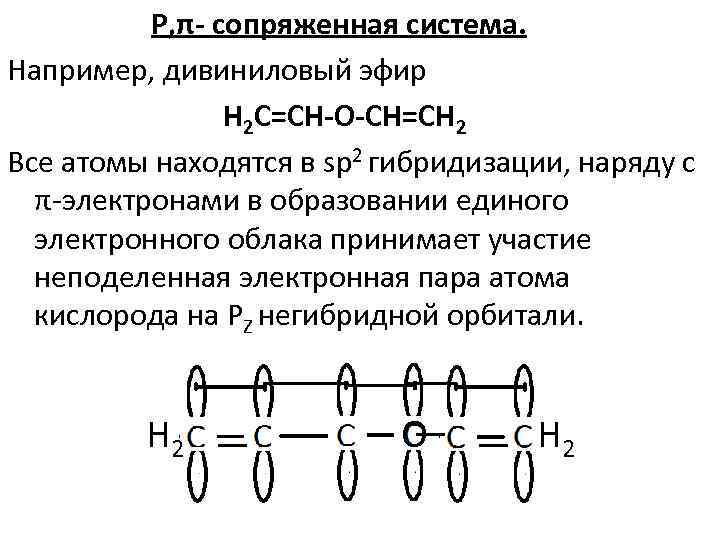 Р, π- сопряженная система. Например, дивиниловый эфир Н 2 С=СН-О-СН=СН 2 Все атомы находятся в sp 2 гибридизации, наряду с π электронами в образовании единого электронного облака принимает участие неподеленная электронная пара атома кислорода на РZ негибридной орбитали. Н 2 О Н 2
Р, π- сопряженная система. Например, дивиниловый эфир Н 2 С=СН-О-СН=СН 2 Все атомы находятся в sp 2 гибридизации, наряду с π электронами в образовании единого электронного облака принимает участие неподеленная электронная пара атома кислорода на РZ негибридной орбитали. Н 2 О Н 2
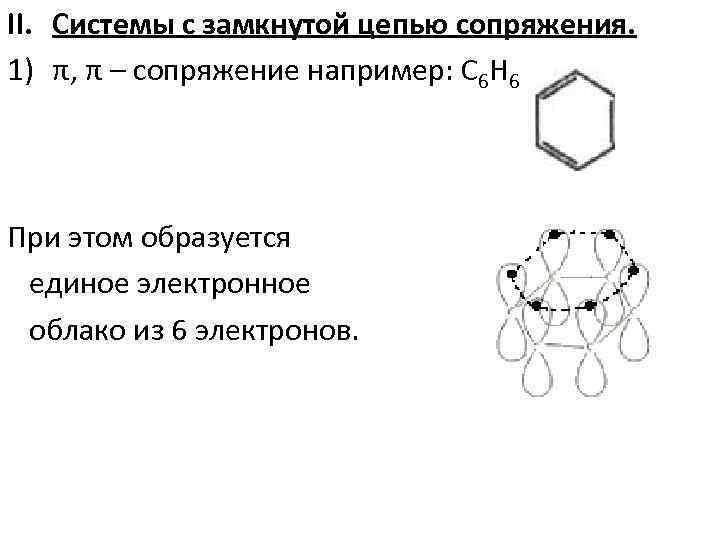 II. Системы с замкнутой цепью сопряжения. 1) π, π – сопряжение например: С 6 Н 6 При этом образуется единое электронное облако из 6 электронов.
II. Системы с замкнутой цепью сопряжения. 1) π, π – сопряжение например: С 6 Н 6 При этом образуется единое электронное облако из 6 электронов.
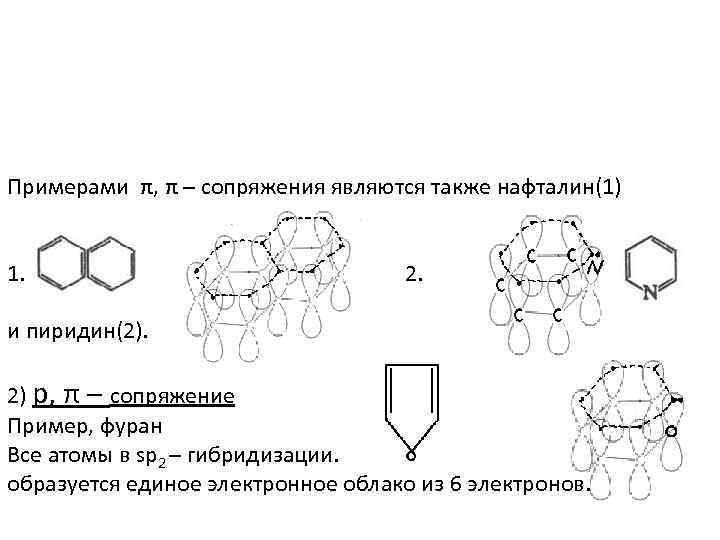 Примерами π, π – сопряжения являются также нафталин(1) 1. 2. и пиридин(2). 2) р, π – сопряжение Пример, фуран Все атомы в sp 2 – гибридизации. образуется единое электронное облако из 6 электронов.
Примерами π, π – сопряжения являются также нафталин(1) 1. 2. и пиридин(2). 2) р, π – сопряжение Пример, фуран Все атомы в sp 2 – гибридизации. образуется единое электронное облако из 6 электронов.
 Примерами р, π – сопряжения являются также: Тиофен и пиррол S N H О термодинамической устойчивости молекул, имеющих сопряженную систему, судят по величине энергии сопряжения, которую расчитывают по формуле: Е = Е н – Еs где, E – энергия сопряжения, которая выделяется при образовании сопряженной системы из несопряженной, выражается в [ к. ДЖ * Моль-1 ]; Ен - полная π – электронная энергия несопряженной системы;
Примерами р, π – сопряжения являются также: Тиофен и пиррол S N H О термодинамической устойчивости молекул, имеющих сопряженную систему, судят по величине энергии сопряжения, которую расчитывают по формуле: Е = Е н – Еs где, E – энергия сопряжения, которая выделяется при образовании сопряженной системы из несопряженной, выражается в [ к. ДЖ * Моль-1 ]; Ен - полная π – электронная энергия несопряженной системы;
 Еs – полная, π – элетронная энергия сопряженной системы Ен несопряженная система Е Еs сопряженная система Чем длиннее цепь сопряжения, тем выше энергия сопряжения и стабильнее молекула. Пример, Е(с6 н 6) = 150, 6 к. ДЖ * Моль 1 Е(сн 2=н сн=сн 2) = 15 к. ДЖ * Моль 1
Еs – полная, π – элетронная энергия сопряженной системы Ен несопряженная система Е Еs сопряженная система Чем длиннее цепь сопряжения, тем выше энергия сопряжения и стабильнее молекула. Пример, Е(с6 н 6) = 150, 6 к. ДЖ * Моль 1 Е(сн 2=н сн=сн 2) = 15 к. ДЖ * Моль 1
 Ароматичность. Ароматическими называют циклические соединения, имеющую замкнутую сопряженную систему, единое электронное облако которого, делокализованно на всех атомах цикла. Ароматические соединения отличаются высокими значениями энергии сопряжения и, в следствии этого, высокой темоденамической устойчивостью. Критерии ароматичности по Хюккелю, (1931 г. ): 1. Молекулы имеют циклическое строение. 2. Все атомы цикла находятся в строении sp 2 гибридизации, соединяясь между собой σ – связями. Они образуют плоский σ – скелет.
Ароматичность. Ароматическими называют циклические соединения, имеющую замкнутую сопряженную систему, единое электронное облако которого, делокализованно на всех атомах цикла. Ароматические соединения отличаются высокими значениями энергии сопряжения и, в следствии этого, высокой темоденамической устойчивостью. Критерии ароматичности по Хюккелю, (1931 г. ): 1. Молекулы имеют циклическое строение. 2. Все атомы цикла находятся в строении sp 2 гибридизации, соединяясь между собой σ – связями. Они образуют плоский σ – скелет.
 Негибридные pz – орбитали располагаясь перпендикулярно по отношению к плоскости σ – скелета, и параллельно по отношению друга, что создает условия для их взаимного перекрывания. 3. Врезультате взаимного перекрывания pz – орбиталей возникает единое замкнутое сопряженное электронное облако, делокализованное на всех атомах цикла, при этом число электронов удовлетворяет “правилу Хюккеля”: 4 n + 2 = 6 (π – е), где n – принадлежит ряду натуральных чисел n = 0, 1, 2, 3… 1. Ароматичность бензоидных соединений или аренов. 1. Пример: C 6 H 6 – бензол Цикл sp 2 гибридизация 4 n+2=6 n=1, что удовлетворяет правилу Хюккеля.
Негибридные pz – орбитали располагаясь перпендикулярно по отношению к плоскости σ – скелета, и параллельно по отношению друга, что создает условия для их взаимного перекрывания. 3. Врезультате взаимного перекрывания pz – орбиталей возникает единое замкнутое сопряженное электронное облако, делокализованное на всех атомах цикла, при этом число электронов удовлетворяет “правилу Хюккеля”: 4 n + 2 = 6 (π – е), где n – принадлежит ряду натуральных чисел n = 0, 1, 2, 3… 1. Ароматичность бензоидных соединений или аренов. 1. Пример: C 6 H 6 – бензол Цикл sp 2 гибридизация 4 n+2=6 n=1, что удовлетворяет правилу Хюккеля.
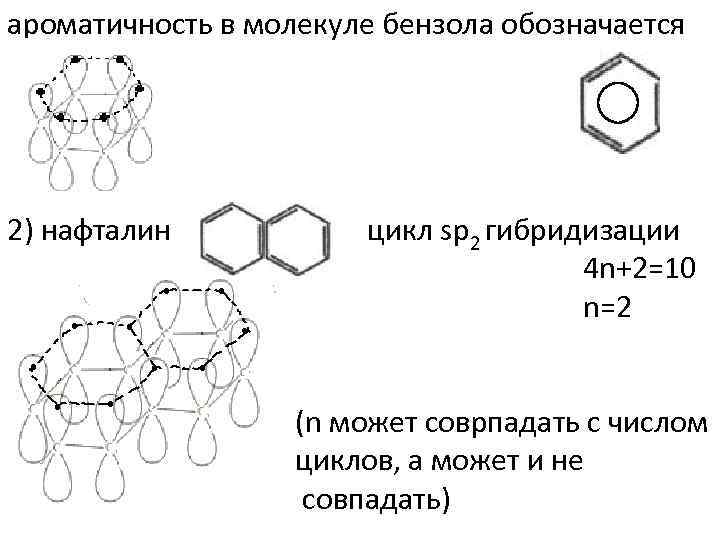 ароматичность в молекуле бензола обозначается 2) нафталин цикл sp 2 гибридизации 4 n+2=10 n=2 (n может соврпадать с числом циклов, а может и не совпадать)
ароматичность в молекуле бензола обозначается 2) нафталин цикл sp 2 гибридизации 4 n+2=10 n=2 (n может соврпадать с числом циклов, а может и не совпадать)
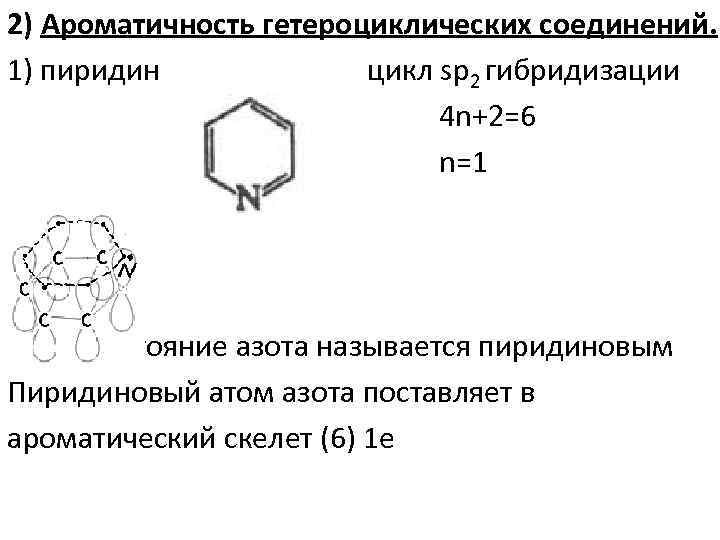 2) Ароматичность гетероциклических соединений. 1) пиридин цикл sp 2 гибридизации 4 n+2=6 n=1 такое состояние азота называется пиридиновым Пиридиновый атом азота поставляет в ароматический скелет (6) 1 e
2) Ароматичность гетероциклических соединений. 1) пиридин цикл sp 2 гибридизации 4 n+2=6 n=1 такое состояние азота называется пиридиновым Пиридиновый атом азота поставляет в ароматический скелет (6) 1 e
 При этом неподеленная пара электронов находится на одной из гибридных орбиталей в плоскости цикла и принимает участие в образовании единого электронного облака =N- 4 n+2=6 4 n=4 n=1
При этом неподеленная пара электронов находится на одной из гибридных орбиталей в плоскости цикла и принимает участие в образовании единого электронного облака =N- 4 n+2=6 4 n=4 n=1
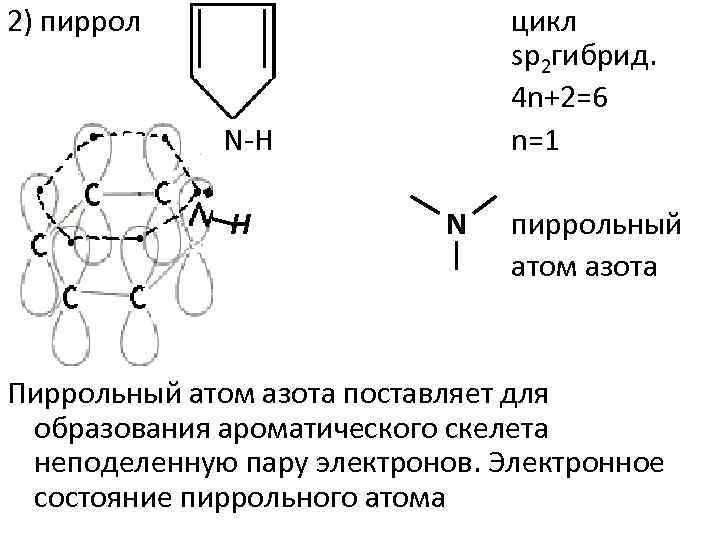 2) пиррол цикл sp 2 гибрид. 4 n+2=6 n=1 N H H N пиррольный атом азота Пиррольный атом азота поставляет для образования ароматического скелета неподеленную пару электронов. Электронное состояние пиррольного атома
2) пиррол цикл sp 2 гибрид. 4 n+2=6 n=1 N H H N пиррольный атом азота Пиррольный атом азота поставляет для образования ароматического скелета неподеленную пару электронов. Электронное состояние пиррольного атома
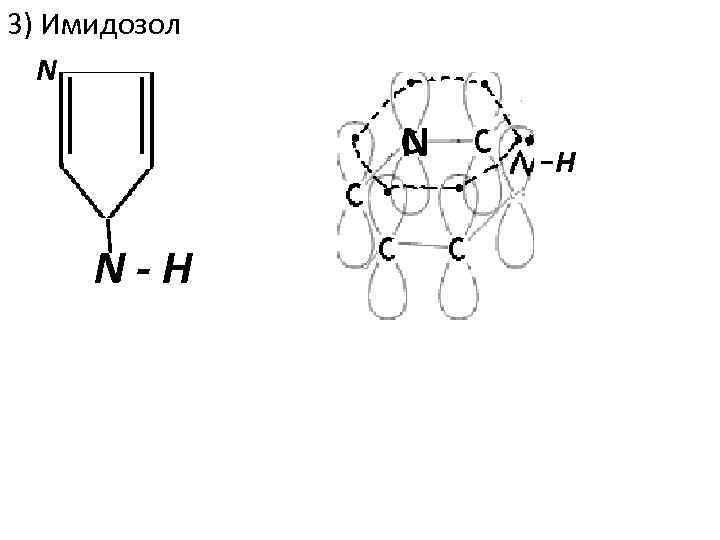 3) Имидозол N N N-H H
3) Имидозол N N N-H H
 Электронные эффекты заместителей. Наличие в молекулах органических соединений заместителей: n – CL, OH, NH 2 C=O H Приводит к поляризации ковалентных связей. Заместитель таким образом может смещать электронную плотность либо на себя, т. е проявлять акцепторные св ва либо от себя, являясь донором
Электронные эффекты заместителей. Наличие в молекулах органических соединений заместителей: n – CL, OH, NH 2 C=O H Приводит к поляризации ковалентных связей. Заместитель таким образом может смещать электронную плотность либо на себя, т. е проявлять акцепторные св ва либо от себя, являясь донором
 Различают 1) Индуктивный эффект (±J) 2) Мезомерный эффект (±М) Знак « » указывает на электроно акцепторные св ва(ЭА); Знак «+» указывает на электроно – донорные св ва (ЭД) Индуктивный эффект – это передача электронного влияния заместителя по цепи одинарных σ связей он имеет место в молекулах где есть атомы с различной электроотрицательностью (ЭО). Обозначается стрелкой вдоль σ связи, ( ), острие которой указывает в сторону более ЭО атома.
Различают 1) Индуктивный эффект (±J) 2) Мезомерный эффект (±М) Знак « » указывает на электроно акцепторные св ва(ЭА); Знак «+» указывает на электроно – донорные св ва (ЭД) Индуктивный эффект – это передача электронного влияния заместителя по цепи одинарных σ связей он имеет место в молекулах где есть атомы с различной электроотрицательностью (ЭО). Обозначается стрелкой вдоль σ связи, ( ), острие которой указывает в сторону более ЭО атома.
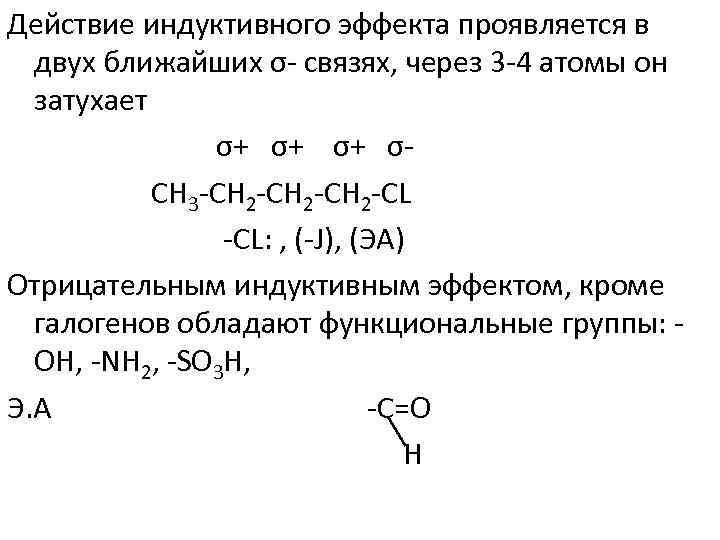 Действие индуктивного эффекта проявляется в двух ближайших σ связях, через 3 4 атомы он затухает σ+ σ+ σ+ σ СН 3 СН 2 СL CL: , ( J), (ЭА) Отрицательным индуктивным эффектом, кроме галогенов обладают функциональные группы: ОН, NH 2, SO 3 H, Э. А С=О Н
Действие индуктивного эффекта проявляется в двух ближайших σ связях, через 3 4 атомы он затухает σ+ σ+ σ+ σ СН 3 СН 2 СL CL: , ( J), (ЭА) Отрицательным индуктивным эффектом, кроме галогенов обладают функциональные группы: ОН, NH 2, SO 3 H, Э. А С=О Н
 Положительный индуктивный эффект n=>, т. е ЭД характер проявляют алкидные радикалы: CH 3, C 2 H 5, и Т. Д. а также металлы Na, K… Мезомерный эффект – это передача электронного влияния заместителя по сопряженной системе. Его обозначают изогнутой стрелкой, начало которой показывает, какие Р и π электроны смещаются, а конец стрелки – куда они смещаются. Положительным мезомерным эффектом обладает заместители содержавшие атом с не поделенной парой электронов, или целым отрицательным зарядом. Пр. : OH; NH О. 2,
Положительный индуктивный эффект n=>, т. е ЭД характер проявляют алкидные радикалы: CH 3, C 2 H 5, и Т. Д. а также металлы Na, K… Мезомерный эффект – это передача электронного влияния заместителя по сопряженной системе. Его обозначают изогнутой стрелкой, начало которой показывает, какие Р и π электроны смещаются, а конец стрелки – куда они смещаются. Положительным мезомерным эффектом обладает заместители содержавшие атом с не поделенной парой электронов, или целым отрицательным зарядом. Пр. : OH; NH О. 2,
 Такие заместители повышают электрон. Плотность в электронной системе. С=ОН , О=S=О Н ОН С=О N O Э. А. ОН О Такие заместители оттягивают электрон. Плотность из сопряженной системы. Мезомерный эффект передает по всей системе без затухания. Он оказывает более сильное влияние на характер заместителей чем индивидуальный эффект. (за исключением галогенов. )
Такие заместители повышают электрон. Плотность в электронной системе. С=ОН , О=S=О Н ОН С=О N O Э. А. ОН О Такие заместители оттягивают электрон. Плотность из сопряженной системы. Мезомерный эффект передает по всей системе без затухания. Он оказывает более сильное влияние на характер заместителей чем индивидуальный эффект. (за исключением галогенов. )
 Пр. : 1) парааминобензойная кислота С=O J, M (Э. А) ОН NH 2 J, +M +M>> J (Э. Д. ) 2) Хлорвинил ÖH CH 2=CH CL: H CL J, M C=O J>>+M (Э. А) C=O OH . . NH 2 +M M OH C=O NH 2
Пр. : 1) парааминобензойная кислота С=O J, M (Э. А) ОН NH 2 J, +M +M>> J (Э. Д. ) 2) Хлорвинил ÖH CH 2=CH CL: H CL J, M C=O J>>+M (Э. А) C=O OH . . NH 2 +M M OH C=O NH 2
 Лекция № 2 Изомерия органических соединений. Изомерия – это явление при которой, вещества имеют одинаковый количественный состав, молекулярную массу, но отличаются химическим строением или пространственным расположением атомов или групп атомов. Изомерия делится на два основных вида: 1) Структурную изомерию 2) Пространственную изомерию или стереометрию. Структурная изомерия включает в себя следующие виды изомерии: 1) изомерия углеродной цепи а) n бутан б) изобутан
Лекция № 2 Изомерия органических соединений. Изомерия – это явление при которой, вещества имеют одинаковый количественный состав, молекулярную массу, но отличаются химическим строением или пространственным расположением атомов или групп атомов. Изомерия делится на два основных вида: 1) Структурную изомерию 2) Пространственную изомерию или стереометрию. Структурная изомерия включает в себя следующие виды изомерии: 1) изомерия углеродной цепи а) n бутан б) изобутан
 2) Изомерия положения кратных связей а) пентен 1 б) пентен 2 3) Изомерия положения функциональных групп. а) пропан 1 б)пропан 2 4) Межклассовая изомерия При этом, одной и той же имперической формуле соответствуют предстаdители разных классов органических соединений. С 2 Н 6 О а) диметиловый эфир б) этанол Пространственная или стереоизомерия, включает следующие виды изомерии: 1)Конформационная изомерия 2) Энантиомерия (оптическая изомерия) 3) Диастереомерия а) σ диастереомерия б) π диастереомерия
2) Изомерия положения кратных связей а) пентен 1 б) пентен 2 3) Изомерия положения функциональных групп. а) пропан 1 б)пропан 2 4) Межклассовая изомерия При этом, одной и той же имперической формуле соответствуют предстаdители разных классов органических соединений. С 2 Н 6 О а) диметиловый эфир б) этанол Пространственная или стереоизомерия, включает следующие виды изомерии: 1)Конформационная изомерия 2) Энантиомерия (оптическая изомерия) 3) Диастереомерия а) σ диастереомерия б) π диастереомерия
 Этантиомерия(оптическая изомерия) возможна у любых органических соединений, содержащих ассиметрический атом углерода. Ассиметрическим – называется атом углерода, соединенный с четырьмя различными атомами или группами атомов. Пр: молочная кислота СООН Н С ОН СН 3 Молекулы веществ, содержащих ассиметричный атом углерода, называются хиральными, а сам ассиметричный атом углерода, находящийся в состоянии sp 3 гибридизации, называется хиральным центром.
Этантиомерия(оптическая изомерия) возможна у любых органических соединений, содержащих ассиметрический атом углерода. Ассиметрическим – называется атом углерода, соединенный с четырьмя различными атомами или группами атомов. Пр: молочная кислота СООН Н С ОН СН 3 Молекулы веществ, содержащих ассиметричный атом углерода, называются хиральными, а сам ассиметричный атом углерода, находящийся в состоянии sp 3 гибридизации, называется хиральным центром.
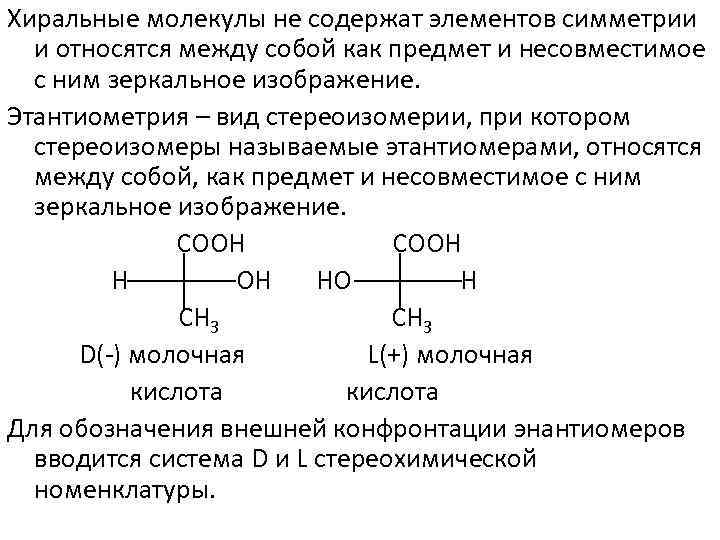 Хиральные молекулы не содержат элементов симметрии и относятся между собой как предмет и несовместимое с ним зеркальное изображение. Этантиометрия – вид стереоизомерии, при котором стереоизомеры называемые этантиомерами, относятся между собой, как предмет и несовместимое с ним зеркальное изображение. СООН НО Н СН 3 D( ) молочная L(+) молочная кислота Для обозначения внешней конфронтации энантиомеров вводится система D и L стереохимической номенклатуры.
Хиральные молекулы не содержат элементов симметрии и относятся между собой как предмет и несовместимое с ним зеркальное изображение. Этантиометрия – вид стереоизомерии, при котором стереоизомеры называемые этантиомерами, относятся между собой, как предмет и несовместимое с ним зеркальное изображение. СООН НО Н СН 3 D( ) молочная L(+) молочная кислота Для обозначения внешней конфронтации энантиомеров вводится система D и L стереохимической номенклатуры.
 D – формула – это энантиомер, в котором заместитель, соединенный с хиральным центром, записывается справа по отношению к углеродной цепи, L – формула – слева Это характерно для энантиомеров с одним хиральным центром. Энантиомеры обладают оптической активностью. Они способны вращать плоскость поляризации света. Оптическая активность энантиомеров определяется на приборе – поляриметре, в котором луч света пройдя через специальную призму, колеблется только в данной плоскости и становится плоскополяризованным
D – формула – это энантиомер, в котором заместитель, соединенный с хиральным центром, записывается справа по отношению к углеродной цепи, L – формула – слева Это характерно для энантиомеров с одним хиральным центром. Энантиомеры обладают оптической активностью. Они способны вращать плоскость поляризации света. Оптическая активность энантиомеров определяется на приборе – поляриметре, в котором луч света пройдя через специальную призму, колеблется только в данной плоскости и становится плоскополяризованным


