00 Пластовая вода.ppt
- Количество слайдов: 51
 Лекция 1. Нефтяная гидрогеология Подземные флюиды (разные по составу, но одинаковые по чуткости к обстановке, размерности параметров состава и качества) Подземная вода и её компоненты и свойства Пластовая нефть Подземный газ Фазовые состояния пластовых флюидов Особенности подземной воды Особенности пластовой нефти Особенности подземного газа Взаимодействие флюидов между собой Место встречи промысловая классификация вод Гетерогенное взаимодействие Вода пластовая нефть Вода – подземный газ Осадочные, артезианские и нефтегазоносные бассейны Структура бассейнов Водоупоры, коллектора, ОВ Гидродинамические и температурные зональности Гидрохимия Источники воды – источники давления
Лекция 1. Нефтяная гидрогеология Подземные флюиды (разные по составу, но одинаковые по чуткости к обстановке, размерности параметров состава и качества) Подземная вода и её компоненты и свойства Пластовая нефть Подземный газ Фазовые состояния пластовых флюидов Особенности подземной воды Особенности пластовой нефти Особенности подземного газа Взаимодействие флюидов между собой Место встречи промысловая классификация вод Гетерогенное взаимодействие Вода пластовая нефть Вода – подземный газ Осадочные, артезианские и нефтегазоносные бассейны Структура бассейнов Водоупоры, коллектора, ОВ Гидродинамические и температурные зональности Гидрохимия Источники воды – источники давления
 Литература 1. Воды нефтяных и газовых месторождений СССР. Под ред. Л. М. Зорькина, М. , Недра, 1989 2. Гидрогеологические условия формирования и размещения нефтяных и газовых месторождений Волго‒Уральской области. М. , Недра, 1973, 280 с. 3. Гуревич А. Е. Практическое руководство по изучению движения подземных вод при поисках полезных ископаемых. Недра, 1980 4. Гуревич А. Е. , Капченко Л. Н. , Кругликов Н. М. Теоретические основы нефтяной гидрогеологии, 1972 5. Зорькин Л. М. Геохимия газов пластовых вод нефтегазовых бассейнов. М. , Недра, 1973. 6. Зорькин Л. М. Гидрохимические условия нефтегазообразовния и нефтегазонакопления 7. Зорькин Л. М. , Суббота М. И. , Стадник Е. В. Нефтегазопоисковая гидрогеология. М. , Недра, 1982. 8. Капченко Л. Н. Гидрогеологические основы теории нефтегазонакопления. Л. , Недра, 1983 9. Капченко Л. Н. Гидрогеологические условия формирования, сохранения и разрушения залежей нефти и газа. Л. , Недра, 1974 10. Карцев А. А. Гидрогеология нефтяных и газовых месторождений. М. , Недра, 1972
Литература 1. Воды нефтяных и газовых месторождений СССР. Под ред. Л. М. Зорькина, М. , Недра, 1989 2. Гидрогеологические условия формирования и размещения нефтяных и газовых месторождений Волго‒Уральской области. М. , Недра, 1973, 280 с. 3. Гуревич А. Е. Практическое руководство по изучению движения подземных вод при поисках полезных ископаемых. Недра, 1980 4. Гуревич А. Е. , Капченко Л. Н. , Кругликов Н. М. Теоретические основы нефтяной гидрогеологии, 1972 5. Зорькин Л. М. Геохимия газов пластовых вод нефтегазовых бассейнов. М. , Недра, 1973. 6. Зорькин Л. М. Гидрохимические условия нефтегазообразовния и нефтегазонакопления 7. Зорькин Л. М. , Суббота М. И. , Стадник Е. В. Нефтегазопоисковая гидрогеология. М. , Недра, 1982. 8. Капченко Л. Н. Гидрогеологические основы теории нефтегазонакопления. Л. , Недра, 1983 9. Капченко Л. Н. Гидрогеологические условия формирования, сохранения и разрушения залежей нефти и газа. Л. , Недра, 1974 10. Карцев А. А. Гидрогеология нефтяных и газовых месторождений. М. , Недра, 1972
 11. Карцев А. А. Нефтегазопромысловая гидрогеология. М. , Недра, 1983 12. Карцев А. А. , Вагин С. Б. , Матусевич В. М. Гидрогеология нефтегазоносных бассейнов, М. , Недра, 1986, 224 с. 13. Корценштейн В. Н. Методика гидрогеологических исследований нефтегазоносных районов. М. , Недра, 1991, 419 с. 14. Методическое пособие по отбору и анализу проб природного газа. Л. , Недра, 1969, 160 с. 15. Методы обработки и интерпретации результатов гидрогеологических исследований в нефтегазопоисковых цлях. М. И. Суббота, В. Ф. Клейменов, Е. В. Стадник и др. , М. , Недра, 1980 16. Основы гидрогеологии Под ред. Е. В. Пинеккера, Новосибирск, 1982. 17. Сухарев Г. И. Гидрогеология нефтяных и газовых месорождений. М. Недра, 1979 18. Теоретические основы нефтегазовой гидрогеологии. Под ред. А. А. Карцева, Недра, 1992 19. Шварцев В. С. Общая гидрогеология, Томск, 1996.
11. Карцев А. А. Нефтегазопромысловая гидрогеология. М. , Недра, 1983 12. Карцев А. А. , Вагин С. Б. , Матусевич В. М. Гидрогеология нефтегазоносных бассейнов, М. , Недра, 1986, 224 с. 13. Корценштейн В. Н. Методика гидрогеологических исследований нефтегазоносных районов. М. , Недра, 1991, 419 с. 14. Методическое пособие по отбору и анализу проб природного газа. Л. , Недра, 1969, 160 с. 15. Методы обработки и интерпретации результатов гидрогеологических исследований в нефтегазопоисковых цлях. М. И. Суббота, В. Ф. Клейменов, Е. В. Стадник и др. , М. , Недра, 1980 16. Основы гидрогеологии Под ред. Е. В. Пинеккера, Новосибирск, 1982. 17. Сухарев Г. И. Гидрогеология нефтяных и газовых месорождений. М. Недра, 1979 18. Теоретические основы нефтегазовой гидрогеологии. Под ред. А. А. Карцева, Недра, 1992 19. Шварцев В. С. Общая гидрогеология, Томск, 1996.
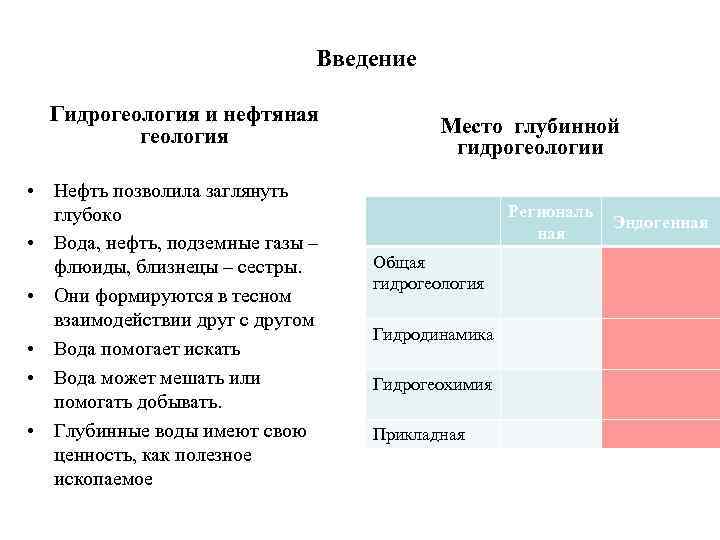 Введение Гидрогеология и нефтяная геология • Нефть позволила заглянуть глубоко • Вода, нефть, подземные газы – флюиды, близнецы – сестры. • Они формируются в тесном взаимодействии друг с другом • Вода помогает искать • Вода может мешать или помогать добывать. • Глубинные воды имеют свою ценность, как полезное ископаемое Место глубинной гидрогеологии Региональ ная Общая гидрогеология Гидродинамика Гидрогеохимия Прикладная Эндогенная
Введение Гидрогеология и нефтяная геология • Нефть позволила заглянуть глубоко • Вода, нефть, подземные газы – флюиды, близнецы – сестры. • Они формируются в тесном взаимодействии друг с другом • Вода помогает искать • Вода может мешать или помогать добывать. • Глубинные воды имеют свою ценность, как полезное ископаемое Место глубинной гидрогеологии Региональ ная Общая гидрогеология Гидродинамика Гидрогеохимия Прикладная Эндогенная
 История • Появилась вместе с нефтяной геологией в начале XX века. • 1908 – Леин (Lane) и Гардон (Gardon ) ввели понятие interstitial water, т. е. поровая водаэ • 1911 работы Пальмера • 1913 – работы Константина Васильевича Харичкова (1865 1921) • В 1934 35 годы публикуются первые работы Константин Лукич Малярова и В. А. Сулина, посвященные водам нефтяных месторождений России. В США в 1935 38 годы Гаррисон (Garrison) и Шилтус (Schilthuis) ввели понятие «connate» , т. е. реликтовой воды • Первая половина XX века: работы В. П. Савченко, А. Л. Козлов, В. А. Соколов. Г. Н. Каменский ввел генетические типы. • Малые глубины: Н. Кл. Игнатович (1899 1950), Ф. А. Макаренко (1906 1984), К. В. Филатов, Н. И. Толстихин, И. К. Зайцев (1907), и другие.
История • Появилась вместе с нефтяной геологией в начале XX века. • 1908 – Леин (Lane) и Гардон (Gardon ) ввели понятие interstitial water, т. е. поровая водаэ • 1911 работы Пальмера • 1913 – работы Константина Васильевича Харичкова (1865 1921) • В 1934 35 годы публикуются первые работы Константин Лукич Малярова и В. А. Сулина, посвященные водам нефтяных месторождений России. В США в 1935 38 годы Гаррисон (Garrison) и Шилтус (Schilthuis) ввели понятие «connate» , т. е. реликтовой воды • Первая половина XX века: работы В. П. Савченко, А. Л. Козлов, В. А. Соколов. Г. Н. Каменский ввел генетические типы. • Малые глубины: Н. Кл. Игнатович (1899 1950), Ф. А. Макаренко (1906 1984), К. В. Филатов, Н. И. Толстихин, И. К. Зайцев (1907), и другие.
 Признаки: М. А. Гатальский, В. А. Кротова, Н. М. Кругликов, Л. Н. Капченко, А. Е. Гуревич Большие глубины: А. А. Кравцов, В. Н. Корценштейн, С. Б. Вагин, Л. М. Зорькин , М. И. Зайдельсон, А. С. Зингер , А. И. Чистовский и др. Рассолов стало очень много. Возникла проблема экологического влияния. Особенности исследования пластовых флюидов • Трудность извлечения. • Подвижность и летучесть. • Свойства: в пластовых и в нормальных условиях (состав, сжимаемость, плотность и т. д. ). • Состав естественный и аналитический • • • 1. 2. 3. Методы исследования пластовых флюидов Опробование и разделение на фрагменты Анализ состава фрагментов Определение пластовых свойств и состава. Опробование зависит от: Условия и подбора в емкости От характера флюида, условий сепарация Требований лаборатории.
Признаки: М. А. Гатальский, В. А. Кротова, Н. М. Кругликов, Л. Н. Капченко, А. Е. Гуревич Большие глубины: А. А. Кравцов, В. Н. Корценштейн, С. Б. Вагин, Л. М. Зорькин , М. И. Зайдельсон, А. С. Зингер , А. И. Чистовский и др. Рассолов стало очень много. Возникла проблема экологического влияния. Особенности исследования пластовых флюидов • Трудность извлечения. • Подвижность и летучесть. • Свойства: в пластовых и в нормальных условиях (состав, сжимаемость, плотность и т. д. ). • Состав естественный и аналитический • • • 1. 2. 3. Методы исследования пластовых флюидов Опробование и разделение на фрагменты Анализ состава фрагментов Определение пластовых свойств и состава. Опробование зависит от: Условия и подбора в емкости От характера флюида, условий сепарация Требований лаборатории.
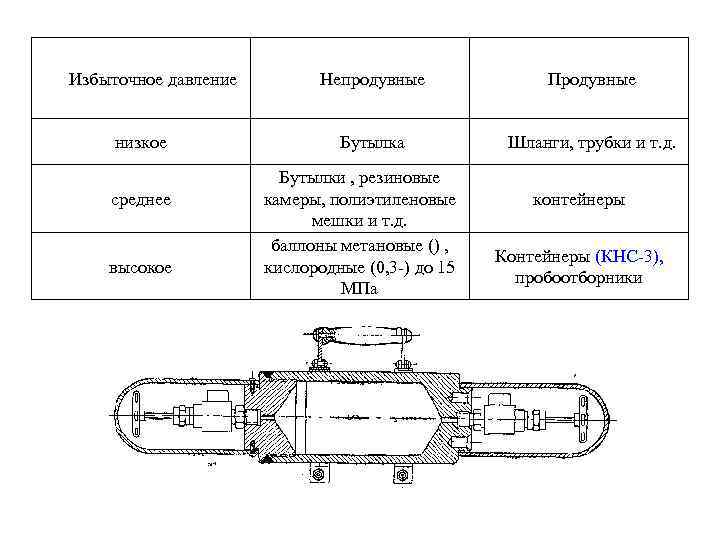 Избыточное давление низкое среднее высокое Непродувные Продувные Бутылка Шланги, трубки и т. д. Бутылки , резиновые камеры, полиэтиленовые мешки и т. д. баллоны метановые () , кислородные (0, 3 ) до 15 МПа контейнеры Контейнеры (КНС 3), пробоотборники
Избыточное давление низкое среднее высокое Непродувные Продувные Бутылка Шланги, трубки и т. д. Бутылки , резиновые камеры, полиэтиленовые мешки и т. д. баллоны метановые () , кислородные (0, 3 ) до 15 МПа контейнеры Контейнеры (КНС 3), пробоотборники
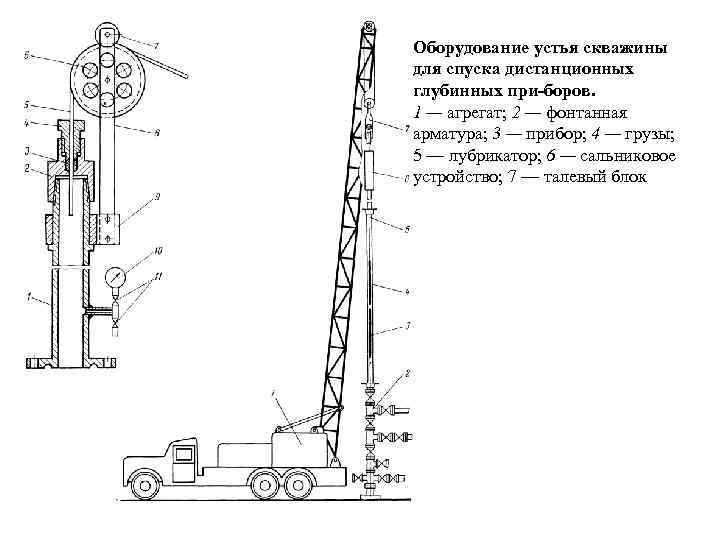 Оборудование устья скважины для спуска дистанционных глубинных при боров. 1 — агрегат; 2 — фонтанная арматура; 3 — прибор; 4 — грузы; 5 — лубрикатор; 6 — сальниковое устройство; 7 — талевый блок
Оборудование устья скважины для спуска дистанционных глубинных при боров. 1 — агрегат; 2 — фонтанная арматура; 3 — прибор; 4 — грузы; 5 — лубрикатор; 6 — сальниковое устройство; 7 — талевый блок
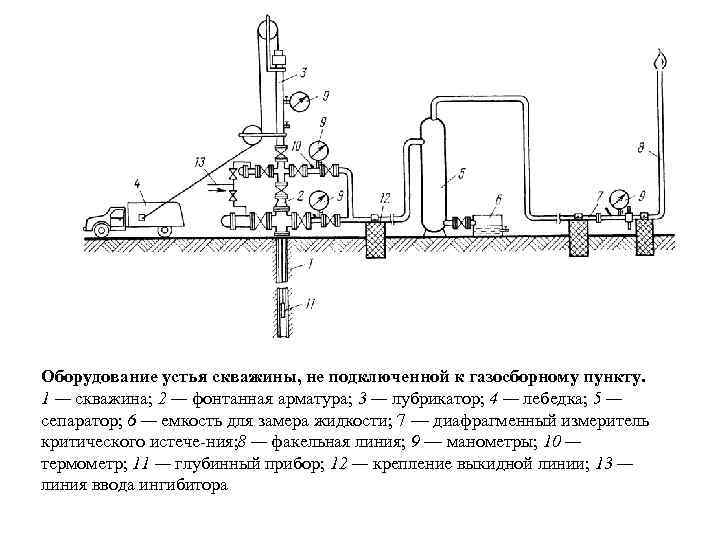 Оборудование устья скважины, не подключенной к газосборному пункту. 1 — скважина; 2 — фонтанная арматура; 3 — лубрикатор; 4 — лебедка; 5 — сепаратор; 6 — емкость для замера жидкости; 7 — диафрагменный измеритель критического истече ния; — факельная линия; 9 — манометры; 10 — 8 термометр; 11 — глубинный прибор; 12 — крепление выкидной линии; 13 — линия ввода ингибитора
Оборудование устья скважины, не подключенной к газосборному пункту. 1 — скважина; 2 — фонтанная арматура; 3 — лубрикатор; 4 — лебедка; 5 — сепаратор; 6 — емкость для замера жидкости; 7 — диафрагменный измеритель критического истече ния; — факельная линия; 9 — манометры; 10 — 8 термометр; 11 — глубинный прибор; 12 — крепление выкидной линии; 13 — линия ввода ингибитора


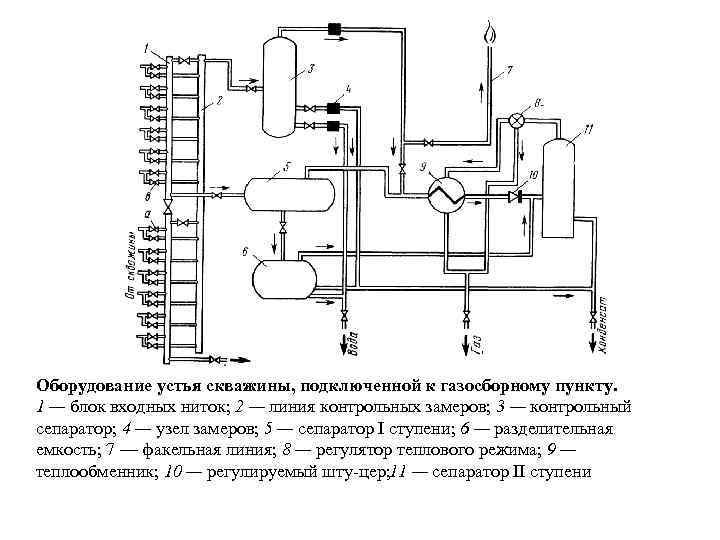 Оборудование устья скважины, подключенной к газосборному пункту. 1 — блок входных ниток; 2 — линия контрольных замеров; 3 — контрольный сепаратор; 4 — узел замеров; 5 — сепаратор I ступени; 6 — разделительная емкость; 7 — факельная линия; 8 — регулятор теплового режима; 9 — теплообменник; 10 — регулируемый шту цер; 1 — сепаратор II ступени 1
Оборудование устья скважины, подключенной к газосборному пункту. 1 — блок входных ниток; 2 — линия контрольных замеров; 3 — контрольный сепаратор; 4 — узел замеров; 5 — сепаратор I ступени; 6 — разделительная емкость; 7 — факельная линия; 8 — регулятор теплового режима; 9 — теплообменник; 10 — регулируемый шту цер; 1 — сепаратор II ступени 1
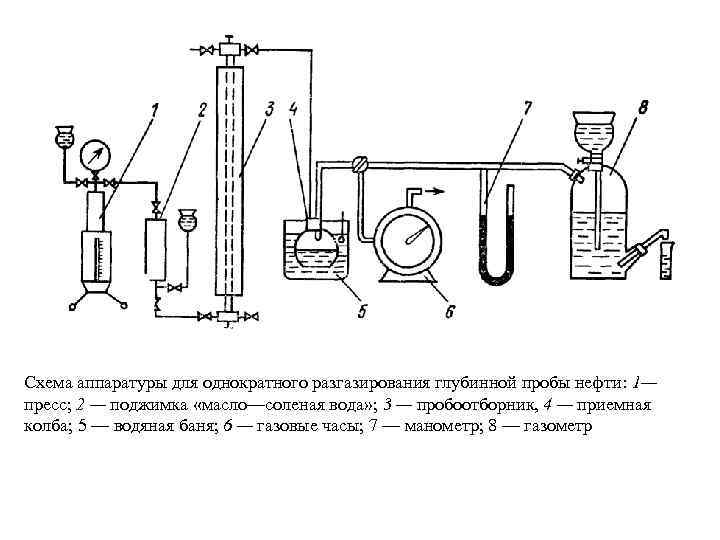 Схема аппаратуры для однократного разгазирования глубинной пробы нефти: 1— пресс; 2 — поджимка «масло—соленая вода» ; 3 — пробоотборник, 4 — приемная колба; 5 — водяная баня; 6 — газовые часы; 7 — манометр; 8 — газометр
Схема аппаратуры для однократного разгазирования глубинной пробы нефти: 1— пресс; 2 — поджимка «масло—соленая вода» ; 3 — пробоотборник, 4 — приемная колба; 5 — водяная баня; 6 — газовые часы; 7 — манометр; 8 — газометр
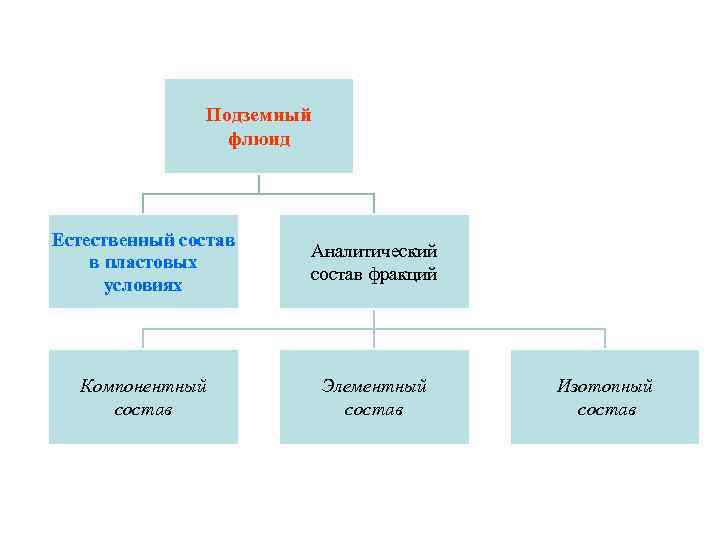 Подземный флюид Естественный состав в пластовых условиях Аналитический состав фракций Компонентный состав Элементный состав Изотопный состав
Подземный флюид Естественный состав в пластовых условиях Аналитический состав фракций Компонентный состав Элементный состав Изотопный состав
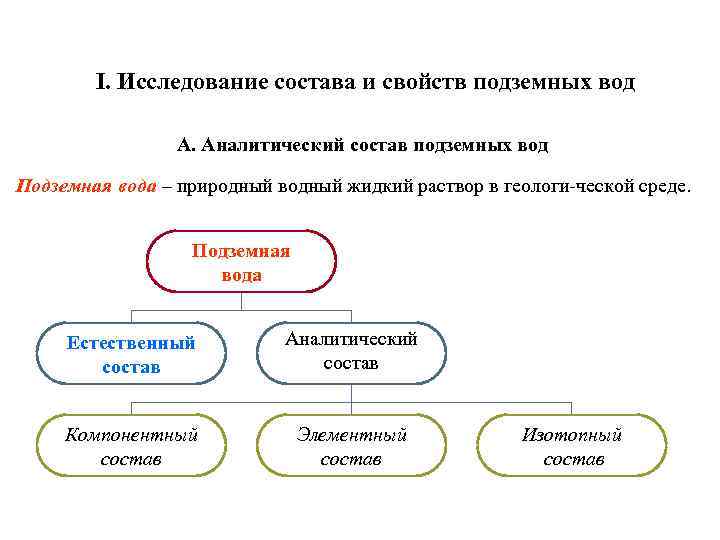 I. Исследование состава и свойств подземных вод А. Аналитический состав подземных вод Подземная вода – природный водный жидкий раствор в геологи ческой среде. Подземная вода Естественный состав Аналитический состав Компонентный состав Элементный состав Изотопный состав
I. Исследование состава и свойств подземных вод А. Аналитический состав подземных вод Подземная вода – природный водный жидкий раствор в геологи ческой среде. Подземная вода Естественный состав Аналитический состав Компонентный состав Элементный состав Изотопный состав
 1. Влага • Изотопы Протией – H, дейтерий D, тритий T. H/D=6700. Standart Mean Ocean Water (SMOW) D от – 40% до +5% в поверхностных водах от – 4% до +0, 8% в подземных T распадается c периодом полураспада 12, 35 лет с образованием He: T→ 3 He+β. 16 O/18 O/17 O =2667/5, 5/1 Standart Mean Ocean Water (SMOW) 18 O от – 4% до +0, 8% в поверхностных водах от – 20, 1% до +5% в подземных.
1. Влага • Изотопы Протией – H, дейтерий D, тритий T. H/D=6700. Standart Mean Ocean Water (SMOW) D от – 40% до +5% в поверхностных водах от – 4% до +0, 8% в подземных T распадается c периодом полураспада 12, 35 лет с образованием He: T→ 3 He+β. 16 O/18 O/17 O =2667/5, 5/1 Standart Mean Ocean Water (SMOW) 18 O от – 4% до +0, 8% в поверхностных водах от – 20, 1% до +5% в подземных.
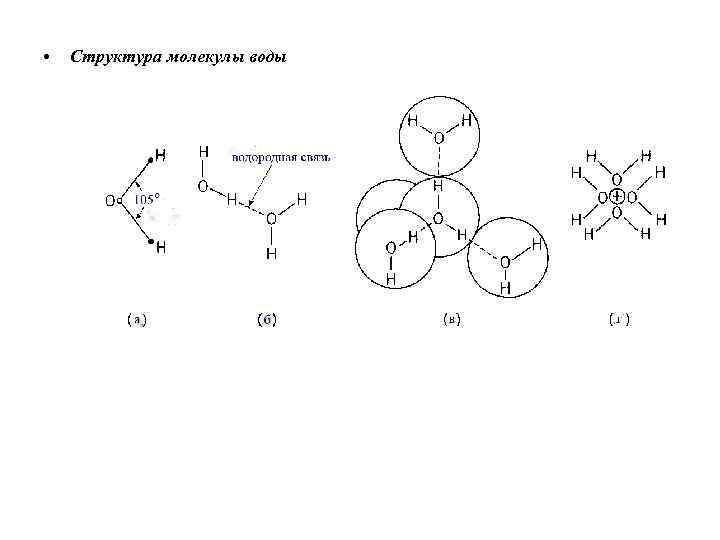 • Структура молекулы воды
• Структура молекулы воды
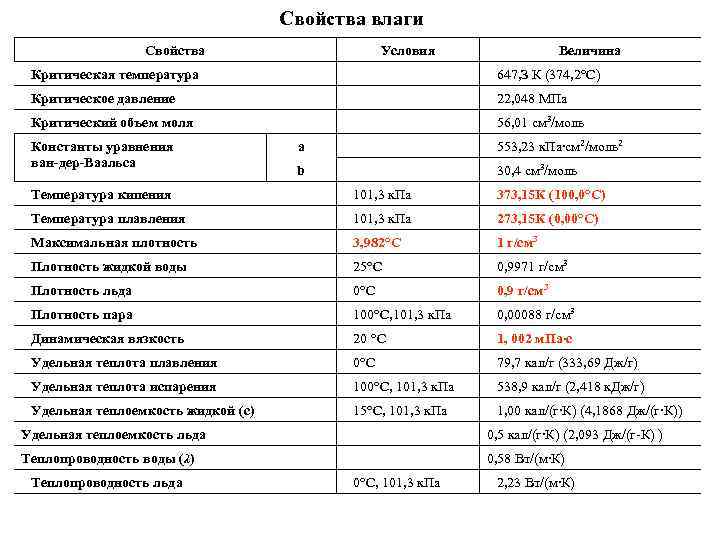 Свойства влаги Свойства Условия Величина Критическая температура 647, З К (374, 2°С) Критическое давление 22, 048 МПа Критический объем моля 56, 01 cм 3/мoль Константы уравнения ван дер Ваальса а 553, 23 к. Пa∙cм 2/мoль2 b 30, 4 см 3/моль Температура кипения 101, 3 к. Па 373, 15 К (100, 0°С) Температура плавления 101, 3 к. Па 273, 15 К (0, 00°С) Максимальная плотность 3, 982°С 1 г/см 3 Плотность жидкой воды 25°С 0, 9971 г/см 3 Плотность льда 0°С 0, 9 г/см 3 Плотность пара 100°С, 101, 3 к. Па 0, 00088 г/см 3 Динамическая вязкость 20 °С 1, 002 м. Па∙с Удельная теплота плавления 0°С 79, 7 кал/г (333, 69 Дж/г) Удельная теплота испарения 100°С, 101, 3 к. Па 538, 9 кал/г (2, 418 к. Дж/г) Удельная теплоемкость жидкой (с) 15°С, 101, 3 к. Па 1, 00 кал/(г∙К) (4, 1868 Дж/(г∙К)) Удельная теплоемкость льда 0, 5 кал/(г∙К) (2, 093 Дж/(г К) ) Теплопроводность воды (λ) 0, 58 Вт/(м∙К) Теплопроводность льда 0°С, 101, 3 к. Па 2, 23 Вт/(м∙К)
Свойства влаги Свойства Условия Величина Критическая температура 647, З К (374, 2°С) Критическое давление 22, 048 МПа Критический объем моля 56, 01 cм 3/мoль Константы уравнения ван дер Ваальса а 553, 23 к. Пa∙cм 2/мoль2 b 30, 4 см 3/моль Температура кипения 101, 3 к. Па 373, 15 К (100, 0°С) Температура плавления 101, 3 к. Па 273, 15 К (0, 00°С) Максимальная плотность 3, 982°С 1 г/см 3 Плотность жидкой воды 25°С 0, 9971 г/см 3 Плотность льда 0°С 0, 9 г/см 3 Плотность пара 100°С, 101, 3 к. Па 0, 00088 г/см 3 Динамическая вязкость 20 °С 1, 002 м. Па∙с Удельная теплота плавления 0°С 79, 7 кал/г (333, 69 Дж/г) Удельная теплота испарения 100°С, 101, 3 к. Па 538, 9 кал/г (2, 418 к. Дж/г) Удельная теплоемкость жидкой (с) 15°С, 101, 3 к. Па 1, 00 кал/(г∙К) (4, 1868 Дж/(г∙К)) Удельная теплоемкость льда 0, 5 кал/(г∙К) (2, 093 Дж/(г К) ) Теплопроводность воды (λ) 0, 58 Вт/(м∙К) Теплопроводность льда 0°С, 101, 3 к. Па 2, 23 Вт/(м∙К)
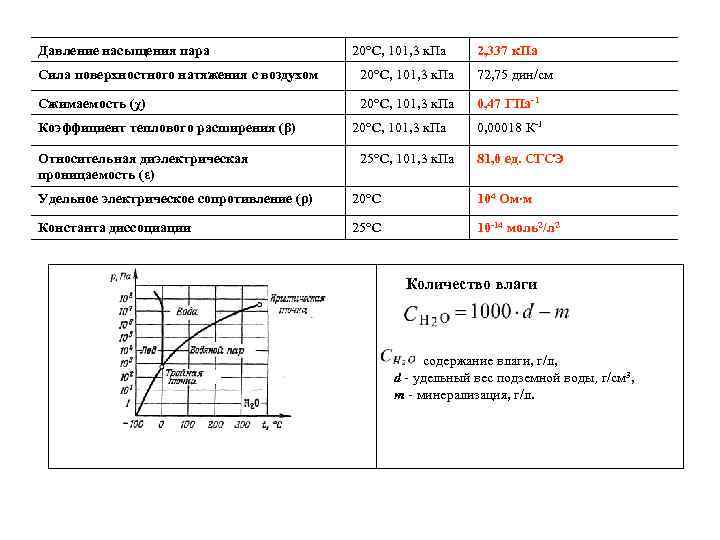 Давление насыщения пара 20°С, 101, 3 к. Па 2, 337 к. Па Сила поверхностного натяжения с воздухом 20°С, 101, 3 к. Па 72, 75 дин/см Сжимаемость (χ) 20°С, 101, 3 к. Па 0, 47 ГПа 1 Коэффициент теплового расширения (β) Относительная диэлектрическая проницаемость (ε) Удельное электрическое сопротивление (ρ) Константа диссоциации 20°С, 101, 3 к. Па 25°С, 101, 3 к. Па 0, 00018 К 1 81, 0 ед. СГСЭ 20°С 104 Ом∙м 25°С 10 14 моль2/л 2 Количество влаги содержание влаги, г/л, d - удельный вес подземной воды, г/см 3, m - минерализация, г/л.
Давление насыщения пара 20°С, 101, 3 к. Па 2, 337 к. Па Сила поверхностного натяжения с воздухом 20°С, 101, 3 к. Па 72, 75 дин/см Сжимаемость (χ) 20°С, 101, 3 к. Па 0, 47 ГПа 1 Коэффициент теплового расширения (β) Относительная диэлектрическая проницаемость (ε) Удельное электрическое сопротивление (ρ) Константа диссоциации 20°С, 101, 3 к. Па 25°С, 101, 3 к. Па 0, 00018 К 1 81, 0 ед. СГСЭ 20°С 104 Ом∙м 25°С 10 14 моль2/л 2 Количество влаги содержание влаги, г/л, d - удельный вес подземной воды, г/см 3, m - минерализация, г/л.
 Лекция 2. Минеральные компоненты a. Свойства • Макрокомпонент: – – Главные: Na+, Ca 2+, Mg 2+ и анионы Cl (хлорид), SO 42 (сульфат), HCO 3 (гидрокарбонат). Второстепенны: K+, Fe 3+, Fe 2+, Al 3+, CO 32 , Si. O 32 , NO 3 , NH 4+. За рубежом т Sr, B, F и Br. Микрокомпонентам (менее 0, 1 мг/л ): Опасные: Hg, Be, Te, Cd, Se, Pb, Sb, V, As, Cr, цианиды (CN ) и другие. • • Почти 50 минеральных компонентов в питьевой воде ограничивается ГОСТАми и САНПИНами: – ГН 2. 1. 5. 689— 98, ГН 2. 1. 5. 690— 98, – Сан. Пи. Н 2. 1. 4. 1074— 01, – Сан. Пи. Н 2. 1. 4. 1116— 02, – Сан. Пи. Н 2. 1. 4. 544— 96, – Сан. Пи. Н 2. 1. 4. 116— 2002. b. Опробование: Стеклянные или полимерные, с пробоотборником или без. – – Фильтрация через фильтр 0, 45 мкм Для катионов пробы подкисляются до p. H < 2, Для анионов охлаждаются до 2 5°С Для NH 4+, NO 3 и NO 2 добавляется 2 4 см 3 хлороформа или бактерицидного тимола ГОСТ 51592 2000 «ВОДА Общие требования к отбору проб»
Лекция 2. Минеральные компоненты a. Свойства • Макрокомпонент: – – Главные: Na+, Ca 2+, Mg 2+ и анионы Cl (хлорид), SO 42 (сульфат), HCO 3 (гидрокарбонат). Второстепенны: K+, Fe 3+, Fe 2+, Al 3+, CO 32 , Si. O 32 , NO 3 , NH 4+. За рубежом т Sr, B, F и Br. Микрокомпонентам (менее 0, 1 мг/л ): Опасные: Hg, Be, Te, Cd, Se, Pb, Sb, V, As, Cr, цианиды (CN ) и другие. • • Почти 50 минеральных компонентов в питьевой воде ограничивается ГОСТАми и САНПИНами: – ГН 2. 1. 5. 689— 98, ГН 2. 1. 5. 690— 98, – Сан. Пи. Н 2. 1. 4. 1074— 01, – Сан. Пи. Н 2. 1. 4. 1116— 02, – Сан. Пи. Н 2. 1. 4. 544— 96, – Сан. Пи. Н 2. 1. 4. 116— 2002. b. Опробование: Стеклянные или полимерные, с пробоотборником или без. – – Фильтрация через фильтр 0, 45 мкм Для катионов пробы подкисляются до p. H < 2, Для анионов охлаждаются до 2 5°С Для NH 4+, NO 3 и NO 2 добавляется 2 4 см 3 хлороформа или бактерицидного тимола ГОСТ 51592 2000 «ВОДА Общие требования к отбору проб»
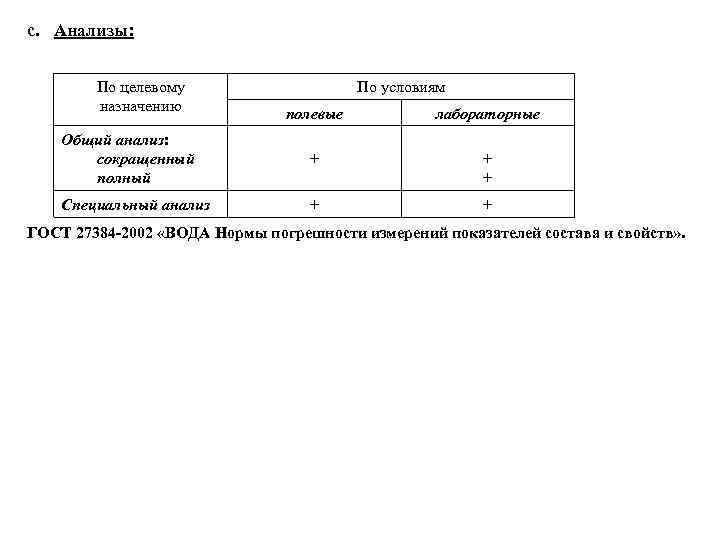 c. Анализы: По целевому назначению По условиям полевые лабораторные Общий анализ: сокращенный полный + + + Специальный анализ + + ГОСТ 27384 2002 «ВОДА Нормы погрешности измерений показателей состава и свойств» .
c. Анализы: По целевому назначению По условиям полевые лабораторные Общий анализ: сокращенный полный + + + Специальный анализ + + ГОСТ 27384 2002 «ВОДА Нормы погрешности измерений показателей состава и свойств» .
 d. Пересчет результатов анализа: Весовые единицы (мг/л, г/кг, ppm) : Cв, i Эквиваленты (мг экв/л): Процент эквиваленты (%): Молярность (моль/л) : Мольные доли (доли единицы, %): Моляльность (моль/кг): Cmi ≈ Cмi ≈ 55, 5 Ci. Активности или относительные термодинамические концентрации
d. Пересчет результатов анализа: Весовые единицы (мг/л, г/кг, ppm) : Cв, i Эквиваленты (мг экв/л): Процент эквиваленты (%): Молярность (моль/л) : Мольные доли (доли единицы, %): Моляльность (моль/кг): Cmi ≈ Cмi ≈ 55, 5 Ci. Активности или относительные термодинамические концентрации
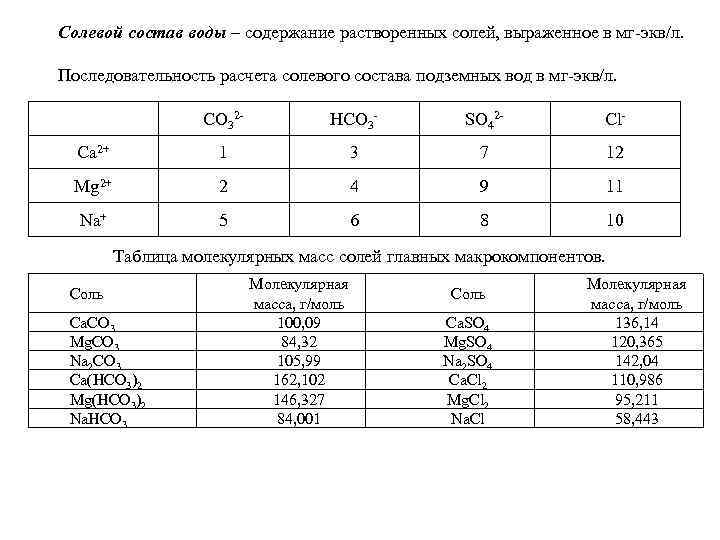 Солевой состав воды – содержание растворенных солей, выраженное в мг экв/л. Последовательность расчета солевого состава подземных вод в мг экв/л. CO 32 HCO 3 SO 42 Cl Ca 2+ 1 3 7 12 Mg 2+ 2 4 9 11 Na+ 5 6 8 10 Таблица молекулярных масс солей главных макрокомпонентов. Соль Ca. CO 3 Mg. CO 3 Na 2 CO 3 Ca(HCO 3)2 Mg(HCO 3)2 Na. HCO 3 Молекулярная масса, г/моль 100, 09 84, 32 105, 99 162, 102 146, 327 84, 001 Соль Ca. SO 4 Mg. SO 4 Na 2 SO 4 Ca. Cl 2 Mg. Cl 2 Na. Cl Молекулярная масса, г/моль 136, 14 120, 365 142, 04 110, 986 95, 211 58, 443
Солевой состав воды – содержание растворенных солей, выраженное в мг экв/л. Последовательность расчета солевого состава подземных вод в мг экв/л. CO 32 HCO 3 SO 42 Cl Ca 2+ 1 3 7 12 Mg 2+ 2 4 9 11 Na+ 5 6 8 10 Таблица молекулярных масс солей главных макрокомпонентов. Соль Ca. CO 3 Mg. CO 3 Na 2 CO 3 Ca(HCO 3)2 Mg(HCO 3)2 Na. HCO 3 Молекулярная масса, г/моль 100, 09 84, 32 105, 99 162, 102 146, 327 84, 001 Соль Ca. SO 4 Mg. SO 4 Na 2 SO 4 Ca. Cl 2 Mg. Cl 2 Na. Cl Молекулярная масса, г/моль 136, 14 120, 365 142, 04 110, 986 95, 211 58, 443
 СО 3 в мг экв/кг НСО 3 SO 42 Сl Са 2+ Mg 2+ Nа+ 6980, 0 930, 9413 1396, 8 5047, 7 10, 0 7, 1 14338, 2 1. Ca. CO 3 : Са 2+ < СО 3 , содержание = 10, 0/ 2 = 5 ммоль/кг. Осталось СО 3 6980, 0 10, 0 мг экв/кг 2. Mg. СО 3 : Mg 2+< СО 3 , содержание = 7, 1/ 2 = 3, 55 ммоль/кг. Осталось СО 3 6980, 0 10, 0 7, 1=6962, 9 мг экв/кг. 3. Na 2 CO 3: Nа+ > СО 3 , содержание = 6962, 9/2=3481, 45 ммоль/кг. Остается Nа+ 14338, 2 6962, 9 = 7375, 4 мг экв/кг. 4. Na. НСО 3 = 930, 9 ммоль/кг, 5. Na 2 SO 4 =1396, 8/2 ммоль/кг 6. Na. Cl = 5047, 7 ммоль/кг, соответственно
СО 3 в мг экв/кг НСО 3 SO 42 Сl Са 2+ Mg 2+ Nа+ 6980, 0 930, 9413 1396, 8 5047, 7 10, 0 7, 1 14338, 2 1. Ca. CO 3 : Са 2+ < СО 3 , содержание = 10, 0/ 2 = 5 ммоль/кг. Осталось СО 3 6980, 0 10, 0 мг экв/кг 2. Mg. СО 3 : Mg 2+< СО 3 , содержание = 7, 1/ 2 = 3, 55 ммоль/кг. Осталось СО 3 6980, 0 10, 0 7, 1=6962, 9 мг экв/кг. 3. Na 2 CO 3: Nа+ > СО 3 , содержание = 6962, 9/2=3481, 45 ммоль/кг. Остается Nа+ 14338, 2 6962, 9 = 7375, 4 мг экв/кг. 4. Na. НСО 3 = 930, 9 ммоль/кг, 5. Na 2 SO 4 =1396, 8/2 ммоль/кг 6. Na. Cl = 5047, 7 ммоль/кг, соответственно
 3. Газовые компоненты a. Свойства – – – Инертные: N 2, He, Ne, Ar и др Углеводородные: CH 4, C 2 H 6, C 3 H 8, n. C 4 H 10, i. C 4 H 10 Химически активные: O 2, CO 2, H 2 S Регламентируются содержания O 2 и H 2 S (< 0, 003 мг/л)
3. Газовые компоненты a. Свойства – – – Инертные: N 2, He, Ne, Ar и др Углеводородные: CH 4, C 2 H 6, C 3 H 8, n. C 4 H 10, i. C 4 H 10 Химически активные: O 2, CO 2, H 2 S Регламентируются содержания O 2 и H 2 S (< 0, 003 мг/л)
 b. Опробование • • Лекция 2. Особенности исследования: природный газ, подземный газ, газовый фактор. Дегазация спонтанная и принудительная – Бутыль В. П. Савченко – Термический дегазатор В. Э. Вассерберга.
b. Опробование • • Лекция 2. Особенности исследования: природный газ, подземный газ, газовый фактор. Дегазация спонтанная и принудительная – Бутыль В. П. Савченко – Термический дегазатор В. Э. Вассерберга.

 c. Газовый анализ природного газа • • • Газовый анализ природного газа: волюметрический, хроматографический, спектральный, масс спектральный и другие О 2 – метод Винклера (или Алстерберга) на основе иодометрии, кислородомеры. CO 2 ГОСТ 23268. 2— 91: монометрический и титрометрический методы H 2 S йодометрическим методом d. Расчет содержания газовых компонентов в воде • Поверка • – – Достоверность анализа природного газа Исключение воздуха N 2/O 2 3, 727, . Азот воздушный= 3, 727 Спр, O 2 Ar/O 2 0, 0444 Аргон воздушный= 0, 0444 Спр, O 2, Доля воздуха = 4, 77 Спр, O 2% где Спр, O 2 содержание молекулярного кислорода в об. %.
c. Газовый анализ природного газа • • • Газовый анализ природного газа: волюметрический, хроматографический, спектральный, масс спектральный и другие О 2 – метод Винклера (или Алстерберга) на основе иодометрии, кислородомеры. CO 2 ГОСТ 23268. 2— 91: монометрический и титрометрический методы H 2 S йодометрическим методом d. Расчет содержания газовых компонентов в воде • Поверка • – – Достоверность анализа природного газа Исключение воздуха N 2/O 2 3, 727, . Азот воздушный= 3, 727 Спр, O 2 Ar/O 2 0, 0444 Аргон воздушный= 0, 0444 Спр, O 2, Доля воздуха = 4, 77 Спр, O 2% где Спр, O 2 содержание молекулярного кислорода в об. %.
 • Расчет содержания газовых компонентов в воде Объёмное (мл/л, м 3/м 3): Cо, i Весовое содержание (мг/л): Молярность (моль/л): Мольные доли (доли единицы, %): Cм, i = 4, 4615 10 5 Cо, i
• Расчет содержания газовых компонентов в воде Объёмное (мл/л, м 3/м 3): Cо, i Весовое содержание (мг/л): Молярность (моль/л): Мольные доли (доли единицы, %): Cм, i = 4, 4615 10 5 Cо, i
 Парциальное давление по коэффициенту растворимости Бунзена: по коэффициенту распределения: 4. , , Органические компоненты a. Состав и свойства. Органическое вещество – совокупность растворенных органических соединений, кроме CH 4, C 2 H 6, C 3 H 8 и C 4 H 10. • Состав элементный: C (44, 5 87, 5%), H (5, 5 13, 1%), O (9, 1 49, 3%), N (1, 1 15, 0%) и S (менее 2, 4%). Биогенные элементы.
Парциальное давление по коэффициенту растворимости Бунзена: по коэффициенту распределения: 4. , , Органические компоненты a. Состав и свойства. Органическое вещество – совокупность растворенных органических соединений, кроме CH 4, C 2 H 6, C 3 H 8 и C 4 H 10. • Состав элементный: C (44, 5 87, 5%), H (5, 5 13, 1%), O (9, 1 49, 3%), N (1, 1 15, 0%) и S (менее 2, 4%). Биогенные элементы.
 Состав компонентный: – Неполярные: + углеводороды: алканы, нафтены (циклоалканы), ароматические – Амфифильные (ионообразующие) с гидроксильной группой. –OH ↔ O + H+ или –NH 2+H 2 O ↔ –NH 3+ + HO + Спирты углеводороды с –OH, + Фенолы бензольное кольцо с –OH, < 1 мкг/л, + Карбоновые кислоты с карбоксильной группой –COOH (муравьиная , пальмитиновая, пропионовая, стеариновая и аминокислоты). Сложные органические соединения (гумусовые кислоты, асфальтово смолистые вещества, хлорофилл, экземы и др. ) + Гумусовые кислоты – растворимая часть гумуса (перегноя), сложные полициклические макромолекулы с функциональными группами (преимущественно –COOH и –OH ), с молекулярным весом 500 -3100. Фульвовые кислоты - растворимые в кислой среде, Гуминовые кислоты нерастворимые в кислой среде. В пресных водах до 100 мг/л (50 90% ВРОВ). Фульвокислот в 10 раз > гуминовых. Придают воде желтый или даже бурый цвет. Иногда образуют коллоидные растворы с аморфной темно-коричневой субстанцией.
Состав компонентный: – Неполярные: + углеводороды: алканы, нафтены (циклоалканы), ароматические – Амфифильные (ионообразующие) с гидроксильной группой. –OH ↔ O + H+ или –NH 2+H 2 O ↔ –NH 3+ + HO + Спирты углеводороды с –OH, + Фенолы бензольное кольцо с –OH, < 1 мкг/л, + Карбоновые кислоты с карбоксильной группой –COOH (муравьиная , пальмитиновая, пропионовая, стеариновая и аминокислоты). Сложные органические соединения (гумусовые кислоты, асфальтово смолистые вещества, хлорофилл, экземы и др. ) + Гумусовые кислоты – растворимая часть гумуса (перегноя), сложные полициклические макромолекулы с функциональными группами (преимущественно –COOH и –OH ), с молекулярным весом 500 -3100. Фульвовые кислоты - растворимые в кислой среде, Гуминовые кислоты нерастворимые в кислой среде. В пресных водах до 100 мг/л (50 90% ВРОВ). Фульвокислот в 10 раз > гуминовых. Придают воде желтый или даже бурый цвет. Иногда образуют коллоидные растворы с аморфной темно-коричневой субстанцией.
 Опасные: галогенпроизводные, фенолы, органометаллические, пестицидами, поверхностно акивные вещества (ПАВ) и другие. В Сан. Пи. Н 2. 1. 4. 1074 01 (2002 г. ) выделяет почти 670 опасных, в том числе 240 высоко опасных и 14 чрезвычайно опасных для жизни человека. b. Опробование Зависит от полярности и летучести. Нелетучие и слабо летучие: T кип. более 400 500°С (охлажд. до 2 5°С). (высокомолекулярные углеводороды, кислоты: амино , окси , поликарбоновые, фенолкарбоновые, многоатомные фенолы, ПАВ’ы, пестициды и т. д ) Летучие : Tкип. менее 400 500°С. В стеклянные емкости, при охлаждении до 2 5°С хранить летучие 1 сут, нелетучие 3 5 сут, при замораживании до 20 o. C до 1 мес.
Опасные: галогенпроизводные, фенолы, органометаллические, пестицидами, поверхностно акивные вещества (ПАВ) и другие. В Сан. Пи. Н 2. 1. 4. 1074 01 (2002 г. ) выделяет почти 670 опасных, в том числе 240 высоко опасных и 14 чрезвычайно опасных для жизни человека. b. Опробование Зависит от полярности и летучести. Нелетучие и слабо летучие: T кип. более 400 500°С (охлажд. до 2 5°С). (высокомолекулярные углеводороды, кислоты: амино , окси , поликарбоновые, фенолкарбоновые, многоатомные фенолы, ПАВ’ы, пестициды и т. д ) Летучие : Tкип. менее 400 500°С. В стеклянные емкости, при охлаждении до 2 5°С хранить летучие 1 сут, нелетучие 3 5 сут, при замораживании до 20 o. C до 1 мес.
 • Концентрирование и разделение: Коэффициент концентрирования: для воды: Степень выделения или извлечения (%): или
• Концентрирование и разделение: Коэффициент концентрирования: для воды: Степень выделения или извлечения (%): или
 • Продувка газом (отгонка): чистыми N 2 или CO 2 • Перегонка паром (дистилляция) неполярных органических соединений: Коэффициент селективности: Расходный коэффициент: • , ректификация: Вымораживание: κi =10 ÷ 20 • Экстракция: Экстрагенты: пентан, гексан, циклогексан, бензол, хлороформ, дихлорметан, этилацетат, октанол, петролейный эфир и др.
• Продувка газом (отгонка): чистыми N 2 или CO 2 • Перегонка паром (дистилляция) неполярных органических соединений: Коэффициент селективности: Расходный коэффициент: • , ректификация: Вымораживание: κi =10 ÷ 20 • Экстракция: Экстрагенты: пентан, гексан, циклогексан, бензол, хлороформ, дихлорметан, этилацетат, октанол, петролейный эфир и др.
 • • Адсорбция: активированный уголь и макропористые смолы Фильтрация или центрифугирование: макромолекул с размером более 0, 1 мкм (гуминовые кислоты, полисахариды, белки и т. д. ), Фильтры с диаметром пор от n до 100·n нм. Центрифугирование со скоростью вращения до 6· 104 обор. /мин c. Анализ • Определение общего содержания: – по БПК, – по ХПК (окисляемости): 1 мг H 2 S потребляет 0, 47 мг O, 1 мг NO 2 0, 35 мг O, 1 мг Fe 2+ 0, 14 мг O, Cl менее 300 мг/л. – по содержанию Cорг. Мокрое и сухое сжигание до CO 2. CO 32 и HCO 3 удаляют или вычитают В среднем 21 мг ОВ требует ~1 мг O или 4 мг KMn. O 4. ВРОВ ≈ 2· Cорг ≈ 0, 75 · ХПК
• • Адсорбция: активированный уголь и макропористые смолы Фильтрация или центрифугирование: макромолекул с размером более 0, 1 мкм (гуминовые кислоты, полисахариды, белки и т. д. ), Фильтры с диаметром пор от n до 100·n нм. Центрифугирование со скоростью вращения до 6· 104 обор. /мин c. Анализ • Определение общего содержания: – по БПК, – по ХПК (окисляемости): 1 мг H 2 S потребляет 0, 47 мг O, 1 мг NO 2 0, 35 мг O, 1 мг Fe 2+ 0, 14 мг O, Cl менее 300 мг/л. – по содержанию Cорг. Мокрое и сухое сжигание до CO 2. CO 32 и HCO 3 удаляют или вычитают В среднем 21 мг ОВ требует ~1 мг O или 4 мг KMn. O 4. ВРОВ ≈ 2· Cорг ≈ 0, 75 · ХПК
 • Определение содержания групп соединений – Органические кислоты: + Общее содержание – подкисляют и удаляют CO 2, перегонка паром и титрование от 4 до 7 p. H. + Гумусовые кислоты перегонка с паром, вымораживание, экстракция и адсорбция. Разделяют кислоты подкислением. Анализ оксидиметрический, спектро фотометрческий или гравиметрический. + Летучие фенолы – перегонка с паром, анализ фотометрический. Фенольный индекс в питьевых водах не должен превышать 0, 25 мг/л – Нефтепродукты неполярные и малополярные соединения, растворимые в гексане (<0, 3− 0, 5 мг/л). Анализ гравиметрический, газохроматографический и ИК спектроскопия. В питьевой воде не более 0, 1 мг/л, а в водоемах не более 0, 3 0, 5 мг/л. – ПАВ – Анализ экстракционно фотометрический. В питьевых водах не выше 0, 5 мг/л.
• Определение содержания групп соединений – Органические кислоты: + Общее содержание – подкисляют и удаляют CO 2, перегонка паром и титрование от 4 до 7 p. H. + Гумусовые кислоты перегонка с паром, вымораживание, экстракция и адсорбция. Разделяют кислоты подкислением. Анализ оксидиметрический, спектро фотометрческий или гравиметрический. + Летучие фенолы – перегонка с паром, анализ фотометрический. Фенольный индекс в питьевых водах не должен превышать 0, 25 мг/л – Нефтепродукты неполярные и малополярные соединения, растворимые в гексане (<0, 3− 0, 5 мг/л). Анализ гравиметрический, газохроматографический и ИК спектроскопия. В питьевой воде не более 0, 1 мг/л, а в водоемах не более 0, 3 0, 5 мг/л. – ПАВ – Анализ экстракционно фотометрический. В питьевых водах не выше 0, 5 мг/л.
 • Анализ отдельных компонентов. – Хроматография (газовая, газожидкостная, тонкослойная и др. ) часто в комбинации, когда за хроматографическим разделением следует идентификация с помощью масс спектрометрии, ИК спектроскопии и т. п. ) – Гравиметрический – Спектрофотометрические – Титриметрические Стандартизация: Международная, в США 600 ые серии методов, в России ГОСТ’ы d. Пересчет. В случае концентрирования или выделения необходимо восстановить начальную концентрацию где κi коэффициент концентрирования, Ri – степень извлечения. Размерности концентраций как у газовых компонентов и рассчитываются также. Исключение парциальное давление. Согласно закону Рауля :
• Анализ отдельных компонентов. – Хроматография (газовая, газожидкостная, тонкослойная и др. ) часто в комбинации, когда за хроматографическим разделением следует идентификация с помощью масс спектрометрии, ИК спектроскопии и т. п. ) – Гравиметрический – Спектрофотометрические – Титриметрические Стандартизация: Международная, в США 600 ые серии методов, в России ГОСТ’ы d. Пересчет. В случае концентрирования или выделения необходимо восстановить начальную концентрацию где κi коэффициент концентрирования, Ri – степень извлечения. Размерности концентраций как у газовых компонентов и рассчитываются также. Исключение парциальное давление. Согласно закону Рауля :
 b. Дисперсное вещество • Взвешенное или дисперсное вещество- вещество удаляемое из раствора фильтрацией и (или) центрифугированием. • По характеру: Неживое вещество: твердые минеральные и органические (детрит) частицы макромолекулы жидкие капли гидрофобных веществ газовые пузыри Живое вещество: живые организмы 1. Неживое вещество а. Состав и свойства • В состоянии покоя органика и пузыри газа всплывают. Органика портит запах и вкус, непригодна для замеса бетона. • Минеральные частицы оседают: Грубая взвесь выпадает из раствора за 5 6 часов. Суспензия – выпадает из раствора после 5 6 часов (>0, 45 мкм) Мицеллы (коллоиды) – не выпадают размером 10 5 10 7 см (10 3 до 10 1 мкм). Образуют коллоидные растворы (золи или гидрозоли). При высоком содержании образуют гели. В питьевых водах не более 0, 25 мг/л. Делают воду абразивной.
b. Дисперсное вещество • Взвешенное или дисперсное вещество- вещество удаляемое из раствора фильтрацией и (или) центрифугированием. • По характеру: Неживое вещество: твердые минеральные и органические (детрит) частицы макромолекулы жидкие капли гидрофобных веществ газовые пузыри Живое вещество: живые организмы 1. Неживое вещество а. Состав и свойства • В состоянии покоя органика и пузыри газа всплывают. Органика портит запах и вкус, непригодна для замеса бетона. • Минеральные частицы оседают: Грубая взвесь выпадает из раствора за 5 6 часов. Суспензия – выпадает из раствора после 5 6 часов (>0, 45 мкм) Мицеллы (коллоиды) – не выпадают размером 10 5 10 7 см (10 3 до 10 1 мкм). Образуют коллоидные растворы (золи или гидрозоли). При высоком содержании образуют гели. В питьевых водах не более 0, 25 мг/л. Делают воду абразивной.

 b. Методы опробования и препарирования Риск привноса при бурении и откачке, при дегазации и окислении. • Органика всплывает на поверхность, сливается в другой сосуд и экстрагируется диэтиловым эфиром. Анализ органического вещества. • Минеральная часть оседает на дно: Грубая взвесь отстаивается и сушится Суспензия отделяется фильтрованием через бумагу, мембрану или центрифугированием. Нельзя при опробовании на газовые, летучие и адсорбируемые компоненты. c. Анализ: Химический, гранулометрический и/или минералогический. Лекция 3 2. Живые организмы a. Состав и свойства Биоценоз: водоросли, простейшие, грибки (100 10 мкм), амебы (15 мкм 1 мм), бактерии (10 мкм и длины 20 мкм, чаще 0, 2 5 мкм), вирусы (20 250 нм) и др. . Биотоп: подземная вода в кавернах порах и трещинах суперкапилляы (0, 25 1, 00 мм) , капилляры ( 0, 1 250 мкм) и субкапилляры (менее 0, 1 мкм).
b. Методы опробования и препарирования Риск привноса при бурении и откачке, при дегазации и окислении. • Органика всплывает на поверхность, сливается в другой сосуд и экстрагируется диэтиловым эфиром. Анализ органического вещества. • Минеральная часть оседает на дно: Грубая взвесь отстаивается и сушится Суспензия отделяется фильтрованием через бумагу, мембрану или центрифугированием. Нельзя при опробовании на газовые, летучие и адсорбируемые компоненты. c. Анализ: Химический, гранулометрический и/или минералогический. Лекция 3 2. Живые организмы a. Состав и свойства Биоценоз: водоросли, простейшие, грибки (100 10 мкм), амебы (15 мкм 1 мм), бактерии (10 мкм и длины 20 мкм, чаще 0, 2 5 мкм), вирусы (20 250 нм) и др. . Биотоп: подземная вода в кавернах порах и трещинах суперкапилляы (0, 25 1, 00 мм) , капилляры ( 0, 1 250 мкм) и субкапилляры (менее 0, 1 мкм).
 Метаболизм бактерий Катализатор: ферменты белки катализаторы, субстрат – вода. Материал: гетеротрофы потребляют только Сорг. из ОВ (видов много, но распространены мало); автотрофы потребляют C из неорганической CO 2 (видов мало, но широко распространены). Энергия: аэробы, анаэробы факультативные анаэробы (денитрифицирующие NO 3 ) строгие аэробы (сульфатвосстанавливающими - SO 42 , CO 2) Два направления изучения: санитарное и биохимическое. a. Болезнетворные микроорганизмы Состав и свойства a. Аллохтоны: Их биотоп живой организм (у нас в толстой кишке на 1 г содержимого приходится в среднем 30 40 млрд. микробов). Преимущественно анаэробы. Бактерии в геологической среде живут до года, вирусы от 7 дней до 6 мес. (исключение: клостридии – возбудитель ботулизма и столбняка. Простейшие (цисты): амебиаз, балантидиаз и др. Бактерии (споры): холера, сибирская язва, брюшной тиф, дизентерии, неприятные формы поноса. Вирусы: гепатит, полиомиелит, лихорадки, диарея
Метаболизм бактерий Катализатор: ферменты белки катализаторы, субстрат – вода. Материал: гетеротрофы потребляют только Сорг. из ОВ (видов много, но распространены мало); автотрофы потребляют C из неорганической CO 2 (видов мало, но широко распространены). Энергия: аэробы, анаэробы факультативные анаэробы (денитрифицирующие NO 3 ) строгие аэробы (сульфатвосстанавливающими - SO 42 , CO 2) Два направления изучения: санитарное и биохимическое. a. Болезнетворные микроорганизмы Состав и свойства a. Аллохтоны: Их биотоп живой организм (у нас в толстой кишке на 1 г содержимого приходится в среднем 30 40 млрд. микробов). Преимущественно анаэробы. Бактерии в геологической среде живут до года, вирусы от 7 дней до 6 мес. (исключение: клостридии – возбудитель ботулизма и столбняка. Простейшие (цисты): амебиаз, балантидиаз и др. Бактерии (споры): холера, сибирская язва, брюшной тиф, дизентерии, неприятные формы поноса. Вирусы: гепатит, полиомиелит, лихорадки, диарея
 b. Опробование. • В стерильные склянки объемом 0, 5 л с притертой или ватной пробкой. • Стерильность: кипячение, сухожаровые шкафы, автоклавы, ионизирующее облучение. • Объем 1 2 л. • Хранить не более 2 часов (летом 4 часов, зимой 6 часов). При 2°С— 10°С до 6 часов. c. Анализ Посев на стерильный питательный субстрат на конкретный срок при заданных условиях. 1. Микробное число (ОМЧ)– число колоний видимых в 1 мл воды при 2 х кратном увеличении на питательном агаре через 1 2 суток при 37°C. В питьевой воде не > 50. 2. Индикаторные микроорганизмы: Колиформные бактерии (кишечные палочки) –показатель фекального загрязнения. Высевают 1 мл воды на 24 часа при 37 о. С и считают число характерных колоний. Коли титр объем воды в мл на одну кишечную палочку. Коли индекс количество кишечных палочек в одном 1 л воды. Вода считается здоровой при коли титре > 100 мл, достаточно здоровой при 10 100 мл, сомнительно здоровой при 1 10 мл, нездоровой при 0, 1 1 мл. Питьевой воде коли титр > 300 мл или коли индекс < 3 штук. Колифаги (бактериальные вирусы) показатели возможного вирусного загрязнения. Посев 1 мл на 18± 2 ч. при 37± 1°С на питательном агаре с палочками. Число бляшек. Измеряется по число бляшкообразующих единиц (БОЕ) в 100 мл. В питьевой воде должны отсутствовать.
b. Опробование. • В стерильные склянки объемом 0, 5 л с притертой или ватной пробкой. • Стерильность: кипячение, сухожаровые шкафы, автоклавы, ионизирующее облучение. • Объем 1 2 л. • Хранить не более 2 часов (летом 4 часов, зимой 6 часов). При 2°С— 10°С до 6 часов. c. Анализ Посев на стерильный питательный субстрат на конкретный срок при заданных условиях. 1. Микробное число (ОМЧ)– число колоний видимых в 1 мл воды при 2 х кратном увеличении на питательном агаре через 1 2 суток при 37°C. В питьевой воде не > 50. 2. Индикаторные микроорганизмы: Колиформные бактерии (кишечные палочки) –показатель фекального загрязнения. Высевают 1 мл воды на 24 часа при 37 о. С и считают число характерных колоний. Коли титр объем воды в мл на одну кишечную палочку. Коли индекс количество кишечных палочек в одном 1 л воды. Вода считается здоровой при коли титре > 100 мл, достаточно здоровой при 10 100 мл, сомнительно здоровой при 1 10 мл, нездоровой при 0, 1 1 мл. Питьевой воде коли титр > 300 мл или коли индекс < 3 штук. Колифаги (бактериальные вирусы) показатели возможного вирусного загрязнения. Посев 1 мл на 18± 2 ч. при 37± 1°С на питательном агаре с палочками. Число бляшек. Измеряется по число бляшкообразующих единиц (БОЕ) в 100 мл. В питьевой воде должны отсутствовать.
 Санитарные нормы по Сан. Пи. Н’у 2. 1. 4. 1074 01 (2002 г), Показатели Число Нормативы Общее микробное число колоний в 1 мл менее 50 Общие колиформные бактерии бактерий в 100 мл Отсутствие Термотолерантные колиформные бактерии бактерий в 100 мл Отсутствие Коли индекс кишечных палочек в 1 л менее 3 Колифаги бляшкообразующих единиц (БОЕ) в 100 мл Отсутствие Споры сульфитредуцирующих клостридий спор в 20 мл Отсутствие Цисты лямблий Отсутствие цист в 50 л
Санитарные нормы по Сан. Пи. Н’у 2. 1. 4. 1074 01 (2002 г), Показатели Число Нормативы Общее микробное число колоний в 1 мл менее 50 Общие колиформные бактерии бактерий в 100 мл Отсутствие Термотолерантные колиформные бактерии бактерий в 100 мл Отсутствие Коли индекс кишечных палочек в 1 л менее 3 Колифаги бляшкообразующих единиц (БОЕ) в 100 мл Отсутствие Споры сульфитредуцирующих клостридий спор в 20 мл Отсутствие Цисты лямблий Отсутствие цист в 50 л
 3. Присутствие самих патогенных микроорганизмов Цисты лямблий, споры сульфитредуцирующие клостридии, фекальные стрептококки, вибрионы, легионеллы и т. д. Посев на специальный субстрат. Число организмов. Биохимические бактерии Их биотоп – геологическая среда. Участвуют в гниении и брожении, в реализации круговорота биогенных элементов (преимущественно редуценты).
3. Присутствие самих патогенных микроорганизмов Цисты лямблий, споры сульфитредуцирующие клостридии, фекальные стрептококки, вибрионы, легионеллы и т. д. Посев на специальный субстрат. Число организмов. Биохимические бактерии Их биотоп – геологическая среда. Участвуют в гниении и брожении, в реализации круговорота биогенных элементов (преимущественно редуценты).
 c. Свойства подземных вод Свойства воды В нормальных условиях В пластовых условиях Органолептические и бальнеологические Химические Физические
c. Свойства подземных вод Свойства воды В нормальных условиях В пластовых условиях Органолептические и бальнеологические Химические Физические
 Органолептические свойства способность воды воздействовать на наши органы чувств. 1. Мутность и прозрачность способность рассеивать и пропускать свет. Методы определения: • Визуально: – прозрачные, слабоопалесцирующие, слегка мутные, мутные и сильно мутные. Опалесцирующие прозрачные только в проходящем свете. • Инструментально: – Турбиметры (мутнометры) фотометрия относительно стандартных суспензий кремнезема, каолина, формозина. Единицы измерения: мг/л у каолина, ЕМ/л или ЕМФ у формазина (1, 5 мг/л каолина соответствует 2, 6 ЕМ/л формазина). – Высота слоя воды в метрах для диск Секки (белый диск диаметром 20 30 см на тросе), в сантиметрах для шрифта средней жирности высотой 3, 5 мм. Предельно допустимая величина мутности питьевой воды 1, 5 мг/л по каолину.
Органолептические свойства способность воды воздействовать на наши органы чувств. 1. Мутность и прозрачность способность рассеивать и пропускать свет. Методы определения: • Визуально: – прозрачные, слабоопалесцирующие, слегка мутные, мутные и сильно мутные. Опалесцирующие прозрачные только в проходящем свете. • Инструментально: – Турбиметры (мутнометры) фотометрия относительно стандартных суспензий кремнезема, каолина, формозина. Единицы измерения: мг/л у каолина, ЕМ/л или ЕМФ у формазина (1, 5 мг/л каолина соответствует 2, 6 ЕМ/л формазина). – Высота слоя воды в метрах для диск Секки (белый диск диаметром 20 30 см на тросе), в сантиметрах для шрифта средней жирности высотой 3, 5 мм. Предельно допустимая величина мутности питьевой воды 1, 5 мг/л по каолину.
 2. Цветность – интенсивность и характер окраски воды. • Методы определения: – Визуально: истинный и кажущийся, бесцветной, зеленоватой, желтой, бурой и т. д. – Инструментально: фотометрия – относительно стандартных растворов: хром-кобальтовая шкала (ГОСТ’а 3351 74) и платинокобальтовая шкала (стандарты Хазена). Единицы Хазена: от 0 до 1000 o, • Предельно допустимая величина цветности в питьевых водах, 35 o по платиново кобальтовой шкале.
2. Цветность – интенсивность и характер окраски воды. • Методы определения: – Визуально: истинный и кажущийся, бесцветной, зеленоватой, желтой, бурой и т. д. – Инструментально: фотометрия – относительно стандартных растворов: хром-кобальтовая шкала (ГОСТ’а 3351 74) и платинокобальтовая шкала (стандарты Хазена). Единицы Хазена: от 0 до 1000 o, • Предельно допустимая величина цветности в питьевых водах, 35 o по платиново кобальтовой шкале.
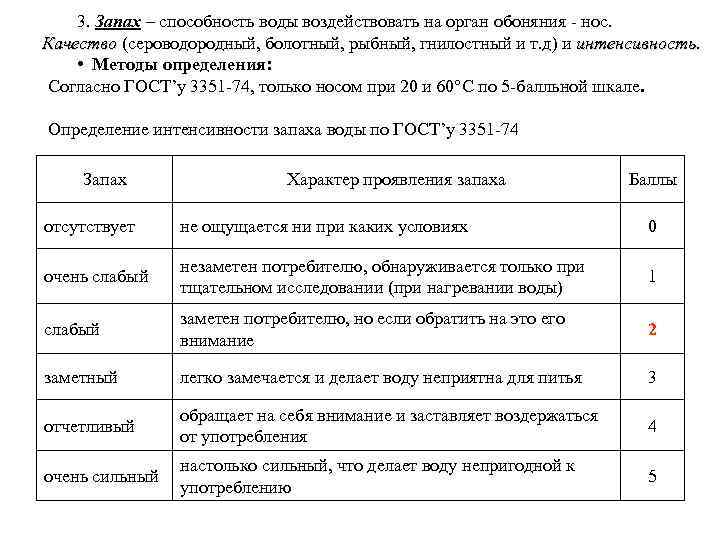 3. Запах – способность воды воздействовать на орган обоняния нос. Качество (сероводородный, болотный, рыбный, гнилостный и т. д) и интенсивность. Качество интенсивность • Методы определения: Согласно ГОСТ’у 3351 74, только носом при 20 и 60°С по 5 балльной шкале. Определение интенсивности запаха воды по ГОСТ’у 3351 74 Запах Характер проявления запаха Баллы отсутствует не ощущается ни при каких условиях 0 очень слабый незаметен потребителю, обнаруживается только при тщательном исследовании (при нагревании воды) 1 слабый заметен потребителю, но если обратить на это его внимание 2 заметный легко замечается и делает воду неприятна для питья 3 отчетливый обращает на себя внимание и заставляет воздержаться от употребления 4 очень сильный настолько сильный, что делает воду непригодной к употреблению 5
3. Запах – способность воды воздействовать на орган обоняния нос. Качество (сероводородный, болотный, рыбный, гнилостный и т. д) и интенсивность. Качество интенсивность • Методы определения: Согласно ГОСТ’у 3351 74, только носом при 20 и 60°С по 5 балльной шкале. Определение интенсивности запаха воды по ГОСТ’у 3351 74 Запах Характер проявления запаха Баллы отсутствует не ощущается ни при каких условиях 0 очень слабый незаметен потребителю, обнаруживается только при тщательном исследовании (при нагревании воды) 1 слабый заметен потребителю, но если обратить на это его внимание 2 заметный легко замечается и делает воду неприятна для питья 3 отчетливый обращает на себя внимание и заставляет воздержаться от употребления 4 очень сильный настолько сильный, что делает воду непригодной к употреблению 5
 • Предельно допустимая интенсивность запаха для питьевой воды не более 2 баллов. Определение содержания по запаху: порог восприятия запаха пороговое число восприятия запаха компонента i в пробе , то концентрация Сi в пробе равна: , где: Сi, ст и Ni, ст – концентрация и пороговое число запаха компонента i в стандартном растворе, Сi, пр и Ni, пр – концентрация и пороговое число запаха компонента i в пробе. • 4. Вкус – способность воды действовать на органы вкуса. Различают только 4 вкуса: соленый, кислый, сладкий, горький. вкуса Остальное – привкусы Методы определения: – согласно ГОСТ’у 3351 74, только языком при 20 o С по 5 балльной шкале.
• Предельно допустимая интенсивность запаха для питьевой воды не более 2 баллов. Определение содержания по запаху: порог восприятия запаха пороговое число восприятия запаха компонента i в пробе , то концентрация Сi в пробе равна: , где: Сi, ст и Ni, ст – концентрация и пороговое число запаха компонента i в стандартном растворе, Сi, пр и Ni, пр – концентрация и пороговое число запаха компонента i в пробе. • 4. Вкус – способность воды действовать на органы вкуса. Различают только 4 вкуса: соленый, кислый, сладкий, горький. вкуса Остальное – привкусы Методы определения: – согласно ГОСТ’у 3351 74, только языком при 20 o С по 5 балльной шкале.
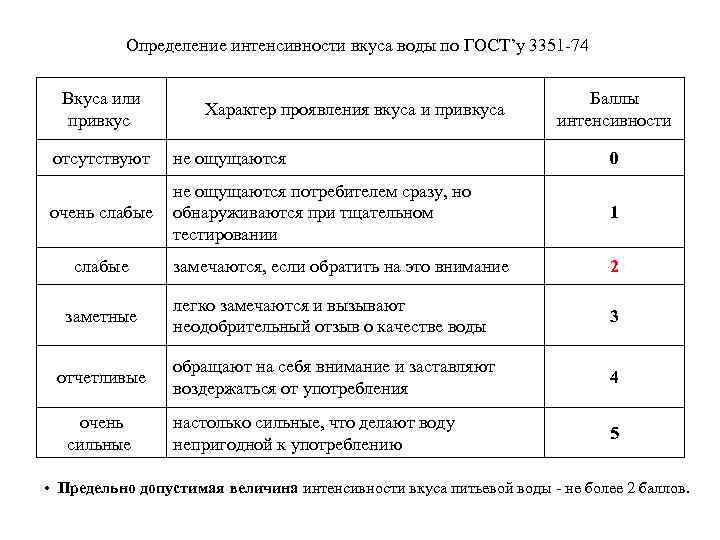 Определение интенсивности вкуса воды по ГОСТ’у 3351 74 Вкуса или привкус Характер проявления вкуса и привкуса Баллы интенсивности отсутствуют не ощущаются 0 очень слабые не ощущаются потребителем сразу, но обнаруживаются при тщательном тестировании 1 замечаются, если обратить на это внимание 2 легко замечаются и вызывают неодобрительный отзыв о качестве воды 3 обращают на себя внимание и заставляют воздержаться от употребления 4 настолько сильные, что делают воду непригодной к употреблению 5 слабые заметные отчетливые очень сильные • Предельно допустимая величина интенсивности вкуса питьевой воды не более 2 баллов.
Определение интенсивности вкуса воды по ГОСТ’у 3351 74 Вкуса или привкус Характер проявления вкуса и привкуса Баллы интенсивности отсутствуют не ощущаются 0 очень слабые не ощущаются потребителем сразу, но обнаруживаются при тщательном тестировании 1 замечаются, если обратить на это внимание 2 легко замечаются и вызывают неодобрительный отзыв о качестве воды 3 обращают на себя внимание и заставляют воздержаться от употребления 4 настолько сильные, что делают воду непригодной к употреблению 5 слабые заметные отчетливые очень сильные • Предельно допустимая величина интенсивности вкуса питьевой воды не более 2 баллов.
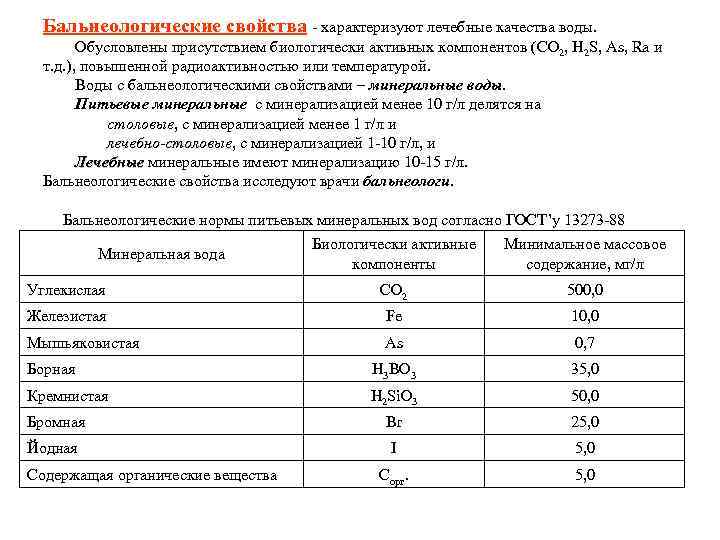 Бальнеологические свойства характеризуют лечебные качества воды. Обусловлены присутствием биологически активных компонентов (CO 2, H 2 S, As, Ra и т. д. ), повышенной радиоактивностью или температурой. Воды с бальнеологическими свойствами – минеральные воды. Питьевые минеральные с минерализацией менее 10 г/л делятся на столовые, с минерализацией менее 1 г/л и лечебно-столовые, с минерализацией 1 10 г/л, и лечебно-столовые Лечебные минеральные имеют минерализацию 10 15 г/л. Лечебные Бальнеологические свойства исследуют врачи бальнеологи. Бальнеологические нормы питьевых минеральных вод согласно ГОСТ’у 13273 88 Биологически активные компоненты Минимальное массовое содержание, мг/л Углекислая CO 2 500, 0 Железистая Fe 10, 0 Мышьяковистая As 0, 7 Борная H 3 BO 3 35, 0 Кремнистая H 2 Si. O 3 50, 0 Бромная Br 25, 0 Йодная I 5, 0 Cорг. 5, 0 Минеральная вода Содержащая органические вещества
Бальнеологические свойства характеризуют лечебные качества воды. Обусловлены присутствием биологически активных компонентов (CO 2, H 2 S, As, Ra и т. д. ), повышенной радиоактивностью или температурой. Воды с бальнеологическими свойствами – минеральные воды. Питьевые минеральные с минерализацией менее 10 г/л делятся на столовые, с минерализацией менее 1 г/л и лечебно-столовые, с минерализацией 1 10 г/л, и лечебно-столовые Лечебные минеральные имеют минерализацию 10 15 г/л. Лечебные Бальнеологические свойства исследуют врачи бальнеологи. Бальнеологические нормы питьевых минеральных вод согласно ГОСТ’у 13273 88 Биологически активные компоненты Минимальное массовое содержание, мг/л Углекислая CO 2 500, 0 Железистая Fe 10, 0 Мышьяковистая As 0, 7 Борная H 3 BO 3 35, 0 Кремнистая H 2 Si. O 3 50, 0 Бромная Br 25, 0 Йодная I 5, 0 Cорг. 5, 0 Минеральная вода Содержащая органические вещества


