Спец-химия. Лекция 1_2.ppt
- Количество слайдов: 17
 Лекция 1 1. Химия и ее задачи в реставрации. 2. Основные понятия химии (моль, различные способы выражения концентрации раствора, диссоциация кислот и солей, р. Н и ПР…). 3. Контрольные вопросы и задачи
Лекция 1 1. Химия и ее задачи в реставрации. 2. Основные понятия химии (моль, различные способы выражения концентрации раствора, диссоциация кислот и солей, р. Н и ПР…). 3. Контрольные вопросы и задачи
 1. 1. Химические процессы разрушения предметов искусства* 1) Окисление под действием агрессивных газов атмосферы и компонентов самого произведения: O 2 , O 3 (от УФ света), H 2 S (продукт разложения белковых веществ), H 2 O 2 (в процессе окисления олиф)… 2) Обменные реакции с компонентами атмосферы: CO 2 - H 2 CO 3(продукт дыхания), SO 2 - H 2 SO 3 (продукт загрязнения от автомобильных выхлопов)… 3) Процессы старения и деструкции полимерных веществ 4) Многочисленные биохимические реакции, катализируемые повышенной влажностью
1. 1. Химические процессы разрушения предметов искусства* 1) Окисление под действием агрессивных газов атмосферы и компонентов самого произведения: O 2 , O 3 (от УФ света), H 2 S (продукт разложения белковых веществ), H 2 O 2 (в процессе окисления олиф)… 2) Обменные реакции с компонентами атмосферы: CO 2 - H 2 CO 3(продукт дыхания), SO 2 - H 2 SO 3 (продукт загрязнения от автомобильных выхлопов)… 3) Процессы старения и деструкции полимерных веществ 4) Многочисленные биохимические реакции, катализируемые повышенной влажностью
 1. 2. Химические материалы для реставрации 1) Требования к материалам (соответствие авторскому замыслу по цвету и фактуре, долговечность, прочность ≤, обратимость) 2) Классификация материалов: • а) основные (адгезивы, консолиданты, композиции для восполнения утраченных фрагментов, материалы для защитных покрытий) б) вспомогательные (бумага, пленки, растворители, составы для удаления загрязнений…)
1. 2. Химические материалы для реставрации 1) Требования к материалам (соответствие авторскому замыслу по цвету и фактуре, долговечность, прочность ≤, обратимость) 2) Классификация материалов: • а) основные (адгезивы, консолиданты, композиции для восполнения утраченных фрагментов, материалы для защитных покрытий) б) вспомогательные (бумага, пленки, растворители, составы для удаления загрязнений…)
 1. 3. Физико-химические процессы и подходы при реставрации* 1) 2) 3) 4) 5) 6) Возникновение и изменение цветности Смачиваемость и адгезия материалов Растворение в водных и неводных средах Химическая совместимость материалов Механизм полимеризации Выбор консервантов и антисептиков… ****** 1) Расчет концентрации 2) Приготовление растворов 3) Контроль кислотности …
1. 3. Физико-химические процессы и подходы при реставрации* 1) 2) 3) 4) 5) 6) Возникновение и изменение цветности Смачиваемость и адгезия материалов Растворение в водных и неводных средах Химическая совместимость материалов Механизм полимеризации Выбор консервантов и антисептиков… ****** 1) Расчет концентрации 2) Приготовление растворов 3) Контроль кислотности …
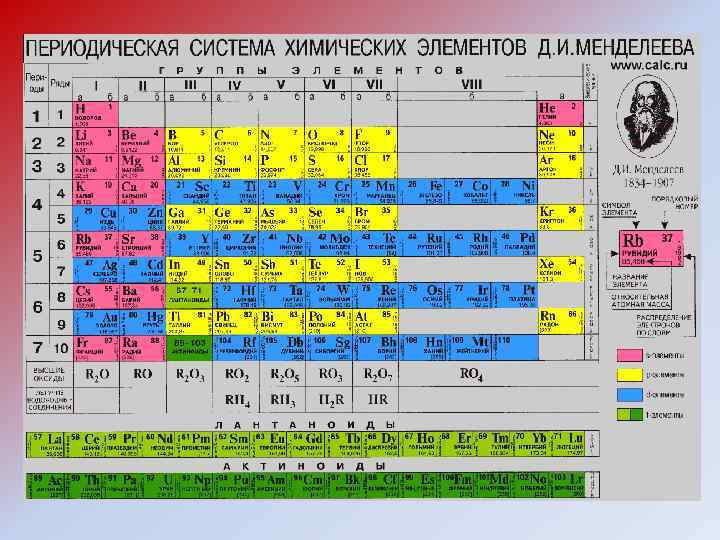
 2. 1. Понятие моля и таблица Менделеева • В химии реакции не между массами, а между кратным количеством молекул 2 H 2 + O 2 = H 2 O => необходимость понятия количества вещества • Моль – единица КВ (т. е. определяется не одинаковой массой, а одинаковым КВ, состоящего из молекул). • Относительные атомные массы в таблице М. (водороднаякислородная-углеродная шкалы). Очевидно, одинаковые КВ разных веществ соотносятся как их относительные молекулярные массы • Масса 1 моля в г = массе 1 молекулы в а. е. м. (по таблице Менделеева) • СЛЕДСТВИЕ (!): 1 моль содержит NA = 6, 02∙ 1023 частиц (результат деления массы моля на определенную много позже массу молекулы) • ПРИМЕНЕНИЕ: Расчет числа молей n = mi /Mi • ДОПОЛНЕНИЕ : 1 г-экв = 1 моль/валентность. Пример 1 г-экв HCl = 1 моль HCl; 1 г-экв H 2 SO 4 = 0, 5 моль H 2 SO 4
2. 1. Понятие моля и таблица Менделеева • В химии реакции не между массами, а между кратным количеством молекул 2 H 2 + O 2 = H 2 O => необходимость понятия количества вещества • Моль – единица КВ (т. е. определяется не одинаковой массой, а одинаковым КВ, состоящего из молекул). • Относительные атомные массы в таблице М. (водороднаякислородная-углеродная шкалы). Очевидно, одинаковые КВ разных веществ соотносятся как их относительные молекулярные массы • Масса 1 моля в г = массе 1 молекулы в а. е. м. (по таблице Менделеева) • СЛЕДСТВИЕ (!): 1 моль содержит NA = 6, 02∙ 1023 частиц (результат деления массы моля на определенную много позже массу молекулы) • ПРИМЕНЕНИЕ: Расчет числа молей n = mi /Mi • ДОПОЛНЕНИЕ : 1 г-экв = 1 моль/валентность. Пример 1 г-экв HCl = 1 моль HCl; 1 г-экв H 2 SO 4 = 0, 5 моль H 2 SO 4
 2. 2. Способы выражения концентрации растворов 1) Массовая доля = процентная концентрация ω = (mв-ва/mр-ра)∙ 100%, Иначе – масса в-ва в 100 г раствора (!) 2) Молярность (c) – количество молей в 1 л (1 дм 3) раствора c = n/V(л) 3) Нормальность – количество г-экв в 1 л раствора !) Пересчет из (1) в (2 -3) и наоборот требует знания плотности d готового раствора (вывести формулу!) ci= ωid∙ 1000/Mi (массовая доля в десятичной дроби) или ci= ωid ∙ 1000/100% ∙ Mi (массовая доля в процентах) (d можно считать равной плотности растворителя только для очень разбавленных растворов)
2. 2. Способы выражения концентрации растворов 1) Массовая доля = процентная концентрация ω = (mв-ва/mр-ра)∙ 100%, Иначе – масса в-ва в 100 г раствора (!) 2) Молярность (c) – количество молей в 1 л (1 дм 3) раствора c = n/V(л) 3) Нормальность – количество г-экв в 1 л раствора !) Пересчет из (1) в (2 -3) и наоборот требует знания плотности d готового раствора (вывести формулу!) ci= ωid∙ 1000/Mi (массовая доля в десятичной дроби) или ci= ωid ∙ 1000/100% ∙ Mi (массовая доля в процентах) (d можно считать равной плотности растворителя только для очень разбавленных растворов)
 2. 3. Плотность и способы ее определения • Плотность (density) d = m/V (г/мл = кг/л) • Основные методы денсиметрии: 1) Непосредственный – взвешиванием фиксированного объема (в пикнометре) 2) Гидростатический - сравнительный (погружение ареометра) 3) На основании изменения иных физических свойств для известных веществ (оптический, акустический и др. ) 4) На основании закона Архимеда, замеряя вес на воздухе и в дист. воде (для тв. веществ)
2. 3. Плотность и способы ее определения • Плотность (density) d = m/V (г/мл = кг/л) • Основные методы денсиметрии: 1) Непосредственный – взвешиванием фиксированного объема (в пикнометре) 2) Гидростатический - сравнительный (погружение ареометра) 3) На основании изменения иных физических свойств для известных веществ (оптический, акустический и др. ) 4) На основании закона Архимеда, замеряя вес на воздухе и в дист. воде (для тв. веществ)
 2. 4. Методы измерения концентрации растворов* 1) 2) 3) 4) 5) 6) 7) 8) 9) Выпаривание - взвешивание Осаждение и взвешивание (иногда и сжигание фильтра) Денсиметрический (для известных веществ) Вискозиметрический (клеи, лаки, краски…) По изменению температуры кипения или замерзания Индикаторный (не только кислоты-щелочи) Кислотно-основное титрование Окислительно-восстановительное титрование Хроматографические методы (анализ многокомпонентных растворов) 10) Спектрофотометрический 11) Прочие физические методы (масс-спектрометрия, ЯМР, электрохимические методы, селективные датчики…)
2. 4. Методы измерения концентрации растворов* 1) 2) 3) 4) 5) 6) 7) 8) 9) Выпаривание - взвешивание Осаждение и взвешивание (иногда и сжигание фильтра) Денсиметрический (для известных веществ) Вискозиметрический (клеи, лаки, краски…) По изменению температуры кипения или замерзания Индикаторный (не только кислоты-щелочи) Кислотно-основное титрование Окислительно-восстановительное титрование Хроматографические методы (анализ многокомпонентных растворов) 10) Спектрофотометрический 11) Прочие физические методы (масс-спектрометрия, ЯМР, электрохимические методы, селективные датчики…)
 2. 5. Вода в химии* 1) 2) 3) 4) 5) 6) 7) 8) 9) Вода - самый известный растворитель неорг. , орг. соединений и даже газов (особенно реагирующих с водой CO 2, SO 2, NH 3, HCl, Cl 2…) Вода - катализатор и участник многих реакций, особенно в неорг. химии (все реакции ионного обмена идут в воде) Без воды нет ни кислот ни оснований (HCl-просто газ, а Na. OH – твердый порошок) Вода является одновременно и кислотой и основанием (H 2 O = H+ + OH- ) За счет такой двойственной природы вода не только растворяет, но и разрушает многие соли (гидролиз) Несмотря на (4), на воздухе р. Н воды всегда < 7 и падает до 5 -5, 5 (поглощение CO 2 с образованием H 2 CO 3) Все предметы на воздухе ВСЕГДА покрыты тонкой пленкой воды Многие минералы в сухой атмосфере меняют цвет и разрушаются , терять свойства могут и с некоторые полимеры Вода - основная среда для жизнедеятельности живых существ, включая бактерии, грибы и др. , выделяющих продукты жизнедеятельности, меняющих «кислотно-щелочной балланс»
2. 5. Вода в химии* 1) 2) 3) 4) 5) 6) 7) 8) 9) Вода - самый известный растворитель неорг. , орг. соединений и даже газов (особенно реагирующих с водой CO 2, SO 2, NH 3, HCl, Cl 2…) Вода - катализатор и участник многих реакций, особенно в неорг. химии (все реакции ионного обмена идут в воде) Без воды нет ни кислот ни оснований (HCl-просто газ, а Na. OH – твердый порошок) Вода является одновременно и кислотой и основанием (H 2 O = H+ + OH- ) За счет такой двойственной природы вода не только растворяет, но и разрушает многие соли (гидролиз) Несмотря на (4), на воздухе р. Н воды всегда < 7 и падает до 5 -5, 5 (поглощение CO 2 с образованием H 2 CO 3) Все предметы на воздухе ВСЕГДА покрыты тонкой пленкой воды Многие минералы в сухой атмосфере меняют цвет и разрушаются , терять свойства могут и с некоторые полимеры Вода - основная среда для жизнедеятельности живых существ, включая бактерии, грибы и др. , выделяющих продукты жизнедеятельности, меняющих «кислотно-щелочной балланс»
 2. 6. Иллюстрация двойственного действия воды и необходимости ее оптимального количества* Аналогичные изменения можно представить и для некоторых органических полимеров (порошокклей(лак)-раствор). 1) В водном растворе Cu. SO 4 распадается в результате гидролиза: 2 Cu. SO 4 + 2 H 2 O = (Cu. OH)2 SO 4 + H 2 SO 4 2) Во влажной атмосфере кристаллогидрат Cu. SO 4∙ 5 H 2 O – яркоголубые кристаллы 3) В сухой атмосфере они теряют воду, разрушаются и превращаются в белый порошок Cu. SO 4 (может служить индикатором влажности) Итак: Cu. SO 4 <- Cu. SO 4∙ 5 H 2 O -> (Cu. OH)2 SO 4 порошок кристалл распад сухо <- влажно -> сыро
2. 6. Иллюстрация двойственного действия воды и необходимости ее оптимального количества* Аналогичные изменения можно представить и для некоторых органических полимеров (порошокклей(лак)-раствор). 1) В водном растворе Cu. SO 4 распадается в результате гидролиза: 2 Cu. SO 4 + 2 H 2 O = (Cu. OH)2 SO 4 + H 2 SO 4 2) Во влажной атмосфере кристаллогидрат Cu. SO 4∙ 5 H 2 O – яркоголубые кристаллы 3) В сухой атмосфере они теряют воду, разрушаются и превращаются в белый порошок Cu. SO 4 (может служить индикатором влажности) Итак: Cu. SO 4 <- Cu. SO 4∙ 5 H 2 O -> (Cu. OH)2 SO 4 порошок кристалл распад сухо <- влажно -> сыро
![2. 7. Кислотно-основная диссоциация Кислота: HA = H+ + АКкисл = [H+]∙[A-]/[HA] Для слабых 2. 7. Кислотно-основная диссоциация Кислота: HA = H+ + АКкисл = [H+]∙[A-]/[HA] Для слабых](https://present5.com/presentation/-96226480_437265562/image-12.jpg) 2. 7. Кислотно-основная диссоциация Кислота: HA = H+ + АКкисл = [H+]∙[A-]/[HA] Для слабых кислот Ккисл = αс∙ αс/(1 -α)с , Ккисл ≈ α 2 с, α ≈ (Ккисл/c)1/2 т. е. степень диссоциации растет с разбавлением Общая кислотность - [Нобщ] определяется общей молярной концентрацией H+, способных участвовать в реакции нейтрализации или замещения, т. е. равна нормальной концентрации кислоты (одинакова для 0, 1 М HCl, 0, 05 М H 2 SO 4 и 0, 1 М CH 3 COOH ) Активная кислотность [Н*] раствора определяется молярной концентрацией свободных (диссоциированных) ионов водорода (α∙Cкты). В данном случае равна 0, 1 М для сильных кислот и 0, 001 для уксусной. Основание: BOH = B+ + OHКосн = [B+ ]∙[OH]/[BOH] Вода: H 2 O = H+ + OHКводы = [H+]∙[OH-]/[H 2 O] Но [H 2 O] = const =(? ) => [H+]∙[OH-]=const=10 -14 (M 2) (это называется ионное произведение воды) Определение: p. H = -lg [H+]; p. OH = -lg [OH-]; p. K = -lg. Kкисл Следствия: p. H=14 – p. OH, нейтральная среда р. Н=7 Пример: 10 м. М Na. OH имеет p. OH=2 => p. H=12
2. 7. Кислотно-основная диссоциация Кислота: HA = H+ + АКкисл = [H+]∙[A-]/[HA] Для слабых кислот Ккисл = αс∙ αс/(1 -α)с , Ккисл ≈ α 2 с, α ≈ (Ккисл/c)1/2 т. е. степень диссоциации растет с разбавлением Общая кислотность - [Нобщ] определяется общей молярной концентрацией H+, способных участвовать в реакции нейтрализации или замещения, т. е. равна нормальной концентрации кислоты (одинакова для 0, 1 М HCl, 0, 05 М H 2 SO 4 и 0, 1 М CH 3 COOH ) Активная кислотность [Н*] раствора определяется молярной концентрацией свободных (диссоциированных) ионов водорода (α∙Cкты). В данном случае равна 0, 1 М для сильных кислот и 0, 001 для уксусной. Основание: BOH = B+ + OHКосн = [B+ ]∙[OH]/[BOH] Вода: H 2 O = H+ + OHКводы = [H+]∙[OH-]/[H 2 O] Но [H 2 O] = const =(? ) => [H+]∙[OH-]=const=10 -14 (M 2) (это называется ионное произведение воды) Определение: p. H = -lg [H+]; p. OH = -lg [OH-]; p. K = -lg. Kкисл Следствия: p. H=14 – p. OH, нейтральная среда р. Н=7 Пример: 10 м. М Na. OH имеет p. OH=2 => p. H=12
 2. 8. Способы определения р. Н среды* 1) Индикаторный (специфические и универсальные индикаторы, индикаторная бумага) 2) Инструментальный (селективный р. Н электрод) 3) Органолептический (язык для кислой среды, пальцы – для щелочной ) 4) Аварийный-нейтрализующий (сода, мел и пр. для кислот, аммонийные соли для щелочей)
2. 8. Способы определения р. Н среды* 1) Индикаторный (специфические и универсальные индикаторы, индикаторная бумага) 2) Инструментальный (селективный р. Н электрод) 3) Органолептический (язык для кислой среды, пальцы – для щелочной ) 4) Аварийный-нейтрализующий (сода, мел и пр. для кислот, аммонийные соли для щелочей)
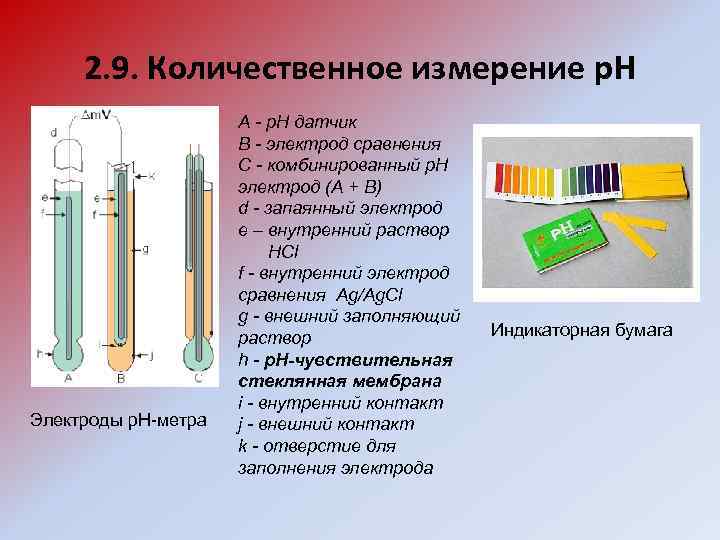 2. 9. Количественное измерение р. Н Электроды р. Н-метра A - p. H датчик B - электрод сравнения C - комбинированный p. H электрод (A + B) d - запаянный электрод e – внутренний раствор HCl f - внутренний электрод сравнения Ag/Ag. Cl g - внешний заполняющий раствор h - p. H-чувствительная стеклянная мембрана i - внутренний контакт j - внешний контакт k - отверстие для заполнения электрода Индикаторная бумага
2. 9. Количественное измерение р. Н Электроды р. Н-метра A - p. H датчик B - электрод сравнения C - комбинированный p. H электрод (A + B) d - запаянный электрод e – внутренний раствор HCl f - внутренний электрод сравнения Ag/Ag. Cl g - внешний заполняющий раствор h - p. H-чувствительная стеклянная мембрана i - внутренний контакт j - внешний контакт k - отверстие для заполнения электрода Индикаторная бумага
![2. 10. Диссоциация солей и произведение растворимости AB = A++B- Kp= [A+]∙[B-]/[AB] Если соль 2. 10. Диссоциация солей и произведение растворимости AB = A++B- Kp= [A+]∙[B-]/[AB] Если соль](https://present5.com/presentation/-96226480_437265562/image-15.jpg) 2. 10. Диссоциация солей и произведение растворимости AB = A++B- Kp= [A+]∙[B-]/[AB] Если соль труднорастворимая, то ее раствор – всегда насыщенный (т. е. [AB]=const), тогда: [A+]∙[B-]= K = ПРAB По величине ПР можно судить о степени растворимости солей и возможности растворения осадков (ионные реакции обмена идут до конца если…? ): XCO 3 + Na 2 SO 4 = XSO 4 +Na 2 CO 3 (X=Ca, Ba) ПРCa. CO 3 = 5∙ 10 -9, ПРCa. SO 4= 6∙ 10 -5 (влево) ПРBa. CO 3 = 8∙ 10 -9, ПРBa. SO 4= 1∙ 10 -10 (вправо)
2. 10. Диссоциация солей и произведение растворимости AB = A++B- Kp= [A+]∙[B-]/[AB] Если соль труднорастворимая, то ее раствор – всегда насыщенный (т. е. [AB]=const), тогда: [A+]∙[B-]= K = ПРAB По величине ПР можно судить о степени растворимости солей и возможности растворения осадков (ионные реакции обмена идут до конца если…? ): XCO 3 + Na 2 SO 4 = XSO 4 +Na 2 CO 3 (X=Ca, Ba) ПРCa. CO 3 = 5∙ 10 -9, ПРCa. SO 4= 6∙ 10 -5 (влево) ПРBa. CO 3 = 8∙ 10 -9, ПРBa. SO 4= 1∙ 10 -10 (вправо)
 3. Контрольные задания: 1) Пользуясь величиной NA и таблицей Менделеева (вообще-то не нужна) рассчитать массу 1 атома водорода 2) Рассчитать %ную и молярную концентрацию воды в воде. Плотность воды 1 г/мл. Определить К диссоциации воды. 3) Пересчитать концентрацию 0, 15 М раствора Na. Cl в процентную (плотность раствора 1, 1 г/мл) 4) Рассчитать процентную концентрацию компонентов раствора, состоящего из 1 -й вес. части А, 2 -х в. ч. Б и 4 -х в. ч. растворителя 5) Концентрация раствора a больше концентрации b на 67%. Насколько % концентрация b меньше концентрации a. 6) Найти концентрацию смеси растворов из 2 кг 70% и 1 кг 50% 7) Сколько надо воды, чтобы из 10 г 4% р-ра сделать 15% р-р? 8) Определить р. Н раствора, содержащего 10 -3 М Ba(OH)2 9) Можно ли высокой концентрацией (1 М) слабой кислоты (p. K=5) создать р. Н =1 (как у сильной кислоты)?
3. Контрольные задания: 1) Пользуясь величиной NA и таблицей Менделеева (вообще-то не нужна) рассчитать массу 1 атома водорода 2) Рассчитать %ную и молярную концентрацию воды в воде. Плотность воды 1 г/мл. Определить К диссоциации воды. 3) Пересчитать концентрацию 0, 15 М раствора Na. Cl в процентную (плотность раствора 1, 1 г/мл) 4) Рассчитать процентную концентрацию компонентов раствора, состоящего из 1 -й вес. части А, 2 -х в. ч. Б и 4 -х в. ч. растворителя 5) Концентрация раствора a больше концентрации b на 67%. Насколько % концентрация b меньше концентрации a. 6) Найти концентрацию смеси растворов из 2 кг 70% и 1 кг 50% 7) Сколько надо воды, чтобы из 10 г 4% р-ра сделать 15% р-р? 8) Определить р. Н раствора, содержащего 10 -3 М Ba(OH)2 9) Можно ли высокой концентрацией (1 М) слабой кислоты (p. K=5) создать р. Н =1 (как у сильной кислоты)?
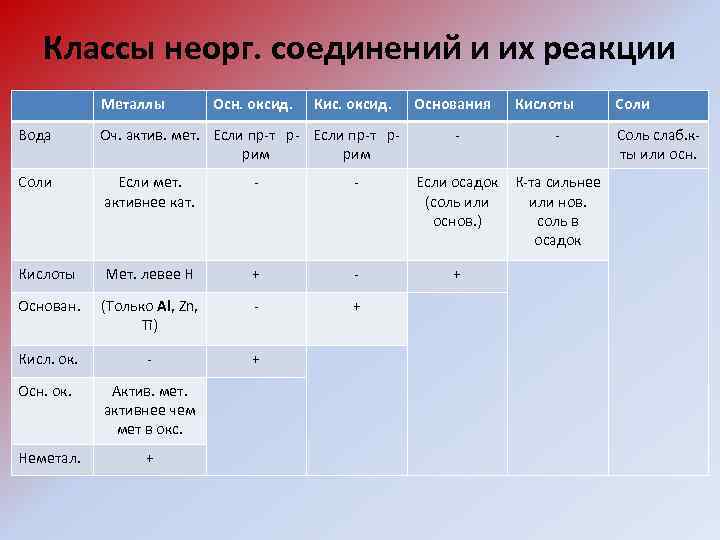 Классы неорг. соединений и их реакции Металлы Осн. оксид. Кис. оксид. Вода Оч. актив. мет. Если пр-т р- Если пр-т ррим Соли Если мет. активнее кат. - - Кислоты Мет. левее Н + - Основан. (Только Al, Zn, Ti) - + Кисл. ок. - + Осн. ок. Актив. мет. активнее чем мет в окс. Неметал. + Основания - Кислоты - Если осадок К-та сильнее (соль или нов. основ. ) соль в осадок + Соли Соль слаб. кты или осн.
Классы неорг. соединений и их реакции Металлы Осн. оксид. Кис. оксид. Вода Оч. актив. мет. Если пр-т р- Если пр-т ррим Соли Если мет. активнее кат. - - Кислоты Мет. левее Н + - Основан. (Только Al, Zn, Ti) - + Кисл. ок. - + Осн. ок. Актив. мет. активнее чем мет в окс. Неметал. + Основания - Кислоты - Если осадок К-та сильнее (соль или нов. основ. ) соль в осадок + Соли Соль слаб. кты или осн.


