Лк1 Общ.понятия осн.зак химии.ppt
- Количество слайдов: 36

ЛЕКЦИИ ПО ДИСЦИПЛИНЕ «ХИМИЯ» ЛЕКТОР: к. б. н. , доцент Орозбаева Жылдыз Мариповна

Lectures on "Chemistry" • Lecturer: Ph. D, assistant professor Orozbaeva Jyldyz Maripovna

3. 1 Список рекомендуемой литературы Основная: • 1 Ершов Ю. А. Общая химия. Биофизическая химия. Химия биогенных элементов / Ю. А. Ершов, В. А. Попков, А. С. Берменд и др. : Учеб. для мед. спец. вузов. Под. ред. Ю. А. Ершова. М. : Высш. шк. , 2007. 559 с. • 2 Слесарев В. И. Химия: Основы Химии живого: Учебник для вузов. СПб: Химиздат, 2006, 2001. 784 с. • 3 Глинка Н. Л. Задачи и упражнения по общей химии. М. : Интеграл-Пресс, 2006.

• Дополнительная: • 1 Коровин В. Н Общая химия. М. : ВШ. , 2007. 556 с. • 2 Глинка Н. Л. Общая химия. М. : Химия, 2002. 727 с.

3. 1 List of recommended literature Summary: • 1 Ershov YA General Chemistry. Biophysical Chemistry of nutrients / Yu. A. Ershov, V. A. Popkov, A. S. Bermend et al. : Proc. for honey. spec. universities. Under. Ed. Yu. A. Ershova. M. : Higher. wk. , 2007. 559 s. • 2 Slesarev VI Chemistry: Principles of Chemistry of the living: Textbook for universities. St. Petersburg: Himizdat 2006, 2001. 784 s. • 3 Glinka NL Problems and exercises in general chemistry. M. : Integral Press, 2006. 240 s.

• Additional: • 1 Korovin VN General Chemistry. M. : HS. , 2007. 556 s. • 2 Glinka NL General Chemistry. M. : Chemistry, 2002. 727 s.

Лекция № 1. Тема: ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ • 1. 1. Определение химии. Предмет химии. Её связь с другими науками. Значение химии в изучении природы и развитии медицины. • Химия – это наука о веществах и законах их превращений.

1. Basic concepts and laws of Chemistry • 1. 1. Determination chemistry. The subject of chemistry. Its relationship with other sciences. The value of chemistry in the study of nature and the development of medicine. • Chemistry - the science of substances and the laws of their transformations.

1. 2. Основные понятия химии • Объектом изучения в химии являются химические элементы и их соединения. • Химическим элементом называют вид атомов с одинаковым зарядом ядер. Атом – наименьшая частица элемента, обладающая его химическими свойствами.

• Молекулой называют наименьшую частицу индивидуального вещества, способную к самостоятельному существованию, обладающую его основными химическими свойствами и состоящую из одинаковых или различных атомов.

1. 2. Basic Concepts of Chemistry • The object of study in chemistry are chemical elements and their compounds. • Chemical elements called atoms with the same kind of nuclear charge. Atom - the smallest particle of an element having its chemical properties.

• Molecule is the smallest particle of an individual substance that is capable of independent existence, having its principal chemical properties and consisting of the same or different atoms.

• Если молекулы состоят из одинаковых атомов, то вещество называют простым или элементарным, например He, Ar, H 2, O 2 , S 4. • Если молекула вещества состоит из разных атомов, то вещество называют сложным (или химическим соединением), например CO, H 2 O , H 3 PO 4.

• If the molecules are composed of the same atoms, or a simple substance called elementary e. g. He, Ar, H 2, O 2, S 4. • If the molecule is a substance composed of different atoms, the substance is called the complex (chemical or compound), such as CO, H 2 O, H 3 PO 4.

Количество вещества ( ) – это число структурных единиц (атомов, молекул, ионов, эквивалентов, электронов и т. д. ) в системе. Единицей измерения количества вещества является моль. Моль – количество вещества, которое содержит столько определенных структурных единиц, сколько атомов содержится в 12 г изотопа углерода 12 С. Число структурных единиц, содержащихся в 1 моле любого вещества в любом агрегатном состоянии, есть постоянная Авогадро: NA=6, 02*1023 моль-1.

• The amount of substance ( ) - is the number of structural units (atoms, molecules, ions, equivalents, electrons, etc. ) in the system. The unit of measurement of the amount of substance is the mole. Mole - amount of substance that contains as many specific structural units, how many atoms contained in 12 g of carbon isotope 12 C. Number of structural units contained in one mole of any substance in any aggregate state, has the Avogadro constant: NA = 6, 02 * 1023 mol-1.

• Молярная масса (М) – это масса 1 моль вещества, равная отношению массы вещества (m) к его количеству ( ): • М=m/.
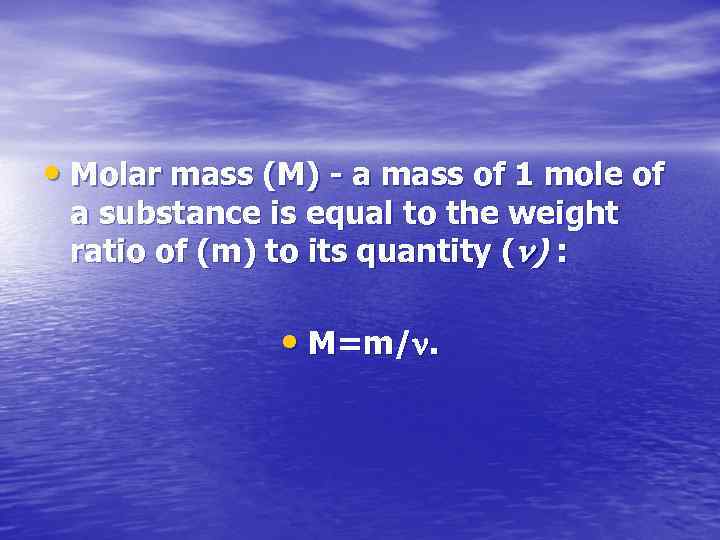
• Molar mass (M) - a mass of 1 mole of a substance is equal to the weight ratio of (m) to its quantity ( ) : • М=m/.

• Эквивалент (Э) – это реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим образом эквивалентна (равноценна) одному иону водорода в кислотно-основных или ионно-обменных реакциях или одному электрону в окислительно-восстановительных реакциях (ОВР).

• The equivalent of (E) - this is a real or notional particle of matter that can replace, append, or release be in any other way is equivalent to (equivalent) one hydrogen ion in acid-base and ionexchange reactions, or one electron in redox reactions (OVR).

Рассмотрим несколько примеров определения формулы эквивалента: • А. 2 Na. OH+H 2 SO 4 =2 H 2 O+Na 2 SO 4. • Краткое ионно-молекулярное уравнение процесса: • 2 OH- +2 H+ =2 H 2 O. • В данной ионообменной реакции участвуют два • • иона водорода. На один ион водорода приходится: Na. OH+1/2 H 2 SO 4=H 2 O+1/2 Na 2 SO 4, т. е. одному иону водорода соответствует одна молекула Na. OH, 1/2 молекулы H 2 SO 4, одна молекула H 2 O, 1/2 молекулы Na 2 SO 4. Поэтому Э(Na. OH)=Na. OH; Э(H 2 SO 4)=1/2 H 2 SO 4; Э(H 2 O)=H 2 O; Э(Na 2 SO 4)=1/2 Na 2 SO 4.

Consider a few examples of the definition of equivalent formulas: • A. 2 Na. OH + H 2 SO 4 = 2 H 2 O + Na 2 SO 4. • Short-ionic equation of the process: • 2 OH- + 2 H + = 2 H 2 O. • This ion exchange reaction involving two hydrogen • • ions. One hydrogen ion is necessary: Na. OH + 1 / 2 H 2 SO 4 = H 2 O + 1 / 2 Na 2 SO 4, ie one corresponds to a hydrogen ion molecule Na. OH, 1/2 molecule H 2 SO 4, one molecule of H 2 O, 1/2 molecule Na 2 SO 4. Therefore, E (Na. OH) = Na. OH; E (H 2 SO 4) = 1 / 2 H 2 SO 4; E (H 2 O) = H 2 O; E (Na 2 SO 4) = 1 / 2 Na 2 SO 4.

• Для расчета молярной массы эквивалента • • вещества можно использовать следующие формулы: 1. Для простого вещества: Мэ=МА/В, где МА – молярная масса атомов данного вещества; В – валентность атома, например, Мэ(Al)=27/3=9 г/моль. 2. Для сложного вещества: Мэ=М/В*n, где В – валентность функциональной группы; n – число функциональных групп в формуле молекулы вещества.

• For the calculation of molar mass equivalent • • • substance can be used the following formula: 1. For a simple substance: ME = MA / B where MA - molar mass of the atoms of the substance; B - the valence of the atom, such as Mae (Al) = 27/3 = 9 g / mol. 2. For a complex matter: ME = M / V * n, where C - a valence functional group; n number of functional groups in formula solute molecules.

1. 3. Основные законы химии • 1. Закон сохранения массы веществ ( М. В. Ломоносов; 1756 г. ): • масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции.

1. 3. Basic laws of chemistry • 1. The law of conservation of mass (MV Lomonosov, 1756): • weight substances, unreacted equal weight substances formed by the reaction.

2. Закон постоянства состава. • Имеет различные формулировки: • состав соединений молекулярной структуры является постоянным независимо от способа получения (более точная современная формулировка); • любое сложное вещество независимо от способа его получения имеет постоянный качественный и количественный состав; • соотношения между массами элементов, входящих в состав данного соединения , постоянны и не зависят от способа получения этого соединения.

2. Law of definite proportions. • Has a different wording: • • the composition of the molecular structure of • • the compounds is constant regardless of the preparation process (a more accurate modern formulation); • any complex substance regardless of the method of preparation has a constant qualitative and quantitative composition; • the ratio between the masses of the elements that make up the compound are constant and do not depend on the method of preparation of this compound.

3. Закон кратных отношений (Дальтон , 1803 г. ): • если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа.

3. The law of multiple proportions (Dalton, 1803): • if the two elements form with one another several chemical compounds, the weight of one of the elements in these compounds is attributable to one and the same weight of the other, are interconnected as small integers.

4. Закон объемных отношений (ЗАКОН ГЕЙ-ЛЮССАКА): • объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие целые числа.

4. The Law of the volume ratio (Gay-Lussac's law): • amounts of reactive gases are to each other and to the volume of the gaseous reaction products formed as small integers.

5. Закон Авогадро (1811 г. ): • в равных объемах любых газов, взятых при одной и той же температуре и при одинаковом давлении, содержится одно и то же число молекул. Постоянная Авогадро NA=6, 02*1023 моль -1 - число структурных единиц в одном моле вещества.

5. The law of Avogadro (1811): • equal volumes of all gases taken at the same temperature and the same pressure contained the same number of molecules. Avogadro constant NA = 6, 02 * 1023 mol -1 number of structural units in one mole of a substance.

Самостоятельная работа студента (конспект) • Тема: Химические явления и процессы (на русском и на английском).

Independent work of students (abstract) • Subject: Chemical processes and phenomena (in Russian and in English).
Лк1 Общ.понятия осн.зак химии.ppt