ВВЕДЕНИЕ и СТРОЕН. И СВ-ВА БЕЛКОВ-.ppt
- Количество слайдов: 123

лекции по биохимии зав. кафедрой биохимии, профессор В. В. Алабовский

Биологическая химия является наукой, которая изучает химический состав и превращения веществ в организме, а также устанавливает связь между данными превращениями и физиологическими процессами в органах и тканях.

Разделы биохимии: 1. Статическая биохимия 2. Динамическая биохимия 3. Функциональная биохимия

• Статическая биохимия – изучает химический состав живых организмов; • Динамическая биохимия – изучает превращения химических веществ; • Функциональная биохимия – изучает связь между биохимическими превращениями и физиологическими процессами в организме.

Роль биохимии в медицине • Дает возможность установить причину, вызывающую болезнь; • Позволяет понять закономерности, лежащие в основе протекания болезни; • Определяет конкретные места нарушений обменных процессов, вызывающих болезнь; • С помощью биохимических методик выявляются поврежденные органы, представляется возможность количественно оценить тяжесть данных нарушений;

Роль биохимии в медицине • Зная место нарушения обмена веществ, врач имеет возможность с помощью химических веществ (лекарств) устранить данные нарушения и восстановить нормальное протекание химических процессов у больного; • С помощью биохимических анализов оцениваются эффективность лечения, правильность выбора лекарств и сроки завершения лечения больного.

Академик Опарин Александр Иванович (Лауреат Ленинской премии 1974 г. ; Премии им. А. Н. Баха, Награжден Золотой медалью им. М. В. Ломоносова

Академик Баев Александрович. (Лауреат Государственной премии 1969 г)

Академик Спирин Александр Сергеевич (лауреат Ленинской премии 1976 г. Награжден медалью им. Ганса Кребса федерации Европейского биохимического общества)

Академик В. П. Скулачев

Разделы динамической биохимии Обмен углеводов Обмен белков Энергетиче ский обмен Обмен липидов Минеральный обмен

Учебники и методические пособия для студентов-медиков

1. Биохимия: Учебник /под ред. Е. С. Северина – 4 -е изд. , испр. М. : ГЭОТАР – медиа, 2005 – 784 с. : ил. 2. Наглядная биохимия: Гринстейн Б. , Гринстейн А пер. с англ. – М. : ГЭОТАР –МЕДИЦИНА. - 2000 119 с 3. Клиническая биохимия: Учебное пособие для студ. мед. вузов /под ред. Ткачука В. А. – М. ГЭОТАР МЕД, 2002. – 358 с. : ил. - ISBN 5 -92310198 -х

4. Биохимия: Учебник – 2 -е изд. /под ред. Березова Т. Т. , Коровкина Б. Ф. – М. : Медицина, 1990. – 528 с 5. Биохимия: Учебник для мед. спец. вузов /под ред. Николаева А. Я. . – М. : Высшая школа, 1989. --495 с. 6. Руководство к лабораторным занятиям по биохимии /под ред Зубаирова Д. М. , Тимербаева В. И. , Давыдова В. С. . – М – ГЭОТАР –Медиа, 2005 с. ил. 7. Ситуационные задачи по биохимии с комментарием. Алабовский В. В. /учебнометодическое пособие для студентов. , ВГМА, 2004. /часть 1 и 2/

Требования, предъявляемые к студентам на экзаменах по биохимии: 1. Иметь четкие представления об основных биохимических процессах, протекающих в организме человека. 2. Должен владеть первичными навыками клинической лабораторной диагностики по биохимическим параметрам крови, мочи и желудочного сока.

Требования, предъявляемые к студентам на экзаменах по биохимии: 3. Должен уметь читать анализы крови, мочи и желудочного сока. 4. Иметь достаточно полные представления о методах биохимического исследования крови, мочи и желудочного сока. 5. Уметь определять наличие глюкозы, белка, крови и кетоновых тел в моче.

Строение и свойства белков

Роль белков в организме • • Структурная Каталитическая Транспортная Регуляторная Защитная Гомеостатическая Депонирующая Функциональная

Уровни организации белковой молекулы • Первичная структура • Вторичная структура • Третичная структура • Четвертичная структура

Под первичной структурой белка понимают порядок соединения аминокислот в полипептидной цепи

Структура проинсулина глу лей ала глн лей гли гли гли лей глу вал ала гли ала глн про асн гли про глн ала глу арг S лиз арг гли иле S арг ала лиз про тре тир фен вал глу глн цис тре сер иле цис сер лей тир глн лей глу асн тир цис асн –СООН S S фен гли арг S S глу гли Н 2 N– фен вал асн глн гис лей цис гли сер гис лей вал глу ала лей тир лей вал цис Структура инсулина S S ала лиз про тре тир фен гли иле вал глу глн цис тре сер иле цис сер лей тир глн лей глу асн тир цис асн –СООН S S S фен гли арг S глу гли Н 2 N– фен вал асн глн гис лей цис гли сер гис лей вал глу ала лей тир лей вал цис

Строение аминокислоты H 2 N–CH–COOH | R H 2 N–CH–COOH | СН 3 Аланин (АЛА) H 2 N–CH–COOH | СН 2–ОН Серин (СЕР)

Строение некоторых аминокислот H 2 N–CH–COOH | СН 3 H 2 N–CH–COOH | СН 2–ОН Аланин (АЛА) Серин (СЕР) H 2 N–CH–COOH | CH 2 | COOH H 2 N–CH–COOH | CH 2–NH 2 Лизин (ЛИЗ) Глутаминовая кислота (ГЛУ) H 2 N–CH–COOH | СН 2–SН Цистеин (ЦИС) H 2 N–CH–COOH | CH 2 | Фенилаланин

Соединение аминокислот друг с другом О H 2 N–CH–C–OH | СН 3 + О H-N–CH–C–OH H | СН 2–ОН О О H 2 N–CH–C ––– N–CH–C–OH | СН 3 СН 2–ОН + H 2 O
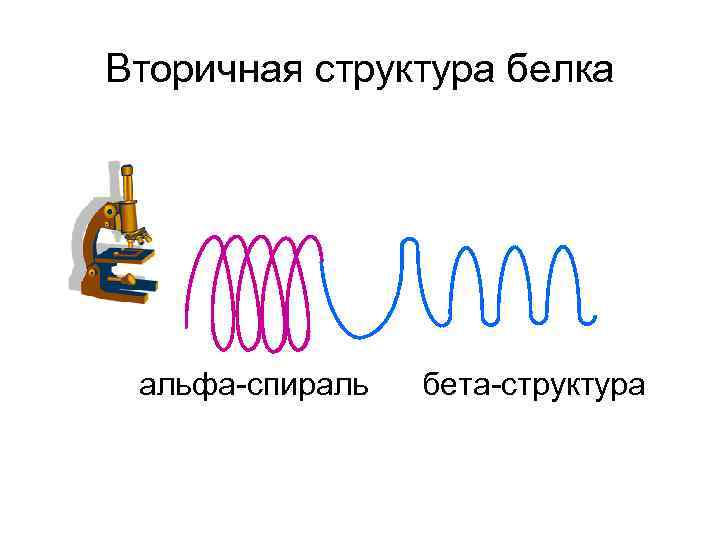
Вторичная структура белка альфа-спираль бета-структура
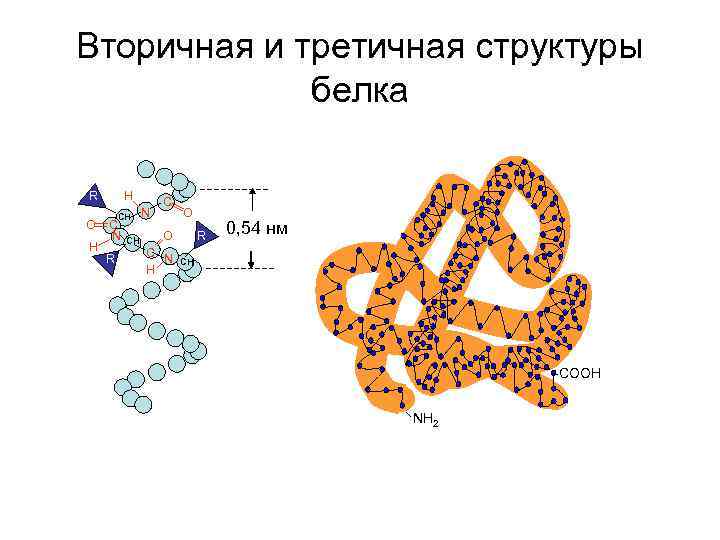
Вторичная и третичная структуры белка R O H H CH C N R CH N С O O C N H R 0, 54 нм CH -COOH NH 2

Связи, стабилизирующие третичную структуру белка NH 3+ ООС ГЛ У ИОННЫЕ СВЯЗИ ЛИ З --s-s-- ЦИС ЦИ С ДИСУЛЬФИДНЫЕ СВЯЗИ ВОДОРОДНЫЕ ГИДРОФОБНЫЕ ВЗАИМОДЕЙСТВИЯ сн 3 -сн-сн 3 вал -NH 2 Н-О-СН 2 - о Н р тир фен се СВЯЗИ
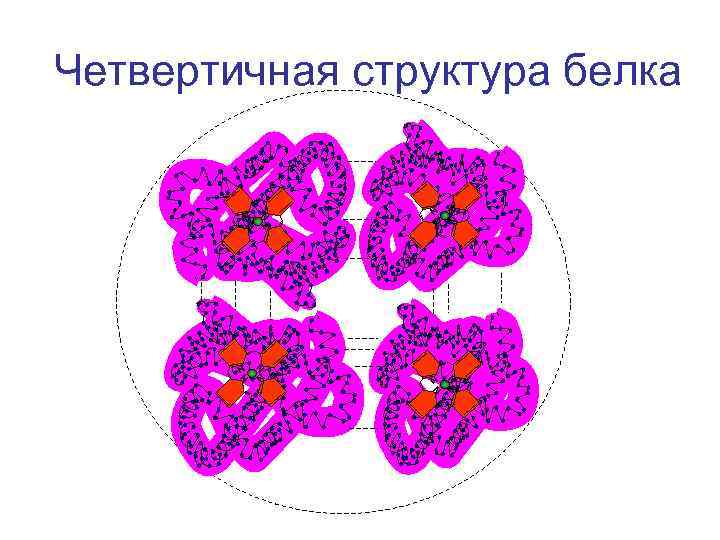
Четвертичная структура белка N N N N

Кооперативные изменения конформации протомеров гемоглобина присоединении О 2 легкие О 2 -- О 2 Венозная кровь О 2 -- О 2 О -2 -О 2 --О 2 артериальная кровь

Изменение конформации протомеров гемоглобина при отдаче О 2 тканям О 2 О 2 -- О -2 --О 2 ---О 2 О 2 артериальная кровь венозная кровь

Субъединичные структуры глутаминсинтетазы вид сбоку вид сверху

Свойства белков • Имеют разную растворимость в воде • Способны выпадать в осадок • Имеют заряды (положительные и отрицательные) • Имеют гидратную оболочку • Способны менять форму молекулы • Способны взаимодействовать между собой (принцип узнавания)

Строение гидрофильных и гидрофобных белков -СОО- -OOC- -ОН - -СН 3 Н 3 С- -СН 3 - НО- Н 2 N- -СОО-NH 2 НО- Н 3 С- -СН 3 мембрана -NH 2 -СН 3 -СОО-

Радикалы аминокислот H 2 N–CH–COOH | СН 3 аланин (АЛА) СН 2–ОН серин (СЕР) СН 2–SН цистеин (ЦИС) H 2 N–CH–COOH | CH 2 | COOH глутаминовая кислота (ГЛУ) | CH 2–NH 2 лизин (ЛИЗ) | CH 2 | фенилаланин (ФЕН)

мембрана Встраивание белков в мембраны клеток Белки мембран

Гидрофобные белки мембран клеток

Денатурация белка o t

Высаливание белков NH 4+ NH 4 CI NH 4+

Влияние кислотности среды на заряд белка --СООН белок --СОО --Растворение в воде --NH 2 --СОО -- белок Кислая среда, избыток --NH 3 + --NH 3+ белок + --NH 3+ --СООН --NH 3+ --СОО -- белок Н+ белок Щелочная среда, избыток ОН -- белок --NH 2 + Н 2 О

Движение белков в электрическом поле (электрофорез) АНОД + + + + + КАТОД --- - -
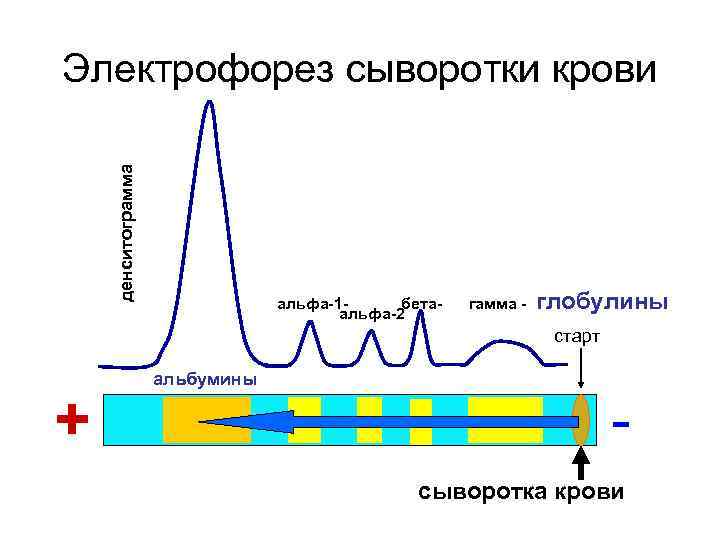
денситограмма Электрофорез сыворотки крови альфа-1 бетаальфа-2 гамма - глобулины старт + альбумины сыворотка крови

Классификация белков • Простые белки ( состоят только из аминокислот) • Сложные белки (в состав белка входят различные вещества –углеводы, липиды, нуклеотиды, металлы, витамины и др. )

Простые и сложные белки миоглобин альбумин ГЕ М

Простые белки • • • Альбумины Глобулины Протамины Гистоны Глютелины Проламины

Схема строения альбумина Гидрофобная площадка +Н +Н 2 N- -Са 2+ -СОО -СО О Са 2+

Роль альбумина • • Запасной источник аминокислот Компонент буферной системы Осмотически активный белок Переносчик жирных кислот Переносчик жирорастворимых витаминов Переносчик жирорастворимых гормонов Са-связывающий белок в сыворотке крови

Роль альбумина • • Запасной источник аминокислот Компонент буферной системы Осмотически активный белок Переносчик жирных кислот Переносчик жирорастворимых витаминов Переносчик жирорастворимых гормонов Са-связывающий белок в сыворотке крови

глобулины

α 1 -глобулиновая фракция сыворотки крови 1. антитрипсин (индикатор воспалительных заболеваний); 2. транскортин (транспорт кортикостероидов); 3. тироксин-связывающий белок.

α 2 -глобулиновая фракция сыворотки крови 1. группоспецифический глобулин 2. гаптоглобин (образует комплекс с гемоглобином)

β - глобулиновая фракция сыворотки крови 1. трансферрин; 2. гемопексин (образует комплекс с гемом); 3. фибриноген.

γ - глобулиновая фракция сыворотки крови Содержит иммунные глобулины (Ig. A; Ig. Е; Ig. М; Ig. D; Ig. G).

Роль гистонов в структуре ДНК Цепь ДНК гистоны нуклеосома

Роль протаминов и гистонов • Факторы укорочения полинуклеотидной цепи • Нейтрализуют кислотность ДНК • Являются регуляторами транскрипции (места нуклеосом являются заблокированными)

Проламины и глютелины – белки растительного происхождения


Сложные белки • Нуклеопротеиды • Липопротеиды • Хромопротеиды • Фосфопротеиды • Гликопротеиды • Белки-ферменты

Строение нуклеопротеидов

нуклеиновая кислоты ДНК РНК дезоксирибонуклеотиды д. АМФ, д. ГМФ АМФ, ГМФ д. ТМФ, д. ЦМФ УМФ, ЦМФ азотистое основание аденин, гуанин, тимин, урацил цитозин пентоза рибоза или дезоксирибоза остаток фосфорной кислоты
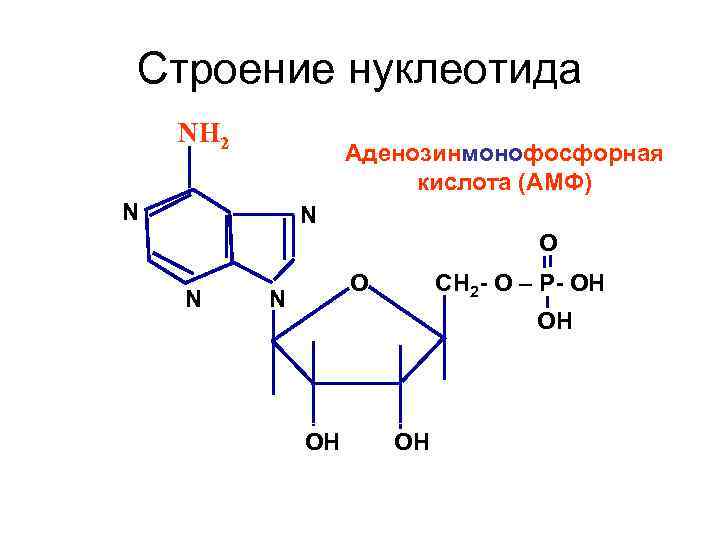
Строение нуклеотида NH 2 Аденозинмонофосфорная кислота (АМФ) N N О N СН 2 - О – Р- ОН ОН ОH ОН
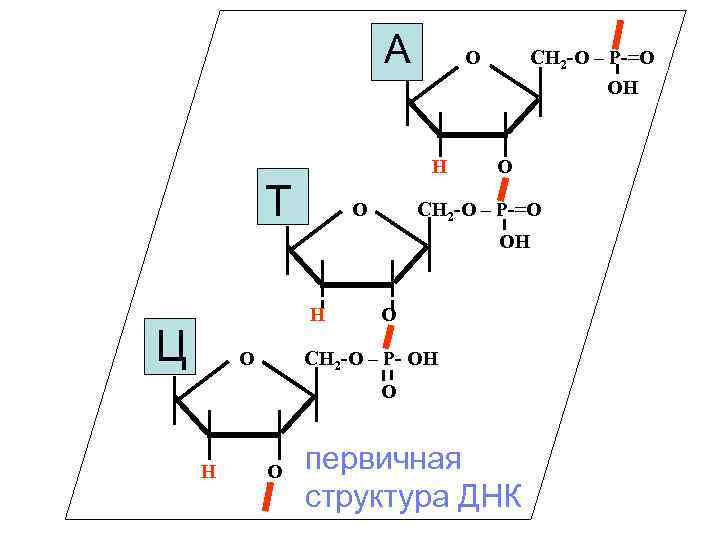
А О Н Т О СН 2 -О – Р-=О ОН H Ц О О СН 2 -О – Р- ОН О H О первичная структура ДНК

N N N Г NH 2 O N Ц NH -N O A N 2 - NH 3 C N H T O NH -N NH 2 N N Двойная спираль ДНК (вторичная структура)

Третичная структура ДНК Цепь ДНК гистоны нуклеосома

Укладка длинной цепи ДНК в хроматиновые нити

Регуляторные участки ДНК полимераза (необходима для синтеза копии ДНК или и-РНК) репрессор (блокирует синтез ДНК или и-РНК) содержит информацию о строении белка оператор промотор структурный ген

Этап инициации транскрипции. Удаление репрессора. комплекс ферментов гормон

Начало процесса транскрипции комплекс ферментов

Транскрипция гена

Транскрипция гена

Транскрипция гена

Транскрипция гена

Транскрипция гена ДНК

Транскрипция гена ДНК

Транскрипция гена ДНК -РНК и

ДНК и-РНК «первичный транскрипт»

Процессинг и-РНК интроны (не информативная часть и-РНК) экзоны (информативная часть и -РНК )

Удаление интронов с помощью «малых ядерных РНК»

Соединение экзонов между собой

Присоединение к информативной части и-РНК контактного участка «сар» и «полиаденилового хвоста» . сар А-А- - -А-А полиадениловый «хвост»

Завершение синтеза и-РНК сар А-А- - -А-А
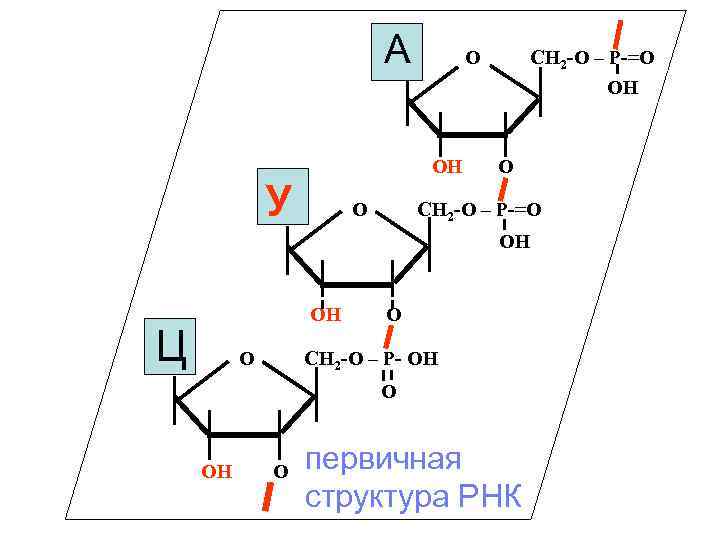
А О ОН У О СН 2 -О – Р-=О ОН ОH Ц О О СН 2 -О – Р- ОН О ОH О первичная структура РНК

Задача -1 Сколько нуклеотидов содержит информативная часть и. РНК, кодирующая белок, состоящий из 100 аминокислот?

Задача-2 Кто читает информацию, заключенную в и-РНК?
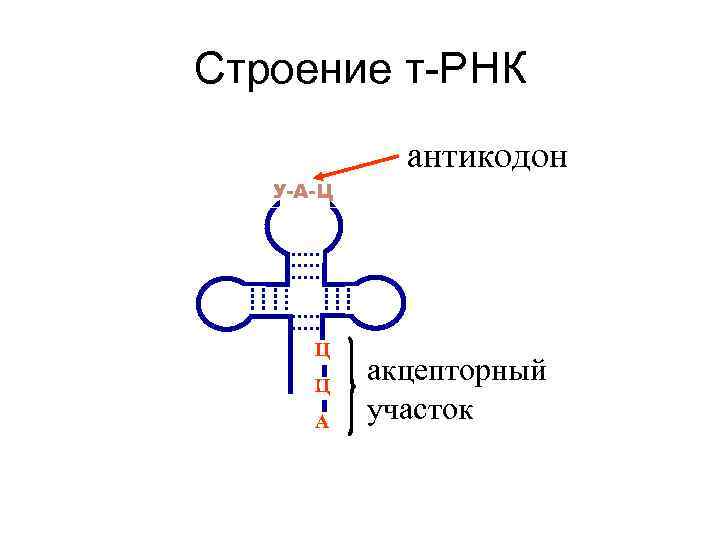
Строение т-РНК антикодон У-А-Ц Ц Ц А акцепторный участок
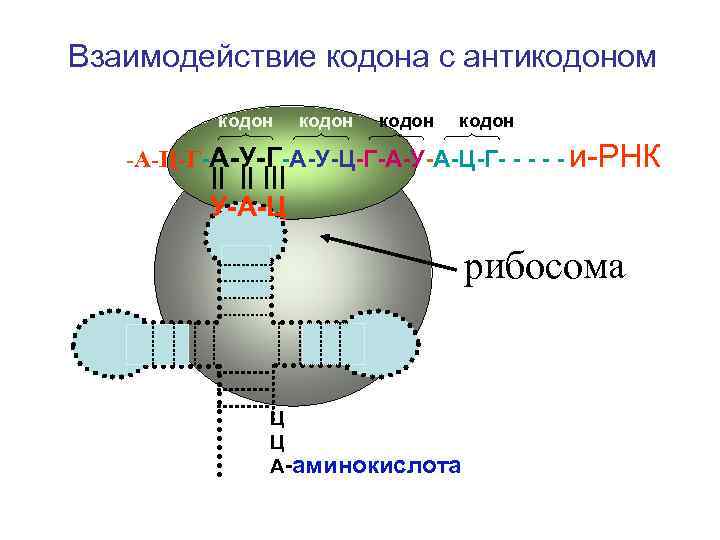
Взаимодействие кодона с антикодоном кодон -А-Ц-Г-А-У-Ц-Г-А-У-А-Ц-Г- - - и-РНК У-А-Ц рибосома Ц Ц А-аминокислота

рибосомальные РНК 18 s РНК 28 s РНК

Строение липопротеидов

Клиссификация липидов Простые Сложные Фосфолипиды триацилглицериды (жиры) глицеро- Гликолипиды цереброзиды Стериды ганглиозиды фосфолипиды сфинголипиды сульфатиды
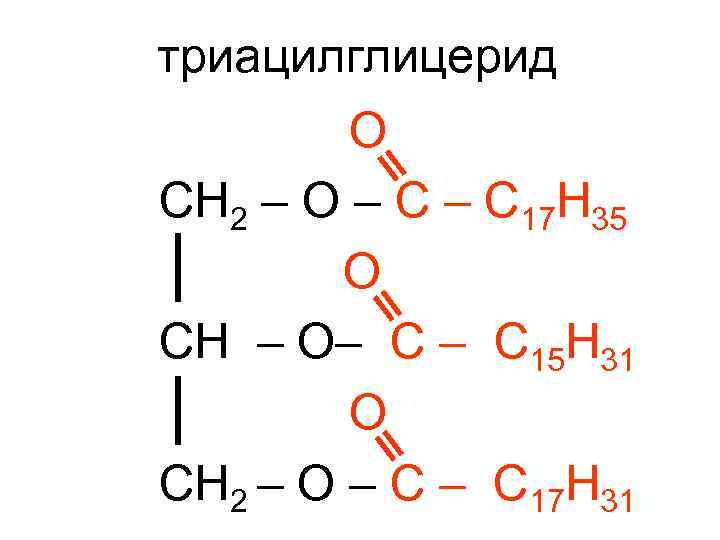
триацилглицерид О СН 2 – О – С 17 Н 35 О СН – О– С 15 Н 31 О СН 2 – О – С 17 Н 31

Формулы высших жирных кислот С 15 Н 31 СООН – пальмитиновая кислота С 17 Н 35 СООН – стеариновая кислота С 17 Н 33 СООН – олеиновая кислота С 17 Н 31 СООН – линолевая кислота С 17 Н 29 СООН – линоленовая кислота С 19 Н 31 СООН – арахидоновая кислота

ХИМИЧЕСКАЯ СТРУКТУРА ФОСФОЛИПИДА (CН 3)3 О N+ СН 2 -О-С СН 2 О СН 2 СН -О-С СН 3 О -О-Р-О СН 2 О гидрофильная часть гидрофобная часть молекулы (остатки двух жирных кислот)

Строение сфингомиелина СН 2 - ОН СН – NН 2 СН – ОН СН СН Р холин жирная кислота СН 3

Строение галактоцереброзида о СН 2 ОН он СН 2 - О он СН – NН- С – С 17 Н 29 СН – ОН О СН СН он СН 3

Строение фосфатидилинозитола ОН ОН О СН 2 – О – С НО ОН О СН – О –С – О–Р О О СН 2 СН 3

ХОЛЕСТЕРИН СН 3 СН 3 НО

ЭФИР ХОЛЕСТЕРИНА СН 3 С 17 Н 31 С=О О СН 3

Строение фосфолипидной молекулы Гидрофильная часть гидрофообная часть
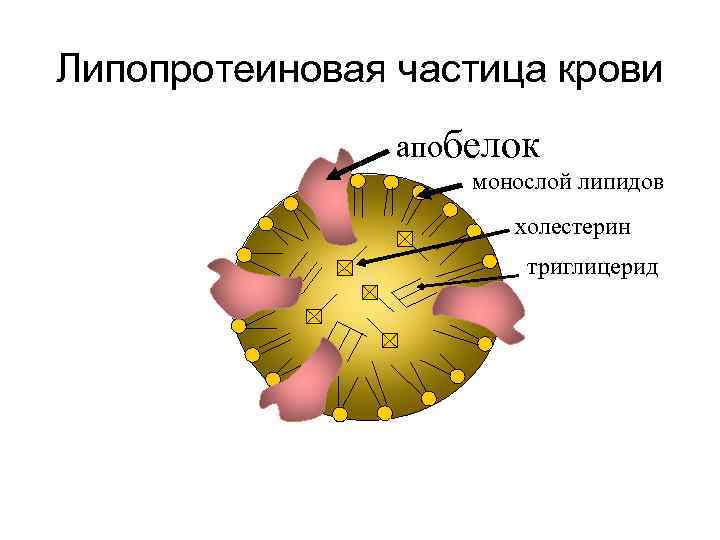
Липопротеиновая частица крови апобелок монослой липидов холестерин триглицерид
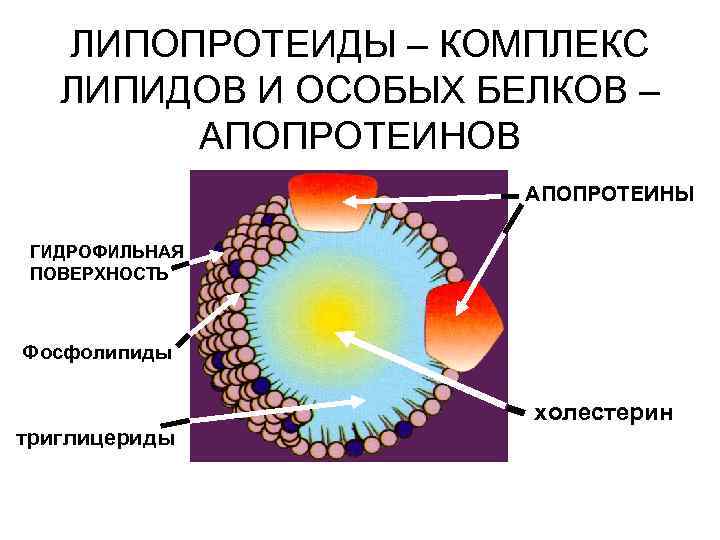
ЛИПОПРОТЕИДЫ – КОМПЛЕКС ЛИПИДОВ И ОСОБЫХ БЕЛКОВ – АПОПРОТЕИНОВ АПОПРОТЕИНЫ ГИДРОФИЛЬНАЯ ПОВЕРХНОСТЬ Фосфолипиды холестерин триглицериды

ЛИПОПРОТЕИДЫ ОТЛИЧАЮТСЯ ПО ПЛОТНОСТИ И ЭЛЕКТРОФОРЕТИЧЕСКОЙ ПОДВИЖНОСТИ пре- -фракция немигрирующая фракция -фракция Электрофорез ЛПВП Ультрацентрифугирование (50% протеины) ЛПНП ЛПОНП 75% ТГ ЛППП (70% ХС) 90% ТГ холестерин триглицериды плотность (г/мл) ЛПОНП ЛППП ЛПНП < 1, 006 < 1, 019 < 1, 063 ХИЛОМИКРОНЫ

мембрана Встраивание белков в мембраны клеток Белки мембран

Гидрофобные белки мембран клеток

Строение хромопротеидов

Молекула гемоглобина N N N N

Строение оксигемоглобина О 2 N N N N О 2

Присоединение гема к глобину N N Fe 2+ ГИС N N ГИС

Присоединение кислорода к гему гемоглобина N N Fe 2+ ГИС N N О 2 ГИС
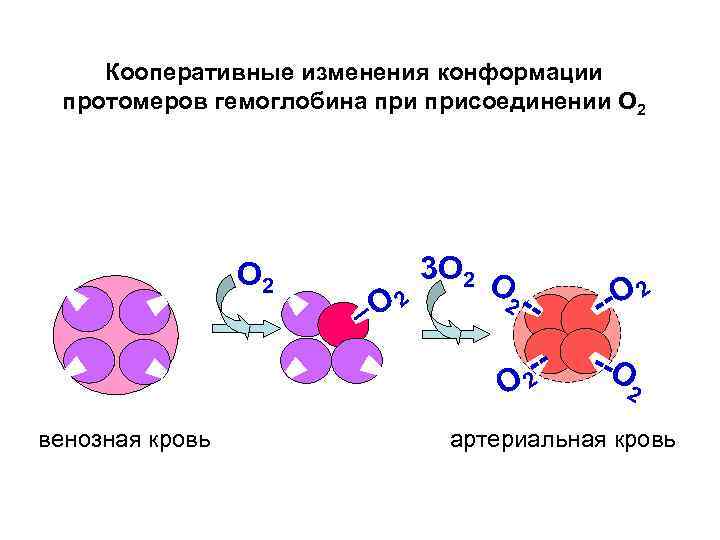
Кооперативные изменения конформации протомеров гемоглобина присоединении О 2 О 2 3 О 2 -- О венозная кровь -2 -О 2 - --О 2 артериальная кровь

Изменение конформации протомеров гемоглобина при отдаче О 2 тканям О 2 О 2 -- О -2 --О 2 ---О 2 О 2 артериальная кровь венозная кровь
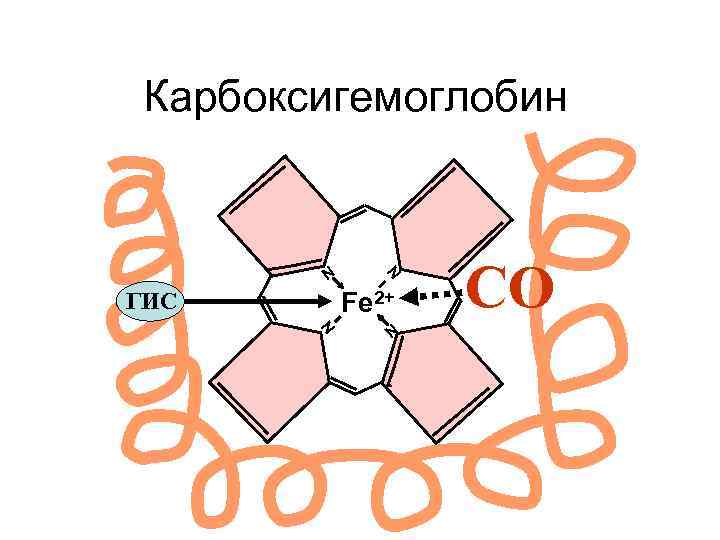
Карбоксигемоглобин N N Fe 2+ ГИС N N СО

Метгемоглобин N N Fe 3+ ОН N N ГИС

Протеинопатиии Серповидно-клеточная анемия нормальный эритроцит анемия

мутация глутаминовая кислота валин

Строение гликопротеина сн 3 сн 2 он он о о С= О о СООН С О СН 2 тир о тре сер о о сер сн 3 он о он сн 2 с он он н N О С= 3 н Н-С-ОН СН 2 ОН сн 3 тре Н-С-ОН СН 3 -С-НN-С-Н О О С Н он Nн он сер он сн 2 он он о Nн С= О сн 3 он он

Углеводы гликопротеидов о он он сн 3 он о сн 2 он он он NH С=О сн 3 фукоза ацетилглюкозамин

Углеводы гликопротеидов СООН Н-С СН 2 Н-С-ОН НО-С-Н О с Н Н-С-ОН СН 2 ОН нейраминовая кислота СООН Н-С СН 2 Н-С-ОН СН 3 -С-НN - С-Н О С Н О Н-С-ОН СН 2 ОН сиаловая кислота

Роль углеводного компонента в гликопротеинах 1. Стабилизирует молекулу белка; 2. Защищает белок от протеолиза (расщепления ферментами); 3. Выполняет роль рецептора при взаимодействии с гормонами.
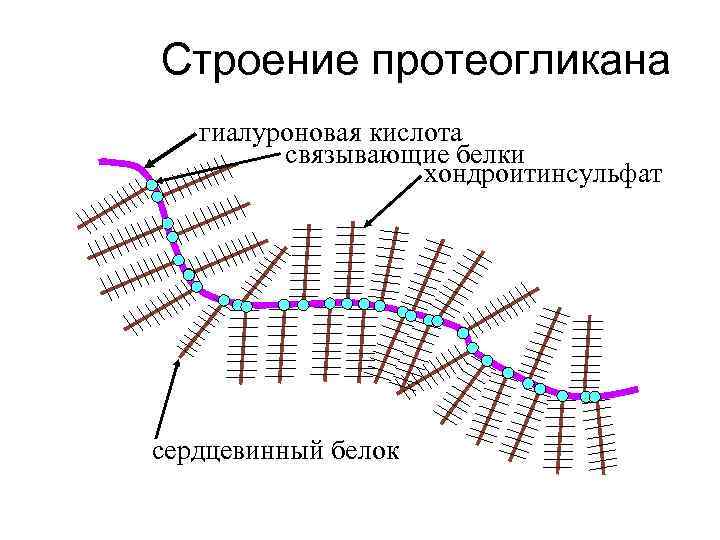
Строение протеогликана гиалуроновая кислота связывающие белки хондроитинсульфат сердцевинный белок

Строение фрагмента гиалуроновой кислоты COOH СН 2 ОН О О О он глюкуроновая к-та НО NH C=O CH 3 n ацетилглюкозамин

Строение фрагмента хондроитинсульфата COOH СН 2 OSO 3 H О О он НО О он глюкуроновая к-та NH C=O CH 3 n ацетилглюкозаминсульфат

Роль протеогликанов в организме человека 1. Повышает прочность оболочек клеток (плазматической мембраны); 2. Проявляет свойство универсального клея. В виде аморфного вещества упрочняет костную и соединительную ткань; 3. Является главным смазочным материалом суставных поверхностей; 4. В виде слизей покрывает поверхность эпителия желудка и кишечника от разрушения протеолитическими ферментами.

О -О-Р=О О Строение фосфопротеина О О -Р= О -О О ОО=РО -О- О Р= О О О =Р-О О О -О О Р О= О -О - Р= О О О

Биологические значение фосфорилирования белков. 1. Является главной реакцией активации ферментов; 2. Фосфопротеиды обладают свойством присоединять к молекуле ионы кальция. Фосфопротеиды молока (казеиногены) являются основным источником Са и Р для растущего организма.
ВВЕДЕНИЕ и СТРОЕН. И СВ-ВА БЕЛКОВ-.ppt