Лекции 5-6. Периодический закон.ppt
- Количество слайдов: 24
 Лекции 5 -6 Периодический закон
Лекции 5 -6 Периодический закон
 Закон триад, (1816 г. - 1829 г. ) Иоганн Вольфганг Дёберейнер (1780 -1849) Дёберейнер показал, что в рядах сходных по свойствам элементов наблюдается закономерное изменение атомной массы. В выделенных Дёберейнером триадах элементов атомный вес среднего элемента триады примерно равен половине суммы атомных весов двух крайних элементов.
Закон триад, (1816 г. - 1829 г. ) Иоганн Вольфганг Дёберейнер (1780 -1849) Дёберейнер показал, что в рядах сходных по свойствам элементов наблюдается закономерное изменение атомной массы. В выделенных Дёберейнером триадах элементов атомный вес среднего элемента триады примерно равен половине суммы атомных весов двух крайних элементов.
 Закон октав (1860 г. - 1864 г. ) Джон. Ньюлендс (1837 -1898) «… Восьмой элемент, начиная с данного элемента, является своего рода повторением первого, подобно восьмой ноте октавы в музыке…»
Закон октав (1860 г. - 1864 г. ) Джон. Ньюлендс (1837 -1898) «… Восьмой элемент, начиная с данного элемента, является своего рода повторением первого, подобно восьмой ноте октавы в музыке…»
 Система Лотара Мейера Юлиус Лотар Мейер (1830 -1895)
Система Лотара Мейера Юлиус Лотар Мейер (1830 -1895)
 Д. И. Менделеев, 1869 г. : Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов
Д. И. Менделеев, 1869 г. : Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов
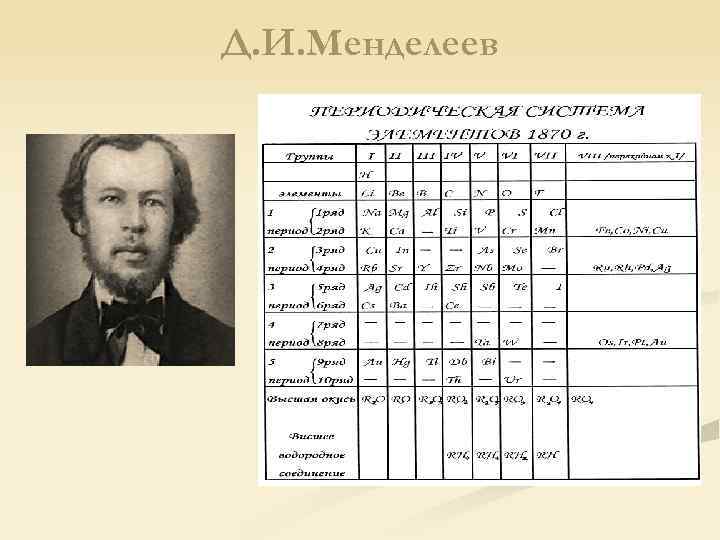 Д. И. Менделеев
Д. И. Менделеев
 1 этап становления физического смысла периодического закона Д. И. Менделеев, 1869 г. : Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов
1 этап становления физического смысла периодического закона Д. И. Менделеев, 1869 г. : Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов
 2 этап становления физического смысла периодического закона Начало ХХ века: Свойства химических элементов, а также образуемых ими соединений находятся в периодической зависимости от величины заряда ядра атома
2 этап становления физического смысла периодического закона Начало ХХ века: Свойства химических элементов, а также образуемых ими соединений находятся в периодической зависимости от величины заряда ядра атома
 3 этап становления физического смысла периодического закона Современная формулировка: Строение и свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атомов и определяются периодически повторяющимися однотипными электронными конфигурациями валентных оболочек
3 этап становления физического смысла периодического закона Современная формулировка: Строение и свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атомов и определяются периодически повторяющимися однотипными электронными конфигурациями валентных оболочек
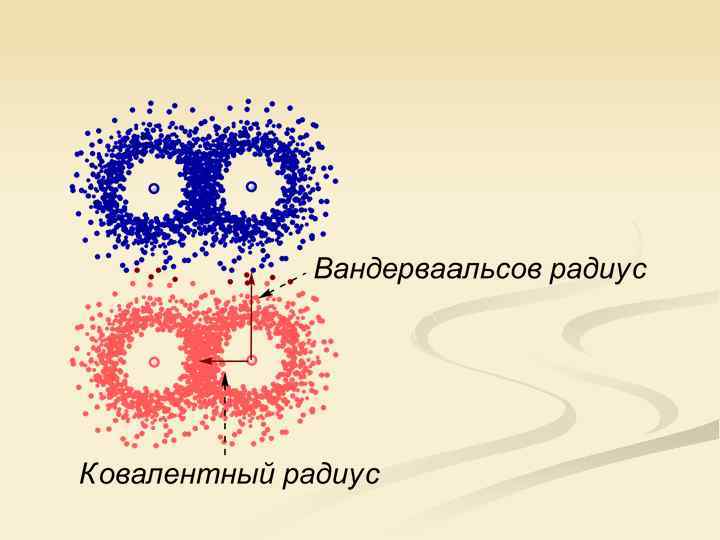
 Свойства атомов и ионов, на которые распространяется периодичность n n n Радиусы Потенциал ионизации Сродство к электрону Электроотрицательность Валентность Характерные степени окисления
Свойства атомов и ионов, на которые распространяется периодичность n n n Радиусы Потенциал ионизации Сродство к электрону Электроотрицательность Валентность Характерные степени окисления
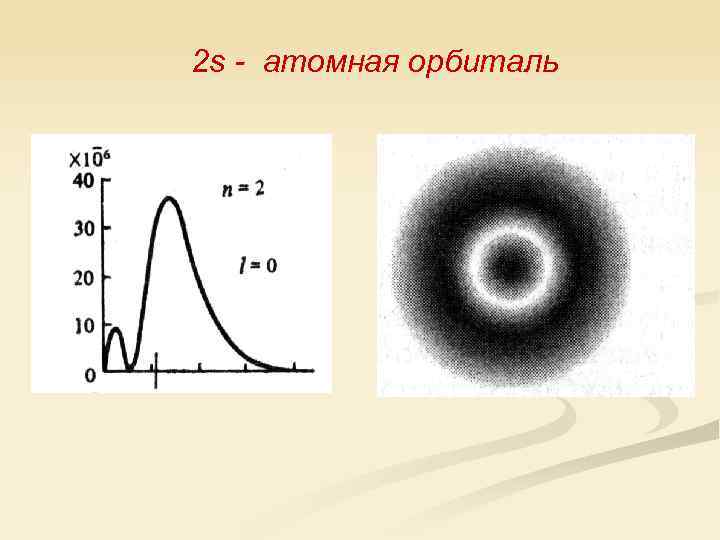 2 s - атомная орбиталь
2 s - атомная орбиталь
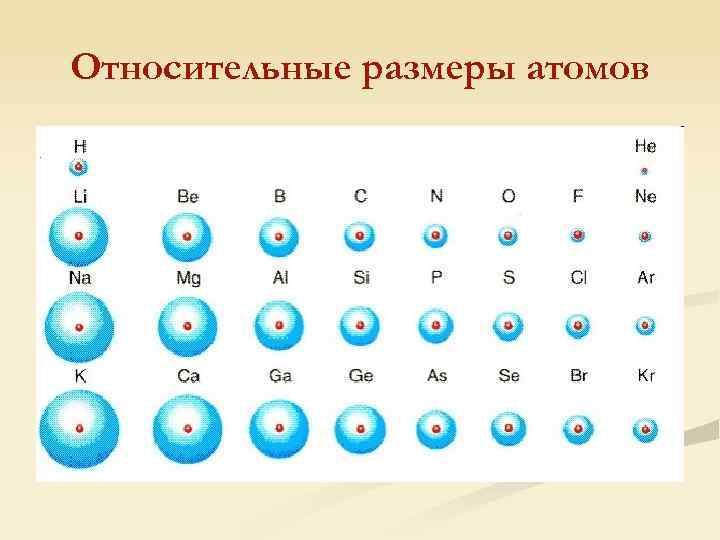 Относительные размеры атомов
Относительные размеры атомов
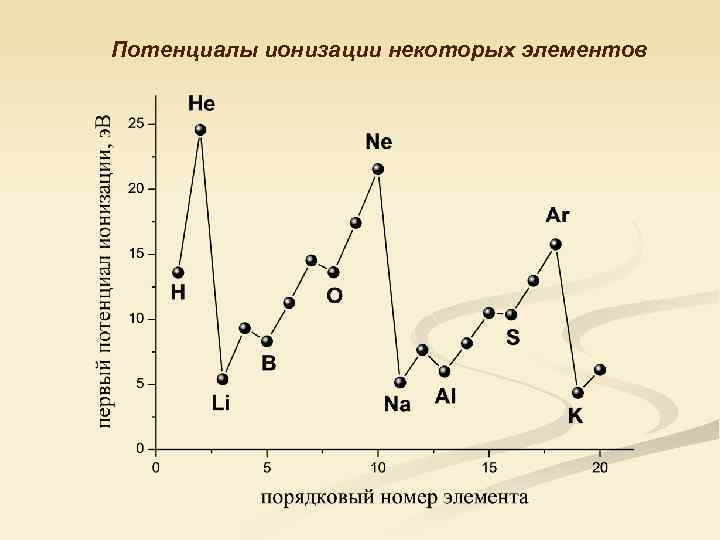 Потенциалы ионизации некоторых элементов
Потенциалы ионизации некоторых элементов
 Значение 1 -го потенциала ионизации атомов элементов 2 -го периода, э. В Li Be B C N O F Ne 5. 39 9. 32 8. 31 11. 2 14. 5 13. 6 17. 4 21. 5 6 3 1 2 6
Значение 1 -го потенциала ионизации атомов элементов 2 -го периода, э. В Li Be B C N O F Ne 5. 39 9. 32 8. 31 11. 2 14. 5 13. 6 17. 4 21. 5 6 3 1 2 6
 Внутренняя периодичность немонотонное изменение атомных характеристик в периоде, отражающее различную устойчивость заполняющихся валентных оболочек
Внутренняя периодичность немонотонное изменение атомных характеристик в периоде, отражающее различную устойчивость заполняющихся валентных оболочек
 2+ Энергия ионизации Х → Х атомов элементов 2 А группы, э. В Be 18. 21 Mg 15. 03 Ca 11. 87 Sr 11. 03 Ba 10. 00 3+ Энергия ионизации Х → Х атомов элементов 3 А группы, э. В B Al Ga In Tl 71. 38 52. 28 57. 22 52. 69 56. 37
2+ Энергия ионизации Х → Х атомов элементов 2 А группы, э. В Be 18. 21 Mg 15. 03 Ca 11. 87 Sr 11. 03 Ba 10. 00 3+ Энергия ионизации Х → Х атомов элементов 3 А группы, э. В B Al Ga In Tl 71. 38 52. 28 57. 22 52. 69 56. 37
 Вторичная периодичность немонотонное изменение атомных характеристик в группе, обусловленное 3 d- и 4 f-сжатием
Вторичная периодичность немонотонное изменение атомных характеристик в группе, обусловленное 3 d- и 4 f-сжатием
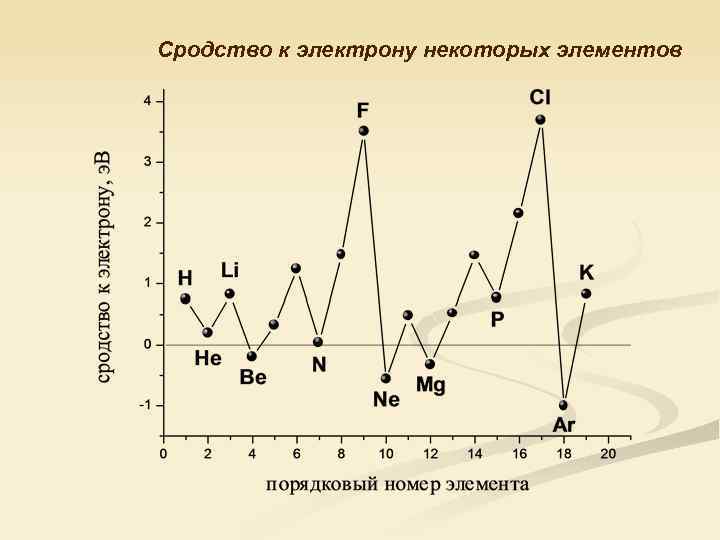 Сродство к электрону некоторых элементов
Сродство к электрону некоторых элементов
 Значение сродства к электрону атомов элементов 2 -го периода, э. В Li Be B C N O F Ne 0, 82 -0, 19 0, 33 1, 24 0, 05 1, 47 3, 50 -0, 57
Значение сродства к электрону атомов элементов 2 -го периода, э. В Li Be B C N O F Ne 0, 82 -0, 19 0, 33 1, 24 0, 05 1, 47 3, 50 -0, 57
 Электроотрицательность мера способности атомов в молекулах (соединениях) притягивать к себе электроны
Электроотрицательность мера способности атомов в молекулах (соединениях) притягивать к себе электроны
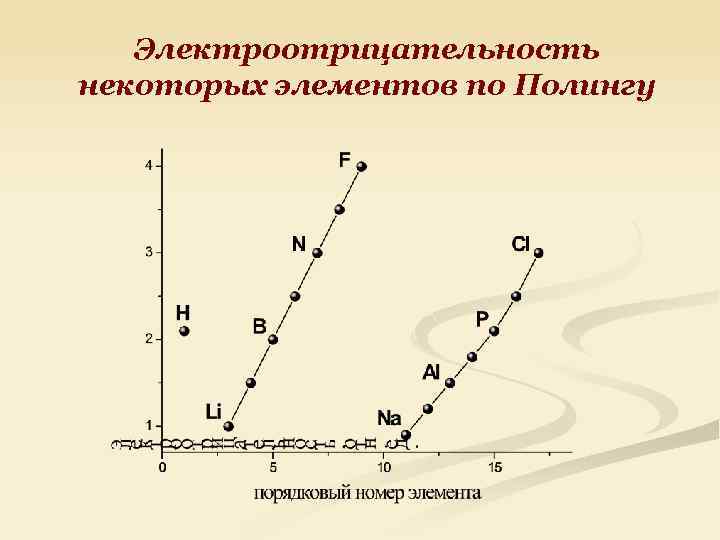 Электроотрицательность некоторых элементов по Полингу
Электроотрицательность некоторых элементов по Полингу
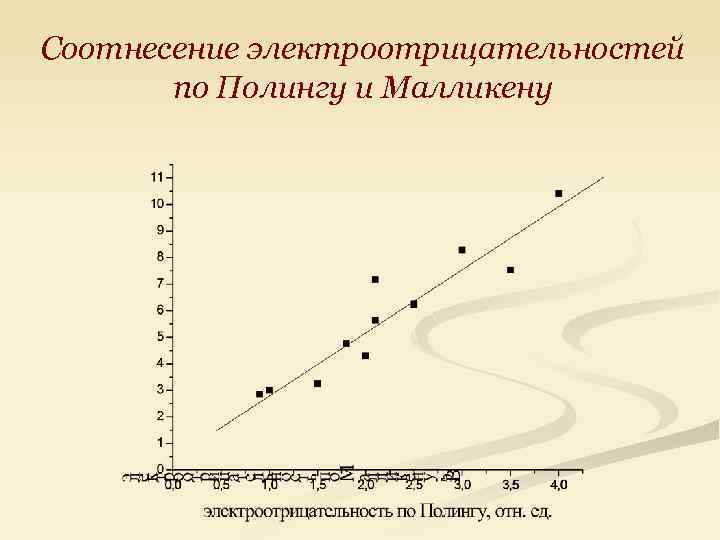 Соотнесение электроотрицательностей по Полингу и Малликену
Соотнесение электроотрицательностей по Полингу и Малликену
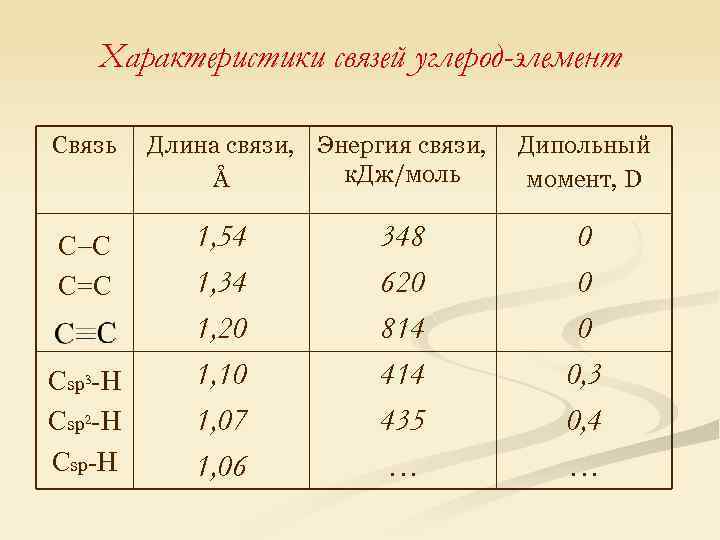 Характеристики связей углерод-элемент Связь С С С=С Сsp 3 -H Сsp 2 -H Сsp-H Длина связи, Энергия связи, к. Дж/моль Å 1, 54 1, 34 1, 20 1, 10 1, 07 1, 06 348 620 814 435 … Дипольный момент, D 0 0, 3 0, 4 …
Характеристики связей углерод-элемент Связь С С С=С Сsp 3 -H Сsp 2 -H Сsp-H Длина связи, Энергия связи, к. Дж/моль Å 1, 54 1, 34 1, 20 1, 10 1, 07 1, 06 348 620 814 435 … Дипольный момент, D 0 0, 3 0, 4 …


