Лекции -25-26-Метал.компл.катал-3.pptx
- Количество слайдов: 41
 Лекции 23 -24 Иткулова Ш. С. Металлокомплексный катализ 2: Металлорганические соединения
Лекции 23 -24 Иткулова Ш. С. Металлокомплексный катализ 2: Металлорганические соединения
 Металлоорганические соединения (МОС) содержать в молекуле связь металл-углерод (М–С). Цианиды, карбиды, а в некоторых случаях и карбонилы металлов, также имеющие связь М–С, считают неорганическими соединениями. К МОС иногда относят органические соединения В, Al, Si и некоторых неметаллов. В связи с этим используют более общий термин – элементоорганические соединения. По характеру связи металл-углерод МОС разделяются на несколько типов: Ø Соединения со связями М–С, в которых органическая группа связана с металлом двухэлектронной двухцентровой ковалентной связью (в некоторых случаях с заметно полярным характером). Такие соединения образует большинство непереходных металлов. Соединения переходных металлов этого типа стабильны только при наличии молекуле p-лиганда (СО, циклопентадиенил и др. ).
Металлоорганические соединения (МОС) содержать в молекуле связь металл-углерод (М–С). Цианиды, карбиды, а в некоторых случаях и карбонилы металлов, также имеющие связь М–С, считают неорганическими соединениями. К МОС иногда относят органические соединения В, Al, Si и некоторых неметаллов. В связи с этим используют более общий термин – элементоорганические соединения. По характеру связи металл-углерод МОС разделяются на несколько типов: Ø Соединения со связями М–С, в которых органическая группа связана с металлом двухэлектронной двухцентровой ковалентной связью (в некоторых случаях с заметно полярным характером). Такие соединения образует большинство непереходных металлов. Соединения переходных металлов этого типа стабильны только при наличии молекуле p-лиганда (СО, циклопентадиенил и др. ).
 Металлоорганические соединения (МОС) Ø МОС с ионной связью М–С. Такие соединения, по существу, металлические соли карбанионов. Xарактерны для щелочных и щелочно-земельных металлов (за исключением Li и Мg), например, Nа+(С 5 H 5)2, К+CºCR– Ø Электронодефицитные соединения с мостиковыми двухэлектронными многоцентровыми связями М–С–М. К ним относят соединения Li, Mg, Be, Al. Ø p-Комплексы – соединения содержащие p-связанные органические лиганды (алкены, алкины, ароматические соединения). МОС этого типа характерны для переходных металлов. Для непереходных металлов известны лишь отдельные примеры.
Металлоорганические соединения (МОС) Ø МОС с ионной связью М–С. Такие соединения, по существу, металлические соли карбанионов. Xарактерны для щелочных и щелочно-земельных металлов (за исключением Li и Мg), например, Nа+(С 5 H 5)2, К+CºCR– Ø Электронодефицитные соединения с мостиковыми двухэлектронными многоцентровыми связями М–С–М. К ним относят соединения Li, Mg, Be, Al. Ø p-Комплексы – соединения содержащие p-связанные органические лиганды (алкены, алкины, ароматические соединения). МОС этого типа характерны для переходных металлов. Для непереходных металлов известны лишь отдельные примеры.
 Названия МОС составляют из названий органического радикала, металла и др. групп, присоединенных к металлу, например, тетраэтилсвинец – [Рb(C 2 H 5)4]. В случае p-комплексов для атомов С, участвующих в связывании с металлом, используют префикс , перед названиями мостиковых лигандов ставят префикс m, напр. тетракарбонил (h-циклопентадиенилванадий [V(СО)4(h-С 5 Н 5).
Названия МОС составляют из названий органического радикала, металла и др. групп, присоединенных к металлу, например, тетраэтилсвинец – [Рb(C 2 H 5)4]. В случае p-комплексов для атомов С, участвующих в связывании с металлом, используют префикс , перед названиями мостиковых лигандов ставят префикс m, напр. тетракарбонил (h-циклопентадиенилванадий [V(СО)4(h-С 5 Н 5).
 Соединения непереходных металлов Основные химические превращения соединений непереходных металлов сопровождаются разрывом связи М–С. К ним относят: окисление, гидролиз, реакции с кислотами, галогенами и солями, присоединение по кратным связям, диспропорционирование, обмен анионоподобных остатков. Многие соединения типа RMn (R – алкил, арил) окисляются до оксида металла, CO 2 и H 2 O. Они гидролизуются до М(ОН)n и RН. Соединения Li, Mg, Zn, Al, чувствительны к влаге и О 2 воздуха, что обусловливает необходимость работы с ними в атмосфере сухого инертного газа. Алкильные производные Li, Na, Be, Mg, Zn, Ca, In, Tl, Sb, Bi самовоспламеняются на воздухе. Соединения металлов IIII гр. (кроме Нg и Тl) могут быть окислены в мягких условиях до пероксидов. Большинство соединений металлов IV гр. и Hg слабо подвержены окислению. Под действием минеральных кислот, галогенов, соединений с подвижным атомом водорода происходит деалкилирование (деарилирование) МОС. Процесс протекает ступенчато с образованием в конечном счете солей металлов.
Соединения непереходных металлов Основные химические превращения соединений непереходных металлов сопровождаются разрывом связи М–С. К ним относят: окисление, гидролиз, реакции с кислотами, галогенами и солями, присоединение по кратным связям, диспропорционирование, обмен анионоподобных остатков. Многие соединения типа RMn (R – алкил, арил) окисляются до оксида металла, CO 2 и H 2 O. Они гидролизуются до М(ОН)n и RН. Соединения Li, Mg, Zn, Al, чувствительны к влаге и О 2 воздуха, что обусловливает необходимость работы с ними в атмосфере сухого инертного газа. Алкильные производные Li, Na, Be, Mg, Zn, Ca, In, Tl, Sb, Bi самовоспламеняются на воздухе. Соединения металлов IIII гр. (кроме Нg и Тl) могут быть окислены в мягких условиях до пероксидов. Большинство соединений металлов IV гр. и Hg слабо подвержены окислению. Под действием минеральных кислот, галогенов, соединений с подвижным атомом водорода происходит деалкилирование (деарилирование) МОС. Процесс протекает ступенчато с образованием в конечном счете солей металлов.
 Соединения непереходных металлов Активные МОС (Li, Mg и др. ) вступают в реакции с органическими соединениями, содержащими функциональные группы. Эти реакции протекают с разрывом связи М–С и широко используются в органическом синтезе. Для соединений металлов II-IV гр. характерны реакции перераспределения радикалов; соединения щелочных и щелочноземельных металлов реагируют с СО 2, давая соли карбоновых кислот; соединения металлов I-III групп образуют устойчивые комплексы с различными основаниями, которыми могут быть растворители (эфиры, амины) и другие МОС, например, МZn. R 3, МAl. R 4 (M – щелочной металл). При отсутствии внешних доноров электронов могут образовываться самоассоциаты, например (Li. CH 3)4, и т. п.
Соединения непереходных металлов Активные МОС (Li, Mg и др. ) вступают в реакции с органическими соединениями, содержащими функциональные группы. Эти реакции протекают с разрывом связи М–С и широко используются в органическом синтезе. Для соединений металлов II-IV гр. характерны реакции перераспределения радикалов; соединения щелочных и щелочноземельных металлов реагируют с СО 2, давая соли карбоновых кислот; соединения металлов I-III групп образуют устойчивые комплексы с различными основаниями, которыми могут быть растворители (эфиры, амины) и другие МОС, например, МZn. R 3, МAl. R 4 (M – щелочной металл). При отсутствии внешних доноров электронов могут образовываться самоассоциаты, например (Li. CH 3)4, и т. п.
 Основные способы получения 1. 2. 3. 4. 5. 6. Взаимодействие металла с алкил- и арилгалогенидами (наиболее широко применяют для получения литий- и магнийорганических соединений). Металлы со степенью окисления больше 1 образуют смешанные МОС. Использование сплавов металлов, например, Нg, Sn или Рb с Nа или Мg, позволяет получить симметричные алкильные соединения Нg, Sn и Рb, что используется в промышленности (металлирование). Взаимодействие литий- и магнийорганических соединений с солями металлов. Этим методом получают полные и смешанные соединения практически всех металлов, за исключением щелочных и щелочноземельных. Реакции Нg. R 2 с металлами; используют для получения индивидуальных МОC, обладающих высокой реакционной способностью (Li, Мg и т. п. ). Диазометод (реакция Несмеянова) – взаимодействие порошка металла с двойными солями арилдиазония. Используют для получения ароматических соединений тяжелых непереходных металлов. Присоединение гидридов А 1, Sn и некоторых других металлов к органическим соединениям, содержащим кратные связи углерод-углерод. Взаимодействие углеводородов и некоторых гетероциклических соединений, содержащих подвижный атом водорода, с металлами и их солями. Используют для получения Nа- и К- производных ацетилена, циклопентадиена, индена, флуорена, арилалкенов, тиофена. Взаимодействие ароматических и гетероароматических соединений с солями Нg широко применяют для получения ртутьорганических соединений.
Основные способы получения 1. 2. 3. 4. 5. 6. Взаимодействие металла с алкил- и арилгалогенидами (наиболее широко применяют для получения литий- и магнийорганических соединений). Металлы со степенью окисления больше 1 образуют смешанные МОС. Использование сплавов металлов, например, Нg, Sn или Рb с Nа или Мg, позволяет получить симметричные алкильные соединения Нg, Sn и Рb, что используется в промышленности (металлирование). Взаимодействие литий- и магнийорганических соединений с солями металлов. Этим методом получают полные и смешанные соединения практически всех металлов, за исключением щелочных и щелочноземельных. Реакции Нg. R 2 с металлами; используют для получения индивидуальных МОC, обладающих высокой реакционной способностью (Li, Мg и т. п. ). Диазометод (реакция Несмеянова) – взаимодействие порошка металла с двойными солями арилдиазония. Используют для получения ароматических соединений тяжелых непереходных металлов. Присоединение гидридов А 1, Sn и некоторых других металлов к органическим соединениям, содержащим кратные связи углерод-углерод. Взаимодействие углеводородов и некоторых гетероциклических соединений, содержащих подвижный атом водорода, с металлами и их солями. Используют для получения Nа- и К- производных ацетилена, циклопентадиена, индена, флуорена, арилалкенов, тиофена. Взаимодействие ароматических и гетероароматических соединений с солями Нg широко применяют для получения ртутьорганических соединений.
 Соединения переходных металлов Переходные металлы образуют соединения с обычной s-связью металл-углерод, а также p-комплексы с органическими ненасыщенными молекулами. Разнообразие органических лигандов и способов их связывания с металлами определяет многочисленность этих соединений. В соответствии с типом органического лиганда различают олефиновые (алкеновые), ацетиленовые (алкиновые), аллильные, диеновые (или полиеновые), циклопентадиенильные (включая металлоцены) и ареновые комплексы переходных металлов. Некоторые карборановые группировки также могут вести себя как p-связанные лиганды. Существуют соединения, содержащие одновременно органические лиганды различных типов. Известны также би- и полиядерные МОС, которые могут содержать связи металл - металл (кластеры). Переходные металлы способны стабилизировать при координации неустойчивые органические молекулы, ионы и свободные радикалы (комплексы циклобутадиена, триметиленметана, карбенов, карбинов и т. п. ).
Соединения переходных металлов Переходные металлы образуют соединения с обычной s-связью металл-углерод, а также p-комплексы с органическими ненасыщенными молекулами. Разнообразие органических лигандов и способов их связывания с металлами определяет многочисленность этих соединений. В соответствии с типом органического лиганда различают олефиновые (алкеновые), ацетиленовые (алкиновые), аллильные, диеновые (или полиеновые), циклопентадиенильные (включая металлоцены) и ареновые комплексы переходных металлов. Некоторые карборановые группировки также могут вести себя как p-связанные лиганды. Существуют соединения, содержащие одновременно органические лиганды различных типов. Известны также би- и полиядерные МОС, которые могут содержать связи металл - металл (кластеры). Переходные металлы способны стабилизировать при координации неустойчивые органические молекулы, ионы и свободные радикалы (комплексы циклобутадиена, триметиленметана, карбенов, карбинов и т. п. ).
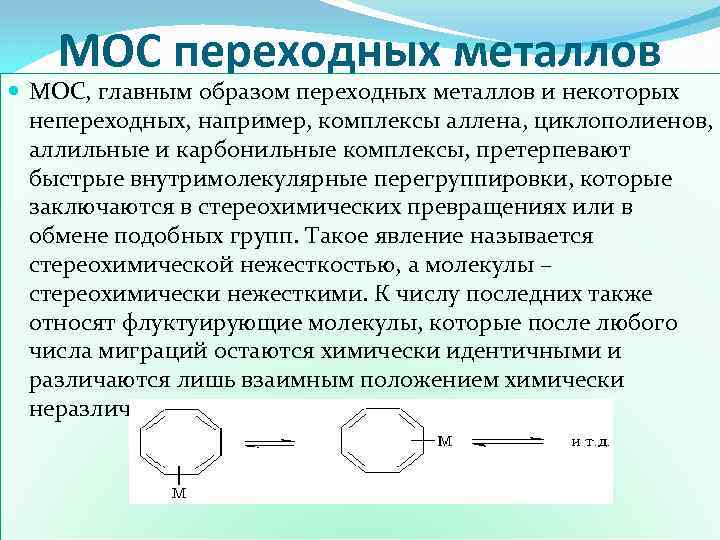 МОС переходных металлов МOC, главным образом переходных металлов и некоторых непереходных, например, комплексы аллена, циклополиенов, аллильные и карбонильные комплексы, претерпевают быстрые внутримолекулярные перегруппировки, которые заключаются в стереохимических превращениях или в обмене подобных групп. Такое явление называется стереохимической нежесткостью, а молекулы – стереохимически нежесткими. К числу последних также относят флуктуирующие молекулы, которые после любого числа миграций остаются химически идентичными и различаются лишь взаимным положением химически неразличимых ядер, например:
МОС переходных металлов МOC, главным образом переходных металлов и некоторых непереходных, например, комплексы аллена, циклополиенов, аллильные и карбонильные комплексы, претерпевают быстрые внутримолекулярные перегруппировки, которые заключаются в стереохимических превращениях или в обмене подобных групп. Такое явление называется стереохимической нежесткостью, а молекулы – стереохимически нежесткими. К числу последних также относят флуктуирующие молекулы, которые после любого числа миграций остаются химически идентичными и различаются лишь взаимным положением химически неразличимых ядер, например:
 Химические свойства pкомплексных МОС зависят главным образом от природы лигандов и в меньшей степени – от природы центральных атомов металла. Реакции этих МОС возможны как с частичным или полным сохранением связи металл лиганд (химическая модификация органического лиганда, замещение, присоединение или отщепление других групп), так и с ее разрывом. Реакции обмена лигандов указывают на сходство этих соединений с неорганическими координационными соединениями, другие реакции, например, электрофильное замещение делают их формальными аналогами ароматических соединений. Ароматический характер проявляют, как правило, комплексы, содержащие циклические непредельные лиганды, металлоцены (прежде всего, ферроцен). При образовании связи с металлом существенно меняются свойства лигандов. В зависимости от природы металла, а также от природы и числа других лигандов, органические лиганды могут проявлять свойства карбанионов, карбкатионов, карбенов или свободных радикалов. Так, непредельные углеводородные лиганды в p-комплексах (особенно катионных) способны реагировать с нуклеофильными реагентами.
Химические свойства pкомплексных МОС зависят главным образом от природы лигандов и в меньшей степени – от природы центральных атомов металла. Реакции этих МОС возможны как с частичным или полным сохранением связи металл лиганд (химическая модификация органического лиганда, замещение, присоединение или отщепление других групп), так и с ее разрывом. Реакции обмена лигандов указывают на сходство этих соединений с неорганическими координационными соединениями, другие реакции, например, электрофильное замещение делают их формальными аналогами ароматических соединений. Ароматический характер проявляют, как правило, комплексы, содержащие циклические непредельные лиганды, металлоцены (прежде всего, ферроцен). При образовании связи с металлом существенно меняются свойства лигандов. В зависимости от природы металла, а также от природы и числа других лигандов, органические лиганды могут проявлять свойства карбанионов, карбкатионов, карбенов или свободных радикалов. Так, непредельные углеводородные лиганды в p-комплексах (особенно катионных) способны реагировать с нуклеофильными реагентами.
 Основные методы получения МОС переходных металлов Из разнообразных методов получения соединений переходных металлов выделяют две основные группы. К первой относятся реакции, при которых происходит образование МОС из солей или карбонилов металлов при действии на них органических или металлоорганических реагентов; при этом органический лиганд присоединяется к атому металла, замещая частично или полностью другие группы, содержащиеся в исходном соединении. Вторая группа методов объединяет превращения одних МОС в другие. В таких реакциях могут происходить изменения в координационной сфере металла, а также внутримолекулярные перегруппировки. Так известны взаимные переходы между h 2 -олефиновыми комплексами и соединениями с s-связью М–С, между h 3 -аллильными комплексами и h 4 -диеновыми (или h 2 -олефиновыми), h 6 ареновыми и h 5 -циклогексадиенильными и т. д.
Основные методы получения МОС переходных металлов Из разнообразных методов получения соединений переходных металлов выделяют две основные группы. К первой относятся реакции, при которых происходит образование МОС из солей или карбонилов металлов при действии на них органических или металлоорганических реагентов; при этом органический лиганд присоединяется к атому металла, замещая частично или полностью другие группы, содержащиеся в исходном соединении. Вторая группа методов объединяет превращения одних МОС в другие. В таких реакциях могут происходить изменения в координационной сфере металла, а также внутримолекулярные перегруппировки. Так известны взаимные переходы между h 2 -олефиновыми комплексами и соединениями с s-связью М–С, между h 3 -аллильными комплексами и h 4 -диеновыми (или h 2 -олефиновыми), h 6 ареновыми и h 5 -циклогексадиенильными и т. д.
 Применение МОС применяют в качестве катализаторов и полупродуктов во многих промышленно важных процессах, например, при гомогенном жидкофазном гидрировании олефинов и ацетиленов (Rh, Ru, Со), а также их димеризации и олигомеризации (Со, Ni, Cu, Rh, Рd), в реакции перераспределения (метатезис олефинов), в многочисленных реакциях с участием СО. Таких, как гидроформилирование и карбонилирование, при получении СН 3 СНО и винилацетата окислением этилена (Рd), при асимметрическом гидрировании и изомеризации (хиральные фосфинродиевые катализаторы). МОС – исходные вещества при получении чистых металлов, металлических пленок и покрытий, стабилизаторов полимеров, антидетонаторов.
Применение МОС применяют в качестве катализаторов и полупродуктов во многих промышленно важных процессах, например, при гомогенном жидкофазном гидрировании олефинов и ацетиленов (Rh, Ru, Со), а также их димеризации и олигомеризации (Со, Ni, Cu, Rh, Рd), в реакции перераспределения (метатезис олефинов), в многочисленных реакциях с участием СО. Таких, как гидроформилирование и карбонилирование, при получении СН 3 СНО и винилацетата окислением этилена (Рd), при асимметрическом гидрировании и изомеризации (хиральные фосфинродиевые катализаторы). МОС – исходные вещества при получении чистых металлов, металлических пленок и покрытий, стабилизаторов полимеров, антидетонаторов.
 Металлокомплексный катализ (МК) основан на взаимодействии субстрата с реагентом в координационной сфере комплекса металла. В ряде случаев аналогичен механизму действия ферментов, содержащих атом металла в качестве кофактора. МК может осуществляться под действием гомогенных и гетерогенных металлокомплексных катализаторов. Первые присутствуют в растворе вместе с реагентами и продуктами, вторые осуществляют катализ на поверхности, если они не растворимы в данной среде или различными способами нанесены на носитель (полимер или неорганический материал). Такие гетерогенизированные катализаторы МК обладают высокой селективностью, отличаются однородностью активных центров и легкостью их модифицирования, а также термостабильностью, длительным сроком службы и регенерируемостью.
Металлокомплексный катализ (МК) основан на взаимодействии субстрата с реагентом в координационной сфере комплекса металла. В ряде случаев аналогичен механизму действия ферментов, содержащих атом металла в качестве кофактора. МК может осуществляться под действием гомогенных и гетерогенных металлокомплексных катализаторов. Первые присутствуют в растворе вместе с реагентами и продуктами, вторые осуществляют катализ на поверхности, если они не растворимы в данной среде или различными способами нанесены на носитель (полимер или неорганический материал). Такие гетерогенизированные катализаторы МК обладают высокой селективностью, отличаются однородностью активных центров и легкостью их модифицирования, а также термостабильностью, длительным сроком службы и регенерируемостью.
 Особенности комплексов переходных металлов, определяющих каталитическую активность 1. Способность образовывать комплексы с молекулами различных типов, которые, входя в координационную сферу металла – комплексообразователя, активируются, что обеспечивает легкость их дальнейшего взаимодействия. Известны, например, комплексы с олефинами (формула I), ацетиленами (II и III), оксидом углерода (IV и V), кислородом (VI и VII), азотом (VIII и IX) и др. (М – атом металла с лигандами).
Особенности комплексов переходных металлов, определяющих каталитическую активность 1. Способность образовывать комплексы с молекулами различных типов, которые, входя в координационную сферу металла – комплексообразователя, активируются, что обеспечивает легкость их дальнейшего взаимодействия. Известны, например, комплексы с олефинами (формула I), ацетиленами (II и III), оксидом углерода (IV и V), кислородом (VI и VII), азотом (VIII и IX) и др. (М – атом металла с лигандами).
 Особенности комплексов переходных металлов, определяющих каталитическую активность 2. Образование комплексов с координирующим ионом или атомом металла понижает энергию связи реагирующих молекул субстратов, что уменьшает энергии активации их последующих. реакций по сравнению с некоординированными молекулами. Понижение энергии связи при комплексообразовании происходит вследствие частичного переноса электронов со связывающих орбиталей молекул субстратов на свободные орбитали металлов и обратного переноса электрона с заполненных d-орбиталей металла на разрыхляющие (антисвязывающие) орбитали молекул субстратов.
Особенности комплексов переходных металлов, определяющих каталитическую активность 2. Образование комплексов с координирующим ионом или атомом металла понижает энергию связи реагирующих молекул субстратов, что уменьшает энергии активации их последующих. реакций по сравнению с некоординированными молекулами. Понижение энергии связи при комплексообразовании происходит вследствие частичного переноса электронов со связывающих орбиталей молекул субстратов на свободные орбитали металлов и обратного переноса электрона с заполненных d-орбиталей металла на разрыхляющие (антисвязывающие) орбитали молекул субстратов.
 Особенности комплексов переходных металлов, определяющих каталитическую активность 3. В координационной сфере металла молекулы изменяют свои кислотные или основные свойства и возникает возможность кислотно-основного взаимодействия при тех значениях р. Н, при которых свободная молекула не реагирует. Например, азот в свободном состоянии является исключительно слабым основанием, а в комплексе типа (R 3 P)4 W(N 2)2 становится по основности близким к простым эфирам.
Особенности комплексов переходных металлов, определяющих каталитическую активность 3. В координационной сфере металла молекулы изменяют свои кислотные или основные свойства и возникает возможность кислотно-основного взаимодействия при тех значениях р. Н, при которых свободная молекула не реагирует. Например, азот в свободном состоянии является исключительно слабым основанием, а в комплексе типа (R 3 P)4 W(N 2)2 становится по основности близким к простым эфирам.
 Особенности комплексов переходных металлов, определяющих каталитическую активность 4. Если имеется запрет по симметрии молекулярных орбиталей, препятствующий взаимодействию молекул, то при реакции в координационной сфере металла он может сниматься или значительно ослабляться. Во внутренней сфере процессы, протекающие через переходное состояние, могут быть разрешены и могут протекать с малыми энергиями активации. а) Окислительное присоединение и обратное ему восстановительное элиминирование молекулы ХУ: б) Внедрение ненасыщенных соединений по связи М–Х и обратное ему bэлиминирование: в) обратимое образование металлоцикла из ненасыщенных соединений и карбена в координационной сфере металла:
Особенности комплексов переходных металлов, определяющих каталитическую активность 4. Если имеется запрет по симметрии молекулярных орбиталей, препятствующий взаимодействию молекул, то при реакции в координационной сфере металла он может сниматься или значительно ослабляться. Во внутренней сфере процессы, протекающие через переходное состояние, могут быть разрешены и могут протекать с малыми энергиями активации. а) Окислительное присоединение и обратное ему восстановительное элиминирование молекулы ХУ: б) Внедрение ненасыщенных соединений по связи М–Х и обратное ему bэлиминирование: в) обратимое образование металлоцикла из ненасыщенных соединений и карбена в координационной сфере металла:
 Особенности комплексов переходных металлов, определяющих каталитическую активность 5. МК позволяет осуществить реакции многоэлектронного окисления и восстановления, в которых молекула субстрата в координационной сфере сразу принимает или отдает несколько электронов. При этом облегчаются процессы, в которых последовательный перенос электронов затруднен из-за термодинамических трудностей одно- или двухэлектронных стадий. Особенно благоприятны условия для таких реакций в случае многоядерных комплексов-кластеров, способных как к одноэлектронному окислению (восстановлению) при взаимодействии с реагентом, так и последующему nэлектронному окислению (восстановлению) субстрата.
Особенности комплексов переходных металлов, определяющих каталитическую активность 5. МК позволяет осуществить реакции многоэлектронного окисления и восстановления, в которых молекула субстрата в координационной сфере сразу принимает или отдает несколько электронов. При этом облегчаются процессы, в которых последовательный перенос электронов затруднен из-за термодинамических трудностей одно- или двухэлектронных стадий. Особенно благоприятны условия для таких реакций в случае многоядерных комплексов-кластеров, способных как к одноэлектронному окислению (восстановлению) при взаимодействии с реагентом, так и последующему nэлектронному окислению (восстановлению) субстрата.
 Основные типы реакций, катализируемых комплексами металлов Гидрирование. Помимо традиционных металлических катализаторов гидрирования в настоящее время применяют металлокомплексы на основе платиновых металлов. Так, для гидрирования олефинов наиболее часто используют Ru. Cl(PPh 3)3 (катализатор Уилкинсона), Ru. HCl(PPh 3)3 и Ru. Cl 2(PPh 3)3. Катализаторы молекулярного и ионного типов на основе комплексов Rh такие, как HRh(CO)(PPh 3)3, используют для гидрирования олефинов, ацетиленов, кетонов. Иридиевые и платиновые комплексы в этой реакции несколько менее активны; среди них наиболее часто применяют комплекс Ir. Cl(CO)(PPh 3)3. Катализаторами гидрирования являются также комплексы неплатиновых металлов, образующиеся, например, при действии сильных восстановителей, таких, как Al(C 2 H 5)3 и других, на соединения Со, Тi и Cr (так называемые катализаторы Циглера - Натты), а также гидриды металлоценов.
Основные типы реакций, катализируемых комплексами металлов Гидрирование. Помимо традиционных металлических катализаторов гидрирования в настоящее время применяют металлокомплексы на основе платиновых металлов. Так, для гидрирования олефинов наиболее часто используют Ru. Cl(PPh 3)3 (катализатор Уилкинсона), Ru. HCl(PPh 3)3 и Ru. Cl 2(PPh 3)3. Катализаторы молекулярного и ионного типов на основе комплексов Rh такие, как HRh(CO)(PPh 3)3, используют для гидрирования олефинов, ацетиленов, кетонов. Иридиевые и платиновые комплексы в этой реакции несколько менее активны; среди них наиболее часто применяют комплекс Ir. Cl(CO)(PPh 3)3. Катализаторами гидрирования являются также комплексы неплатиновых металлов, образующиеся, например, при действии сильных восстановителей, таких, как Al(C 2 H 5)3 и других, на соединения Со, Тi и Cr (так называемые катализаторы Циглера - Натты), а также гидриды металлоценов.
 Основные типы реакций, катализируемых комплексами металлов Синтезы с участием оксида углерода. Для присоединения СО и Н 2 к олефинам с образованием альдегидов (гидроформилирование олефинов) в промышленном масштабе применяют октакарбонил Со, который в условиях катализа превращается в гидридотетракарбонильный комплекс: Co 2(CO)8 + H 2 <–> 2[HCo(CO)4] Все большее применение в этой реакции находят фосфиновые и фосфитные комплексы Rh. В зависимости от реагентов и условий реакции синтезы на основе СО могут приводить к образованию альдегидов, кетонов, высших спиртов, карбоновых кислот и их эфиров. Так, гидрокарбонилирование осуществляется в присутствии Ni(СО)4. Карбонилирование спиртов катализируется соединениями Rh, например, уксусную кислоту получают из СН 3 ОН и СО в присутствии Rh. Cl 3· 3 H 2 O (сокатализатор HI).
Основные типы реакций, катализируемых комплексами металлов Синтезы с участием оксида углерода. Для присоединения СО и Н 2 к олефинам с образованием альдегидов (гидроформилирование олефинов) в промышленном масштабе применяют октакарбонил Со, который в условиях катализа превращается в гидридотетракарбонильный комплекс: Co 2(CO)8 + H 2 <–> 2[HCo(CO)4] Все большее применение в этой реакции находят фосфиновые и фосфитные комплексы Rh. В зависимости от реагентов и условий реакции синтезы на основе СО могут приводить к образованию альдегидов, кетонов, высших спиртов, карбоновых кислот и их эфиров. Так, гидрокарбонилирование осуществляется в присутствии Ni(СО)4. Карбонилирование спиртов катализируется соединениями Rh, например, уксусную кислоту получают из СН 3 ОН и СО в присутствии Rh. Cl 3· 3 H 2 O (сокатализатор HI).
 Основные типы реакций, катализируемых комплексами металлов Полимеризация, димеризация, олигомеризация олефинов и ацетиленов. Для этих реакций наиболее часто используют катализаторы, образующиеся при взаимодействии алкилъных производных Аl, Li, Mo, Sn и др. с соединениями переходных металлов (катализаторы Циглера - Натты). Так, при взаимодействии Al(C 2 H 5)3 с Ti. Cl 4 и Ti. Cl 3 в углеводородных растворителях образуются гетерогенные катализаторы полимеризации этилена и a-олефинов; при взаимодействии Al(C 2 H 5)3 с (h-C 5 H 5)Ti. Cl 2 – гомогенные. Полимеризация пропилена и других a-олефинов на таких катализаторах происходит с образованием стереорегулярных полимеров. Комплексы, образующиеся при взаимодействии триалкилалюминия с тетрабутокситианом катализируют, димеризацию этилена. Для димеризации и олигомеризации олефинов применяют также комплексы Ni, образующиеся при взаимодействии Ni. Cl 2 с галогенидами и алкилгалогенидами Аl.
Основные типы реакций, катализируемых комплексами металлов Полимеризация, димеризация, олигомеризация олефинов и ацетиленов. Для этих реакций наиболее часто используют катализаторы, образующиеся при взаимодействии алкилъных производных Аl, Li, Mo, Sn и др. с соединениями переходных металлов (катализаторы Циглера - Натты). Так, при взаимодействии Al(C 2 H 5)3 с Ti. Cl 4 и Ti. Cl 3 в углеводородных растворителях образуются гетерогенные катализаторы полимеризации этилена и a-олефинов; при взаимодействии Al(C 2 H 5)3 с (h-C 5 H 5)Ti. Cl 2 – гомогенные. Полимеризация пропилена и других a-олефинов на таких катализаторах происходит с образованием стереорегулярных полимеров. Комплексы, образующиеся при взаимодействии триалкилалюминия с тетрабутокситианом катализируют, димеризацию этилена. Для димеризации и олигомеризации олефинов применяют также комплексы Ni, образующиеся при взаимодействии Ni. Cl 2 с галогенидами и алкилгалогенидами Аl.
 Основные типы реакций, катализируемых комплексами металлов Олигомеризация ацетиленов в циклооктатетраен или производные бензола протекает в присутствии комплексов Ni, Co, Pd, Rh, Ir, таких как Ni(СО)4, Со(СО)2(h-С 5 Н 5)2. При контакте газообразного ацетилена с поверхностью раствора гомогенного катализатора, приготовленного смешением Al(C 2 H 5)3, Тi(ОС 4 Н 9)4 или фосфиновых комплексов Ni и Со с Na. BH 4 получается кристаллический цис-полиацетилен (поливинилен).
Основные типы реакций, катализируемых комплексами металлов Олигомеризация ацетиленов в циклооктатетраен или производные бензола протекает в присутствии комплексов Ni, Co, Pd, Rh, Ir, таких как Ni(СО)4, Со(СО)2(h-С 5 Н 5)2. При контакте газообразного ацетилена с поверхностью раствора гомогенного катализатора, приготовленного смешением Al(C 2 H 5)3, Тi(ОС 4 Н 9)4 или фосфиновых комплексов Ni и Со с Na. BH 4 получается кристаллический цис-полиацетилен (поливинилен).
 Основные типы реакций, катализируемых комплексами металлов Окисление углеводородов в карбонильные соединения и эпоксиды. Окисление этилена в ацетальдегид кислородом воздуха в водном растворе НСl (так называемый Вакер процесс) катализируется комплексами Pd (сокатализатор – соль Сu). Окисление этилена на аналогичном катализаторе в присутствии СН 3 СООН приводит к винилацетату. Синтез пропиленоксида из пропилена осуществляют с использованием гексакарбонила молибдена Мо(СО)6 или ацетилацетоната ванадила VO(C 3 H 7 O 2)2. Эпоксидирование олефинов действием H 2 O 2 или органических пероксидов катализируется комплексами Мо, а также пероксимолибденовыми и пероксивольфрамовыми соединениями. Радикально-цепное окисление углеводородов кислородом осуществляется в присутствии солей переходных металлов, таких, как Со(II), Мn(II) и др. Таким образом, проводят синтез терефталевой кислоты из p-ксилола, уксусной кислоты из бутана и т. п. Все эти процессы находят широкое применение в промышленности.
Основные типы реакций, катализируемых комплексами металлов Окисление углеводородов в карбонильные соединения и эпоксиды. Окисление этилена в ацетальдегид кислородом воздуха в водном растворе НСl (так называемый Вакер процесс) катализируется комплексами Pd (сокатализатор – соль Сu). Окисление этилена на аналогичном катализаторе в присутствии СН 3 СООН приводит к винилацетату. Синтез пропиленоксида из пропилена осуществляют с использованием гексакарбонила молибдена Мо(СО)6 или ацетилацетоната ванадила VO(C 3 H 7 O 2)2. Эпоксидирование олефинов действием H 2 O 2 или органических пероксидов катализируется комплексами Мо, а также пероксимолибденовыми и пероксивольфрамовыми соединениями. Радикально-цепное окисление углеводородов кислородом осуществляется в присутствии солей переходных металлов, таких, как Со(II), Мn(II) и др. Таким образом, проводят синтез терефталевой кислоты из p-ксилола, уксусной кислоты из бутана и т. п. Все эти процессы находят широкое применение в промышленности.
 Основные типы реакций, катализируемых комплексами металлов Метатезис олефинов и ацетиленов. Реакции типа СН 2=СН 2 + Рh. СН=СНPh <–> 2 Рh. СН=СН 2 катализируются комплексами переходных металлов VI и VII групп. Катализаторы – продукты взаимодействия WCl 6, Mo. Cl 5, W(CO)6 и других с алкильными производными металлов Al. R 3, Li. R, Sn. R 4, RMg. X и др.
Основные типы реакций, катализируемых комплексами металлов Метатезис олефинов и ацетиленов. Реакции типа СН 2=СН 2 + Рh. СН=СНPh <–> 2 Рh. СН=СН 2 катализируются комплексами переходных металлов VI и VII групп. Катализаторы – продукты взаимодействия WCl 6, Mo. Cl 5, W(CO)6 и других с алкильными производными металлов Al. R 3, Li. R, Sn. R 4, RMg. X и др.
 Основные типы реакций, катализируемых комплексами металлов Гидросилилирование. Присоединение фрагмента Si–H к ненасыщенным соединениям протекает в присутствии Н 2 Pt. Cl 6, Rh. Cl(PPh 3)3 и др. ; находит применение в производстве силиконовых полимеров.
Основные типы реакций, катализируемых комплексами металлов Гидросилилирование. Присоединение фрагмента Si–H к ненасыщенным соединениям протекает в присутствии Н 2 Pt. Cl 6, Rh. Cl(PPh 3)3 и др. ; находит применение в производстве силиконовых полимеров.
 Основные типы реакций, катализируемых комплексами металлов Фиксация азота. Восстановление N 2 до нитридных производных при комнатной температуре происходит в присутствии восстановителей (Li. R, RMg. X, Al. R 3 и др. ) и соединений переходные металлов (Тi, V, Cr, Mo, и др. ). В протонных средах в присутствии Мо(III) или V(II) N 2 образует гидразин и аммиак. В случае катализаторов на основе Мо(III) для протекания реакции необходимо присутствие в смеси внешних восстановителя, в качестве которого могут быть использованы Тi(OH)3, Сr(ОН)2 или Nа–Нg; при электрохимическом восстановлении – ртутный катод.
Основные типы реакций, катализируемых комплексами металлов Фиксация азота. Восстановление N 2 до нитридных производных при комнатной температуре происходит в присутствии восстановителей (Li. R, RMg. X, Al. R 3 и др. ) и соединений переходные металлов (Тi, V, Cr, Mo, и др. ). В протонных средах в присутствии Мо(III) или V(II) N 2 образует гидразин и аммиак. В случае катализаторов на основе Мо(III) для протекания реакции необходимо присутствие в смеси внешних восстановителя, в качестве которого могут быть использованы Тi(OH)3, Сr(ОН)2 или Nа–Нg; при электрохимическом восстановлении – ртутный катод.
 Основные типы реакций, катализируемых комплексами металлов Активация алканов в растворах. Комплексы Рt при 80 -120°С катализируют изотопный обмен насыщенных углеводородов с D 2 О. Эти же комплексы используют при окислении алканов. Катализаторы Циглера - Натты способствуют гидрометилированию ненасыщенных соединений в присутствии комплекса Ni метан с ацетиленом образуют пропилен.
Основные типы реакций, катализируемых комплексами металлов Активация алканов в растворах. Комплексы Рt при 80 -120°С катализируют изотопный обмен насыщенных углеводородов с D 2 О. Эти же комплексы используют при окислении алканов. Катализаторы Циглера - Натты способствуют гидрометилированию ненасыщенных соединений в присутствии комплекса Ni метан с ацетиленом образуют пропилен.
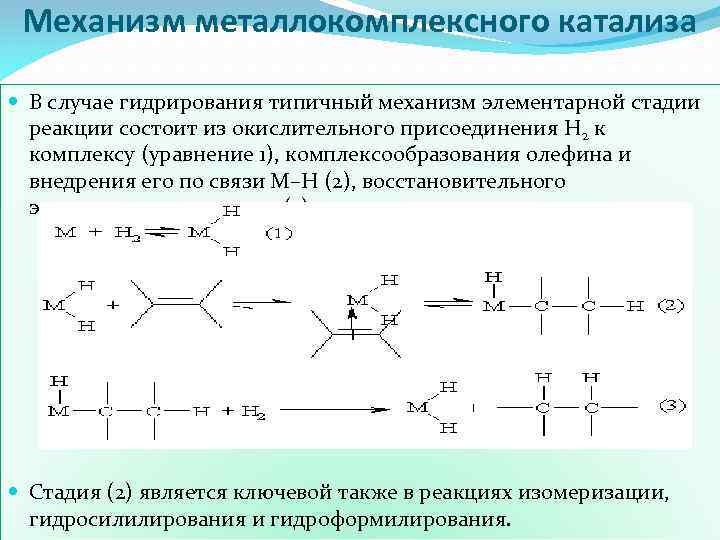 Механизм металлокомплексного катализа В случае гидрирования типичный механизм элементарной стадии реакции состоит из окислительного присоединения Н 2 к комплексу (уравнение 1), комплексообразования олефина и внедрения его по связи М–Н (2), восстановительного элиминирования алкана (3): Стадия (2) является ключевой также в реакциях изомеризации, гидросилилирования и гидроформилирования.
Механизм металлокомплексного катализа В случае гидрирования типичный механизм элементарной стадии реакции состоит из окислительного присоединения Н 2 к комплексу (уравнение 1), комплексообразования олефина и внедрения его по связи М–Н (2), восстановительного элиминирования алкана (3): Стадия (2) является ключевой также в реакциях изомеризации, гидросилилирования и гидроформилирования.
 Механизм металлокомплексного катализа Полимеризация протекает по механизму последовательного внедрения молекул олефина по связи М–С. Метатезис обычно протекает через стадию образования карбеновых комплексов металла с олефинами и выделение металлокомплексов. При восстановительной фиксации азота в протонных средах внешний восстановитель (например, катод) восстанавливает соединения Мо(VI) до Мо(III) с образованием кластера, cпособного координировать молекулы N 2 и переводить их в гидразин путем четырехэлектронного восстановления. Развитие МК, в том числе с использованием принципа ферментов, позволяет создавать новые практически важные каталитические процессы, протекающие с высокой селективностью по основному продукту, высоким выходом, низкими энергозатратами и малым загрязнением окружающей среды.
Механизм металлокомплексного катализа Полимеризация протекает по механизму последовательного внедрения молекул олефина по связи М–С. Метатезис обычно протекает через стадию образования карбеновых комплексов металла с олефинами и выделение металлокомплексов. При восстановительной фиксации азота в протонных средах внешний восстановитель (например, катод) восстанавливает соединения Мо(VI) до Мо(III) с образованием кластера, cпособного координировать молекулы N 2 и переводить их в гидразин путем четырехэлектронного восстановления. Развитие МК, в том числе с использованием принципа ферментов, позволяет создавать новые практически важные каталитические процессы, протекающие с высокой селективностью по основному продукту, высоким выходом, низкими энергозатратами и малым загрязнением окружающей среды.
 Металлоцены – дициклопентадиенильные соединения переходных металлов общей формулы (p-С 5 Н 5)2 М. Получены для большинства элементов. Имеют структуру "сэндвича" – металл в степени окисления +2, располагается между двумя лежащими в параллельных плоскостях циклопентадиенильными кольцами на равном расстоянии от всех атомов С. В большинстве металлоценов связь металла с лигандами ковалентна; исключение манганоцен, в котором связь обусловлена электростатическим взаимодействием катиона Мn 2+ с анионами С 5 H 5. Частично ионный характер имеют также хромоцен и ванадоцен. В кристаллическом состоянии ферроцен находится в заторможенной антипризматической или призматической формации, рутеноцен и осмоцен в призматической.
Металлоцены – дициклопентадиенильные соединения переходных металлов общей формулы (p-С 5 Н 5)2 М. Получены для большинства элементов. Имеют структуру "сэндвича" – металл в степени окисления +2, располагается между двумя лежащими в параллельных плоскостях циклопентадиенильными кольцами на равном расстоянии от всех атомов С. В большинстве металлоценов связь металла с лигандами ковалентна; исключение манганоцен, в котором связь обусловлена электростатическим взаимодействием катиона Мn 2+ с анионами С 5 H 5. Частично ионный характер имеют также хромоцен и ванадоцен. В кристаллическом состоянии ферроцен находится в заторможенной антипризматической или призматической формации, рутеноцен и осмоцен в призматической.
 Металлоцены – интенсивно окрашенные кристаллы, хорошо растворимые органических растворителях, возгоняются. Соединения, имеющие у иона металла оболочку благородного газа (ферроцен, рутеноцен и осмоцен), устойчивы на воздухе, выдерживают нагревание выше 400°С. Такие металлоцены проявляют ароматические свойства, в частности атом водорода замещается при действии электрофильных реагентов (сульфирование, алкилирование по Фриделю-Крафтсу, меркурирование, металлирование и др. ). Ограниченно устойчив никелоцен. Остальные металлоцены очень быстро окисляются на воздухе. С акцепторами электронов, например, п-хлоранилом, тетрацианэтиленом, металлоцены образуют комплексы с переносом заряда. Большинство металлоценов окисляется до металлоцениевых катионов [(C 5 H 5)2 M]+ или [(C 5 H 5)2 M]2+, которые существуют обычно в кислых водных растворах, осаждаются в виде солей с комплексными анионами. Ионы кобальтоцения, родоцения, иридоцения, исключительно устойчивы к действию окислителей – не разрушаются при нагревании с концентрированной НNО 3 и царской водкой.
Металлоцены – интенсивно окрашенные кристаллы, хорошо растворимые органических растворителях, возгоняются. Соединения, имеющие у иона металла оболочку благородного газа (ферроцен, рутеноцен и осмоцен), устойчивы на воздухе, выдерживают нагревание выше 400°С. Такие металлоцены проявляют ароматические свойства, в частности атом водорода замещается при действии электрофильных реагентов (сульфирование, алкилирование по Фриделю-Крафтсу, меркурирование, металлирование и др. ). Ограниченно устойчив никелоцен. Остальные металлоцены очень быстро окисляются на воздухе. С акцепторами электронов, например, п-хлоранилом, тетрацианэтиленом, металлоцены образуют комплексы с переносом заряда. Большинство металлоценов окисляется до металлоцениевых катионов [(C 5 H 5)2 M]+ или [(C 5 H 5)2 M]2+, которые существуют обычно в кислых водных растворах, осаждаются в виде солей с комплексными анионами. Ионы кобальтоцения, родоцения, иридоцения, исключительно устойчивы к действию окислителей – не разрушаются при нагревании с концентрированной НNО 3 и царской водкой.
 Олефиновые комплексы переходных металлов (алкеновые комплексы) – металлоорганические соединения, содержащие в качестве p-лигандов олефины или их производные (h 2 -лиганды). Иногда к олефиновым комплексам (ОК) относят комплексы с диенами и полиенами, если в координации с атомом металла участвует одна двойная связь непредельного лиганда. Известны ОК для переходных металлов I, IV-VIII гр. , наиболее характерны и изучены – для металлов VIII группы, прежде всего для Pt. Олефиновый лиганд формально передает металлу два электрона и занимает одно координационное место. Комплексы помимо олефина обычно содержат и другие лиганды: СО, галогены, фосфины, циклопентадиенил, арен и т. д. Они могут быть нейтральными или ионными соединениями, как правило диамагнитными, многие из них подчиняются правилу "эффективного атомного номера"
Олефиновые комплексы переходных металлов (алкеновые комплексы) – металлоорганические соединения, содержащие в качестве p-лигандов олефины или их производные (h 2 -лиганды). Иногда к олефиновым комплексам (ОК) относят комплексы с диенами и полиенами, если в координации с атомом металла участвует одна двойная связь непредельного лиганда. Известны ОК для переходных металлов I, IV-VIII гр. , наиболее характерны и изучены – для металлов VIII группы, прежде всего для Pt. Олефиновый лиганд формально передает металлу два электрона и занимает одно координационное место. Комплексы помимо олефина обычно содержат и другие лиганды: СО, галогены, фосфины, циклопентадиенил, арен и т. д. Они могут быть нейтральными или ионными соединениями, как правило диамагнитными, многие из них подчиняются правилу "эффективного атомного номера"
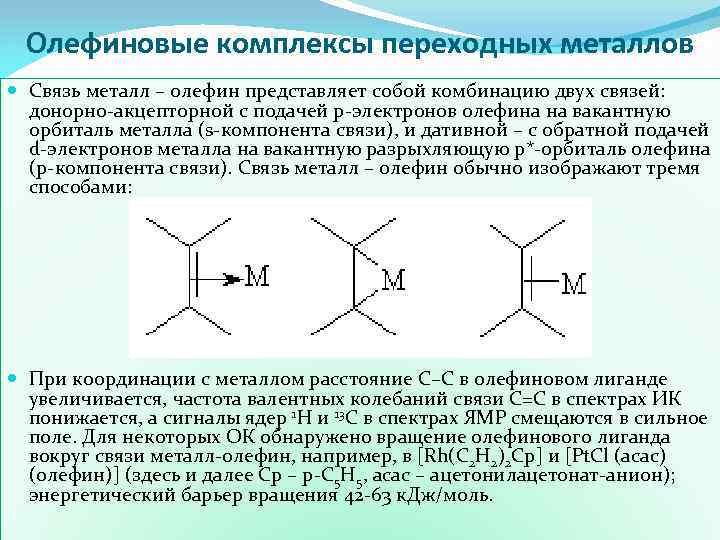 Олефиновые комплексы переходных металлов Связь металл – олефин представляет собой комбинацию двух связей: донорно-акцепторной с подачей p-электронов олефина на вакантную орбиталь металла (s-компонента связи), и дативной – с обратной подачей d-электронов металла на вакантную разрыхляющую p*-орбиталь олефина (p-компонента связи). Связь металл – олефин обычно изображают тремя способами: При координации с металлом расстояние С–С в олефиновом лиганде увеличивается, частота валентных колебаний связи С=С в спектрах ИК понижается, а сигналы ядер 1 Н и 13 С в спектрах ЯМР смещаются в сильное поле. Для некоторых ОК обнаружено вращение олефинового лиганда вокруг связи металл-олефин, например, в [Rh(C 2 H 2)2 Cp] и [Pt. Cl (асас) (олефин)] (здесь и далее Ср – p-С 5 Н 5, асас – ацетонилацетонат-анион); энергетический барьер вращения 42 -63 к. Дж/моль.
Олефиновые комплексы переходных металлов Связь металл – олефин представляет собой комбинацию двух связей: донорно-акцепторной с подачей p-электронов олефина на вакантную орбиталь металла (s-компонента связи), и дативной – с обратной подачей d-электронов металла на вакантную разрыхляющую p*-орбиталь олефина (p-компонента связи). Связь металл – олефин обычно изображают тремя способами: При координации с металлом расстояние С–С в олефиновом лиганде увеличивается, частота валентных колебаний связи С=С в спектрах ИК понижается, а сигналы ядер 1 Н и 13 С в спектрах ЯМР смещаются в сильное поле. Для некоторых ОК обнаружено вращение олефинового лиганда вокруг связи металл-олефин, например, в [Rh(C 2 H 2)2 Cp] и [Pt. Cl (асас) (олефин)] (здесь и далее Ср – p-С 5 Н 5, асас – ацетонилацетонат-анион); энергетический барьер вращения 42 -63 к. Дж/моль.
 Олефиновые комплексы переходных металлов Применение ОК – катализаторы и промежуточные соединения в каталитических превращениях олефинов (гомогенное гидрирование, гидросилилирование, гидроформилирование, карбонилирование, изомеризация, олигомеризация и полимеризация, метатезис и др. ), их применяют также в стереохимимическом органическом синтезе.
Олефиновые комплексы переходных металлов Применение ОК – катализаторы и промежуточные соединения в каталитических превращениях олефинов (гомогенное гидрирование, гидросилилирование, гидроформилирование, карбонилирование, изомеризация, олигомеризация и полимеризация, метатезис и др. ), их применяют также в стереохимимическом органическом синтезе.
 Ацетиленовые комплексы переходных металлов (АК) – p-комплексы, содержащие в качестве лиганда ацетилен или его производные. Связь между атомом металла и лигандом осуществляется перекрыванием вакантной орбитали металла со связывающей p-орбиталью ацетилена (связь донорно-акцепторного типа) и заполненной d-орбитали металла с разрыхляющей p-орбиталью ацетилена (обратная дативная связь). Координированный ацетилен имеет искаженную цис-конфигурацию (заместители повернуты в сторону от атома металла). Связь СºС в комплексе длиннее, чем в свободном ацетилене; частота валентных колебаний координированной связи понижена. Степень искажения молекулы ацетилена при координации с металлом тем больше, значительнее вклад дативной компоненты в связь металл – ацетилен. В комплексах Pt(II), Pd(II), Cu(I), Ag(I) тройная связь искажена слабо, в комплексах металлов V-VIII групп, находящихся в низших степенях окисления (0, +1) – существенно. Величина Dn, т. е. разность частот валентных колебаний тройной связи СºС в свободном ацетилене и в комплексе, составляет в первом случае около 200 см-1, во втором 450 см-1. Молекула ацетилена может координироваться одновременно с двумя атомами металла, образуя мост между ними. Ацетиленовый лиганд может быть связан с металлическим кластером.
Ацетиленовые комплексы переходных металлов (АК) – p-комплексы, содержащие в качестве лиганда ацетилен или его производные. Связь между атомом металла и лигандом осуществляется перекрыванием вакантной орбитали металла со связывающей p-орбиталью ацетилена (связь донорно-акцепторного типа) и заполненной d-орбитали металла с разрыхляющей p-орбиталью ацетилена (обратная дативная связь). Координированный ацетилен имеет искаженную цис-конфигурацию (заместители повернуты в сторону от атома металла). Связь СºС в комплексе длиннее, чем в свободном ацетилене; частота валентных колебаний координированной связи понижена. Степень искажения молекулы ацетилена при координации с металлом тем больше, значительнее вклад дативной компоненты в связь металл – ацетилен. В комплексах Pt(II), Pd(II), Cu(I), Ag(I) тройная связь искажена слабо, в комплексах металлов V-VIII групп, находящихся в низших степенях окисления (0, +1) – существенно. Величина Dn, т. е. разность частот валентных колебаний тройной связи СºС в свободном ацетилене и в комплексе, составляет в первом случае около 200 см-1, во втором 450 см-1. Молекула ацетилена может координироваться одновременно с двумя атомами металла, образуя мост между ними. Ацетиленовый лиганд может быть связан с металлическим кластером.
 Ацетиленовые комплексы переходных металлов Наиболее характерна для координированных ацетиленов циклоолигомеризация, приводящая к возникновению новых связей С–С. Участие атома металла и координированных с металлом лигандов (в том числе карбонильных) приводит к образованию циклов с s-связями М–С, соединений ряда циклопентадиенона, хинона и др. Образующиеся продукты выделяются в свободном состоянии либо сохраняют связь с металлом. Так, при действии ацетиленов, а также при нагревании из комплексов [Fe 2(CO)6(RCºCR)] получены железоорганические соединения и свободные хиноны. Общий метод синтеза АК основан на замещении ацетиленом различных лигандов, например: K[Pt. Cl 3(C 2 H 4)] + R–CºC–R –> K[Pt. Cl 3(RCºCR)] [Со 2(СО)8] + R–CºC–R –> [Co 2(CO)6(RCºCR)]
Ацетиленовые комплексы переходных металлов Наиболее характерна для координированных ацетиленов циклоолигомеризация, приводящая к возникновению новых связей С–С. Участие атома металла и координированных с металлом лигандов (в том числе карбонильных) приводит к образованию циклов с s-связями М–С, соединений ряда циклопентадиенона, хинона и др. Образующиеся продукты выделяются в свободном состоянии либо сохраняют связь с металлом. Так, при действии ацетиленов, а также при нагревании из комплексов [Fe 2(CO)6(RCºCR)] получены железоорганические соединения и свободные хиноны. Общий метод синтеза АК основан на замещении ацетиленом различных лигандов, например: K[Pt. Cl 3(C 2 H 4)] + R–CºC–R –> K[Pt. Cl 3(RCºCR)] [Со 2(СО)8] + R–CºC–R –> [Co 2(CO)6(RCºCR)]
 Алюминийорганические соединения (АОС) содержат связь Аl–С; общая формула Rn. Al. X 3 -n, где R – органический радикал; Х = Наl, Н, ОR, SR, NR 2, RСОО, СN и др. ; n=1 -3. Различают симметричные, или полные АОС (n=3) и несимметричные, или смешанные. АОС чувствительны к влаге и О 2 воздуха (соединения до С 5 на воздухе самовоспламеняются). Поэтому все работы с АОС выполняются в атмосфере сухого инертного газа, например, азота иди аргона. Аlk 3 Аl – бесцветные жидкости, Аr 3 Аl – твердые вещества, растворимые в органических растворителях. Некоторые АОС – электрононенасыщенные соединения, что обусловливает склонность их молекул к ассоциации друг с другом. В образующихся димерах и тримерах атомы Аl соединены через органические радикалы трехцентровыми мостиковыми связями. Известны также АОС типа R 2 Al–Al. R 2. С донорами электронов, например, аминами и эфирами, АОC образуют прочные аддукты состава 1: 1, с анионными донорами МR или МХ, где М – щелочной или щелочноземельный металл – солеобразные комплексы типа М[Rn. Аl. Х 4 -n] (так называемые ат - комплексы).
Алюминийорганические соединения (АОС) содержат связь Аl–С; общая формула Rn. Al. X 3 -n, где R – органический радикал; Х = Наl, Н, ОR, SR, NR 2, RСОО, СN и др. ; n=1 -3. Различают симметричные, или полные АОС (n=3) и несимметричные, или смешанные. АОС чувствительны к влаге и О 2 воздуха (соединения до С 5 на воздухе самовоспламеняются). Поэтому все работы с АОС выполняются в атмосфере сухого инертного газа, например, азота иди аргона. Аlk 3 Аl – бесцветные жидкости, Аr 3 Аl – твердые вещества, растворимые в органических растворителях. Некоторые АОС – электрононенасыщенные соединения, что обусловливает склонность их молекул к ассоциации друг с другом. В образующихся димерах и тримерах атомы Аl соединены через органические радикалы трехцентровыми мостиковыми связями. Известны также АОС типа R 2 Al–Al. R 2. С донорами электронов, например, аминами и эфирами, АОC образуют прочные аддукты состава 1: 1, с анионными донорами МR или МХ, где М – щелочной или щелочноземельный металл – солеобразные комплексы типа М[Rn. Аl. Х 4 -n] (так называемые ат - комплексы).
 Основные реакции АОС бурное взаимодействие с водой, кислотами, спиртами, аминами и другими протонсодержащими соединениями с выделением углеводородов. окисление с образованием алкоголятов: R 3 Al + 1. 5 O 2 –> (RO)3 Al реакция с СО 2, приводящая после гидролиза к карбоновым кислотам: R 3 Al + CO 2 –> R 2 Al. OC(O)R –> RCOOH взаимодействие с галогенидами, оксидами и алкоголятами элементов более электроотрицательными, чем Аl (В, Gа, Si, Sn. Рb и др. ). с образованием их алкилпроизводных, например, R 3 Al + ЭHaln –> Rm. ЭHalm-n + Al. Hal 3 перераспределение органических радикалов между симметричными АС и галогенидами или алкоголятами Аl, например: 2 Al. R 3 Al + Al. X 3 –> 3 R 2 Al. X реакция с олефинами, в результате которой получают высшие АОС: RAl< + n. CH 2=CH 2 –> R–(–CH 2–)n–Al<
Основные реакции АОС бурное взаимодействие с водой, кислотами, спиртами, аминами и другими протонсодержащими соединениями с выделением углеводородов. окисление с образованием алкоголятов: R 3 Al + 1. 5 O 2 –> (RO)3 Al реакция с СО 2, приводящая после гидролиза к карбоновым кислотам: R 3 Al + CO 2 –> R 2 Al. OC(O)R –> RCOOH взаимодействие с галогенидами, оксидами и алкоголятами элементов более электроотрицательными, чем Аl (В, Gа, Si, Sn. Рb и др. ). с образованием их алкилпроизводных, например, R 3 Al + ЭHaln –> Rm. ЭHalm-n + Al. Hal 3 перераспределение органических радикалов между симметричными АС и галогенидами или алкоголятами Аl, например: 2 Al. R 3 Al + Al. X 3 –> 3 R 2 Al. X реакция с олефинами, в результате которой получают высшие АОС: RAl< + n. CH 2=CH 2 –> R–(–CH 2–)n–Al<
 Применение АОC – компоненты катализаторов Циглера-Натты, используемых в синтезе полиолефинов и стереорегулярных диеновых каучуков, катализаторы стереоспецифической полимеризации полярных мономеров, например, ацетальдегида, окисей олефинов, капролактама, а также синтеза a-олефинов нормального строения и др. На основе АОС разработаны методы получения высших жирных спиртов нормального строения, высших жирных кислот, тетраэтилсвинца, а также металлического Аl высокой чистоты. Алюминийалкилы – восстановители при получении карбонилов переходных металлов, диалкилалюминийгидриды восстановители в органическом синтезе.
Применение АОC – компоненты катализаторов Циглера-Натты, используемых в синтезе полиолефинов и стереорегулярных диеновых каучуков, катализаторы стереоспецифической полимеризации полярных мономеров, например, ацетальдегида, окисей олефинов, капролактама, а также синтеза a-олефинов нормального строения и др. На основе АОС разработаны методы получения высших жирных спиртов нормального строения, высших жирных кислот, тетраэтилсвинца, а также металлического Аl высокой чистоты. Алюминийалкилы – восстановители при получении карбонилов переходных металлов, диалкилалюминийгидриды восстановители в органическом синтезе.
 Кремнийорганические соединения (КОС) содержат связь Si–С. Иногда к КОC относят все органические вещества, содержащие Si, например, эфиры кремниевых кислот. Классификация и номенклатура КОC подразделяют на "мономерные", содержащие один или несколько атомов Si, и кремнийорганические полимеры. Наиболее изучены следующие группы КОС: органогалогенсиланы Rn. Si. Cl 4 -n (n=1 -3) и Rn. Si. Hm. Cl 4 -m+n (m и n = 1, 2; m + n = 2, 3); алкоксисиланы и ароксисиланы Si(OR)4, органогидросиланы Rn. Si. H 4 -n, органоаминосиланы Rn. Si(NR'2)4 -n, органосиланолы Rn. Si(OH)4 -n; органоацилоксисиланы Rn. Si(OCOR')4 -n, силатраны и другие; соединения с несколькими атомами Si – органосилоксаны со связями Si–О–Si, органосилазаны со связями Si–N–Si, органосилатианы (Si–S–Si), полиорганосиланы (Si–Si) и др. Большую группу составляют карбофункциональные КОC, из которых наиболее исследованы вещества, содержащие в органическим радикале атомы галогена, амино-, гидрокси-, алкокси-, эпокси-группу и т. д. ; соединения, содержащие группировку Si. M, Si. OM и Si. RM (М – атом металла или неметалла, например, Li, Nа, К, В, Аl, Sn, Тi, Р, Fе), – так называемые кремнийэлементоорганические соединения, а также гетероциклические КОC, содержащие один или более атомов Si в цикле, например силациклобутан, 10 -дихлор-9 -окса-10 -сила-9, 10 -дигилрофенантрен ("оксафен") и др.
Кремнийорганические соединения (КОС) содержат связь Si–С. Иногда к КОC относят все органические вещества, содержащие Si, например, эфиры кремниевых кислот. Классификация и номенклатура КОC подразделяют на "мономерные", содержащие один или несколько атомов Si, и кремнийорганические полимеры. Наиболее изучены следующие группы КОС: органогалогенсиланы Rn. Si. Cl 4 -n (n=1 -3) и Rn. Si. Hm. Cl 4 -m+n (m и n = 1, 2; m + n = 2, 3); алкоксисиланы и ароксисиланы Si(OR)4, органогидросиланы Rn. Si. H 4 -n, органоаминосиланы Rn. Si(NR'2)4 -n, органосиланолы Rn. Si(OH)4 -n; органоацилоксисиланы Rn. Si(OCOR')4 -n, силатраны и другие; соединения с несколькими атомами Si – органосилоксаны со связями Si–О–Si, органосилазаны со связями Si–N–Si, органосилатианы (Si–S–Si), полиорганосиланы (Si–Si) и др. Большую группу составляют карбофункциональные КОC, из которых наиболее исследованы вещества, содержащие в органическим радикале атомы галогена, амино-, гидрокси-, алкокси-, эпокси-группу и т. д. ; соединения, содержащие группировку Si. M, Si. OM и Si. RM (М – атом металла или неметалла, например, Li, Nа, К, В, Аl, Sn, Тi, Р, Fе), – так называемые кремнийэлементоорганические соединения, а также гетероциклические КОC, содержащие один или более атомов Si в цикле, например силациклобутан, 10 -дихлор-9 -окса-10 -сила-9, 10 -дигилрофенантрен ("оксафен") и др.
 Применение КОС Основное применение мономерных КОС – синтез кремнийорганических полимеров. Моно- и дифункционалъные КОС используют в производстве кремнийорганических жидкостей, дифункционалъные – при получении кремнийорганических каучуков; ди-, три -, тетра- и полифункционые в производстве смол и лаков. КОС применяют также в качестве гидрофобизаторов, антиадгезивов, аппретов для стекловолокна, текстильных и строительных материалов, наполнителей пластмасс, для модифицирования поверхностей и др. материалов; получения покрытий для микроэлектронных устройств, специальной керамики; в качестве исходного сырья в синтезе катализаторов полимеризации олефинов, пестицидов, лекарственных средств и т. д.
Применение КОС Основное применение мономерных КОС – синтез кремнийорганических полимеров. Моно- и дифункционалъные КОС используют в производстве кремнийорганических жидкостей, дифункционалъные – при получении кремнийорганических каучуков; ди-, три -, тетра- и полифункционые в производстве смол и лаков. КОС применяют также в качестве гидрофобизаторов, антиадгезивов, аппретов для стекловолокна, текстильных и строительных материалов, наполнителей пластмасс, для модифицирования поверхностей и др. материалов; получения покрытий для микроэлектронных устройств, специальной керамики; в качестве исходного сырья в синтезе катализаторов полимеризации олефинов, пестицидов, лекарственных средств и т. д.


