 ЛЕД Типы структур
ЛЕД Типы структур
 РАСПРОСТРАНЕННОГО И В ТО ЖЕ ВРЕМЯ БОЛЕЕ ЗАГАДОЧНОГО ВЕЩЕСТВА, ЧЕМ ВОДА В ЖИДКОЙ И ТВЕРДОЙ ФАЗАХ. ДЕЙСТВИТЕЛЬНО, ДОСТАТОЧНО ВСПОМНИТЬ, ЧТО ВСЕ ЖИВОЕ ВЫШЛО ИЗ ВОДЫ И СОСТОИТ ИЗ НЕЕ БОЛЕЕ ЧЕМ НА 50%, ЧТО 71% ПОВЕРХНОСТИ ЗЕМЛИ ПОКРЫТ ВОДОЙ И ЛЬДОМ, А ЗНАЧИТЕЛЬНАЯ ЧАСТЬ СЕВЕРНЫХ ТЕРРИТОРИЙ СУШИ ПРЕДСТАВЛЯЕТ СОБОЙ ВЕЧНУЮ МЕРЗЛОТУ. ОСНОВЫ СОВРЕМЕННОГО ПОНИМАНИЯ ФИЗИКОХИМИИ ВОДЫ ЗАЛОЖИЛИ ОКОЛО 200 ЛЕТ НАЗАД ГЕНРИ КАВЕНДИШ И АНТУАН ЛАВУАЗЬЕ, ОБНАРУЖИВШИЕ, ЧТО ВОДА - ЭТО НЕ ПРОСТОЙ ХИМИЧЕСКИЙ ЭЛЕМЕНТ, КАК СЧИТАЛИ СРЕДНЕВЕКОВЫЕ АЛХИМИКИ, А СОЕДИНЕНИЕ КИСЛОРОДА И ВОДОРОДА В ОПРЕДЕЛЕННОМ ОТНОШЕНИИ. СОБСТВЕННО И НАЗВАНИЕ СВОЕ ВОДОРОД (HYDROGENE) - РОЖДАЮЩИЙ ВОДУ - ПОЛУЧИЛ ТОЛЬКО ПОСЛЕ ЭТОГО ОТКРЫТИЯ, И ВОДА ПРИОБРЕЛА СОВРЕМЕННОЕ ХИМИЧЕСКОЕ ОБОЗНАЧЕНИЕ, ИЗВЕСТНОЕ ТЕПЕРЬ КАЖДОМУ ШКОЛЬНИКУ, - H 2 O.
РАСПРОСТРАНЕННОГО И В ТО ЖЕ ВРЕМЯ БОЛЕЕ ЗАГАДОЧНОГО ВЕЩЕСТВА, ЧЕМ ВОДА В ЖИДКОЙ И ТВЕРДОЙ ФАЗАХ. ДЕЙСТВИТЕЛЬНО, ДОСТАТОЧНО ВСПОМНИТЬ, ЧТО ВСЕ ЖИВОЕ ВЫШЛО ИЗ ВОДЫ И СОСТОИТ ИЗ НЕЕ БОЛЕЕ ЧЕМ НА 50%, ЧТО 71% ПОВЕРХНОСТИ ЗЕМЛИ ПОКРЫТ ВОДОЙ И ЛЬДОМ, А ЗНАЧИТЕЛЬНАЯ ЧАСТЬ СЕВЕРНЫХ ТЕРРИТОРИЙ СУШИ ПРЕДСТАВЛЯЕТ СОБОЙ ВЕЧНУЮ МЕРЗЛОТУ. ОСНОВЫ СОВРЕМЕННОГО ПОНИМАНИЯ ФИЗИКОХИМИИ ВОДЫ ЗАЛОЖИЛИ ОКОЛО 200 ЛЕТ НАЗАД ГЕНРИ КАВЕНДИШ И АНТУАН ЛАВУАЗЬЕ, ОБНАРУЖИВШИЕ, ЧТО ВОДА - ЭТО НЕ ПРОСТОЙ ХИМИЧЕСКИЙ ЭЛЕМЕНТ, КАК СЧИТАЛИ СРЕДНЕВЕКОВЫЕ АЛХИМИКИ, А СОЕДИНЕНИЕ КИСЛОРОДА И ВОДОРОДА В ОПРЕДЕЛЕННОМ ОТНОШЕНИИ. СОБСТВЕННО И НАЗВАНИЕ СВОЕ ВОДОРОД (HYDROGENE) - РОЖДАЮЩИЙ ВОДУ - ПОЛУЧИЛ ТОЛЬКО ПОСЛЕ ЭТОГО ОТКРЫТИЯ, И ВОДА ПРИОБРЕЛА СОВРЕМЕННОЕ ХИМИЧЕСКОЕ ОБОЗНАЧЕНИЕ, ИЗВЕСТНОЕ ТЕПЕРЬ КАЖДОМУ ШКОЛЬНИКУ, - H 2 O.
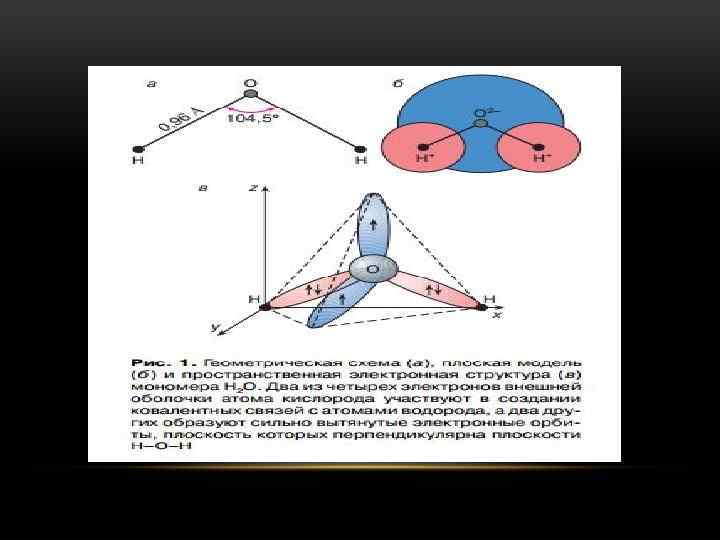
 ЛЁД - МИНЕРАЛ С ХИМИЧЕСКОЙ ФОРМУЛОЙ H 2 O, ПРЕДСТАВЛЯЕТ СОБОЙ ВОДУ В КРИСТАЛЛИЧЕСКОМ СОСТОЯНИИ. ХИМИЧЕСКИЙ СОСТАВ ЛЬДА: Н - 11, 2%, О - 88, 8%. ИНОГДА ЛЕД СОДЕРЖИТ ГАЗООБРАЗНЫЕ И ТВЕРДЫЕ МЕХАНИЧЕСКИЕ ПРИМЕСИ. В ПРИРОДЕ ЛЁД ПРЕДСТАВЛЕН, ГЛАВНЫМ ОБРАЗОМ, ОДНОЙ ИЗ НЕСКОЛЬКИХ КРИСТАЛЛИЧЕСКИХ МОДИФИКАЦИЙ, УСТОЙЧИВОЙ В ИНТЕРВАЛЕ ТЕМПЕРАТУР ОТ 0 ДО 80°C, ИМЕЮЩЕЙ ТОЧКУ ПЛАВЛЕНИЯ 0°С. СВОЙСТВА ЛЬДА: ЛЁД БЕСЦВЕТЕН. В БОЛЬШИХ СКОПЛЕНИЯХ ОН ПРИОБРЕТАЕТ СИНЕВАТЫЙ ОТТЕНОК. БЛЕСК СТЕКЛЯННЫЙ. ПРОЗРАЧНЫЙ. СПАЙНОСТИ НЕ ИМЕЕТ. ТВЕРДОСТЬ 1, 5. ХРУПКИЙ. ОПТИЧЕСКИ ПОЛОЖИТЕЛЬНЫЙ, ПОКАЗАТЕЛЬ ПРЕЛОМЛЕНИЯ ОЧЕНЬ НИЗКИЙ (N = 1, 310, NM = 1, 309). ФОРМЫ НАХОЖДЕНИЯ ЛЬДА: В ПРИРОДЕ ЛЁД - ОЧЕНЬ РАСПРОСТРАНЕННЫЙ МИНЕРАЛ. В ЗЕМНОЙ КОРЕ СУЩЕСТВУЕТ НЕСКОЛЬКО РАЗНОВИДНОСТЕЙ ЛЬДА: РЕЧНОЙ, ОЗЁРНЫЙ, МОРСКОЙ, ГРУНТОВЫЙ, ФИРНОВЫЙ И ГЛЕТЧЕРНЫЙ. ЧАЩЕ ОН ОБРАЗУЕТ АГРЕГАТНЫЕ СКОПЛЕНИЯ МЕЛКОКРИСТАЛЛИЧЕСКИХ ЗЕРЕН. ИЗВЕСТНЫ ТАКЖЕ КРИСТАЛЛИЧЕСКИЕ ОБРАЗОВАНИЯ ЛЬДА, ВОЗНИКАЮЩИЕ СУБЛИМАЦИОННЫМ ПУТЕМ, Т. Е. НЕПОСРЕДСТВЕННО ИЗ ПАРООБРАЗНОГО СОСТОЯНИЯ. В ЭТИХ СЛУЧАЯХ ЛЕД ИМЕЕТ ВИД СКЕЛЕТНЫХ КРИСТАЛЛОВ (СНЕЖИНКИ) И АГРЕГАТОВ СКЕЛЕТНОГО И ДЕНДРИТНОГО РОСТА (ПЕЩЕРНЫЙ ЛЁД, ИЗМОРОЗЬ, ИНЕЙ И УЗОРЫ НА СТЕКЛЕ). КРУПНЫЕ ХОРОШО ОГРАНЁННЫЕ КРИСТАЛЛЫ ВСТРЕЧАЮТСЯ, НО ОЧЕНЬ РЕДКО.
ЛЁД - МИНЕРАЛ С ХИМИЧЕСКОЙ ФОРМУЛОЙ H 2 O, ПРЕДСТАВЛЯЕТ СОБОЙ ВОДУ В КРИСТАЛЛИЧЕСКОМ СОСТОЯНИИ. ХИМИЧЕСКИЙ СОСТАВ ЛЬДА: Н - 11, 2%, О - 88, 8%. ИНОГДА ЛЕД СОДЕРЖИТ ГАЗООБРАЗНЫЕ И ТВЕРДЫЕ МЕХАНИЧЕСКИЕ ПРИМЕСИ. В ПРИРОДЕ ЛЁД ПРЕДСТАВЛЕН, ГЛАВНЫМ ОБРАЗОМ, ОДНОЙ ИЗ НЕСКОЛЬКИХ КРИСТАЛЛИЧЕСКИХ МОДИФИКАЦИЙ, УСТОЙЧИВОЙ В ИНТЕРВАЛЕ ТЕМПЕРАТУР ОТ 0 ДО 80°C, ИМЕЮЩЕЙ ТОЧКУ ПЛАВЛЕНИЯ 0°С. СВОЙСТВА ЛЬДА: ЛЁД БЕСЦВЕТЕН. В БОЛЬШИХ СКОПЛЕНИЯХ ОН ПРИОБРЕТАЕТ СИНЕВАТЫЙ ОТТЕНОК. БЛЕСК СТЕКЛЯННЫЙ. ПРОЗРАЧНЫЙ. СПАЙНОСТИ НЕ ИМЕЕТ. ТВЕРДОСТЬ 1, 5. ХРУПКИЙ. ОПТИЧЕСКИ ПОЛОЖИТЕЛЬНЫЙ, ПОКАЗАТЕЛЬ ПРЕЛОМЛЕНИЯ ОЧЕНЬ НИЗКИЙ (N = 1, 310, NM = 1, 309). ФОРМЫ НАХОЖДЕНИЯ ЛЬДА: В ПРИРОДЕ ЛЁД - ОЧЕНЬ РАСПРОСТРАНЕННЫЙ МИНЕРАЛ. В ЗЕМНОЙ КОРЕ СУЩЕСТВУЕТ НЕСКОЛЬКО РАЗНОВИДНОСТЕЙ ЛЬДА: РЕЧНОЙ, ОЗЁРНЫЙ, МОРСКОЙ, ГРУНТОВЫЙ, ФИРНОВЫЙ И ГЛЕТЧЕРНЫЙ. ЧАЩЕ ОН ОБРАЗУЕТ АГРЕГАТНЫЕ СКОПЛЕНИЯ МЕЛКОКРИСТАЛЛИЧЕСКИХ ЗЕРЕН. ИЗВЕСТНЫ ТАКЖЕ КРИСТАЛЛИЧЕСКИЕ ОБРАЗОВАНИЯ ЛЬДА, ВОЗНИКАЮЩИЕ СУБЛИМАЦИОННЫМ ПУТЕМ, Т. Е. НЕПОСРЕДСТВЕННО ИЗ ПАРООБРАЗНОГО СОСТОЯНИЯ. В ЭТИХ СЛУЧАЯХ ЛЕД ИМЕЕТ ВИД СКЕЛЕТНЫХ КРИСТАЛЛОВ (СНЕЖИНКИ) И АГРЕГАТОВ СКЕЛЕТНОГО И ДЕНДРИТНОГО РОСТА (ПЕЩЕРНЫЙ ЛЁД, ИЗМОРОЗЬ, ИНЕЙ И УЗОРЫ НА СТЕКЛЕ). КРУПНЫЕ ХОРОШО ОГРАНЁННЫЕ КРИСТАЛЛЫ ВСТРЕЧАЮТСЯ, НО ОЧЕНЬ РЕДКО.
 В НАСТОЯЩЕЕ ВРЕМЯ ИЗВЕСТНЫ ТРИ АМОРФНЫХ РАЗНОВИДНОСТИ И 15 КРИСТАЛЛИЧЕСКИЙ МОДИФИКАЦИЙ ЛЬДА. В ПРИРОДНЫХ УСЛОВИЯХ ЗЕМЛИЛЁД ПРЕДСТАВЛЕН, ГЛАВНЫМ ОБРАЗОМ, ОДНОЙ КРИСТАЛЛИЧЕСКОЙ МОДИФИКАЦИЕЙ, КРИСТАЛЛИЗУЮЩЕЙСЯ ГЕКСАГОНАЛЬНОЙ СИНГОНИИ. ВО ЛЬДУ I H КАЖДАЯ МОЛЕКУЛА Н 2 O ОКРУЖЕНА ЧЕТЫРЬМЯ БЛИЖАЙШИМИ К НЕЙ МОЛЕКУЛАМИ, НАХОДЯЩИМИСЯ НА ОДИНАКОВЫХ РАССТОЯНИЯХ ОТ НЕЁ, РАВНЫХ 2, 76 Å И РАЗМЕЩЁННЫХ В ВЕРШИНАХ ПРАВИЛЬНОГО ТЕТРАЭДЕРА АЖУРНАЯ СТРУКТУРА ТАКОГО ЛЬДА ПРИВОДИТ К ТОМУ, ЧТО ЕГО ПЛОТНОСТЬ, РАВНАЯ 916, 7 КГ/М³ ПРИ 0 °C, НИЖЕ ПЛОТНОСТИ ВОДЫ (999, 8 КГ/М³) ПРИ ТОЙ ЖЕ ТЕМПЕРАТУРЕ. ПОЭТОМУ ВОДА, ПРЕВРАЩАЯСЬ В ЛЁД, УВЕЛИЧИВАЕТ СВОЙ ОБЪЁМ ПРИМЕРНО НА 9 % [1]. ЛЁД, БУДУЧИ ЛЕГЧЕ ЖИДКОЙ ВОДЫ, ОБРАЗУЕТСЯ НА ПОВЕРХНОСТИ ВОДОЁМОВ, ЧТО ПРЕПЯТСТВУЕТ ДАЛЬНЕЙШЕМУ ЗАМЕРЗАНИЮ ВОДЫ.
В НАСТОЯЩЕЕ ВРЕМЯ ИЗВЕСТНЫ ТРИ АМОРФНЫХ РАЗНОВИДНОСТИ И 15 КРИСТАЛЛИЧЕСКИЙ МОДИФИКАЦИЙ ЛЬДА. В ПРИРОДНЫХ УСЛОВИЯХ ЗЕМЛИЛЁД ПРЕДСТАВЛЕН, ГЛАВНЫМ ОБРАЗОМ, ОДНОЙ КРИСТАЛЛИЧЕСКОЙ МОДИФИКАЦИЕЙ, КРИСТАЛЛИЗУЮЩЕЙСЯ ГЕКСАГОНАЛЬНОЙ СИНГОНИИ. ВО ЛЬДУ I H КАЖДАЯ МОЛЕКУЛА Н 2 O ОКРУЖЕНА ЧЕТЫРЬМЯ БЛИЖАЙШИМИ К НЕЙ МОЛЕКУЛАМИ, НАХОДЯЩИМИСЯ НА ОДИНАКОВЫХ РАССТОЯНИЯХ ОТ НЕЁ, РАВНЫХ 2, 76 Å И РАЗМЕЩЁННЫХ В ВЕРШИНАХ ПРАВИЛЬНОГО ТЕТРАЭДЕРА АЖУРНАЯ СТРУКТУРА ТАКОГО ЛЬДА ПРИВОДИТ К ТОМУ, ЧТО ЕГО ПЛОТНОСТЬ, РАВНАЯ 916, 7 КГ/М³ ПРИ 0 °C, НИЖЕ ПЛОТНОСТИ ВОДЫ (999, 8 КГ/М³) ПРИ ТОЙ ЖЕ ТЕМПЕРАТУРЕ. ПОЭТОМУ ВОДА, ПРЕВРАЩАЯСЬ В ЛЁД, УВЕЛИЧИВАЕТ СВОЙ ОБЪЁМ ПРИМЕРНО НА 9 % [1]. ЛЁД, БУДУЧИ ЛЕГЧЕ ЖИДКОЙ ВОДЫ, ОБРАЗУЕТСЯ НА ПОВЕРХНОСТИ ВОДОЁМОВ, ЧТО ПРЕПЯТСТВУЕТ ДАЛЬНЕЙШЕМУ ЗАМЕРЗАНИЮ ВОДЫ.
![Фаза Характеристики[3][4] Аморфный лёд не обладает кристаллической структурой. Он существует в трех формах: аморфный Фаза Характеристики[3][4] Аморфный лёд не обладает кристаллической структурой. Он существует в трех формах: аморфный](https://present5.com/presentation/12950147_113945966/image-6.jpg) Фаза Характеристики[3][4] Аморфный лёд не обладает кристаллической структурой. Он существует в трех формах: аморфный лёд низкой плотности (LDA), образующийся при атмосферном давлении и ниже, аморфный лёд высокой плотности (HDA) и аморфный лёд очень Аморфн высокой плотности (VHDA), образующийся при высоких ый лёд давлениях. Лёд LDA получают очень быстрым охлаждением жидкой воды ( «сверхохлаждённая стекловидная вода» , HGW), или конденсацией водяного пара на очень холодной подложке ( «аморфная твёрдая вода» , ASW), или путём нагрева высокоплотностных форм льда при нормальном давлении ( «LDA» ). Обычный гексагональный кристаллический лёд. Практически Лёд Ih весь лёд на Земле относится ко льду Ih, и только очень малая часть — ко льду Ic. Метастабильный кубический кристаллический лёд. Атомы кислорода расположены как в кристаллической решётке алмаза. Его получают при температуре в диапазоне от − 133 °C до Лёд Ic − 123 °C, он остаётся устойчивым до − 73 °C, а при дальнейшем нагреве переходит в лёд Ih. Он изредка встречается в верхних слоях атмосферы. Тригональный кристаллический лёд с высокоупорядоченной Лёд II структурой. Образуется изо льда Ih при сжатии и температурах от − 83 °C до − 63 °C. При нагреве он преобразуется в лёд III. Тетрагональный кристаллический лёд, который возникает при охлаждении воды до − 23 °C и давлении 300 МПа. Его плотность Лёд III больше, чем у воды, но он наименее плотный из всех разновидностей льда в зоне высоких давлений. Метастабильный тригональный лёд. Его трудно получить без Новые исследования формирования водяного льда на ровной поверхности Лёд IV нуклеирующей затравки. меди при температурах от − 173 °C до − 133 °C показали, что сначала на поверхности возникают цепочки молекул шириной около 1 нм не гексагональной, а пентагональной структуры[6]
Фаза Характеристики[3][4] Аморфный лёд не обладает кристаллической структурой. Он существует в трех формах: аморфный лёд низкой плотности (LDA), образующийся при атмосферном давлении и ниже, аморфный лёд высокой плотности (HDA) и аморфный лёд очень Аморфн высокой плотности (VHDA), образующийся при высоких ый лёд давлениях. Лёд LDA получают очень быстрым охлаждением жидкой воды ( «сверхохлаждённая стекловидная вода» , HGW), или конденсацией водяного пара на очень холодной подложке ( «аморфная твёрдая вода» , ASW), или путём нагрева высокоплотностных форм льда при нормальном давлении ( «LDA» ). Обычный гексагональный кристаллический лёд. Практически Лёд Ih весь лёд на Земле относится ко льду Ih, и только очень малая часть — ко льду Ic. Метастабильный кубический кристаллический лёд. Атомы кислорода расположены как в кристаллической решётке алмаза. Его получают при температуре в диапазоне от − 133 °C до Лёд Ic − 123 °C, он остаётся устойчивым до − 73 °C, а при дальнейшем нагреве переходит в лёд Ih. Он изредка встречается в верхних слоях атмосферы. Тригональный кристаллический лёд с высокоупорядоченной Лёд II структурой. Образуется изо льда Ih при сжатии и температурах от − 83 °C до − 63 °C. При нагреве он преобразуется в лёд III. Тетрагональный кристаллический лёд, который возникает при охлаждении воды до − 23 °C и давлении 300 МПа. Его плотность Лёд III больше, чем у воды, но он наименее плотный из всех разновидностей льда в зоне высоких давлений. Метастабильный тригональный лёд. Его трудно получить без Новые исследования формирования водяного льда на ровной поверхности Лёд IV нуклеирующей затравки. меди при температурах от − 173 °C до − 133 °C показали, что сначала на поверхности возникают цепочки молекул шириной около 1 нм не гексагональной, а пентагональной структуры[6]
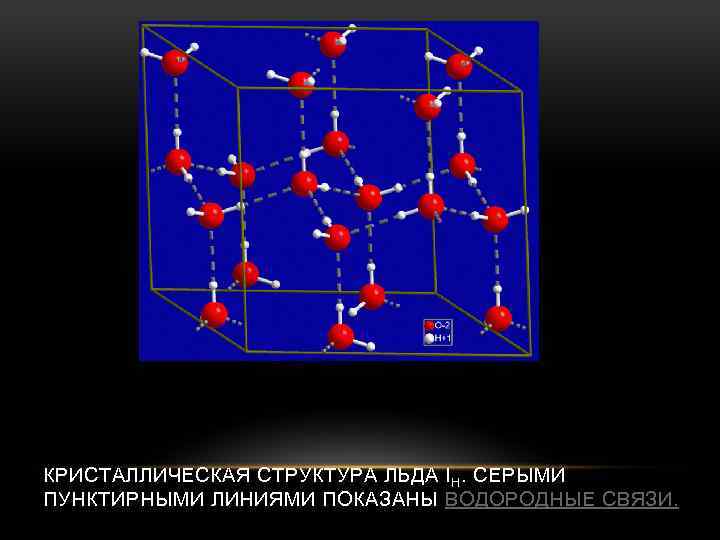 КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА ЛЬДА I H. СЕРЫМИ ПУНКТИРНЫМИ ЛИНИЯМИ ПОКАЗАНЫ ВОДОРОДНЫЕ СВЯЗИ.
КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА ЛЬДА I H. СЕРЫМИ ПУНКТИРНЫМИ ЛИНИЯМИ ПОКАЗАНЫ ВОДОРОДНЫЕ СВЯЗИ.
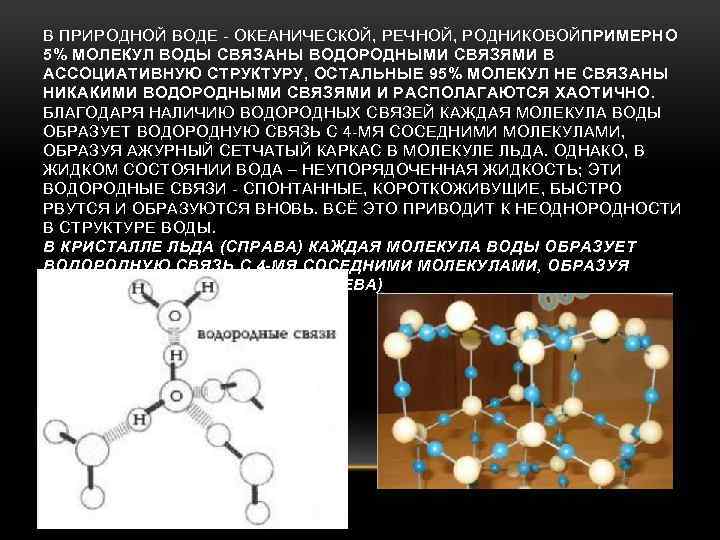 В ПРИРОДНОЙ ВОДЕ - ОКЕАНИЧЕСКОЙ, РЕЧНОЙ, РОДНИКОВОЙПРИМЕРНО 5% МОЛЕКУЛ ВОДЫ СВЯЗАНЫ ВОДОРОДНЫМИ СВЯЗЯМИ В АССОЦИАТИВНУЮ СТРУКТУРУ, ОСТАЛЬНЫЕ 95% МОЛЕКУЛ НЕ СВЯЗАНЫ НИКАКИМИ ВОДОРОДНЫМИ СВЯЗЯМИ И РАСПОЛАГАЮТСЯ ХАОТИЧНО. БЛАГОДАРЯ НАЛИЧИЮ ВОДОРОДНЫХ СВЯЗЕЙ КАЖДАЯ МОЛЕКУЛА ВОДЫ ОБРАЗУЕТ ВОДОРОДНУЮ СВЯЗЬ С 4 -МЯ СОСЕДНИМИ МОЛЕКУЛАМИ, ОБРАЗУЯ АЖУРНЫЙ СЕТЧАТЫЙ КАРКАС В МОЛЕКУЛЕ ЛЬДА. ОДНАКО, В ЖИДКОМ СОСТОЯНИИ ВОДА – НЕУПОРЯДОЧЕННАЯ ЖИДКОСТЬ; ЭТИ ВОДОРОДНЫЕ СВЯЗИ - СПОНТАННЫЕ, КОРОТКОЖИВУЩИЕ, БЫСТРО РВУТСЯ И ОБРАЗУЮТСЯ ВНОВЬ. ВСЁ ЭТО ПРИВОДИТ К НЕОДНОРОДНОСТИ В СТРУКТУРЕ ВОДЫ. В КРИСТАЛЛЕ ЛЬДА (СПРАВА) КАЖДАЯ МОЛЕКУЛА ВОДЫ ОБРАЗУЕТ ВОДОРОДНУЮ СВЯЗЬ С 4 -МЯ СОСЕДНИМИ МОЛЕКУЛАМИ, ОБРАЗУЯ АЖУРНЫЙ СЕТЧАТЫЙ КАРКАС (СЛЕВА)
В ПРИРОДНОЙ ВОДЕ - ОКЕАНИЧЕСКОЙ, РЕЧНОЙ, РОДНИКОВОЙПРИМЕРНО 5% МОЛЕКУЛ ВОДЫ СВЯЗАНЫ ВОДОРОДНЫМИ СВЯЗЯМИ В АССОЦИАТИВНУЮ СТРУКТУРУ, ОСТАЛЬНЫЕ 95% МОЛЕКУЛ НЕ СВЯЗАНЫ НИКАКИМИ ВОДОРОДНЫМИ СВЯЗЯМИ И РАСПОЛАГАЮТСЯ ХАОТИЧНО. БЛАГОДАРЯ НАЛИЧИЮ ВОДОРОДНЫХ СВЯЗЕЙ КАЖДАЯ МОЛЕКУЛА ВОДЫ ОБРАЗУЕТ ВОДОРОДНУЮ СВЯЗЬ С 4 -МЯ СОСЕДНИМИ МОЛЕКУЛАМИ, ОБРАЗУЯ АЖУРНЫЙ СЕТЧАТЫЙ КАРКАС В МОЛЕКУЛЕ ЛЬДА. ОДНАКО, В ЖИДКОМ СОСТОЯНИИ ВОДА – НЕУПОРЯДОЧЕННАЯ ЖИДКОСТЬ; ЭТИ ВОДОРОДНЫЕ СВЯЗИ - СПОНТАННЫЕ, КОРОТКОЖИВУЩИЕ, БЫСТРО РВУТСЯ И ОБРАЗУЮТСЯ ВНОВЬ. ВСЁ ЭТО ПРИВОДИТ К НЕОДНОРОДНОСТИ В СТРУКТУРЕ ВОДЫ. В КРИСТАЛЛЕ ЛЬДА (СПРАВА) КАЖДАЯ МОЛЕКУЛА ВОДЫ ОБРАЗУЕТ ВОДОРОДНУЮ СВЯЗЬ С 4 -МЯ СОСЕДНИМИ МОЛЕКУЛАМИ, ОБРАЗУЯ АЖУРНЫЙ СЕТЧАТЫЙ КАРКАС (СЛЕВА)
 ВОДЫ ПРОДОЛЖАЕТ УВЕЛИЧИВАТЬСЯ И ДОСТИГАЕТ МАКСИМУМА ПРИ 4°C. МЕНЕЕ ИЗВЕСТНА АНОМАЛИЯ СЖИМАЕМОСТИ ВОДЫ: ПРИ НАГРЕВЕ ОТ ТОЧКИ ПЛАВЛЕНИЯ ВПЛОТЬ ДО 40°C ОНА УМЕНЬШАЕТСЯ, А ПОТОМ УВЕЛИЧИВАЕТСЯ. ТЕПЛОЁМКОСТЬ ВОДЫ ТОЖЕ ЗАВИСИТ ОТ ТЕМПЕРАТУРЫ НЕМОНОТОННО. КРОМЕ ТОГО, ПРИ ТЕМПЕРАТУРЕ НИЖЕ 30°C С УВЕЛИЧЕНИЕМ ДАВЛЕНИЯ ОТ АТМОСФЕРНОГО ДО 0, 2 ГПА ВЯЗКОСТЬ ВОДЫ УМЕНЬШАЕТСЯ, А КОЭФФИЦИЕНТ САМОДИФФУЗИИ - ПАРАМЕТР, КОТОРЫЙ ОПРЕДЕЛЯЕТ СКОРОСТЬ ПЕРЕМЕЩЕНИЯ МОЛЕКУЛ ВОДЫ ОТНОСИТЕЛЬНО ДРУГА РАСТЁТ. ДЛЯ ДРУГИХ ЖИДКОСТЕЙ ЗАВИСИМОСТЬ ОБРАТНАЯ, И ПОЧТИ НИГДЕ НЕ БЫВАЕТ, ЧТОБЫ КАКОЙ-ТО ВАЖНЫЙ ПАРАМЕТР ВЁЛ СЕБЯ НЕ МОНОТОННО, Т. Е. СНАЧАЛА РОС, А ПОСЛЕ ПРОХОЖДЕНИЯ КРИТИЧЕСКОГО ЗНАЧЕНИЯ ТЕМПЕРАТУРЫ ИЛИ ДАВЛЕНИЯ УМЕНЬШАЛСЯ. ВОЗНИКЛО ПРЕДПОЛОЖЕНИЕ, ЧТО НА САМОМ ДЕЛЕ ВОДА — ЭТО НЕ ЕДИНАЯ ЖИДКОСТЬ, А СМЕСЬ ДВУХ КОМПОНЕНТОВ, КОТОРЫЕ РАЗЛИЧАЮТСЯ СВОЙСТВАМИ, НАПРИМЕР ПЛОТНОСТЬЮ И ВЯЗКОСТЬЮ, А СЛЕДОВАТЕЛЬНО, И СТРУКТУРОЙ. ТАКИЕ ИДЕИ СТАЛИ ВОЗНИКАТЬ В КОНЦЕ XIX ВЕКА, КОГДА НАКОПИЛОСЬ МНОГО ДАННЫХ ОБ АНОМАЛИЯХ ВОДЫ. СЕЙЧАС НАУКОЙ ДОКАЗАНО, ЧТО ОСОБЕННОСТИ ФИЗИЧЕСКИХ СВОЙСТВ ВОДЫ И МНОГОЧИСЛЕННЫЕ КОРОТКОЖИВУЩИЕ ВОДОРОДНЫЕ СВЯЗИ МЕЖДУ СОСЕДНИМИ АТОМАМИ ВОДОРОДА И КИСЛОРОДА В МОЛЕКУЛЕ ВОДЫ СОЗДАЮТ БЛАГОПРИЯТНЫЕ ВОЗМОЖНОСТИ ДЛЯ ОБРАЗОВАНИЯ ОСОБЫХ СТРУКТУР-АССОЦИАТОВ (КЛАСТЕРОВ), ВОСПРИНИМАЮЩИХ, ХРАНЯЩИХ И ПЕРЕДАЮЩИХ САМУЮ РАЗЛИЧНУЮ ИНФОРМАЦИЮ. СТРУКТУРНОЙ ЕДИНИЦЕЙ ТАКОЙ ВОДЫ ЯВЛЯЕТСЯ КЛАСТЕР, СОСТОЯЩИЙ ИЗ КЛАТРАТОВ, ПРИРОДА КОТОРЫХ ОБУСЛОВЛЕНА ДАЛЬНИМИ КУЛОНОВСКИМИ СИЛАМИ. В СТРУКТУРЕ КЛАСТРОВ ЗАКОДИРОВАНА ИНФОРМАЦИЯ О ВЗАИМОДЕЙСТВИЯХ, ИМЕВШИХ МЕСТО С ДАННЫМИ МОЛЕКУЛАМИ ВОДЫ. В ВОДНЫХ КЛАСТЕРАХ ЗА СЧЁТ ВЗАИМОДЕЙСТВИЯ МЕЖДУ КОВАЛЕНТНЫМИ И ВОДОРОДНЫМИ СВЯЗЯМИ МЕЖДУ АТОМАМИ КИСЛОРОДА И АТОМАМИ ВОДОРОДА МОЖЕТ ПРОИСХОДИТЬ МИГРАЦИЯ ПРОТОНА (Н+) ПО ЭСТАФЕТНОМУ МЕХАНИЗМУ, ПРИВОДЯЩИЕ К ДЕЛОКАЛИЗАЦИИ ПРОТОНА В ПРЕДЕЛАХ КЛАСТЕРА.
ВОДЫ ПРОДОЛЖАЕТ УВЕЛИЧИВАТЬСЯ И ДОСТИГАЕТ МАКСИМУМА ПРИ 4°C. МЕНЕЕ ИЗВЕСТНА АНОМАЛИЯ СЖИМАЕМОСТИ ВОДЫ: ПРИ НАГРЕВЕ ОТ ТОЧКИ ПЛАВЛЕНИЯ ВПЛОТЬ ДО 40°C ОНА УМЕНЬШАЕТСЯ, А ПОТОМ УВЕЛИЧИВАЕТСЯ. ТЕПЛОЁМКОСТЬ ВОДЫ ТОЖЕ ЗАВИСИТ ОТ ТЕМПЕРАТУРЫ НЕМОНОТОННО. КРОМЕ ТОГО, ПРИ ТЕМПЕРАТУРЕ НИЖЕ 30°C С УВЕЛИЧЕНИЕМ ДАВЛЕНИЯ ОТ АТМОСФЕРНОГО ДО 0, 2 ГПА ВЯЗКОСТЬ ВОДЫ УМЕНЬШАЕТСЯ, А КОЭФФИЦИЕНТ САМОДИФФУЗИИ - ПАРАМЕТР, КОТОРЫЙ ОПРЕДЕЛЯЕТ СКОРОСТЬ ПЕРЕМЕЩЕНИЯ МОЛЕКУЛ ВОДЫ ОТНОСИТЕЛЬНО ДРУГА РАСТЁТ. ДЛЯ ДРУГИХ ЖИДКОСТЕЙ ЗАВИСИМОСТЬ ОБРАТНАЯ, И ПОЧТИ НИГДЕ НЕ БЫВАЕТ, ЧТОБЫ КАКОЙ-ТО ВАЖНЫЙ ПАРАМЕТР ВЁЛ СЕБЯ НЕ МОНОТОННО, Т. Е. СНАЧАЛА РОС, А ПОСЛЕ ПРОХОЖДЕНИЯ КРИТИЧЕСКОГО ЗНАЧЕНИЯ ТЕМПЕРАТУРЫ ИЛИ ДАВЛЕНИЯ УМЕНЬШАЛСЯ. ВОЗНИКЛО ПРЕДПОЛОЖЕНИЕ, ЧТО НА САМОМ ДЕЛЕ ВОДА — ЭТО НЕ ЕДИНАЯ ЖИДКОСТЬ, А СМЕСЬ ДВУХ КОМПОНЕНТОВ, КОТОРЫЕ РАЗЛИЧАЮТСЯ СВОЙСТВАМИ, НАПРИМЕР ПЛОТНОСТЬЮ И ВЯЗКОСТЬЮ, А СЛЕДОВАТЕЛЬНО, И СТРУКТУРОЙ. ТАКИЕ ИДЕИ СТАЛИ ВОЗНИКАТЬ В КОНЦЕ XIX ВЕКА, КОГДА НАКОПИЛОСЬ МНОГО ДАННЫХ ОБ АНОМАЛИЯХ ВОДЫ. СЕЙЧАС НАУКОЙ ДОКАЗАНО, ЧТО ОСОБЕННОСТИ ФИЗИЧЕСКИХ СВОЙСТВ ВОДЫ И МНОГОЧИСЛЕННЫЕ КОРОТКОЖИВУЩИЕ ВОДОРОДНЫЕ СВЯЗИ МЕЖДУ СОСЕДНИМИ АТОМАМИ ВОДОРОДА И КИСЛОРОДА В МОЛЕКУЛЕ ВОДЫ СОЗДАЮТ БЛАГОПРИЯТНЫЕ ВОЗМОЖНОСТИ ДЛЯ ОБРАЗОВАНИЯ ОСОБЫХ СТРУКТУР-АССОЦИАТОВ (КЛАСТЕРОВ), ВОСПРИНИМАЮЩИХ, ХРАНЯЩИХ И ПЕРЕДАЮЩИХ САМУЮ РАЗЛИЧНУЮ ИНФОРМАЦИЮ. СТРУКТУРНОЙ ЕДИНИЦЕЙ ТАКОЙ ВОДЫ ЯВЛЯЕТСЯ КЛАСТЕР, СОСТОЯЩИЙ ИЗ КЛАТРАТОВ, ПРИРОДА КОТОРЫХ ОБУСЛОВЛЕНА ДАЛЬНИМИ КУЛОНОВСКИМИ СИЛАМИ. В СТРУКТУРЕ КЛАСТРОВ ЗАКОДИРОВАНА ИНФОРМАЦИЯ О ВЗАИМОДЕЙСТВИЯХ, ИМЕВШИХ МЕСТО С ДАННЫМИ МОЛЕКУЛАМИ ВОДЫ. В ВОДНЫХ КЛАСТЕРАХ ЗА СЧЁТ ВЗАИМОДЕЙСТВИЯ МЕЖДУ КОВАЛЕНТНЫМИ И ВОДОРОДНЫМИ СВЯЗЯМИ МЕЖДУ АТОМАМИ КИСЛОРОДА И АТОМАМИ ВОДОРОДА МОЖЕТ ПРОИСХОДИТЬ МИГРАЦИЯ ПРОТОНА (Н+) ПО ЭСТАФЕТНОМУ МЕХАНИЗМУ, ПРИВОДЯЩИЕ К ДЕЛОКАЛИЗАЦИИ ПРОТОНА В ПРЕДЕЛАХ КЛАСТЕРА.
 СТРУКТУРНОЙ ЕДИНИЦЕЙ ТАКОЙ ВОДЫ ЯВЛЯЕТСЯ КЛАСТЕР, СОСТОЯЩИЙ ИЗ КЛАТРАТОВ, ПРИРОДА КОТОРЫХ ОБУСЛОВЛЕНА ДАЛЬНИМИ КУЛОНОВСКИМИ СИЛАМИ. В СТРУКТУРЕ КЛАСТРОВ ЗАКОДИРОВАНА ИНФОРМАЦИЯ О ВЗАИМОДЕЙСТВИЯХ, ИМЕВШИХ МЕСТО С ДАННЫМИ МОЛЕКУЛАМИ ВОДЫ. В ВОДНЫХ КЛАСТЕРАХ ЗА СЧЁТ ВЗАИМОДЕЙСТВИЯ МЕЖДУ КОВАЛЕНТНЫМИ И ВОДОРОДНЫМИ СВЯЗЯМИ МЕЖДУ АТОМАМИ КИСЛОРОДА И АТОМАМИ ВОДОРОДА МОЖЕТ ПРОИСХОДИТЬ МИГРАЦИЯ ПРОТОНА (Н+) ПО ЭСТАФЕТНОМУ МЕХАНИЗМУ, ПРИВОДЯЩИЕ К ДЕЛОКАЛИЗАЦИИ ПРОТОНА В ПРЕДЕЛАХ КЛАСТЕРА.
СТРУКТУРНОЙ ЕДИНИЦЕЙ ТАКОЙ ВОДЫ ЯВЛЯЕТСЯ КЛАСТЕР, СОСТОЯЩИЙ ИЗ КЛАТРАТОВ, ПРИРОДА КОТОРЫХ ОБУСЛОВЛЕНА ДАЛЬНИМИ КУЛОНОВСКИМИ СИЛАМИ. В СТРУКТУРЕ КЛАСТРОВ ЗАКОДИРОВАНА ИНФОРМАЦИЯ О ВЗАИМОДЕЙСТВИЯХ, ИМЕВШИХ МЕСТО С ДАННЫМИ МОЛЕКУЛАМИ ВОДЫ. В ВОДНЫХ КЛАСТЕРАХ ЗА СЧЁТ ВЗАИМОДЕЙСТВИЯ МЕЖДУ КОВАЛЕНТНЫМИ И ВОДОРОДНЫМИ СВЯЗЯМИ МЕЖДУ АТОМАМИ КИСЛОРОДА И АТОМАМИ ВОДОРОДА МОЖЕТ ПРОИСХОДИТЬ МИГРАЦИЯ ПРОТОНА (Н+) ПО ЭСТАФЕТНОМУ МЕХАНИЗМУ, ПРИВОДЯЩИЕ К ДЕЛОКАЛИЗАЦИИ ПРОТОНА В ПРЕДЕЛАХ КЛАСТЕРА.
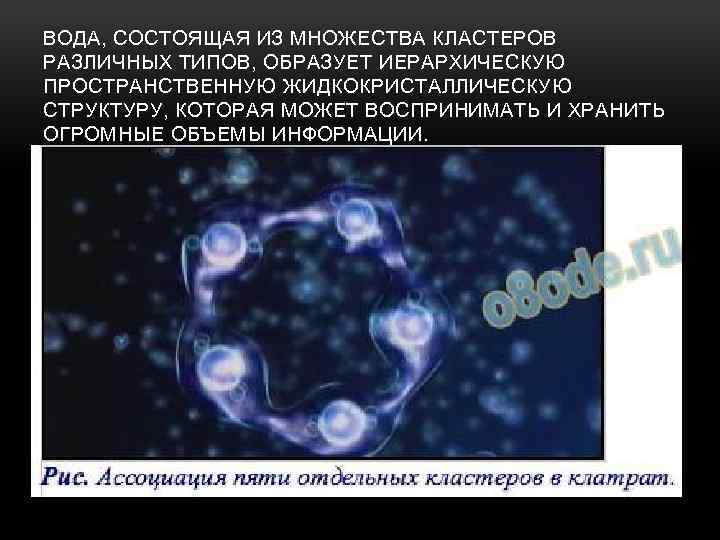 ВОДА, СОСТОЯЩАЯ ИЗ МНОЖЕСТВА КЛАСТЕРОВ РАЗЛИЧНЫХ ТИПОВ, ОБРАЗУЕТ ИЕРАРХИЧЕСКУЮ ПРОСТРАНСТВЕННУЮ ЖИДКОКРИСТАЛЛИЧЕСКУЮ СТРУКТУРУ, КОТОРАЯ МОЖЕТ ВОСПРИНИМАТЬ И ХРАНИТЬ ОГРОМНЫЕ ОБЪЕМЫ ИНФОРМАЦИИ.
ВОДА, СОСТОЯЩАЯ ИЗ МНОЖЕСТВА КЛАСТЕРОВ РАЗЛИЧНЫХ ТИПОВ, ОБРАЗУЕТ ИЕРАРХИЧЕСКУЮ ПРОСТРАНСТВЕННУЮ ЖИДКОКРИСТАЛЛИЧЕСКУЮ СТРУКТУРУ, КОТОРАЯ МОЖЕТ ВОСПРИНИМАТЬ И ХРАНИТЬ ОГРОМНЫЕ ОБЪЕМЫ ИНФОРМАЦИИ.
 КРИСТАЛЛЫ ВСЕХ МОДИФИКАЦИЙ ЛЬДА ПОСТРОЕНЫ ИЗ МОЛЕКУЛ ВОДЫ H 2 O, СОЕДИНЁННЫХ ВОДОРОДНЫМИ СВЯЗЯМИ В ТРЁХМЕРНЫЙ КАРКАС, АНАЛОГИЧНЫЙ СТРУКТУРЕ АЛМАЗА. ИМЕННО В СВЯЗИ С ТЕМ, ЧТО ЛЁД ИМЕЕТ ТАКУЮ ВЫСОКОРЕГУЛЯРНУЮ СЕТЧАТУЮ СТРУКТУРУ И СВЯЗИ С НИЗКИМ КООРДИНАЦИОННЫМ ЧИСЛОМ ЛЁД ИМЕЕТ НЕВЫСОКУЮ ПЛОТНОСТЬ. САМЫЙ ЯРКИЙ ПРИМЕР СТРУКТУРИРОВАННОЙ ВОДЫ - ТАЛАЯ ВОДА. ЕЁ МОЖНО ЛЕГКО ПОЛУЧИТЬ В ДОМАШНИХ УСЛОВИЯХ МЕТОДОМ ЗАМОРАЖИВАНИЯ-ОТТАИВАНИЯ. ОНА ПОЯВЛЯЕТСЯ ПРИ ТАЯНИИ ЛЬДА И СОХРАНЯЕТ ТЕМПЕРАТУРУ 4 °С, ПОКА НЕ РАСТАЕТ ВЕСЬ ЛЁД. СПЕЦИФИКА МЕЖМОЛЕКУЛЯРНЫХ ВЗАИМОДЕЙСТВИЙ, ХАРАКТЕРНАЯ ДЛЯ СТРУКТУРЫ, СОХРАНЯЕТСЯ И В ТАЛОЙ ВОДЕ, ТАК КАК ПРИ ПЛАВЛЕНИИ КРИСТАЛЛА ЛЬДА РАЗРУШАЕТСЯ ТОЛЬКО 15% ВСЕХ ВОДОРОДНЫХ СВЯЗЕЙ. ПОЭТОМУ ПРИСУЩАЯ ЛЬДУ СВЯЗЬ КАЖДОЙ МОЛЕКУЛЫ ВОДЫ С ЧЕТЫРЬМЯ СОСЕДНИМИ ( «БЛИЖНИЙ ПОРЯДОК» ) В ЗНАЧИТЕЛЬНОЙ СТЕПЕНИ НЕ НАРУШАЕТСЯ, ХОТЯ И НАБЛЮДАЕТСЯ БOЛЬШАЯ РАЗМЫТОСТЬ КИСЛОРОДНОЙ КАРКАСНОЙ РЕШЁТКИ.
КРИСТАЛЛЫ ВСЕХ МОДИФИКАЦИЙ ЛЬДА ПОСТРОЕНЫ ИЗ МОЛЕКУЛ ВОДЫ H 2 O, СОЕДИНЁННЫХ ВОДОРОДНЫМИ СВЯЗЯМИ В ТРЁХМЕРНЫЙ КАРКАС, АНАЛОГИЧНЫЙ СТРУКТУРЕ АЛМАЗА. ИМЕННО В СВЯЗИ С ТЕМ, ЧТО ЛЁД ИМЕЕТ ТАКУЮ ВЫСОКОРЕГУЛЯРНУЮ СЕТЧАТУЮ СТРУКТУРУ И СВЯЗИ С НИЗКИМ КООРДИНАЦИОННЫМ ЧИСЛОМ ЛЁД ИМЕЕТ НЕВЫСОКУЮ ПЛОТНОСТЬ. САМЫЙ ЯРКИЙ ПРИМЕР СТРУКТУРИРОВАННОЙ ВОДЫ - ТАЛАЯ ВОДА. ЕЁ МОЖНО ЛЕГКО ПОЛУЧИТЬ В ДОМАШНИХ УСЛОВИЯХ МЕТОДОМ ЗАМОРАЖИВАНИЯ-ОТТАИВАНИЯ. ОНА ПОЯВЛЯЕТСЯ ПРИ ТАЯНИИ ЛЬДА И СОХРАНЯЕТ ТЕМПЕРАТУРУ 4 °С, ПОКА НЕ РАСТАЕТ ВЕСЬ ЛЁД. СПЕЦИФИКА МЕЖМОЛЕКУЛЯРНЫХ ВЗАИМОДЕЙСТВИЙ, ХАРАКТЕРНАЯ ДЛЯ СТРУКТУРЫ, СОХРАНЯЕТСЯ И В ТАЛОЙ ВОДЕ, ТАК КАК ПРИ ПЛАВЛЕНИИ КРИСТАЛЛА ЛЬДА РАЗРУШАЕТСЯ ТОЛЬКО 15% ВСЕХ ВОДОРОДНЫХ СВЯЗЕЙ. ПОЭТОМУ ПРИСУЩАЯ ЛЬДУ СВЯЗЬ КАЖДОЙ МОЛЕКУЛЫ ВОДЫ С ЧЕТЫРЬМЯ СОСЕДНИМИ ( «БЛИЖНИЙ ПОРЯДОК» ) В ЗНАЧИТЕЛЬНОЙ СТЕПЕНИ НЕ НАРУШАЕТСЯ, ХОТЯ И НАБЛЮДАЕТСЯ БOЛЬШАЯ РАЗМЫТОСТЬ КИСЛОРОДНОЙ КАРКАСНОЙ РЕШЁТКИ.
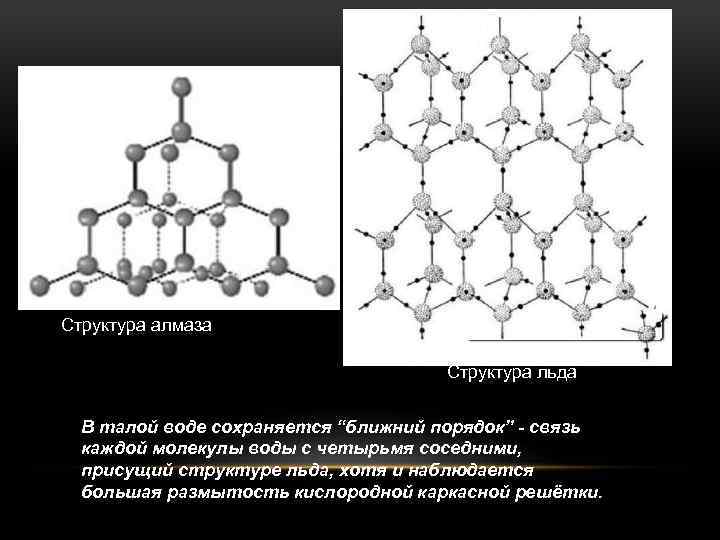 Структура алмаза Структура льда В талой воде сохраняется “ближний порядок” - связь каждой молекулы воды с четырьмя соседними, присущий структуре льда, хотя и наблюдается бoльшая размытость кислородной каркасной решётки.
Структура алмаза Структура льда В талой воде сохраняется “ближний порядок” - связь каждой молекулы воды с четырьмя соседними, присущий структуре льда, хотя и наблюдается бoльшая размытость кислородной каркасной решётки.
 СВОЙСТВА ВОДЫ МОГУТ БЫТЬ ЧАСТИЧНО ОБЪЯСНЕНЫ НА ОСНОВЕ ПОДХОДОВ КВАНТОВОЙ МЕХАНИКИ. ТАКОЙ ВЫВОД СДЕЛАН ГРУППОЙ ИССЛЕДОВАТЕЛЕЙ ИЗ США И ВЕЛИКОБРИТАНИИ, КОТОРЫЕ ПРОВЕЛИ ВЫСОКОЧУВСТВИТЕЛЬНЫЙ ЭКСПЕРИМЕНТ С МИКРОСКОПИЧЕСКИМ КОЛИЧЕСТВОМ ВОДЫ, ПОДВЕРГАЕМОЙ ВОЗДЕЙСТВИЮ ВЫСОКОЭНЕРГИЧНЫХ НЕЙТРОНОВ, КОТОРЫЕ ПРОИЗВОДИЛ ИСТОЧНИК ISIS (ЛАБОРАТОРИЯ РЕЗЕРФОРДА-ЭППЛТОНА, ОКСФОРДШИР, АНГЛИЯ). ДЕЛО В ТОМ, ЧТО В СХОЖЕМ СОСТОЯНИИ ВОДА НАХОДИТСЯ И В ЖИВЫХ КЛЕТКАХ ОРГАНИЗМА. ИССЛЕДОВАНИЯ ПРОВОДИЛИСЬ ПРИ КОМНАТНОЙ И НИЗКОЙ ТЕМПЕРАТУРАХ (300 И 170 ° ПО ШКАЛЕ КЕЛЬВИНА СООТВЕТСТВЕННО). ИЗ ДРУГИХ СВОЙСТВ ВОДЫ ТАКЖЕ ИЗВЕСТНО, ЧТО НАИБОЛЬШЕЙ ПЛОТНОСТЬЮ ВОДА ОБЛАДАЕТ ПРИ ТЕМПЕРАТУРЕ +4 °C, ЧТО ОБЕСПЕЧИВАЕТ ЗАМЕРЗАНИЕ ВОДЫ СВЕРХУ ВНИЗ, А НЕ В ОБРАТНОМ НАПРАВЛЕНИИ, ТЕМ САМЫМ ОБЕСПЕЧИВАЯ СОХРАНЕНИЕ ЖИЗНИ НА ГЛУБИНАХ В ПЕРИОДЫ ОБЛЕДЕНЕНИЯ. КСТАТИ, ВСКОРЕ ЭТО МОЖЕТ БЫТЬ ПОДТВЕРЖДЕНО "ВТОРЖЕНИЕМ" В ПОДЛЕДНОЕ АНТАРКТИЧЕСКОЕ ОЗЕРО РОССИЙСКИМИ ИССЛЕДОВАТЕЛЯМИ. В СВОЕЙ ПОСЛЕДНЕЙ РАБОТЕ ДЖОРДЖ РЕЙТЕР С КОЛЛЕГАМИ ИЗ ХЬЮСТОНСКОГО УНИВЕРСИТЕТА ПОПЫТАЛИСЬ ПОДРОБНО ИССЛЕДОВАТЬ КЛЮЧЕВОЙ ФАКТОР, ОТВЕТСТВЕННЫЙ ЗА НЕОБЫЧНЫЕ СВОЙСТВА ВОДЫ - ВОДОРОДНУЮ СВЯЗЬ. ЭТА МЕЖМОЛЕКУЛЯРНАЯ СВЯЗЬ ВОЗНИКАЕТ МЕЖДУ АТОМАМИ КИСЛОРОДА В ОДНОЙ МОЛЕКУЛЕ ВОДЫ И АТОМАМИ ВОДОРОДА В ДРУГОЙ МОЛЕКУЛЕ. БУДУЧИ СУЩЕСТВЕННО (НА ПОРЯДКИ) СЛАБЕЕ ХИМИЧЕСКИХ СВЯЗЕЙ, ВОДОРОДНАЯ СВЯЗЬ ОТВЕТСТВЕННА ЗА ЭЛЕКТРОСТАТИЧЕСКИЕ ЯВЛЕНИЯ, ДРУГИМИ СЛОВАМИ, ВОДА СОСТОИТ ИЗ ОТДЕЛЬНЫХ МОЛЕКУЛ ВОДЫ, СОЕДИНЕННЫХ ОДНА С ДРУГОЙ ПОЛОЖИТЕЛЬНЫМИ И ОТРИЦАТЕЛЬНЫМИ ЗАРЯДАМИ (ИЗВЕСТНЫЕ ДИПОЛИ ИЗ УЧЕБНИКА ХИМИИ).
СВОЙСТВА ВОДЫ МОГУТ БЫТЬ ЧАСТИЧНО ОБЪЯСНЕНЫ НА ОСНОВЕ ПОДХОДОВ КВАНТОВОЙ МЕХАНИКИ. ТАКОЙ ВЫВОД СДЕЛАН ГРУППОЙ ИССЛЕДОВАТЕЛЕЙ ИЗ США И ВЕЛИКОБРИТАНИИ, КОТОРЫЕ ПРОВЕЛИ ВЫСОКОЧУВСТВИТЕЛЬНЫЙ ЭКСПЕРИМЕНТ С МИКРОСКОПИЧЕСКИМ КОЛИЧЕСТВОМ ВОДЫ, ПОДВЕРГАЕМОЙ ВОЗДЕЙСТВИЮ ВЫСОКОЭНЕРГИЧНЫХ НЕЙТРОНОВ, КОТОРЫЕ ПРОИЗВОДИЛ ИСТОЧНИК ISIS (ЛАБОРАТОРИЯ РЕЗЕРФОРДА-ЭППЛТОНА, ОКСФОРДШИР, АНГЛИЯ). ДЕЛО В ТОМ, ЧТО В СХОЖЕМ СОСТОЯНИИ ВОДА НАХОДИТСЯ И В ЖИВЫХ КЛЕТКАХ ОРГАНИЗМА. ИССЛЕДОВАНИЯ ПРОВОДИЛИСЬ ПРИ КОМНАТНОЙ И НИЗКОЙ ТЕМПЕРАТУРАХ (300 И 170 ° ПО ШКАЛЕ КЕЛЬВИНА СООТВЕТСТВЕННО). ИЗ ДРУГИХ СВОЙСТВ ВОДЫ ТАКЖЕ ИЗВЕСТНО, ЧТО НАИБОЛЬШЕЙ ПЛОТНОСТЬЮ ВОДА ОБЛАДАЕТ ПРИ ТЕМПЕРАТУРЕ +4 °C, ЧТО ОБЕСПЕЧИВАЕТ ЗАМЕРЗАНИЕ ВОДЫ СВЕРХУ ВНИЗ, А НЕ В ОБРАТНОМ НАПРАВЛЕНИИ, ТЕМ САМЫМ ОБЕСПЕЧИВАЯ СОХРАНЕНИЕ ЖИЗНИ НА ГЛУБИНАХ В ПЕРИОДЫ ОБЛЕДЕНЕНИЯ. КСТАТИ, ВСКОРЕ ЭТО МОЖЕТ БЫТЬ ПОДТВЕРЖДЕНО "ВТОРЖЕНИЕМ" В ПОДЛЕДНОЕ АНТАРКТИЧЕСКОЕ ОЗЕРО РОССИЙСКИМИ ИССЛЕДОВАТЕЛЯМИ. В СВОЕЙ ПОСЛЕДНЕЙ РАБОТЕ ДЖОРДЖ РЕЙТЕР С КОЛЛЕГАМИ ИЗ ХЬЮСТОНСКОГО УНИВЕРСИТЕТА ПОПЫТАЛИСЬ ПОДРОБНО ИССЛЕДОВАТЬ КЛЮЧЕВОЙ ФАКТОР, ОТВЕТСТВЕННЫЙ ЗА НЕОБЫЧНЫЕ СВОЙСТВА ВОДЫ - ВОДОРОДНУЮ СВЯЗЬ. ЭТА МЕЖМОЛЕКУЛЯРНАЯ СВЯЗЬ ВОЗНИКАЕТ МЕЖДУ АТОМАМИ КИСЛОРОДА В ОДНОЙ МОЛЕКУЛЕ ВОДЫ И АТОМАМИ ВОДОРОДА В ДРУГОЙ МОЛЕКУЛЕ. БУДУЧИ СУЩЕСТВЕННО (НА ПОРЯДКИ) СЛАБЕЕ ХИМИЧЕСКИХ СВЯЗЕЙ, ВОДОРОДНАЯ СВЯЗЬ ОТВЕТСТВЕННА ЗА ЭЛЕКТРОСТАТИЧЕСКИЕ ЯВЛЕНИЯ, ДРУГИМИ СЛОВАМИ, ВОДА СОСТОИТ ИЗ ОТДЕЛЬНЫХ МОЛЕКУЛ ВОДЫ, СОЕДИНЕННЫХ ОДНА С ДРУГОЙ ПОЛОЖИТЕЛЬНЫМИ И ОТРИЦАТЕЛЬНЫМИ ЗАРЯДАМИ (ИЗВЕСТНЫЕ ДИПОЛИ ИЗ УЧЕБНИКА ХИМИИ).
 ЧИСТЫЙ ПРОТОННЫЙ ЭКСПЕРИМЕНТ РЕЙТЕР С КОЛЛЕГАМИ ОБНАРУЖИЛИ, ЧТО ОПИСАННАЯ РАНЕЕ ЭЛЕКТРОСТАТИЧЕСКАЯ МОДЕЛЬ НЕ МОЖЕТ БЫТЬ ИСПОЛЬЗОВАНА ДЛЯ РАСЧЕТА ЭНЕРГИИ ОТДЕЛЬНЫХ ПРОТОНОВ ВНУТРИ МОЛЕКУЛЫ ВОДЫ. ПОМЕЩАЯ ВОДУ ВНУТРЬ 1. 4 -НАНОМЕТРОВОГО ДИАМЕТРА ОДНОСЛОЙНОЙ И 1. 6 - И 2, 3 -НАНОМЕТРОВОГО ДИАМЕТРА ДВУХСЛОЙНЫХ УГЛЕРОДНЫХ НАНОТРУБОК, ПОДВЕРГАЛИ ЕЕ ВЫСОКОЭНЕРГЕТИЧЕСКОМУ НЕЙТРОННОМУ ОБЛУЧЕНИЮ. ТАКОЕ ОБЛУЧЕНИЕ ОБЕСПЕЧИВАЕТ ВЗАИМОДЕЙСТВИЕ НЕПОСРЕДСТВЕННО С ПРОТОНАМИ МОЛЕКУЛ ВОДЫ, ПРИ ЭТОМ ДРУГИМИ РАССЕИВАЮЩИМИ ФАКТОРАМИ МОЖНО ПРЕНЕБРЕЧЬ. РАСПРЕДЕЛЕНИЕ ЭНЕРГИИ ВЗАИМОДЕЙСТВУЮЩИХ НЕЙТРОНОВ, ТАКИМ ОБРАЗОМ, ДАЕТ ИССЛЕДОВАТЕЛЯМ ВОЗМОЖНОСТЬ НАПРЯМУЮ ИЗМЕРИТЬ И РАСПРЕДЕЛЕНИЕ ИМПУЛЬСА И ЭНЕРГИИ ПРОТОНОВ КИСЛОРОДА В ВОДЕ. НАНОТРУБКИ ВЫБРАНЫ КАК ИДЕАЛЬНЫЕ МОДЕЛИ КАНАЛОВ В БИОЛОГИЧЕСКИХ ЖИВЫХ СИСТЕМАХ. ВЫЯСНИЛОСЬ, ЧТО РАСПРЕДЕЛЕНИЕ ИМПУЛЬСОВ ПРОТОНОВ СИЛЬНО ЗАВИСИТ ОТ ТЕМПЕРАТУРЫ, И СИЛЬНО ОТЛИЧАЕТСЯ ОТ ПРЕДСКАЗЫВАЕМОГО ЭЛЕКТРОСТАТИЧЕСКОЙ МОДЕЛЬЮ. ЭНЕРГИЯ ВОДЫ В 1, 6 -НАНОМЕТРОВОЙ ДВУХСЛОЙНОЙ НАНОТРУБКЕ ОКАЗАЛАСЬ ВЫШЕ НА 50% В УСЛОВИЯХ НИЗКОЙ ТЕМПЕРАТУРЫ, И НА 20%. ДЛЯ КОМНАТНОЙ. Т. Е. БОЛЕЕ-МЕНЕЕ ПРИЕМЛЕМЫЙ ПРОГНОЗ ЭТА ТЕОРИЯ ДАЕТ ТОЛЬКО ДЛЯ КОМНАТНОЙ ТЕМПЕРАТУРЫ. ВЫВОД КОМАНДЫ ИССЛЕДОВАТЕЛЕЙ СОСТОИТ В ТОМ, ЧТО ТАКИЕ МАЛЕНЬКИЕ КОЛИЧЕСТВА ВОДЫ МЕЖДУ СТЕНКАМИ НАНОТРУБКИ ВЫЗЫВАЮТ ОСОБЫЕ КВАНТОВЫЕ СОСТОЯНИЯ АТОМОВ В МОЛЕКУЛЕ ПРИ НИЗКИХ ТЕМПЕРАТУРАХ, КОТОРЫЕ НЕ МОГУТ БЫТЬ ПРЕДСКАЗАЫ ЭЛЕКТРОСТАТИЧЕСКОЙ МОДЕЛЬЮ. ПРИ ТИПИЧНЫХ РАССТОЯНИЯХ В 0, 1 НАНОМЕТРА, ОТДЕЛЯЮЩИХ МОЛЕКУЛЫ, ТОЛЬКО ОСРЕДНЕННЫЙ МЕЖМОЛЕКУЛЯРНЫЙ ПОТЕНЦИАЛ МОЖЕТ ОКАЗЫВАТЬ СУЩЕСТВЕННОЕ ВОЗДЕЙСТВИЕ, ТОГДА КАК ПРИ 0, 01 НАНОМЕТРОВЫХ МАСШТАБАХ СУЩЕСТВЕННЫМИ СТАНОВЯТСЯ КВАНТОВЫЕ ФЛУКТУАЦИИ ЗАРЯДА В ИНДИВИДУАЛЬНОМ ПРОТОННОМ ПОТЕНЦИАЛЕ. В ТАКИХ УСЛОВИЯХ ВОДОРОДНЫЕ СВЯЗИ ФОРМИРУЮТ ТАК НАЗЫВАЕМУЮ "СВЯЗАННУЮ ЭЛЕКТРОННУЮ СТРУКТУРУ", И ИМЕННО ОНА ОТВЕСТВЕННАЯ ЗА РЕАКЦИЮ НА СЖАТИЕ И СУЩЕСТВЕННЫЕ ИЗМЕНЕНИЯ В ЭНЕРГИИ ПРОТОНА. НО СУЩЕСТВЕННЫЕ ИЗМЕНЕНИЯ В ЭНЕРГИИ ПРОИСХОДЯТ И ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ. ЭТО ПОКА НИКАК НЕ ОБЪЯСНЯЕТСЯ.
ЧИСТЫЙ ПРОТОННЫЙ ЭКСПЕРИМЕНТ РЕЙТЕР С КОЛЛЕГАМИ ОБНАРУЖИЛИ, ЧТО ОПИСАННАЯ РАНЕЕ ЭЛЕКТРОСТАТИЧЕСКАЯ МОДЕЛЬ НЕ МОЖЕТ БЫТЬ ИСПОЛЬЗОВАНА ДЛЯ РАСЧЕТА ЭНЕРГИИ ОТДЕЛЬНЫХ ПРОТОНОВ ВНУТРИ МОЛЕКУЛЫ ВОДЫ. ПОМЕЩАЯ ВОДУ ВНУТРЬ 1. 4 -НАНОМЕТРОВОГО ДИАМЕТРА ОДНОСЛОЙНОЙ И 1. 6 - И 2, 3 -НАНОМЕТРОВОГО ДИАМЕТРА ДВУХСЛОЙНЫХ УГЛЕРОДНЫХ НАНОТРУБОК, ПОДВЕРГАЛИ ЕЕ ВЫСОКОЭНЕРГЕТИЧЕСКОМУ НЕЙТРОННОМУ ОБЛУЧЕНИЮ. ТАКОЕ ОБЛУЧЕНИЕ ОБЕСПЕЧИВАЕТ ВЗАИМОДЕЙСТВИЕ НЕПОСРЕДСТВЕННО С ПРОТОНАМИ МОЛЕКУЛ ВОДЫ, ПРИ ЭТОМ ДРУГИМИ РАССЕИВАЮЩИМИ ФАКТОРАМИ МОЖНО ПРЕНЕБРЕЧЬ. РАСПРЕДЕЛЕНИЕ ЭНЕРГИИ ВЗАИМОДЕЙСТВУЮЩИХ НЕЙТРОНОВ, ТАКИМ ОБРАЗОМ, ДАЕТ ИССЛЕДОВАТЕЛЯМ ВОЗМОЖНОСТЬ НАПРЯМУЮ ИЗМЕРИТЬ И РАСПРЕДЕЛЕНИЕ ИМПУЛЬСА И ЭНЕРГИИ ПРОТОНОВ КИСЛОРОДА В ВОДЕ. НАНОТРУБКИ ВЫБРАНЫ КАК ИДЕАЛЬНЫЕ МОДЕЛИ КАНАЛОВ В БИОЛОГИЧЕСКИХ ЖИВЫХ СИСТЕМАХ. ВЫЯСНИЛОСЬ, ЧТО РАСПРЕДЕЛЕНИЕ ИМПУЛЬСОВ ПРОТОНОВ СИЛЬНО ЗАВИСИТ ОТ ТЕМПЕРАТУРЫ, И СИЛЬНО ОТЛИЧАЕТСЯ ОТ ПРЕДСКАЗЫВАЕМОГО ЭЛЕКТРОСТАТИЧЕСКОЙ МОДЕЛЬЮ. ЭНЕРГИЯ ВОДЫ В 1, 6 -НАНОМЕТРОВОЙ ДВУХСЛОЙНОЙ НАНОТРУБКЕ ОКАЗАЛАСЬ ВЫШЕ НА 50% В УСЛОВИЯХ НИЗКОЙ ТЕМПЕРАТУРЫ, И НА 20%. ДЛЯ КОМНАТНОЙ. Т. Е. БОЛЕЕ-МЕНЕЕ ПРИЕМЛЕМЫЙ ПРОГНОЗ ЭТА ТЕОРИЯ ДАЕТ ТОЛЬКО ДЛЯ КОМНАТНОЙ ТЕМПЕРАТУРЫ. ВЫВОД КОМАНДЫ ИССЛЕДОВАТЕЛЕЙ СОСТОИТ В ТОМ, ЧТО ТАКИЕ МАЛЕНЬКИЕ КОЛИЧЕСТВА ВОДЫ МЕЖДУ СТЕНКАМИ НАНОТРУБКИ ВЫЗЫВАЮТ ОСОБЫЕ КВАНТОВЫЕ СОСТОЯНИЯ АТОМОВ В МОЛЕКУЛЕ ПРИ НИЗКИХ ТЕМПЕРАТУРАХ, КОТОРЫЕ НЕ МОГУТ БЫТЬ ПРЕДСКАЗАЫ ЭЛЕКТРОСТАТИЧЕСКОЙ МОДЕЛЬЮ. ПРИ ТИПИЧНЫХ РАССТОЯНИЯХ В 0, 1 НАНОМЕТРА, ОТДЕЛЯЮЩИХ МОЛЕКУЛЫ, ТОЛЬКО ОСРЕДНЕННЫЙ МЕЖМОЛЕКУЛЯРНЫЙ ПОТЕНЦИАЛ МОЖЕТ ОКАЗЫВАТЬ СУЩЕСТВЕННОЕ ВОЗДЕЙСТВИЕ, ТОГДА КАК ПРИ 0, 01 НАНОМЕТРОВЫХ МАСШТАБАХ СУЩЕСТВЕННЫМИ СТАНОВЯТСЯ КВАНТОВЫЕ ФЛУКТУАЦИИ ЗАРЯДА В ИНДИВИДУАЛЬНОМ ПРОТОННОМ ПОТЕНЦИАЛЕ. В ТАКИХ УСЛОВИЯХ ВОДОРОДНЫЕ СВЯЗИ ФОРМИРУЮТ ТАК НАЗЫВАЕМУЮ "СВЯЗАННУЮ ЭЛЕКТРОННУЮ СТРУКТУРУ", И ИМЕННО ОНА ОТВЕСТВЕННАЯ ЗА РЕАКЦИЮ НА СЖАТИЕ И СУЩЕСТВЕННЫЕ ИЗМЕНЕНИЯ В ЭНЕРГИИ ПРОТОНА. НО СУЩЕСТВЕННЫЕ ИЗМЕНЕНИЯ В ЭНЕРГИИ ПРОИСХОДЯТ И ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ. ЭТО ПОКА НИКАК НЕ ОБЪЯСНЯЕТСЯ.
 БУДУЧИ ПОМЕЩЕННОЙ В ОСОБЫЙ МЕМБРАННЫЙ МАТЕРИАЛ NAFION, КОТОРЫЙ ИСПОЛЬЗУЕТСЯ ДЛЯ ПРОИЗВОДСТВА ТОПЛИВНЫХ ЭЛЕМЕНТОВ, ВОДА ОБЛАДАЛА ЭНЕРГИЕЙ ПОЧТИ В ДВА РАЗА БОЛЬШЕЙ, ЧЕМ В СВОБОДНОМ СОСТОЯНИИ. ТАКЖЕ БЫЛО ОБНАРУЖЕНО (ЭКСПЕРИМЕНТ СМОТРИ ВЫШЕ), ЧТО, БУДУЧИ ПОМЕЩЕННОЙ В 1. 4 НАНОМЕТРОВУЮ ОДНОСТЕНОЧНУЮ НАНОТРУБКУ, РАСПРЕДЕЛЕНИЕ ПРОТОНОВ ВЫЯВИЛО ПАДЕНИЕ КИНЕТИЧЕСКОЙ ЭНЕРГИИ НА 30% ПО СРАВНЕНИЮ СО СВОБОДНОЙ ВОДОЙ. КАК СКАЗАЛ РЕЙТЕР, ХИМИЧЕСКИЕ РАКЦИИ В ЭТОМ СЛУЧАЕ НЕ ИМЕЛИ МЕСТА, И ЕДИНСТВЕННОЙ РАЗНИЦЕЙ МЕЖДУ ДВУМЯ НАБОРАМИ НАНОТРУБОК (ПОЛУЧЕННЫХ, КСТАТИ, МЕТОДОМ ПРОПУСКАНИЯ ТОКА ПРИ ИСПАРЕНИИ НА МЕТАЛЛО-УГЛЕРОДНОМ КОМПОЗИЦИОННОМ АНОДЕ) БЫЛ ИХ РАЗМЕР. ЭТО ГОВОРИТ О ТОМ, ЧТО КВАНТОВЫЕ СОСТОЯНИЯ РЕАЛИЗУЮТСЯ ПРИ ПОМЕЩЕНИИ МОЛЕКУЛЫ В ЦИЛИНДР, И В СУЩЕСТВЕННОЙ СТЕПЕНИ ЗАВИСЯТ ОТ ВЕЛИЧИНЫ ЭТОГО ЦИЛИНДРА. ИДЕНТИФИКАЦИЯ И ПЕРЕКЛЮЧЕНИЕ ТАКИХ КВАНТОВЫХ СОСТОЯНИЙ МОЛЕКУЛ ВОДЫ МОЖЕТ БЫТЬ ВАЖНОЙ ВВИДУ ТОГО, ЧТО РАССТОЯНИЯ В ЭКСПЕРИМЕНТЕ - ОКОЛО 2 НМ - ПРИБЛИЗИТЕЛЬНО СООТВЕСТВУЮТ СТРУКТУРНЫМ ЭЛЕМЕНТАМ ВНУТРИ БИОЛОГИЧЕСКИХ КЛЕТОК. КАК СКАЗАЛ РЕЙТЕР, " МНЕ КАЖЕТСЯ, ЧТО КВАНТОВАЯ МЕХАНИКА ПРОТОНОВ В ВОДЕ ИГРАЕТ РОЛЬ В РАЗВИТИИ КЛЕТОЧНЫХ ФОРМ ЖИЗНИ НАМНОГО БОЛЕЕ ВАЖНУЮ, ЧЕМ МЫ МОГЛИ ПРЕДПОЛАГАТЬ РАНЕЕ ". ИЗ ВОЗМОЖНЫХ ПРАКТИЧЕСКИХ ПРИМЕНЕНИЙ ИССЛЕДОВАНИЯ ЯВЛЯЕТСЯ УЛУЧШЕНИЕ ПРОИЗОДИТЕЛЬНОСТИ ТОПЛИВНЫХ ЯЧЕЕК. ОБНАРУЖЕНА КОРРЕЛЯЦИЯ МЕЖДУ ПРОВОДИМОСТЬЮ ВОДЫ ПОМЕЩЕННОЙ В МАТЕРИАЛ НАФИОН, И УРОВНЕМ ЭНЕРГИИ ПРОТОНОВ ВНУТРИ ВОДЫ, ПОМЕЩЕННОЙ МЕЖДУ ДВОЙНЫМИ ИЛИ ОДИНАРНЫМИ ПОТЕНЦИАЛЬНЫМИ СТЕНКАМИ. С ТЕМ, ЧТО СТРУКТУРА ВОДОРОДНЫХ СВЯЗЕЙ В СТЕСНЕННОЙ И СВОБОДНОЙ ВОДЕ БУДЕТ СОВЕРШЕННО РАЗЛИЧНОЙ, СОГЛШАЕТСЯ И ПРОФЕССОР СОУ-ХСИН ЧЕН ИЗ МАСАЧУСЕТСКОГО ТЕХНОЛОГИЧЕСКОГО ИНСТИТУТА, КОТОРЫЕ НЕ ПРИНИМАЛ УЧАСТИЯ В ДАННОМ ИССЛЕДОВАНИИ. СЛЕДУЮЩИМ ШАГОМ В ИССЛЕДОВАНИИ, НА ЕГО ВЗГЛЯД, ДОЛЖНО СТАТЬ ИЗУЧЕНИЕ МЕТОДОАМИ КВАНТОВОГО МЕХАНИЧЕСКОГО МОДЕЛИРОВАНИЯ, КАК ИЗМЕНЯЮТСЯ СВОЙСТВА СТЕСНЕННОЙ ВОДЫ. НО ЗАТРУДНЕНИЕМ ЗДЕСЬ ЯВЛЯЕТСЯ ТО, ЧТО НЕ ВСЕ СВОЙСТВА ВОДЫ МОГУТ БЫТЬ ОБЬЯСНЕНЫ С ИСПОЛЬЗОВАНИЕМ КВАНТОВОЙ МЕХАНИКИ. ОН ПОЛАГАЕТ, В ЧАСТНОСТИ, ЧТО ЗАЯВЛЕНИЯ, СДЕЛАННЫЕ НЕКОТОРЫМИ ИССЛЕДОВАТЕЛЬСКИМИ ГРУППАМИ, ЧТО ПЕРЕОХЛАЖДЕННАЯ ВОДА ИМЕЕТ РАЗЛИЧАЮЩИЕСЯ ВЫСОКО- И НИЗКО-ПЛОТНЫЕ ФОРМЫ, ЛУЧШЕ ОБЪЯСНЯТЬ ПОДХОДАМИ СТАТИСТИЧЕСКОЙ МЕХАНИКИ, ЧЕМ РАССМАТРИВАЕМЫМ ЗДЕСЬ ПОВЕДЕНИЕМ ИНДИВИДУАЛЬНЫХ ЧАСТИЦ, СВОЙСТВЕНЫХ КВАНТОВОЙ МЕХАНИКЕ.
БУДУЧИ ПОМЕЩЕННОЙ В ОСОБЫЙ МЕМБРАННЫЙ МАТЕРИАЛ NAFION, КОТОРЫЙ ИСПОЛЬЗУЕТСЯ ДЛЯ ПРОИЗВОДСТВА ТОПЛИВНЫХ ЭЛЕМЕНТОВ, ВОДА ОБЛАДАЛА ЭНЕРГИЕЙ ПОЧТИ В ДВА РАЗА БОЛЬШЕЙ, ЧЕМ В СВОБОДНОМ СОСТОЯНИИ. ТАКЖЕ БЫЛО ОБНАРУЖЕНО (ЭКСПЕРИМЕНТ СМОТРИ ВЫШЕ), ЧТО, БУДУЧИ ПОМЕЩЕННОЙ В 1. 4 НАНОМЕТРОВУЮ ОДНОСТЕНОЧНУЮ НАНОТРУБКУ, РАСПРЕДЕЛЕНИЕ ПРОТОНОВ ВЫЯВИЛО ПАДЕНИЕ КИНЕТИЧЕСКОЙ ЭНЕРГИИ НА 30% ПО СРАВНЕНИЮ СО СВОБОДНОЙ ВОДОЙ. КАК СКАЗАЛ РЕЙТЕР, ХИМИЧЕСКИЕ РАКЦИИ В ЭТОМ СЛУЧАЕ НЕ ИМЕЛИ МЕСТА, И ЕДИНСТВЕННОЙ РАЗНИЦЕЙ МЕЖДУ ДВУМЯ НАБОРАМИ НАНОТРУБОК (ПОЛУЧЕННЫХ, КСТАТИ, МЕТОДОМ ПРОПУСКАНИЯ ТОКА ПРИ ИСПАРЕНИИ НА МЕТАЛЛО-УГЛЕРОДНОМ КОМПОЗИЦИОННОМ АНОДЕ) БЫЛ ИХ РАЗМЕР. ЭТО ГОВОРИТ О ТОМ, ЧТО КВАНТОВЫЕ СОСТОЯНИЯ РЕАЛИЗУЮТСЯ ПРИ ПОМЕЩЕНИИ МОЛЕКУЛЫ В ЦИЛИНДР, И В СУЩЕСТВЕННОЙ СТЕПЕНИ ЗАВИСЯТ ОТ ВЕЛИЧИНЫ ЭТОГО ЦИЛИНДРА. ИДЕНТИФИКАЦИЯ И ПЕРЕКЛЮЧЕНИЕ ТАКИХ КВАНТОВЫХ СОСТОЯНИЙ МОЛЕКУЛ ВОДЫ МОЖЕТ БЫТЬ ВАЖНОЙ ВВИДУ ТОГО, ЧТО РАССТОЯНИЯ В ЭКСПЕРИМЕНТЕ - ОКОЛО 2 НМ - ПРИБЛИЗИТЕЛЬНО СООТВЕСТВУЮТ СТРУКТУРНЫМ ЭЛЕМЕНТАМ ВНУТРИ БИОЛОГИЧЕСКИХ КЛЕТОК. КАК СКАЗАЛ РЕЙТЕР, " МНЕ КАЖЕТСЯ, ЧТО КВАНТОВАЯ МЕХАНИКА ПРОТОНОВ В ВОДЕ ИГРАЕТ РОЛЬ В РАЗВИТИИ КЛЕТОЧНЫХ ФОРМ ЖИЗНИ НАМНОГО БОЛЕЕ ВАЖНУЮ, ЧЕМ МЫ МОГЛИ ПРЕДПОЛАГАТЬ РАНЕЕ ". ИЗ ВОЗМОЖНЫХ ПРАКТИЧЕСКИХ ПРИМЕНЕНИЙ ИССЛЕДОВАНИЯ ЯВЛЯЕТСЯ УЛУЧШЕНИЕ ПРОИЗОДИТЕЛЬНОСТИ ТОПЛИВНЫХ ЯЧЕЕК. ОБНАРУЖЕНА КОРРЕЛЯЦИЯ МЕЖДУ ПРОВОДИМОСТЬЮ ВОДЫ ПОМЕЩЕННОЙ В МАТЕРИАЛ НАФИОН, И УРОВНЕМ ЭНЕРГИИ ПРОТОНОВ ВНУТРИ ВОДЫ, ПОМЕЩЕННОЙ МЕЖДУ ДВОЙНЫМИ ИЛИ ОДИНАРНЫМИ ПОТЕНЦИАЛЬНЫМИ СТЕНКАМИ. С ТЕМ, ЧТО СТРУКТУРА ВОДОРОДНЫХ СВЯЗЕЙ В СТЕСНЕННОЙ И СВОБОДНОЙ ВОДЕ БУДЕТ СОВЕРШЕННО РАЗЛИЧНОЙ, СОГЛШАЕТСЯ И ПРОФЕССОР СОУ-ХСИН ЧЕН ИЗ МАСАЧУСЕТСКОГО ТЕХНОЛОГИЧЕСКОГО ИНСТИТУТА, КОТОРЫЕ НЕ ПРИНИМАЛ УЧАСТИЯ В ДАННОМ ИССЛЕДОВАНИИ. СЛЕДУЮЩИМ ШАГОМ В ИССЛЕДОВАНИИ, НА ЕГО ВЗГЛЯД, ДОЛЖНО СТАТЬ ИЗУЧЕНИЕ МЕТОДОАМИ КВАНТОВОГО МЕХАНИЧЕСКОГО МОДЕЛИРОВАНИЯ, КАК ИЗМЕНЯЮТСЯ СВОЙСТВА СТЕСНЕННОЙ ВОДЫ. НО ЗАТРУДНЕНИЕМ ЗДЕСЬ ЯВЛЯЕТСЯ ТО, ЧТО НЕ ВСЕ СВОЙСТВА ВОДЫ МОГУТ БЫТЬ ОБЬЯСНЕНЫ С ИСПОЛЬЗОВАНИЕМ КВАНТОВОЙ МЕХАНИКИ. ОН ПОЛАГАЕТ, В ЧАСТНОСТИ, ЧТО ЗАЯВЛЕНИЯ, СДЕЛАННЫЕ НЕКОТОРЫМИ ИССЛЕДОВАТЕЛЬСКИМИ ГРУППАМИ, ЧТО ПЕРЕОХЛАЖДЕННАЯ ВОДА ИМЕЕТ РАЗЛИЧАЮЩИЕСЯ ВЫСОКО- И НИЗКО-ПЛОТНЫЕ ФОРМЫ, ЛУЧШЕ ОБЪЯСНЯТЬ ПОДХОДАМИ СТАТИСТИЧЕСКОЙ МЕХАНИКИ, ЧЕМ РАССМАТРИВАЕМЫМ ЗДЕСЬ ПОВЕДЕНИЕМ ИНДИВИДУАЛЬНЫХ ЧАСТИЦ, СВОЙСТВЕНЫХ КВАНТОВОЙ МЕХАНИКЕ.


