Лактоны.ppt
- Количество слайдов: 13

Лактоны полиоксикарбоновых кислот Кислота аскорбиновая. Acidum ascorbinicum. Vit. C.
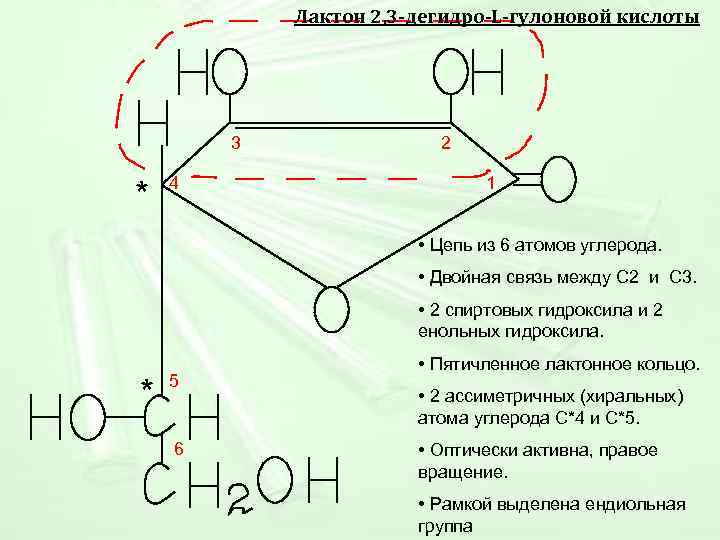
Лактон 2, 3 -дегидро-L-гулоновой кислоты 3 2 4 1 * • Цепь из 6 атомов углерода. • Двойная связь между С 2 и С 3. • 2 спиртовых гидроксила и 2 енольных гидроксила. • Пятичленное лактонное кольцо. 5 * • 2 ассиметричных (хиральных) атома углерода С*4 и С*5. 6 • Оптически активна, правое вращение. • Рамкой выделена ендиольная группа

Строение • Цепь из 6 атомов углерода. • Двойная связь между С 2 и С 3. • 2 спиртовых гидроксила и 2 енольных гидроксила. • Пятичленное лактонное кольцо. • 2 ассиметричных (хиральных) атома углерода С*4 и С*5. • Оптически активна, правое вращение. • Рамкой выделена ендиольная группа -Лактон 2, 3 -дегидро-L-гулоновой кислоты

Получение • Получают из глюкозы, которая образуется при гидролизе крахмала. СХЕМА ПОЛУЧЕНИЯ АСКОРБИНОВОЙ КИСЛОТЫ H 2 SO 4 [H] м/б Крахмал гидролиз Д-глюкоза Д-сорбит окисление L-сорбоза L- аскорбиновая кислота • Синтезирована в 1933 году. • Содержится в ягодах, фруктах, плодах.

Физические свойства Белый кристаллический порошок без запаха, кислого вкуса. ЛР в воде, Р в спирте, ПНР в эфире, хлороформе. В кристаллическом виде более устойчива, чем в растворах.

Химические свойства 1. Кислотные свойства аскорбиновой кислоты. • Обусловлены наличием енольных гидроксилов, обладающих кислотными свойствами. Эти свойства более выражены у гидроксила в 3 -ем положении, т. е. аскорбиновая кислота является одноосновной кислотой. • Она даёт кислую реакцию на лакмус, взаимодействует с едкими и углекислыми щелочами, образует соли ( аскорбинаты ): НО ОН Na. O OH + Na. OH (Na. HCO 3) + Н 2 О + CO 2 Аскорбинат натрия

2. Восстановительные свойства. • Обусловлены наличием подвижных атомов водорода ендиольной группы. • Окисление аскорбиновой кислоты идёт в 2 стадии. 1 -ая стадия окисления обратима: Окисление идёт до дегидроаскорбиновой кислоты (кетоформы аскорбиновой кислоты). 2 -ая стадия окисления необратима: Она заканчивается образованием фурфурола. Витаминная активность пропадает. НО ОН О О [O] С [H] Н Аскорбиновая 1 -ая Дегидроаскорби 2 -ая О кислота стадия новая кислота стадия фурфурол (енольная форма) окисления (кетоформа а. к. ) окисления Дикетоаскорби новая кислота
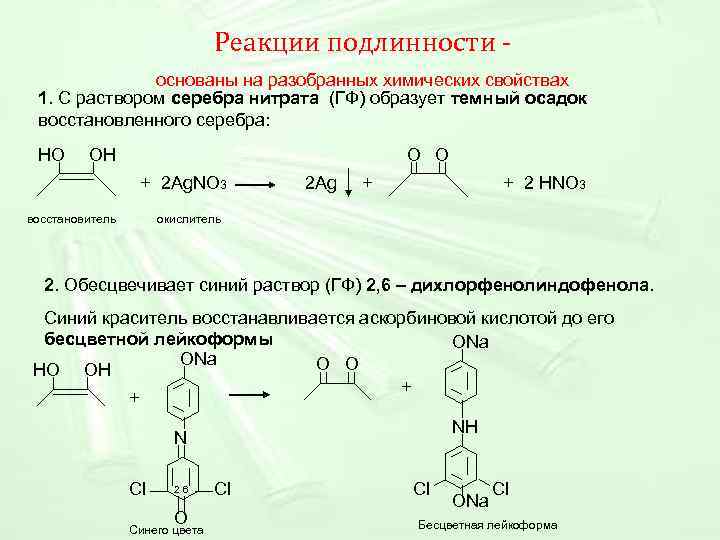
Реакции подлинности - основаны на разобранных химических свойствах 1. С раствором серебра нитрата (ГФ) образует темный осадок восстановленного серебра: НО ОН O O + 2 Ag. NO 3 2 Ag + 2 HNO 3 восстановитель окислитель 2. Обесцвечивает синий раствор (ГФ) 2, 6 – дихлорфенолиндофенола. Синий краситель восстанавливается аскорбиновой кислотой до его бесцветной лейкоформы ONa О О НО ОН + + NН N Cl 26 Cl ONa O Бесцветная лейкоформа Синего цвета
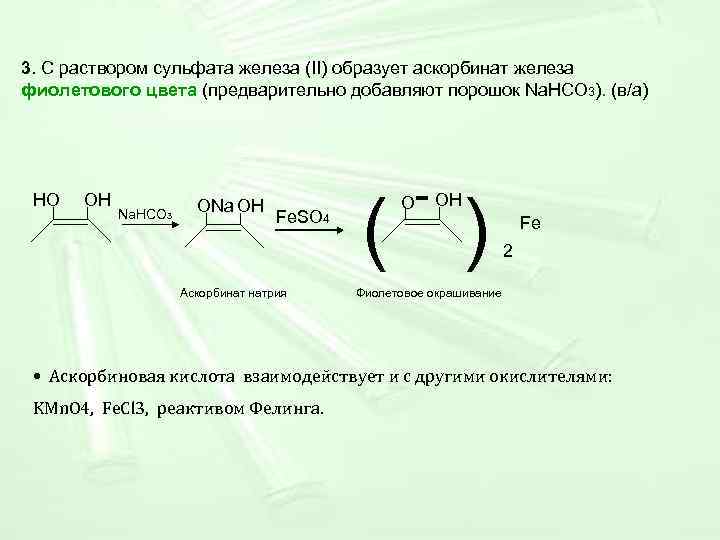
3. С раствором сульфата железа (II) образует аскорбинат железа фиолетового цвета (предварительно добавляют порошок Na. HCO 3). (в/а) - OH ( ) НО ОН ONa ОН O Na. HCO 3 Fe. SO 4 Fe 2 Аскорбинат натрия Фиолетовое окрашивание • Аскорбиновая кислота взаимодействует и с другими окислителями: KMn. O 4, Fe. Cl 3, реактивом Фелинга.
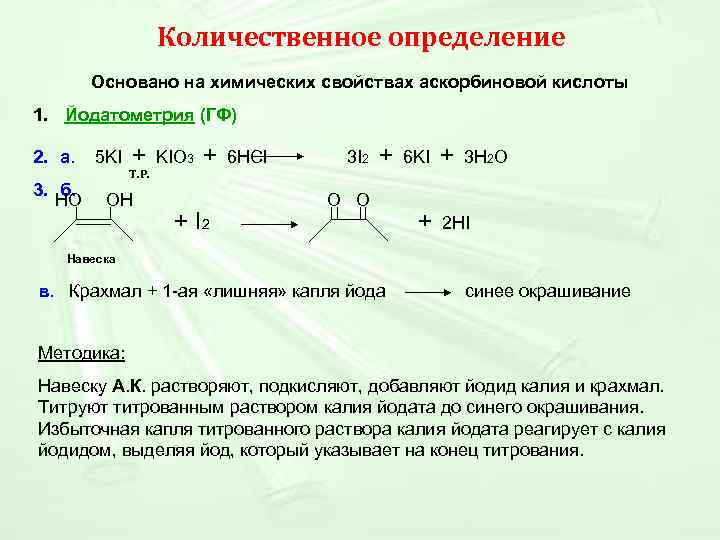
Количественное определение Основано на химических свойствах аскорбиновой кислоты 1. Йодатометрия (ГФ) 2. а. 5 KI + KIO 3 + 6 HCl 3 I 2 + 6 KI + 3 H 2 O Т. Р. 3. б. НО ОН O O + I 2 + 2 HI Навеска в. Крахмал + 1 -ая «лишняя» капля йода синее окрашивание Методика: Навеску А. К. растворяют, подкисляют, добавляют йодид калия и крахмал. Титруют титрованным раствором калия йодата до синего окрашивания. Избыточная капля титрованного раствора калия йодата реагирует с калия йодидом, выделяя йод, который указывает на конец титрования.
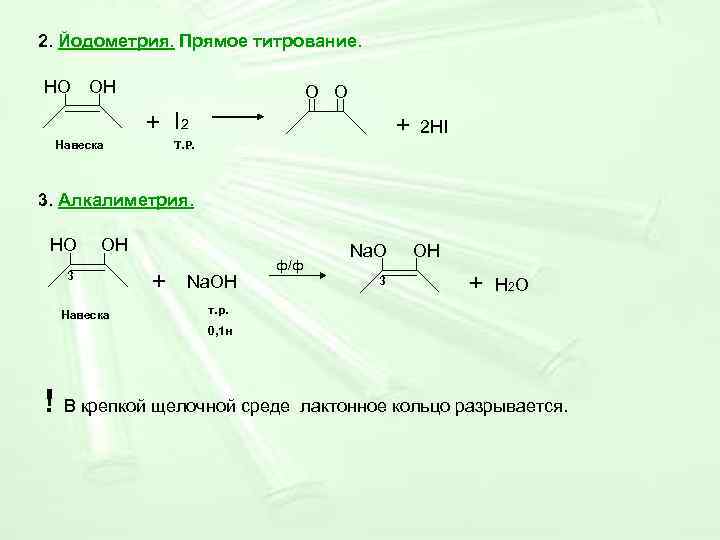
2. Йодометрия. Прямое титрование. НО ОН O O + I 2 + 2 HI Навеска Т. Р. 3. Алкалиметрия. НО ОН Na. O ОН ф/ф 3 + Na. OH 3 + H 2 O Навеска т. р. 0, 1 н ! В крепкой щелочной среде лактонное кольцо разрывается.

Чистота • Регламентируется содержание сульфатной золы и т. м. • Содержание органических примесей определяют с конц. H 2 SO 4. • Окраска не должна превышать эталона 5 б. Применение Внутрь, в/м, в/в как витаминное средство. Регулирует окислительно- восстановительные процессы. Выпускается в виде порошка, таблеток, драже, растворов д/и. Хранение В хорошо укупоренной таре, предохраняя от действия света и воздуха.

Примечания • Раствор аскорбиновой кислоты 5% для инъекций стабилизируют добавлением натрия гидрокарбоната и натрия сульфита (или метабисульфита). • Натрия гидрокарбонат добавляют для снижения болезненности инъекций. • Натрия сульфит и натрия метабисульфит являются антиоксидантами. • Сульфит натрия при количественном определении йодатометрическим методом будет взаимодействовать с титрантом-раствором калия йодата. Поэтому вначале ГФ рекомендует добавлять раствор формальдегида для связывания антиоксидантов: OH Na 2 SO 3 + H-C-H + H 2 O H-C-SO 3 Na + Na. OH O H Затем кислоту аскорбиновую титруют стандартным раствором калия йодата (см. выше). • 5% раствор аскорбиновой кислоты для инъекций ГФ рекомендует разливать в ампулы в токе СО 2. • Окраска инъекционного раствора аскорбиновой кислоты не должна быть интенсивнее эталона № 4 а
Лактоны.ppt