Chimie Generale Cours 1.ppt
- Количество слайдов: 30
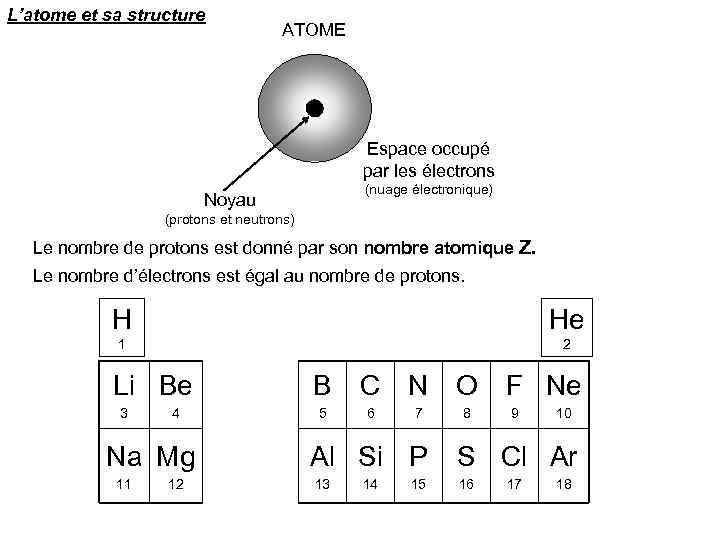 L’atome et sa structure ATOME Espace occupé par les électrons (nuage électronique) Noyau (protons et neutrons) Le nombre de protons est donné par son nombre atomique Z. Le nombre d’électrons est égal au nombre de protons. H He 1 2 Li Be 3 4 Na Mg 11 12 B 5 C N O 6 7 Al Si P 13 14 15 8 F Ne 9 10 S Cl Ar 16 17 18
L’atome et sa structure ATOME Espace occupé par les électrons (nuage électronique) Noyau (protons et neutrons) Le nombre de protons est donné par son nombre atomique Z. Le nombre d’électrons est égal au nombre de protons. H He 1 2 Li Be 3 4 Na Mg 11 12 B 5 C N O 6 7 Al Si P 13 14 15 8 F Ne 9 10 S Cl Ar 16 17 18
 Les électrons v Les électrons ne sont pas placés autour du noyau de façon aléatoire. v Les électrons occupent des niveaux d’énergie distincts = couches électroniques. v Ces couches sont numérotées depuis le centre à l’aide de nombres entiers appelés nombres quantiques principaux : - La 1ére couche (la plus proche du noyau) représente le niveau d’énergie le plus bas. Plus il ressent l’attraction exercée par les protons du noyau et plus basse est son énergie, - Les couches plus éloignées du noyau ont des nombres quantiques plus élevés, elles augmentent en taille et les électrons qui les occupent, ont des énergies plus élevées.
Les électrons v Les électrons ne sont pas placés autour du noyau de façon aléatoire. v Les électrons occupent des niveaux d’énergie distincts = couches électroniques. v Ces couches sont numérotées depuis le centre à l’aide de nombres entiers appelés nombres quantiques principaux : - La 1ére couche (la plus proche du noyau) représente le niveau d’énergie le plus bas. Plus il ressent l’attraction exercée par les protons du noyau et plus basse est son énergie, - Les couches plus éloignées du noyau ont des nombres quantiques plus élevés, elles augmentent en taille et les électrons qui les occupent, ont des énergies plus élevées.
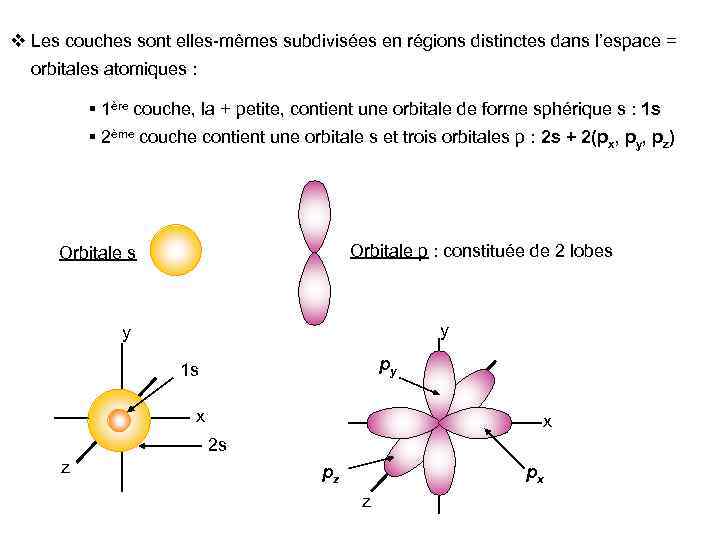 v Les couches sont elles-mêmes subdivisées en régions distinctes dans l’espace = orbitales atomiques : § 1ère couche, la + petite, contient une orbitale de forme sphérique s : 1 s § 2ème couche contient une orbitale s et trois orbitales p : 2 s + 2(px, py, pz) Orbitale p : constituée de 2 lobes Orbitale s y y py 1 s x x 2 s z pz px z
v Les couches sont elles-mêmes subdivisées en régions distinctes dans l’espace = orbitales atomiques : § 1ère couche, la + petite, contient une orbitale de forme sphérique s : 1 s § 2ème couche contient une orbitale s et trois orbitales p : 2 s + 2(px, py, pz) Orbitale p : constituée de 2 lobes Orbitale s y y py 1 s x x 2 s z pz px z
 Les électrons occupent ces orbitales d’une manière prévisible déduite des trois règles (règles de remplissage) qui suivent : v Règle 1 : Les orbitales de plus basse énergie se remplissent d’abord v Règle 2 : Un maximum de 2 électrons (de spins opposés) peuvent occuper une même orbitale (principe d’exclusion de Pauli) v Règle 3 : Quand il y a plus d’une orbitale de même niveau d’énergie (par exemple px, py et pz) aucune ne peut contenir 2 électrons tant que chacune n’en contient pas un (règle de Hund). En appliquant ces règles, on peut déduire l’arrangement électronique autour de tous les noyaux atomiques dans leur état fondamental. Configuration électronique
Les électrons occupent ces orbitales d’une manière prévisible déduite des trois règles (règles de remplissage) qui suivent : v Règle 1 : Les orbitales de plus basse énergie se remplissent d’abord v Règle 2 : Un maximum de 2 électrons (de spins opposés) peuvent occuper une même orbitale (principe d’exclusion de Pauli) v Règle 3 : Quand il y a plus d’une orbitale de même niveau d’énergie (par exemple px, py et pz) aucune ne peut contenir 2 électrons tant que chacune n’en contient pas un (règle de Hund). En appliquant ces règles, on peut déduire l’arrangement électronique autour de tous les noyaux atomiques dans leur état fondamental. Configuration électronique
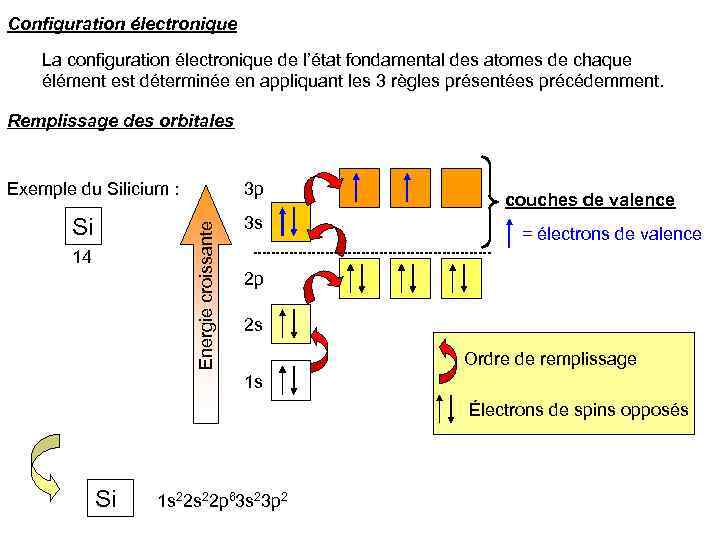 Configuration électronique La configuration électronique de l’état fondamental des atomes de chaque élément est déterminée en appliquant les 3 règles présentées précédemment. Remplissage des orbitales Exemple du Silicium : Energie croissante Si 3 p 14 3 s couches de valence = électrons de valence 2 p 2 s Ordre de remplissage 1 s Électrons de spins opposés Si 1 s 22 p 63 s 23 p 2
Configuration électronique La configuration électronique de l’état fondamental des atomes de chaque élément est déterminée en appliquant les 3 règles présentées précédemment. Remplissage des orbitales Exemple du Silicium : Energie croissante Si 3 p 14 3 s couches de valence = électrons de valence 2 p 2 s Ordre de remplissage 1 s Électrons de spins opposés Si 1 s 22 p 63 s 23 p 2
 L ’ordre de progression des niveaux d’énergie et la manière dont ils sont remplis dans les différents atomes se reflètent dans la structure du tableau périodique : v les éléments sont placés en ligne ; le numéro de la ligne (période) où ils se trouvent est identique au nombre quantique principal de leur couche électronique externe, v les colonnes sont désignées comme des familles. Les éléments d’une même famille possède des propriétés et des réactivités chimiques semblables car leur couche externe possède exactement la même configuration (exemple : C et Si ; les halogènes, …) Les électrons de valence (de la couche externe) participent aux différents types de liaisons caractéristiques de ces éléments. Sauf dans le cas de la dernière colonne du tableau, les gaz nobles sont inertes (chimiquement non réactifs) car leur couche externe (de valence) est entièrement remplie correspondant à une configuration très stable : → ns 2 np 6 → soit 8 électrons sur la couche externe. Règle de l’octet
L ’ordre de progression des niveaux d’énergie et la manière dont ils sont remplis dans les différents atomes se reflètent dans la structure du tableau périodique : v les éléments sont placés en ligne ; le numéro de la ligne (période) où ils se trouvent est identique au nombre quantique principal de leur couche électronique externe, v les colonnes sont désignées comme des familles. Les éléments d’une même famille possède des propriétés et des réactivités chimiques semblables car leur couche externe possède exactement la même configuration (exemple : C et Si ; les halogènes, …) Les électrons de valence (de la couche externe) participent aux différents types de liaisons caractéristiques de ces éléments. Sauf dans le cas de la dernière colonne du tableau, les gaz nobles sont inertes (chimiquement non réactifs) car leur couche externe (de valence) est entièrement remplie correspondant à une configuration très stable : → ns 2 np 6 → soit 8 électrons sur la couche externe. Règle de l’octet
 Règle de l’octet Définition : Lorsque des liaisons se forment, les atomes tendent à acquérir la configuration électronique du gaz noble dont ils sont le plus proches dans le tableau périodique (couche externe pleine, 8 électrons). Modèle de liaison par paires d’électrons : Structures de Lewis Définition : Structures de Lewis sont des formules structurales dans lesquelles tous les électrons de valence de chaque atome sont indiqués sous forme de points autour du symbole de l’élément en respectant les règles suivantes : v Règle 1 : Dessiner le squelette de la molécules. Exemple : le méthane CH 4 v Règle 2 : Compter le nombre d’électrons de valence disponibles. v. Règle 3 : (règle de l’octet) Représenter chacune des liaisons covalentes par 2 électrons appariés, en veillant à attribuer au plus grand nombre possible d’atomes un entourage électronique réalisant l’octet, sauf pour H (1 doublet) doublet octet
Règle de l’octet Définition : Lorsque des liaisons se forment, les atomes tendent à acquérir la configuration électronique du gaz noble dont ils sont le plus proches dans le tableau périodique (couche externe pleine, 8 électrons). Modèle de liaison par paires d’électrons : Structures de Lewis Définition : Structures de Lewis sont des formules structurales dans lesquelles tous les électrons de valence de chaque atome sont indiqués sous forme de points autour du symbole de l’élément en respectant les règles suivantes : v Règle 1 : Dessiner le squelette de la molécules. Exemple : le méthane CH 4 v Règle 2 : Compter le nombre d’électrons de valence disponibles. v. Règle 3 : (règle de l’octet) Représenter chacune des liaisons covalentes par 2 électrons appariés, en veillant à attribuer au plus grand nombre possible d’atomes un entourage électronique réalisant l’octet, sauf pour H (1 doublet) doublet octet
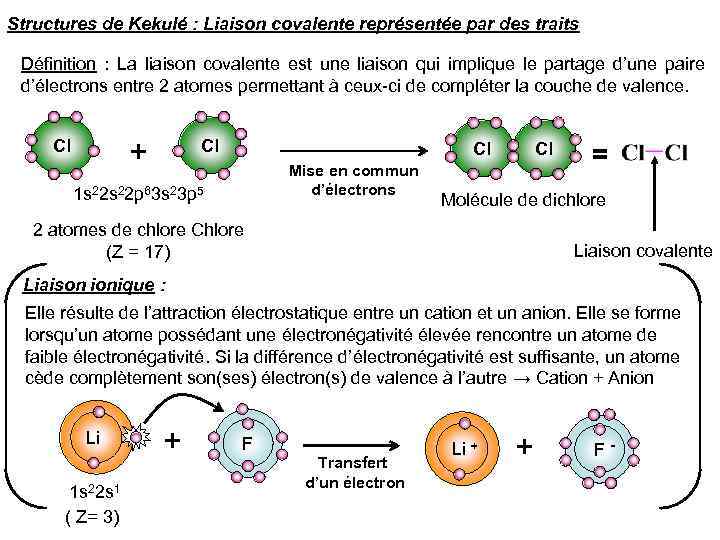 Structures de Kekulé : Liaison covalente représentée par des traits Définition : La liaison covalente est une liaison qui implique le partage d’une paire d’électrons entre 2 atomes permettant à ceux-ci de compléter la couche de valence. + Cl Cl Mise en commun d’électrons 1 s 22 p 63 s 23 p 5 = Molécule de dichlore 2 atomes de chlore Chlore (Z = 17) Liaison covalente Liaison ionique : Elle résulte de l’attraction électrostatique entre un cation et un anion. Elle se forme lorsqu’un atome possédant une électronégativité élevée rencontre un atome de faible électronégativité. Si la différence d’électronégativité est suffisante, un atome cède complètement son(ses) électron(s) de valence à l’autre → Cation + Anion Li 1 s 22 s 1 ( Z= 3) + F Transfert d’un électron Li + + F -
Structures de Kekulé : Liaison covalente représentée par des traits Définition : La liaison covalente est une liaison qui implique le partage d’une paire d’électrons entre 2 atomes permettant à ceux-ci de compléter la couche de valence. + Cl Cl Mise en commun d’électrons 1 s 22 p 63 s 23 p 5 = Molécule de dichlore 2 atomes de chlore Chlore (Z = 17) Liaison covalente Liaison ionique : Elle résulte de l’attraction électrostatique entre un cation et un anion. Elle se forme lorsqu’un atome possédant une électronégativité élevée rencontre un atome de faible électronégativité. Si la différence d’électronégativité est suffisante, un atome cède complètement son(ses) électron(s) de valence à l’autre → Cation + Anion Li 1 s 22 s 1 ( Z= 3) + F Transfert d’un électron Li + + F -
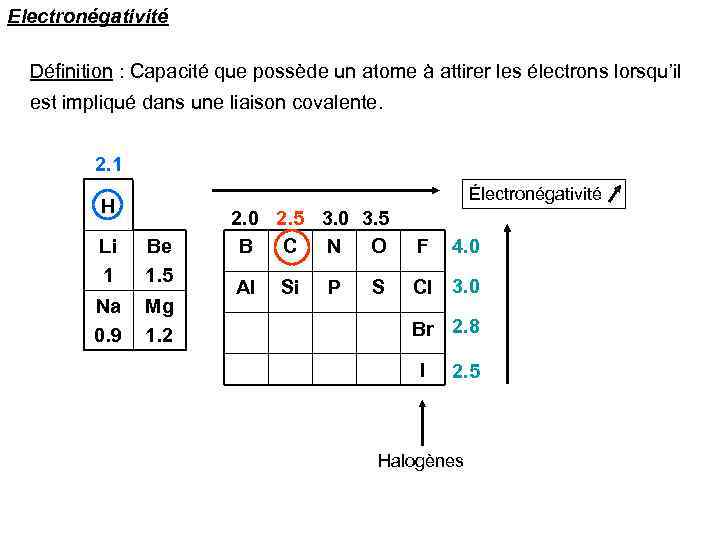 Electronégativité Définition : Capacité que possède un atome à attirer les électrons lorsqu’il est impliqué dans une liaison covalente. 2. 1 Électronégativité H Li 1 Be 1. 5 Na 0. 9 Mg 1. 2 2. 0 2. 5 3. 0 3. 5 B C N O F Al Cl 3. 0 Si P S 4. 0 Br 2. 8 I 2. 5 Halogènes
Electronégativité Définition : Capacité que possède un atome à attirer les électrons lorsqu’il est impliqué dans une liaison covalente. 2. 1 Électronégativité H Li 1 Be 1. 5 Na 0. 9 Mg 1. 2 2. 0 2. 5 3. 0 3. 5 B C N O F Al Cl 3. 0 Si P S 4. 0 Br 2. 8 I 2. 5 Halogènes
 Liaison covalente du carbone Le carbone se situe juste au milieu de l’échelle des électronégativités et ne forme généralement que des liaisons covalentes. Configuration du C à l’état fondamental 2 p 2 s 1 s px py pz Or le carbone forme très souvent des liaisons avec 4 autres atomes à la fois : il est tétravalent. Ex : CH 4 Une tétravalence de ce type de ce carbone ne peut venir d’une simple mise en commun de 2 électrons p non appariés. Les modes de liaison dans les composés carbonés s’expliquent par un processus appelé : hybridation d’orbitales. Le modèle consiste à exprimer les orbitales atomiques déformées comme des combinaisons linéaires des orbitales atomiques appartenant à des souscouches différentes. Les nouvelles orbitales sont à ce titre appelées orbitales hybrides.
Liaison covalente du carbone Le carbone se situe juste au milieu de l’échelle des électronégativités et ne forme généralement que des liaisons covalentes. Configuration du C à l’état fondamental 2 p 2 s 1 s px py pz Or le carbone forme très souvent des liaisons avec 4 autres atomes à la fois : il est tétravalent. Ex : CH 4 Une tétravalence de ce type de ce carbone ne peut venir d’une simple mise en commun de 2 électrons p non appariés. Les modes de liaison dans les composés carbonés s’expliquent par un processus appelé : hybridation d’orbitales. Le modèle consiste à exprimer les orbitales atomiques déformées comme des combinaisons linéaires des orbitales atomiques appartenant à des souscouches différentes. Les nouvelles orbitales sont à ce titre appelées orbitales hybrides.
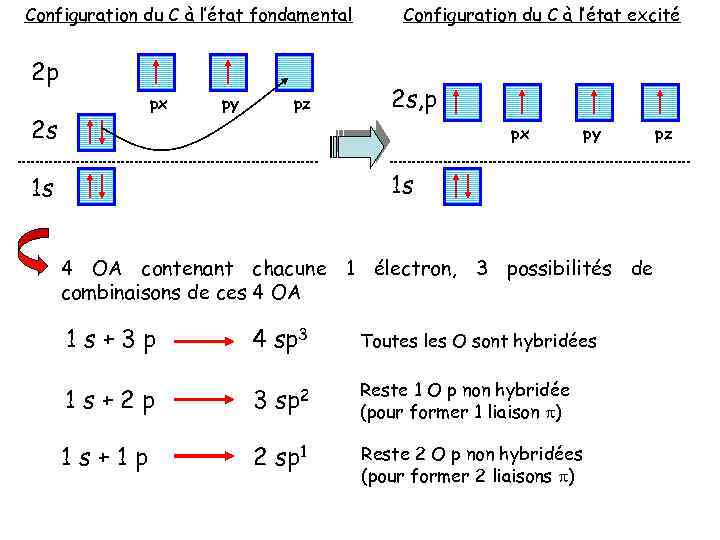 Configuration du C à l’état fondamental 2 p px 2 s py pz Configuration du C à l’état excité 2 s, p px py 1 s 1 s 4 OA contenant chacune 1 électron, 3 possibilités de combinaisons de ces 4 OA 1 s+3 p 4 sp 3 Toutes les O sont hybridées 1 s+2 p 3 sp 2 Reste 1 O p non hybridée (pour former 1 liaison p) 1 s+1 p 2 sp 1 Reste 2 O p non hybridées (pour former 2 liaisons p) pz
Configuration du C à l’état fondamental 2 p px 2 s py pz Configuration du C à l’état excité 2 s, p px py 1 s 1 s 4 OA contenant chacune 1 électron, 3 possibilités de combinaisons de ces 4 OA 1 s+3 p 4 sp 3 Toutes les O sont hybridées 1 s+2 p 3 sp 2 Reste 1 O p non hybridée (pour former 1 liaison p) 1 s+1 p 2 sp 1 Reste 2 O p non hybridées (pour former 2 liaisons p) pz
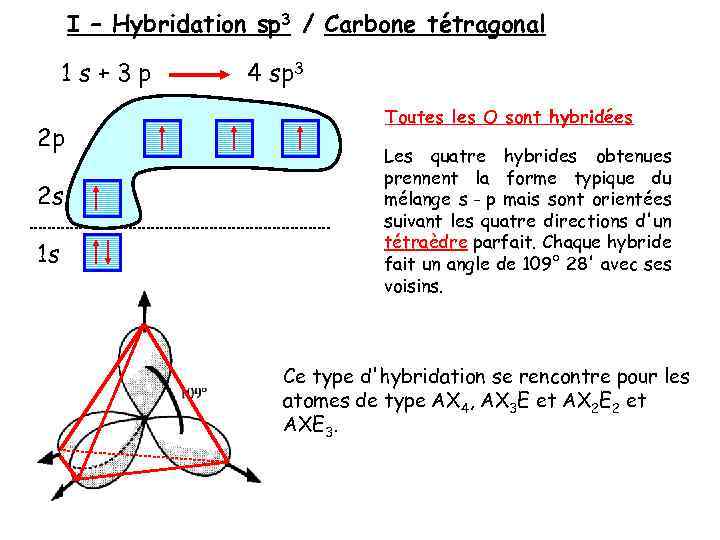 I – Hybridation sp 3 / Carbone tétragonal 1 s+3 p 2 p 2 s 1 s 4 sp 3 Toutes les O sont hybridées Les quatre hybrides obtenues prennent la forme typique du mélange s - p mais sont orientées suivant les quatre directions d'un tétraèdre parfait. Chaque hybride fait un angle de 109° 28' avec ses voisins. Ce type d'hybridation se rencontre pour les atomes de type AX 4, AX 3 E et AX 2 E 2 et AXE 3.
I – Hybridation sp 3 / Carbone tétragonal 1 s+3 p 2 p 2 s 1 s 4 sp 3 Toutes les O sont hybridées Les quatre hybrides obtenues prennent la forme typique du mélange s - p mais sont orientées suivant les quatre directions d'un tétraèdre parfait. Chaque hybride fait un angle de 109° 28' avec ses voisins. Ce type d'hybridation se rencontre pour les atomes de type AX 4, AX 3 E et AX 2 E 2 et AXE 3.
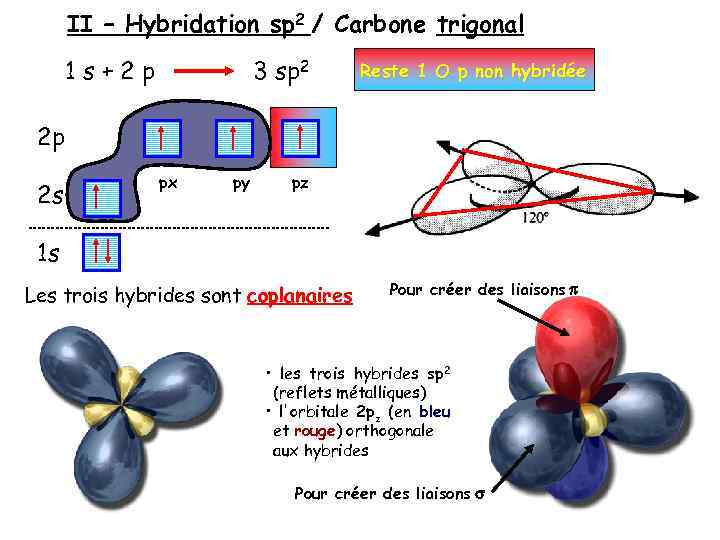 II – Hybridation sp 2 / Carbone trigonal 1 s+2 p 3 sp 2 Reste 1 O p non hybridée 2 p 2 s px py pz 1 s Les trois hybrides sont coplanaires Pour créer des liaisons p • les trois hybrides sp 2 (reflets métalliques) • l'orbitale 2 pz (en bleu et rouge) orthogonale aux hybrides Pour créer des liaisons s
II – Hybridation sp 2 / Carbone trigonal 1 s+2 p 3 sp 2 Reste 1 O p non hybridée 2 p 2 s px py pz 1 s Les trois hybrides sont coplanaires Pour créer des liaisons p • les trois hybrides sp 2 (reflets métalliques) • l'orbitale 2 pz (en bleu et rouge) orthogonale aux hybrides Pour créer des liaisons s
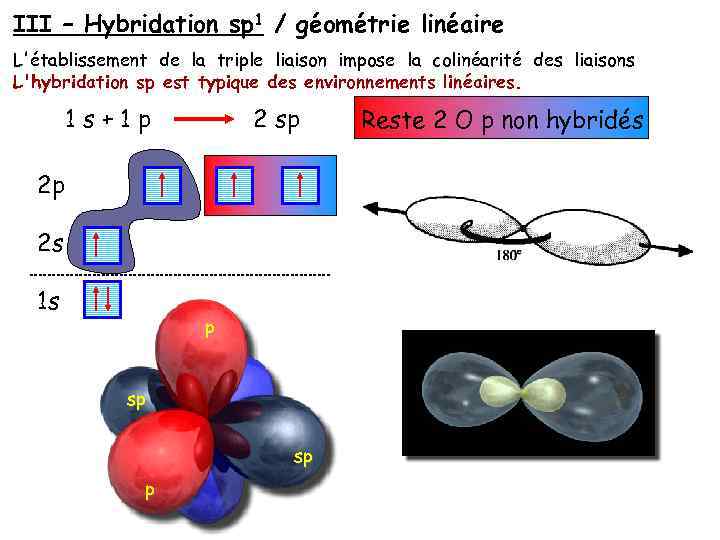 III – Hybridation sp 1 / géométrie linéaire L'établissement de la triple liaison impose la colinéarité des liaisons L'hybridation sp est typique des environnements linéaires. 1 s+1 p 2 sp 2 p 2 s 1 s p sp sp p Reste 2 O p non hybridés
III – Hybridation sp 1 / géométrie linéaire L'établissement de la triple liaison impose la colinéarité des liaisons L'hybridation sp est typique des environnements linéaires. 1 s+1 p 2 sp 2 p 2 s 1 s p sp sp p Reste 2 O p non hybridés
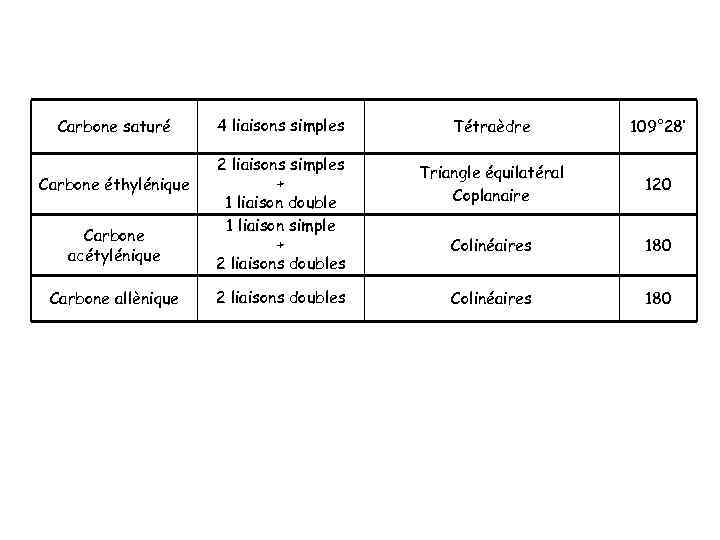 Carbone saturé Carbone éthylénique Carbone acétylénique Carbone allènique 4 liaisons simples 2 liaisons simples + 1 liaison double 1 liaison simple + 2 liaisons doubles Tétraèdre 109° 28’ Triangle équilatéral Coplanaire 120 Colinéaires 180
Carbone saturé Carbone éthylénique Carbone acétylénique Carbone allènique 4 liaisons simples 2 liaisons simples + 1 liaison double 1 liaison simple + 2 liaisons doubles Tétraèdre 109° 28’ Triangle équilatéral Coplanaire 120 Colinéaires 180
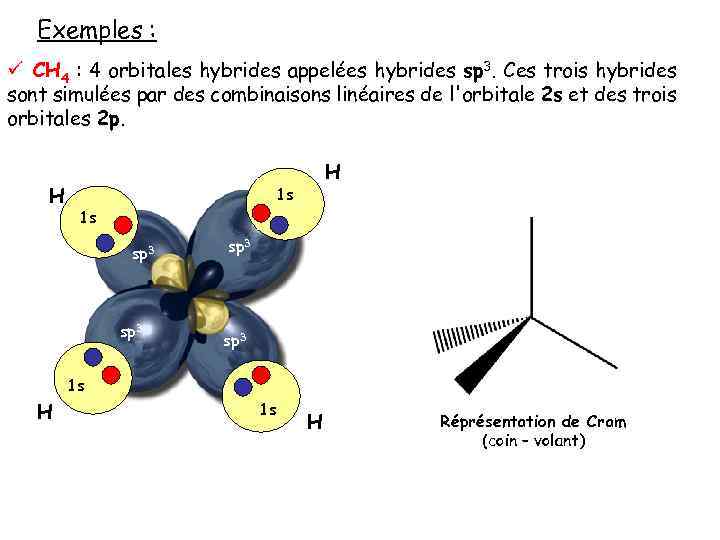 Exemples : ü CH 4 : 4 orbitales hybrides appelées hybrides sp 3. Ces trois hybrides sont simulées par des combinaisons linéaires de l'orbitale 2 s et des trois orbitales 2 p. H H 1 s 1 s sp 3 1 s H Réprésentation de Cram (coin – volant)
Exemples : ü CH 4 : 4 orbitales hybrides appelées hybrides sp 3. Ces trois hybrides sont simulées par des combinaisons linéaires de l'orbitale 2 s et des trois orbitales 2 p. H H 1 s 1 s sp 3 1 s H Réprésentation de Cram (coin – volant)
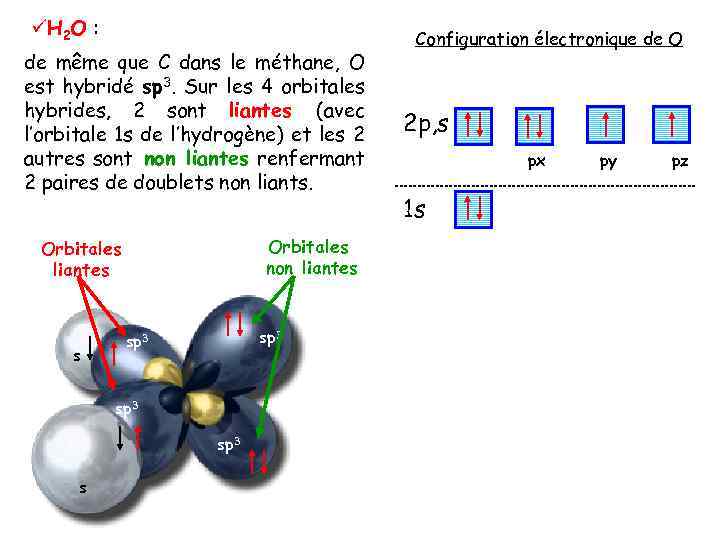 üH 2 O : de même que C dans le méthane, O est hybridé sp 3. Sur les 4 orbitales hybrides, 2 sont liantes (avec l’orbitale 1 s de l’hydrogène) et les 2 autres sont non liantes renfermant 2 paires de doublets non liants. Orbitales non liantes Orbitales liantes s sp 3 s Configuration électronique de O 2 p, s px 1 s py pz
üH 2 O : de même que C dans le méthane, O est hybridé sp 3. Sur les 4 orbitales hybrides, 2 sont liantes (avec l’orbitale 1 s de l’hydrogène) et les 2 autres sont non liantes renfermant 2 paires de doublets non liants. Orbitales non liantes Orbitales liantes s sp 3 s Configuration électronique de O 2 p, s px 1 s py pz
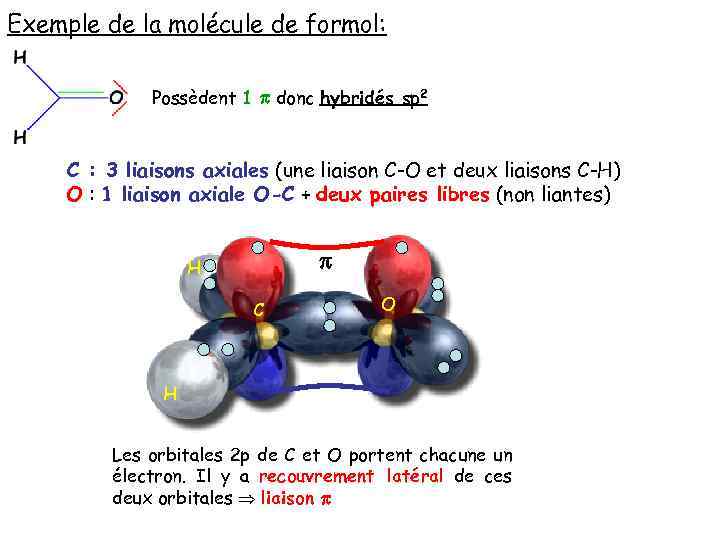 Exemple de la molécule de formol: Possèdent 1 p donc hybridés sp 2 C : 3 liaisons axiales (une liaison C-O et deux liaisons C-H) O : 1 liaison axiale O-C + deux paires libres (non liantes) p H C O H Les orbitales 2 p de C et O portent chacune un électron. Il y a recouvrement latéral de ces deux orbitales liaison p
Exemple de la molécule de formol: Possèdent 1 p donc hybridés sp 2 C : 3 liaisons axiales (une liaison C-O et deux liaisons C-H) O : 1 liaison axiale O-C + deux paires libres (non liantes) p H C O H Les orbitales 2 p de C et O portent chacune un électron. Il y a recouvrement latéral de ces deux orbitales liaison p
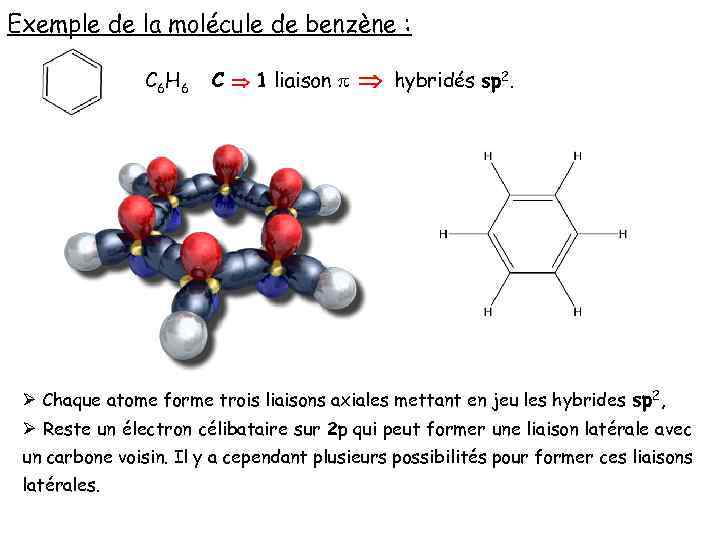 Exemple de la molécule de benzène : C 6 H 6 C 1 liaison p hybridés sp 2. Ø Chaque atome forme trois liaisons axiales mettant en jeu les hybrides sp 2, Ø Reste un électron célibataire sur 2 p qui peut former une liaison latérale avec un carbone voisin. Il y a cependant plusieurs possibilités pour former ces liaisons latérales.
Exemple de la molécule de benzène : C 6 H 6 C 1 liaison p hybridés sp 2. Ø Chaque atome forme trois liaisons axiales mettant en jeu les hybrides sp 2, Ø Reste un électron célibataire sur 2 p qui peut former une liaison latérale avec un carbone voisin. Il y a cependant plusieurs possibilités pour former ces liaisons latérales.
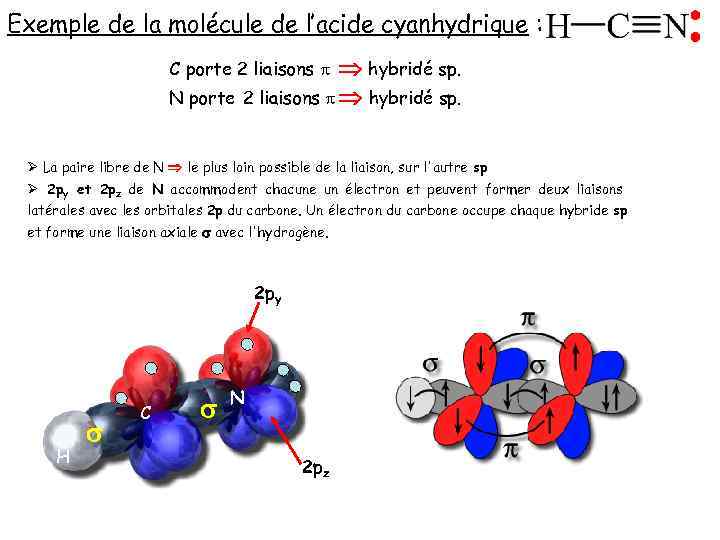 Exemple de la molécule de l’acide cyanhydrique : hybridé sp. 2 liaisons p hybridé sp. C porte 2 liaisons p N porte Ø La paire libre de N le plus loin possible de la liaison, sur l'autre sp Ø 2 py et 2 pz de N accommodent chacune un électron et peuvent former deux liaisons latérales avec les orbitales 2 p du carbone. Un électron du carbone occupe chaque hybride sp et forme une liaison axiale s avec l'hydrogène. 2 py H s C s N 2 pz
Exemple de la molécule de l’acide cyanhydrique : hybridé sp. 2 liaisons p hybridé sp. C porte 2 liaisons p N porte Ø La paire libre de N le plus loin possible de la liaison, sur l'autre sp Ø 2 py et 2 pz de N accommodent chacune un électron et peuvent former deux liaisons latérales avec les orbitales 2 p du carbone. Un électron du carbone occupe chaque hybride sp et forme une liaison axiale s avec l'hydrogène. 2 py H s C s N 2 pz
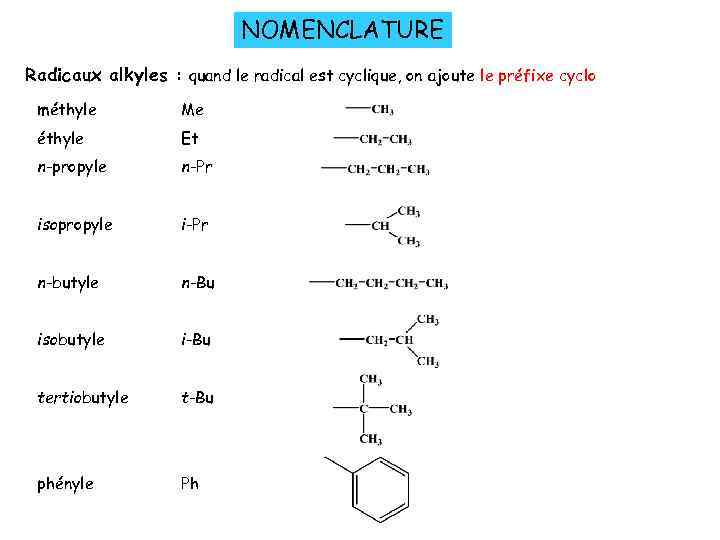 NOMENCLATURE Radicaux alkyles : quand le radical est cyclique, on ajoute le préfixe cyclo méthyle Me éthyle Et n-propyle n-Pr isopropyle i-Pr n-butyle n-Bu isobutyle i-Bu tertiobutyle t-Bu phényle Ph
NOMENCLATURE Radicaux alkyles : quand le radical est cyclique, on ajoute le préfixe cyclo méthyle Me éthyle Et n-propyle n-Pr isopropyle i-Pr n-butyle n-Bu isobutyle i-Bu tertiobutyle t-Bu phényle Ph
 REGLES DE BASE DE NOMENCLATURE I – ALCANES Règle 1 : Trouver la chaîne carbonée la plus longue dans la molécule et la nommer. Règle 2 : Nommer tous les substituants alkyle attachés à la chaîne la plus longue. Règle 3 : Numéroter les carbones de la chaîne la plus longue en commençant par le bout le plus proche d ’un substituant. Règle 4 : Ranger les substituants par ordre alphabétique, chacun étant précédé d ’un tiret et du numéro du carbone auquel il est attaché puis ajouter le nom de l ’alcane correspondant à la chaîne la plus longue. Ex. 4 -éthyl-2, 3 -diméthylheptane
REGLES DE BASE DE NOMENCLATURE I – ALCANES Règle 1 : Trouver la chaîne carbonée la plus longue dans la molécule et la nommer. Règle 2 : Nommer tous les substituants alkyle attachés à la chaîne la plus longue. Règle 3 : Numéroter les carbones de la chaîne la plus longue en commençant par le bout le plus proche d ’un substituant. Règle 4 : Ranger les substituants par ordre alphabétique, chacun étant précédé d ’un tiret et du numéro du carbone auquel il est attaché puis ajouter le nom de l ’alcane correspondant à la chaîne la plus longue. Ex. 4 -éthyl-2, 3 -diméthylheptane
 II – COMPOSES COMPORTANT DES GROUPES FONCTIONNELS Règle 1 : Choisir comme squelette carboné fondamental le plus long enchaînement d ’atomes de carbone renfermant la fonction principale et le maximum d ’insaturations. Règle 2 : Nommer cette structure fondamentale en utilisant la racine du nom de l ’alcane contenant le même nombre de carbones et ajouter à la racine du nom les suffixes indiquant le degré d ’insaturation et la nature de la fonction principale. Les substituants (groupes alkyle ou groupes fonctionnels secondaires) sont désignés par des préfixes. . Règle 3 : Numéroter les carbones du squelette fondamental en appliquant les critères suivants (par ordre de priorité) : 1) Attribuer le n° 1 à l ’atome de carbone de la fonction principale si elle est terminale. 2) Attribuer le n° le plus petit possible à la fonction principale si elle n ’est pas terminale. 3) Assigner les n° de façon à montrer la position des substituants par les plus petits chiffres possibles. Ex. Acide 4 -aminohexanoïque
II – COMPOSES COMPORTANT DES GROUPES FONCTIONNELS Règle 1 : Choisir comme squelette carboné fondamental le plus long enchaînement d ’atomes de carbone renfermant la fonction principale et le maximum d ’insaturations. Règle 2 : Nommer cette structure fondamentale en utilisant la racine du nom de l ’alcane contenant le même nombre de carbones et ajouter à la racine du nom les suffixes indiquant le degré d ’insaturation et la nature de la fonction principale. Les substituants (groupes alkyle ou groupes fonctionnels secondaires) sont désignés par des préfixes. . Règle 3 : Numéroter les carbones du squelette fondamental en appliquant les critères suivants (par ordre de priorité) : 1) Attribuer le n° 1 à l ’atome de carbone de la fonction principale si elle est terminale. 2) Attribuer le n° le plus petit possible à la fonction principale si elle n ’est pas terminale. 3) Assigner les n° de façon à montrer la position des substituants par les plus petits chiffres possibles. Ex. Acide 4 -aminohexanoïque
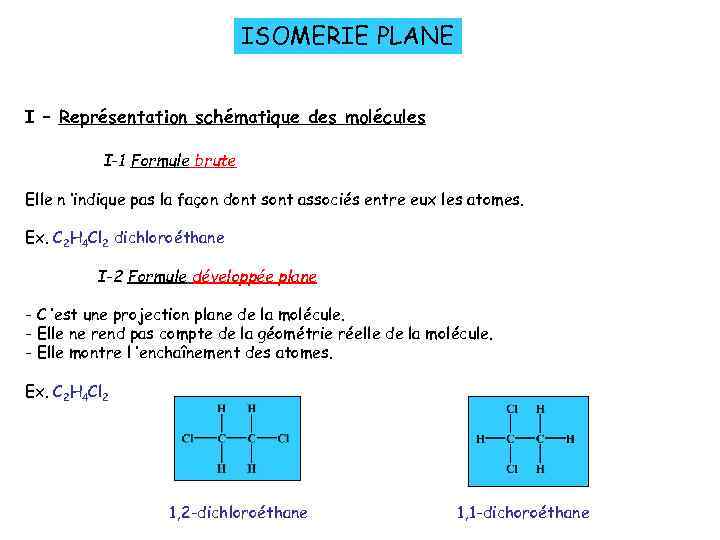 ISOMERIE PLANE I – Représentation schématique des molécules I-1 Formule brute Elle n ’indique pas la façon dont sont associés entre eux les atomes. Ex. C 2 H 4 Cl 2 dichloroéthane I-2 Formule développée plane - C ’est une projection plane de la molécule. - Elle ne rend pas compte de la géométrie réelle de la molécule. - Elle montre l ’enchaînement des atomes. Ex. C 2 H 4 Cl 2 1, 2 -dichloroéthane 1, 1 -dichoroéthane
ISOMERIE PLANE I – Représentation schématique des molécules I-1 Formule brute Elle n ’indique pas la façon dont sont associés entre eux les atomes. Ex. C 2 H 4 Cl 2 dichloroéthane I-2 Formule développée plane - C ’est une projection plane de la molécule. - Elle ne rend pas compte de la géométrie réelle de la molécule. - Elle montre l ’enchaînement des atomes. Ex. C 2 H 4 Cl 2 1, 2 -dichloroéthane 1, 1 -dichoroéthane
 I-3 Formule semi-développée Les liaisons carbone-hydrogène n ’apparaissent plus. Les liaisons carbone-carbone ou carbone-halogène, carbone-hétéroatome restent présentes. Ex. C 4 H 9 Cl 2 -chlorobutane I-4 Formule topologique C ’est la représentation la plus simplifiée. Les atomes de carbone et d ’hydrogène (liés aux atomes de carbone) ne sont plus représentés. Ex. C 4 H 9 Cl 2 -chlorobutane
I-3 Formule semi-développée Les liaisons carbone-hydrogène n ’apparaissent plus. Les liaisons carbone-carbone ou carbone-halogène, carbone-hétéroatome restent présentes. Ex. C 4 H 9 Cl 2 -chlorobutane I-4 Formule topologique C ’est la représentation la plus simplifiée. Les atomes de carbone et d ’hydrogène (liés aux atomes de carbone) ne sont plus représentés. Ex. C 4 H 9 Cl 2 -chlorobutane
 II – Isomérie * Deux isomères sont deux composés qui ont la même formule brute mais dont les molécules sont différentes. * Soient deux isomères : leurs molécules peuvent différer par 1) l ’ordre ou la nature des liaisons entre atomes 2) la disposition des atomes dans l ’espace * Les molécules de deux isomères ne sont pas superposables. * Les isomères ont des propriétés physiques et/ou chimiques qui sont différentes ; ces différences de propriété sont liées à une différence de structure entre les molécules. III – Isomérie plane On parle d ’isomérie plane ou isomérie de constitution si la différence structurale entre les isomères concerne l ’enchaînement des atomes. On peut alors en rendre compte au moyen des formules semi-développées planes.
II – Isomérie * Deux isomères sont deux composés qui ont la même formule brute mais dont les molécules sont différentes. * Soient deux isomères : leurs molécules peuvent différer par 1) l ’ordre ou la nature des liaisons entre atomes 2) la disposition des atomes dans l ’espace * Les molécules de deux isomères ne sont pas superposables. * Les isomères ont des propriétés physiques et/ou chimiques qui sont différentes ; ces différences de propriété sont liées à une différence de structure entre les molécules. III – Isomérie plane On parle d ’isomérie plane ou isomérie de constitution si la différence structurale entre les isomères concerne l ’enchaînement des atomes. On peut alors en rendre compte au moyen des formules semi-développées planes.
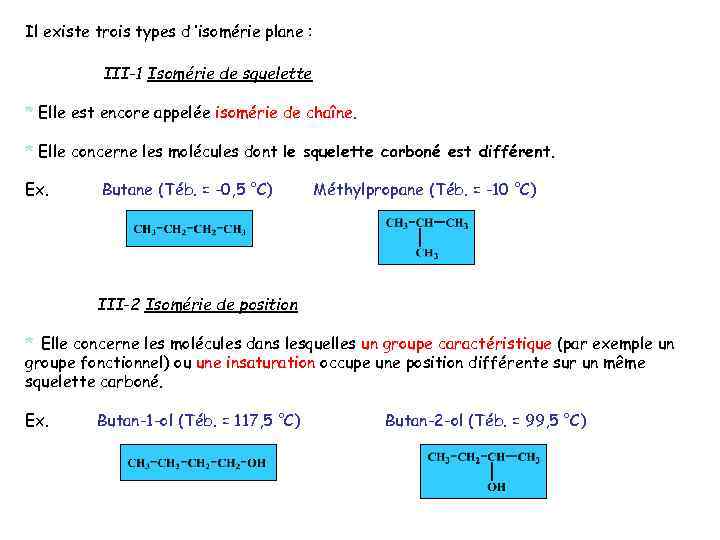 Il existe trois types d ’isomérie plane : III-1 Isomérie de squelette * Elle est encore appelée isomérie de chaîne. * Elle concerne les molécules dont le squelette carboné est différent. Ex. Butane (Téb. = -0, 5 °C) Méthylpropane (Téb. = -10 °C) III-2 Isomérie de position * Elle concerne les molécules dans lesquelles un groupe caractéristique (par exemple un groupe fonctionnel) ou une insaturation occupe une position différente sur un même squelette carboné. Ex. Butan-1 -ol (Téb. = 117, 5 °C) Butan-2 -ol (Téb. = 99, 5 °C)
Il existe trois types d ’isomérie plane : III-1 Isomérie de squelette * Elle est encore appelée isomérie de chaîne. * Elle concerne les molécules dont le squelette carboné est différent. Ex. Butane (Téb. = -0, 5 °C) Méthylpropane (Téb. = -10 °C) III-2 Isomérie de position * Elle concerne les molécules dans lesquelles un groupe caractéristique (par exemple un groupe fonctionnel) ou une insaturation occupe une position différente sur un même squelette carboné. Ex. Butan-1 -ol (Téb. = 117, 5 °C) Butan-2 -ol (Téb. = 99, 5 °C)
 Ex. But-1 -ène But-2 -ène III-3 Isomérie de fonction * Elle concerne les molécules qui présentent des groupes fonctionnels différents. * Les différences de propriétés chimiques sont alors très importantes. Ex. Butan-1 -ol (Téb. = 117 °C) Oxyde de diéthyle (Téb. = 35 °C) III-4 Conclusion Un isomère de constitution est parfaitement déterminé lorsque l ’on connaît : -son squelette carboné -son groupe fonctionnel -la position où ce groupe est fixé sur le squelette. Il est alors représenté au moyen d ’une formule semi-développée plane.
Ex. But-1 -ène But-2 -ène III-3 Isomérie de fonction * Elle concerne les molécules qui présentent des groupes fonctionnels différents. * Les différences de propriétés chimiques sont alors très importantes. Ex. Butan-1 -ol (Téb. = 117 °C) Oxyde de diéthyle (Téb. = 35 °C) III-4 Conclusion Un isomère de constitution est parfaitement déterminé lorsque l ’on connaît : -son squelette carboné -son groupe fonctionnel -la position où ce groupe est fixé sur le squelette. Il est alors représenté au moyen d ’une formule semi-développée plane.
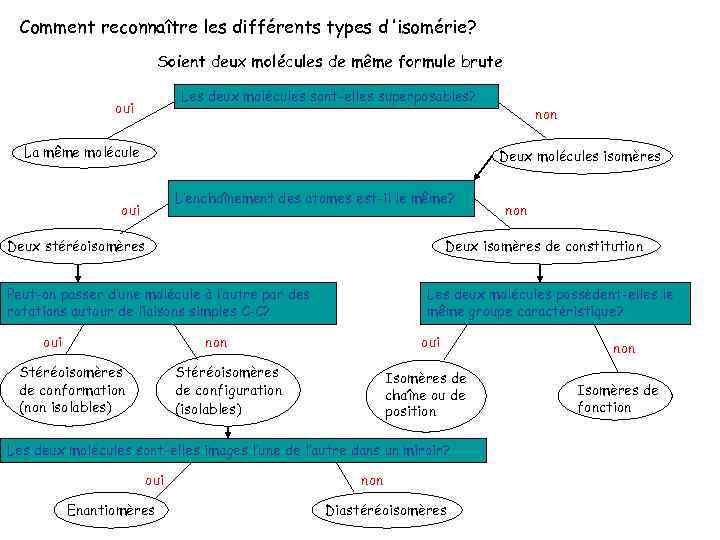 Comment reconnaître les différents types d ’isomérie? Soient deux molécules de même formule brute Les deux molécules sont-elles superposables? oui La même molécule non Deux molécules isomères L’enchaînement des atomes est-il le même? oui Deux stéréoisomères Deux isomères de constitution Peut-on passer d’une molécule à l’autre par des rotations autour de liaisons simples C-C? oui Les deux molécules possèdent-elles le même groupe caractéristique? non Stéréoisomères de conformation (non isolables) oui Stéréoisomères de configuration (isolables) Isomères de chaîne ou de position Les deux molécules sont-elles images l’une de l’autre dans un miroir? oui Enantiomères non Diastéréoisomères non Isomères de fonction
Comment reconnaître les différents types d ’isomérie? Soient deux molécules de même formule brute Les deux molécules sont-elles superposables? oui La même molécule non Deux molécules isomères L’enchaînement des atomes est-il le même? oui Deux stéréoisomères Deux isomères de constitution Peut-on passer d’une molécule à l’autre par des rotations autour de liaisons simples C-C? oui Les deux molécules possèdent-elles le même groupe caractéristique? non Stéréoisomères de conformation (non isolables) oui Stéréoisomères de configuration (isolables) Isomères de chaîne ou de position Les deux molécules sont-elles images l’une de l’autre dans un miroir? oui Enantiomères non Diastéréoisomères non Isomères de fonction
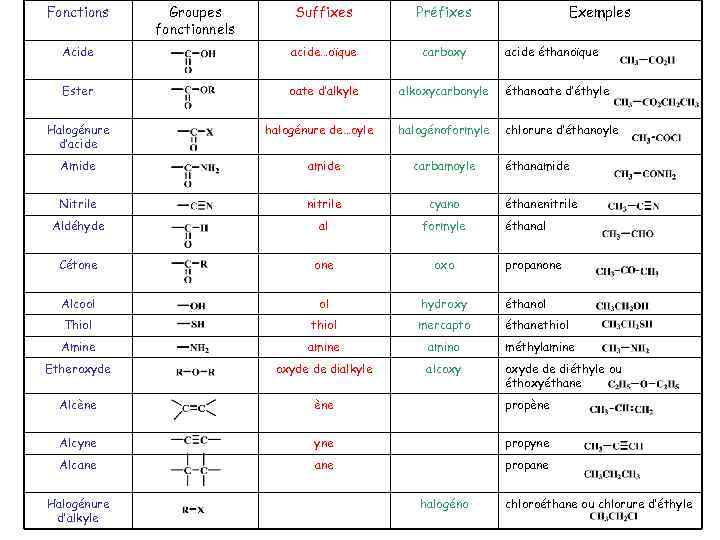 Fonctions Suffixes Préfixes Acide acide…oïque carboxy Ester oate d’alkyle alkoxycarbonyle éthanoate d’éthyle halogénoformyle chlorure d’éthanoyle Halogénure d’acide Groupes fonctionnels halogénure de…oyle Exemples acide éthanoïque Amide amide carbamoyle Nitrile nitrile cyano Aldéhyde al formyle Cétone oxo Alcool ol hydroxy éthanol Thiol thiol mercapto éthanethiol Amine amino méthylamine Etheroxyde de dialkyle alcoxy oxyde de diéthyle ou éthoxyéthane Alcène propène Alcyne propyne Alcane propane Halogénure d’alkyle halogéno éthanamide éthanenitrile éthanal propanone chloroéthane ou chlorure d’éthyle
Fonctions Suffixes Préfixes Acide acide…oïque carboxy Ester oate d’alkyle alkoxycarbonyle éthanoate d’éthyle halogénoformyle chlorure d’éthanoyle Halogénure d’acide Groupes fonctionnels halogénure de…oyle Exemples acide éthanoïque Amide amide carbamoyle Nitrile nitrile cyano Aldéhyde al formyle Cétone oxo Alcool ol hydroxy éthanol Thiol thiol mercapto éthanethiol Amine amino méthylamine Etheroxyde de dialkyle alcoxy oxyde de diéthyle ou éthoxyéthane Alcène propène Alcyne propyne Alcane propane Halogénure d’alkyle halogéno éthanamide éthanenitrile éthanal propanone chloroéthane ou chlorure d’éthyle


