Л12_Термо_2012.ppt
- Количество слайдов: 21
 Л 12 ТЕРМОДИНАМИКА и МОЛЕКУЛЯРНАЯ ФИЗИКА Термодинамические системы и их параметры 1
Л 12 ТЕРМОДИНАМИКА и МОЛЕКУЛЯРНАЯ ФИЗИКА Термодинамические системы и их параметры 1
 ТЕРМОДИНАМИКА В основе любого технологического процесса лежит определенное физическое, химическое или электрохимическое воздействие на материал с целью управляемого изменения его состояния, структуры или состава. 2
ТЕРМОДИНАМИКА В основе любого технологического процесса лежит определенное физическое, химическое или электрохимическое воздействие на материал с целью управляемого изменения его состояния, структуры или состава. 2
 Одним из общих, базовых подходов к описанию физических явлений является термодинамический подход, который дает результаты, применимые к разнообразным макроскопическим системам без выяснения их микроскопической основы. Задача данного раздела – рассмотреть фундаментальные вопросы термодинамики, необходимые для понимания физических закономерностей, лежащих в основе разнообразных методов и процессов, используемых в современной технологии. 3
Одним из общих, базовых подходов к описанию физических явлений является термодинамический подход, который дает результаты, применимые к разнообразным макроскопическим системам без выяснения их микроскопической основы. Задача данного раздела – рассмотреть фундаментальные вопросы термодинамики, необходимые для понимания физических закономерностей, лежащих в основе разнообразных методов и процессов, используемых в современной технологии. 3
 Термодинамика хорошо определят те события и процессы, которые невозможны. С другой стороны термодинамика может быть довольно неопределенной относительно возможных реакций и процессов. Традиционное изложение термодинамики базируется на трех постулатах, называемых началами термодинамики, которые феноменологически выражают общие закономерности, наблюдаемые в природе, без выяснения их микроскопической основы. 4
Термодинамика хорошо определят те события и процессы, которые невозможны. С другой стороны термодинамика может быть довольно неопределенной относительно возможных реакций и процессов. Традиционное изложение термодинамики базируется на трех постулатах, называемых началами термодинамики, которые феноменологически выражают общие закономерности, наблюдаемые в природе, без выяснения их микроскопической основы. 4
 Закономерности и соотношения между физическими величинами, к которым приводит термодинамика, имеют универсальный характер. 5
Закономерности и соотношения между физическими величинами, к которым приводит термодинамика, имеют универсальный характер. 5
 Определения Термодинамическая система – совокупность рассматриваемых тел Состояние системы Термодинамические параметры состояния: температура, объем, давление Процесс – всякое изменение хотя бы одного параметра Равновесное состояние системы Неравновесное состояние системы 6
Определения Термодинамическая система – совокупность рассматриваемых тел Состояние системы Термодинамические параметры состояния: температура, объем, давление Процесс – всякое изменение хотя бы одного параметра Равновесное состояние системы Неравновесное состояние системы 6
 Термодинамической системой называют совокупность элементов (одно или несколько тел), между которыми возможен теплообмен и диффузия хотя бы одного сорта атомов. Равновесным называют такое состояние системы, которое сохраняется неизменным сколь угодно долго. 7
Термодинамической системой называют совокупность элементов (одно или несколько тел), между которыми возможен теплообмен и диффузия хотя бы одного сорта атомов. Равновесным называют такое состояние системы, которое сохраняется неизменным сколь угодно долго. 7
 Гомогенная система - это однородная система. Внутри гомогенной системы нет поверхностей раздела отдельных частей, различных по строению или свойствам. Гетерогенная система - это неоднородная система. Гетерогенность системы выражается в распадении ее на отдельные области, имеющие различные физические и химические свойства и отделенные друг от друга поверхностями раздела. 8
Гомогенная система - это однородная система. Внутри гомогенной системы нет поверхностей раздела отдельных частей, различных по строению или свойствам. Гетерогенная система - это неоднородная система. Гетерогенность системы выражается в распадении ее на отдельные области, имеющие различные физические и химические свойства и отделенные друг от друга поверхностями раздела. 8
 Гетерогенная система состоит из гомогенных частей, называемых фазами. Наиболее сильные и отчетливо выраженные фазовые различия присущи разным агрегатным состояниям вещества – твердому, жидкому и газообразному. В гетерогенной системе могут иметь место явления межфазного обмена, т. е. химическое превращение в результате протекания химических реакций, или фазовое превращение в результате перераспределения массы. 9
Гетерогенная система состоит из гомогенных частей, называемых фазами. Наиболее сильные и отчетливо выраженные фазовые различия присущи разным агрегатным состояниям вещества – твердому, жидкому и газообразному. В гетерогенной системе могут иметь место явления межфазного обмена, т. е. химическое превращение в результате протекания химических реакций, или фазовое превращение в результате перераспределения массы. 9
 Изменение параметров системы называется термодинамическим процессом. Переходная стадия термодинамического процесса - релаксация системы характеризуется постоянной времени, называемой временем релаксации r. Процесс, который может быть представлен как последовательная смена равновесных состояний, называется квазистатическим процессом. Это имеет место тогда, когда r t, где t – время, характеризующее скорость изменения внешних условий 10
Изменение параметров системы называется термодинамическим процессом. Переходная стадия термодинамического процесса - релаксация системы характеризуется постоянной времени, называемой временем релаксации r. Процесс, который может быть представлен как последовательная смена равновесных состояний, называется квазистатическим процессом. Это имеет место тогда, когда r t, где t – время, характеризующее скорость изменения внешних условий 10
 Термодинамическая система (ТС) всегда занимает некоторый объем, соответственно, для того, чтобы термодинамические параметры (ТП) могли описывать состояние всего такого объема – ТС должна очень медленно изменять свое состояние с течением времени, так, чтобы значение любого ТП для всех точек объема ТС было равно (или очень близко) к его среднему значению по объему ТС Такие состояния ТС называют равновесными термодинамическими состояниями - РТС Уравнением состояния называют уравнение, которое устанавливает взаимозависимость ТП для РТС изучаемой ТС 11
Термодинамическая система (ТС) всегда занимает некоторый объем, соответственно, для того, чтобы термодинамические параметры (ТП) могли описывать состояние всего такого объема – ТС должна очень медленно изменять свое состояние с течением времени, так, чтобы значение любого ТП для всех точек объема ТС было равно (или очень близко) к его среднему значению по объему ТС Такие состояния ТС называют равновесными термодинамическими состояниями - РТС Уравнением состояния называют уравнение, которое устанавливает взаимозависимость ТП для РТС изучаемой ТС 11
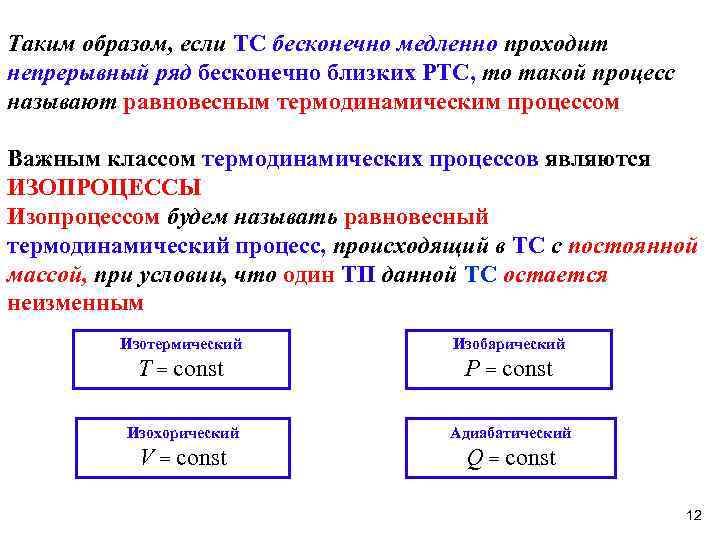 Таким образом, если ТС бесконечно медленно проходит непрерывный ряд бесконечно близких РТС, то такой процесс называют равновесным термодинамическим процессом Важным классом термодинамических процессов являются ИЗОПРОЦЕССЫ Изопроцессом будем называть равновесный термодинамический процесс, происходящий в ТС с постоянной массой, при условии, что один ТП данной ТС остается неизменным Изотермический Изобарический T = const P = const Изохорический Адиабатический V = const Q = const 12
Таким образом, если ТС бесконечно медленно проходит непрерывный ряд бесконечно близких РТС, то такой процесс называют равновесным термодинамическим процессом Важным классом термодинамических процессов являются ИЗОПРОЦЕССЫ Изопроцессом будем называть равновесный термодинамический процесс, происходящий в ТС с постоянной массой, при условии, что один ТП данной ТС остается неизменным Изотермический Изобарический T = const P = const Изохорический Адиабатический V = const Q = const 12
 Уравнение состояния идеального газа Идеальным газом называется ТС, состоящая из очень большого количества материальных точек, которые взаимодействуют между собой только механически Уравнение состояния для такой ТС (идеального газа) называют уравнением Клапейрона где R – универсальная газовая постоянная, m - масса газа, μ молярная масса газа, P, V, T - термодинамические параметры – давление, объем и абсолютная температура идеального газа 13
Уравнение состояния идеального газа Идеальным газом называется ТС, состоящая из очень большого количества материальных точек, которые взаимодействуют между собой только механически Уравнение состояния для такой ТС (идеального газа) называют уравнением Клапейрона где R – универсальная газовая постоянная, m - масса газа, μ молярная масса газа, P, V, T - термодинамические параметры – давление, объем и абсолютная температура идеального газа 13
 Универсальная газовая постоянная связана с числом Авогадро Несложно получить уравнение (n 0 концентрация), позволяющее получить наглядное представление о физическом смысле давления газов - количество вещества 14
Универсальная газовая постоянная связана с числом Авогадро Несложно получить уравнение (n 0 концентрация), позволяющее получить наглядное представление о физическом смысле давления газов - количество вещества 14
 Клапейрон Бенуа Поль Эмиль (26. 01. 1799 – 28. 01. 1864) французский физик и инженер родился в Париже, Франция (Paris, France) умер в Париже, Франция (Paris, France) 15
Клапейрон Бенуа Поль Эмиль (26. 01. 1799 – 28. 01. 1864) французский физик и инженер родился в Париже, Франция (Paris, France) умер в Париже, Франция (Paris, France) 15
 МЕНДЕЛЕЕВ Дмитрий Иванович (08. 02. 1834 -02. 1907) русский химик родился в Тобольске, Россия умер в Петербурге, Россия 16
МЕНДЕЛЕЕВ Дмитрий Иванович (08. 02. 1834 -02. 1907) русский химик родился в Тобольске, Россия умер в Петербурге, Россия 16
 Определения 2 Процесс, при котором система после ряда изменений возвращается в исходное состояние называется круговым процессом или циклом Внутренняя энергия - суммарная кинетическая энергия движения - собственная потенциальная энергия - внутренняя энергия самих атомов… 17
Определения 2 Процесс, при котором система после ряда изменений возвращается в исходное состояние называется круговым процессом или циклом Внутренняя энергия - суммарная кинетическая энергия движения - собственная потенциальная энергия - внутренняя энергия самих атомов… 17
 Исходные понятия Теплота и работа Общее количество энергии, переданное ТС, внешними телами при их взаимодействии, называют количеством тепла Сам процесс обмена энергией называют теплообменом Количество энергии, переданное ТС, внешними телами за счет их силового воздействия на ТС, называют работой, совершенной над системой Работой расширения называют работу, которую система производит против внешних сил Если процесс равновесный Таким образом F Внутренней энергией ТС называют энергию, зависящую только от термодинамического состояния ТС ТПр при котором система возвращается в исходное состояние называют круговым Таким образом для кругового процесса U 1 U 2 1 2 P 18
Исходные понятия Теплота и работа Общее количество энергии, переданное ТС, внешними телами при их взаимодействии, называют количеством тепла Сам процесс обмена энергией называют теплообменом Количество энергии, переданное ТС, внешними телами за счет их силового воздействия на ТС, называют работой, совершенной над системой Работой расширения называют работу, которую система производит против внешних сил Если процесс равновесный Таким образом F Внутренней энергией ТС называют энергию, зависящую только от термодинамического состояния ТС ТПр при котором система возвращается в исходное состояние называют круговым Таким образом для кругового процесса U 1 U 2 1 2 P 18
 Первое начало термодинамики Элементарное количество тепла δQ , переданное ТС, расходуется ТС на элементарное изменение ее внутренней энергии d. U и совершение элементарной работы δA над внешними телами Тогда для любого РТПр P 2 где обозначено A 12 – работа ТС над внешними телами При круговом процессе изменение внутренней энергии ТС равно нулю следовательно первое начало термодинамики для кругового процесса принимает вид Тепловой машиной (двигателем) будем называть ТС (периодически повторяющую круговой процесс), задачей которой является совершение работы над внешними телами за счет количества тепла QO , подведенного к системе в течение каждого кругового процесса (цикла) Соответственно, вечным двигателем 1 -го рода называют тепловую машину совершающую работу AO > QO за цикл вечный двигатель 1 -го рода невозможен 19
Первое начало термодинамики Элементарное количество тепла δQ , переданное ТС, расходуется ТС на элементарное изменение ее внутренней энергии d. U и совершение элементарной работы δA над внешними телами Тогда для любого РТПр P 2 где обозначено A 12 – работа ТС над внешними телами При круговом процессе изменение внутренней энергии ТС равно нулю следовательно первое начало термодинамики для кругового процесса принимает вид Тепловой машиной (двигателем) будем называть ТС (периодически повторяющую круговой процесс), задачей которой является совершение работы над внешними телами за счет количества тепла QO , подведенного к системе в течение каждого кругового процесса (цикла) Соответственно, вечным двигателем 1 -го рода называют тепловую машину совершающую работу AO > QO за цикл вечный двигатель 1 -го рода невозможен 19
 Внутренняя энергия U является функцией состояния и не зависит от того, каким путем система переведена в данное состояние Закон сохранения энергии в термодинамике и есть первое начало термодинамики Q = d. U + A 20
Внутренняя энергия U является функцией состояния и не зависит от того, каким путем система переведена в данное состояние Закон сохранения энергии в термодинамике и есть первое начало термодинамики Q = d. U + A 20
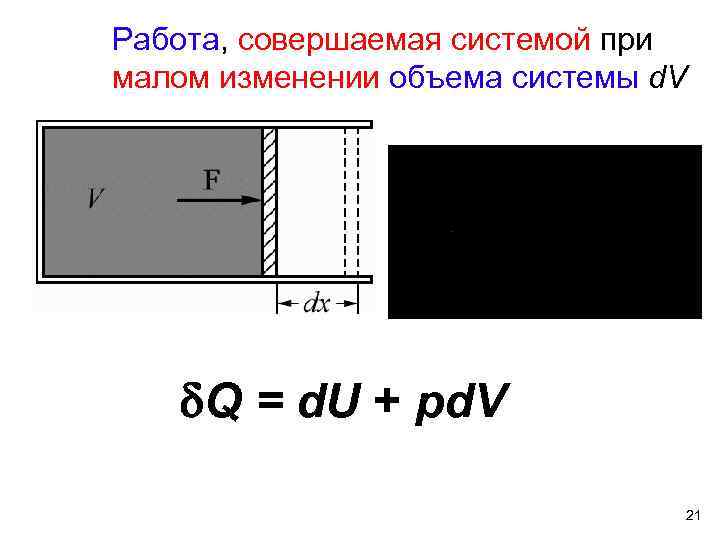 Работа, совершаемая системой при малом изменении объема системы d. V Q = d. U + pd. V 21
Работа, совершаемая системой при малом изменении объема системы d. V Q = d. U + pd. V 21


