12.Квантовая механика многоэлектронных атомов..ppt
- Количество слайдов: 41
 Квантовая механика многоэлектронных атомов 60. Квантовая механика многоэлектронных атомов. Качественная теория атома гелия. 61. Приближенная количественная теория атома гелия. 62. Квантовая механика и периодическая система элементов Д. И. Менделеева.
Квантовая механика многоэлектронных атомов 60. Квантовая механика многоэлектронных атомов. Качественная теория атома гелия. 61. Приближенная количественная теория атома гелия. 62. Квантовая механика и периодическая система элементов Д. И. Менделеева.
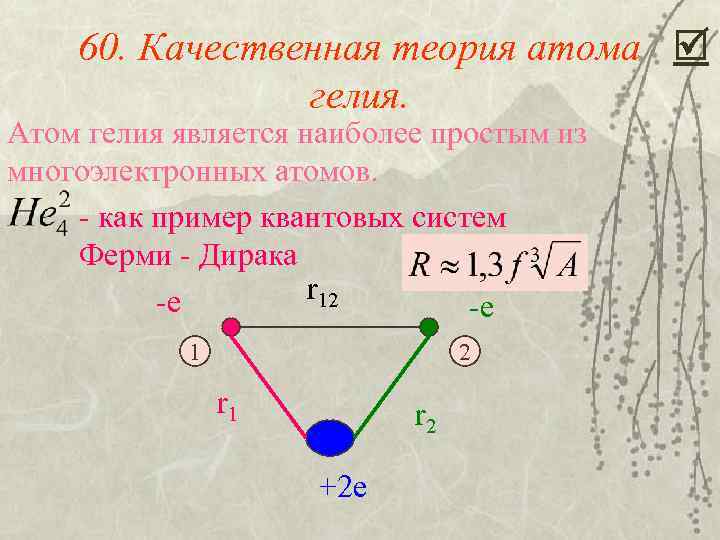 60. Качественная теория атома гелия. Атом гелия является наиболее простым из многоэлектронных атомов. - как пример квантовых систем Ферми - Дирака r 12 -е -е 1 2 r 1 r 2 +2 е
60. Качественная теория атома гелия. Атом гелия является наиболее простым из многоэлектронных атомов. - как пример квантовых систем Ферми - Дирака r 12 -е -е 1 2 r 1 r 2 +2 е
 Решаем уравнение Шредингера для данной системы: Определим вид оператора гамильтониана для электронов атома гелия: Взаимодействия состоят из двух групп. 1. Кулоновские взаимодействия между ядром и электронами:
Решаем уравнение Шредингера для данной системы: Определим вид оператора гамильтониана для электронов атома гелия: Взаимодействия состоят из двух групп. 1. Кулоновские взаимодействия между ядром и электронами:
 - оператор кинетической энергии первого электрона - оператор кинетической энергии второго электрона - кулоновская энергия взаимодействия 2. Слабое магнитное взаимодействие, обусловленное взаимодействием спинов электронов между собой.
- оператор кинетической энергии первого электрона - оператор кинетической энергии второго электрона - кулоновская энергия взаимодействия 2. Слабое магнитное взаимодействие, обусловленное взаимодействием спинов электронов между собой.
 Запишем полную волновую функцию двух электронов атома гелия в виде: 1 -координатная волновая функция - спиновая волновая функция
Запишем полную волновую функцию двух электронов атома гелия в виде: 1 -координатная волновая функция - спиновая волновая функция
 Разделим на координатные и волновые функции. Электроны – фермионы должны быть антисимметричны, поэтому: 2 Поскольку волновая функция разделена, то оператор перестановки можно представить в виде произведения двух операторов перестановки: 3 -действует на координатную часть - действует на спиновую часть
Разделим на координатные и волновые функции. Электроны – фермионы должны быть антисимметричны, поэтому: 2 Поскольку волновая функция разделена, то оператор перестановки можно представить в виде произведения двух операторов перестановки: 3 -действует на координатную часть - действует на спиновую часть
 3 и 1 подставляем в 2 Есть 2 случая. Этот минус «-» сначала подставляем в координатную часть к Ф, а потом в спиновую часть к S:
3 и 1 подставляем в 2 Есть 2 случая. Этот минус «-» сначала подставляем в координатную часть к Ф, а потом в спиновую часть к S:
 I У спиновой функции знак плюс «+» Координатная часть антисимметрична а спиновая – симметрична Тогда полная волновая функция:
I У спиновой функции знак плюс «+» Координатная часть антисимметрична а спиновая – симметрична Тогда полная волновая функция:
 II У спиновой функции знак минус «-» Координатная часть симметрична а спиновая – симметрична Тогда полная волновая функция:
II У спиновой функции знак минус «-» Координатная часть симметрична а спиновая – симметрична Тогда полная волновая функция:
 Найдем спиновые волновые функции. Каждую функцию можно написать в виде произведения спиновых функций, относящихся к каждому электрону в отдельности: - указывают направление спина электрона относительно оси ОZ
Найдем спиновые волновые функции. Каждую функцию можно написать в виде произведения спиновых функций, относящихся к каждому электрону в отдельности: - указывают направление спина электрона относительно оси ОZ
 А Рассмотрим антисимметричную полную спиновую функцию (спины направлены противоположно) Суммарный спин для антисимметричного спинового состояния: + -
А Рассмотрим антисимметричную полную спиновую функцию (спины направлены противоположно) Суммарный спин для антисимметричного спинового состояния: + -
 То есть Это состояние называется синглетным, когда спиновые функции антисимметричные, а координатные функции симметричные. В таком состоянии гелий называется - Пара-гелий синглет
То есть Это состояние называется синглетным, когда спиновые функции антисимметричные, а координатные функции симметричные. В таком состоянии гелий называется - Пара-гелий синглет
 Б Если спины электронов параллельны, то антисимметричные состояния невозможны Расщепляем на произвольные односпиновые функции
Б Если спины электронов параллельны, то антисимметричные состояния невозможны Расщепляем на произвольные односпиновые функции
 В этом случае мы можем иметь следующие состояния спина электронов: 1. 2. 3.
В этом случае мы можем иметь следующие состояния спина электронов: 1. 2. 3.
 3 состояния: + + - - 2 S+1=3 – триплетное состояние В таком состоянии когда спиновая функция симметричная, а координатная функция антисимметричная гелий называется - Орто-гелий
3 состояния: + + - - 2 S+1=3 – триплетное состояние В таком состоянии когда спиновая функция симметричная, а координатная функция антисимметричная гелий называется - Орто-гелий
 Вспомним о свойствах ЛГО: То есть, возбужденное состояние соответствует узлу (n = число узлов). Чем больше узлов, тем больше энергия. У пара -гелия симметричная, у орто-гелия антисимметричная координатная функция. То есть хотя бы на один узел там больше, значит это состояние принадлежит к большей энергии.
Вспомним о свойствах ЛГО: То есть, возбужденное состояние соответствует узлу (n = число узлов). Чем больше узлов, тем больше энергия. У пара -гелия симметричная, у орто-гелия антисимметричная координатная функция. То есть хотя бы на один узел там больше, значит это состояние принадлежит к большей энергии.
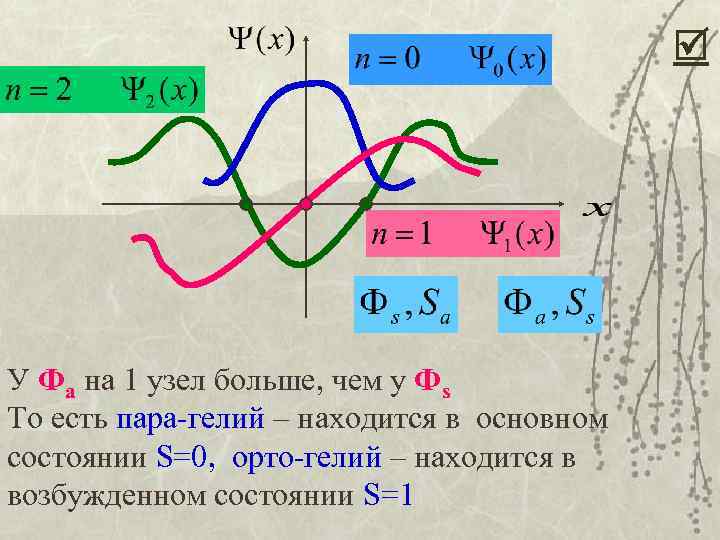 У Фа на 1 узел больше, чем у Фs То есть пара-гелий – находится в основном состоянии S=0, орто-гелий – находится в возбужденном состоянии S=1
У Фа на 1 узел больше, чем у Фs То есть пара-гелий – находится в основном состоянии S=0, орто-гелий – находится в возбужденном состоянии S=1
 61. Приближенная количественная теория атома гелия. Расчитаем квантовые уровни атома гелия. Рассмотрим уравнение Шредингера: Если принибречь спиново-орбитальными взаимодействиями, тогда гамильтониан имеет вид:
61. Приближенная количественная теория атома гелия. Расчитаем квантовые уровни атома гелия. Рассмотрим уравнение Шредингера: Если принибречь спиново-орбитальными взаимодействиями, тогда гамильтониан имеет вид:
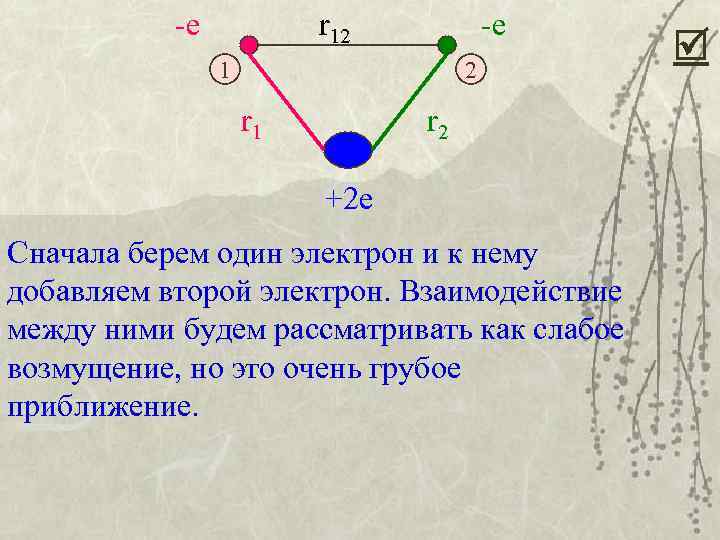 -е r 12 -е 1 2 r 1 r 2 +2 е Сначала берем один электрон и к нему добавляем второй электрон. Взаимодействие между ними будем рассматривать как слабое возмущение, но это очень грубое приближение.
-е r 12 -е 1 2 r 1 r 2 +2 е Сначала берем один электрон и к нему добавляем второй электрон. Взаимодействие между ними будем рассматривать как слабое возмущение, но это очень грубое приближение.
 Оператор - оператор полной энергии двух электронов в поле ядра без взаимодействия их между собой. - энергия взаимодействия электронов (как малая поправка)
Оператор - оператор полной энергии двух электронов в поле ядра без взаимодействия их между собой. - энергия взаимодействия электронов (как малая поправка)
 Представим, что 1 -й электрон находится в n-ом квантовом состоянии: 2 -й электрон возьмем в другом состоянии, состояние - m Если это так, то полная волновая функция нулевого приближения будет выглядеть следующим образом: 1
Представим, что 1 -й электрон находится в n-ом квантовом состоянии: 2 -й электрон возьмем в другом состоянии, состояние - m Если это так, то полная волновая функция нулевого приближения будет выглядеть следующим образом: 1
 Но электроны можно поменять местами: Получилось другое состояние, то есть волновые функции, облака изменились, а энергия осталась та же самая - двукратное вырождение Когда энергия одна, а волновые функции разные, такое состояние называется вырожденным состоянием. Это случай обменного вырождения. Мы имеем дело с теорией возмущений для двукратно вырожденного случая. 2
Но электроны можно поменять местами: Получилось другое состояние, то есть волновые функции, облака изменились, а энергия осталась та же самая - двукратное вырождение Когда энергия одна, а волновые функции разные, такое состояние называется вырожденным состоянием. Это случай обменного вырождения. Мы имеем дело с теорией возмущений для двукратно вырожденного случая. 2
 Применим теорию возмущений для двукратно вырожденного случая: вопрос N 45. 3 - кулоновское отталкивание 4
Применим теорию возмущений для двукратно вырожденного случая: вопрос N 45. 3 - кулоновское отталкивание 4
 5 К и А – энергии кулоновского взаимодействия, они обе разные. К – это средняя энергия кулоновского взаимодействия двух электронов. К- любой из диагональных объектов. и - разные функции. Второе состояние получается из первого обменом квантовыми состояниями электронов.
5 К и А – энергии кулоновского взаимодействия, они обе разные. К – это средняя энергия кулоновского взаимодействия двух электронов. К- любой из диагональных объектов. и - разные функции. Второе состояние получается из первого обменом квантовыми состояниями электронов.
 Поэтому А называют обменной энергией. Понятие обменной энергии существует только в квантовой механике и связано с неразличимостью 6 У орто-гелия К-А, у пара-гелия К+А. Поправки к энергии отличаются знаком обменной энергии. В разных спиновых состояниях влияние обменной энергии разное, оно зависит от спина электронной оболочки.
Поэтому А называют обменной энергией. Понятие обменной энергии существует только в квантовой механике и связано с неразличимостью 6 У орто-гелия К-А, у пара-гелия К+А. Поправки к энергии отличаются знаком обменной энергии. В разных спиновых состояниях влияние обменной энергии разное, оно зависит от спина электронной оболочки.
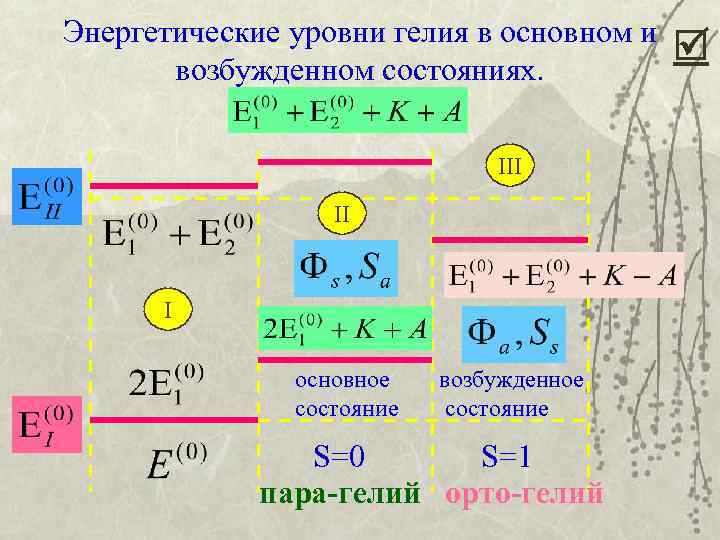 Энергетические уровни гелия в основном и возбужденном состояниях. III II I основное состояние возбужденное состояние S=0 S=1 пара-гелий орто-гелий
Энергетические уровни гелия в основном и возбужденном состояниях. III II I основное состояние возбужденное состояние S=0 S=1 пара-гелий орто-гелий
 62. Квантовая механика и периодическая система элементов Д. И. Менделеева. Периодичность свойств химических элементов тесно связана с периодичностью занятия внешних электронных оболочек атомов этой таблицы. Начнем строить электронные оболочки: Главное в описании: Z –изотопы, порядковый номер или заряд.
62. Квантовая механика и периодическая система элементов Д. И. Менделеева. Периодичность свойств химических элементов тесно связана с периодичностью занятия внешних электронных оболочек атомов этой таблицы. Начнем строить электронные оболочки: Главное в описании: Z –изотопы, порядковый номер или заряд.
 А – атомный вес. Устойчивый атом – это атом с наименьшей энергией: - главное квантовое число - орбитальное квантовое число - квантовое число полного механического момента - магнитное квантовое число
А – атомный вес. Устойчивый атом – это атом с наименьшей энергией: - главное квантовое число - орбитальное квантовое число - квантовое число полного механического момента - магнитное квантовое число
 Электроны подчиняются запрету Паули: не может быть одинаковый набор квантовых чисел в одном и том же состоянии. Z=1 H 1 электрон - электронная конфигурация - основное состояние электронной оболочки атома водорода.
Электроны подчиняются запрету Паули: не может быть одинаковый набор квантовых чисел в одном и том же состоянии. Z=1 H 1 электрон - электронная конфигурация - основное состояние электронной оболочки атома водорода.
 Z=2 Hе 2 электрона: 1 как у H, второй: - электронная конфигурация Суммарный орбитальный момент: Суммарный спиновый момент: - квантовое число полного механического момента - основное состояние атома гелия
Z=2 Hе 2 электрона: 1 как у H, второй: - электронная конфигурация Суммарный орбитальный момент: Суммарный спиновый момент: - квантовое число полного механического момента - основное состояние атома гелия
 Z=3 Li 3 электрона: 2 как у He, третий: - электронная конфигурация Суммарный орбитальный момент: Суммарный магнитный момент: Суммарный спиновый момент:
Z=3 Li 3 электрона: 2 как у He, третий: - электронная конфигурация Суммарный орбитальный момент: Суммарный магнитный момент: Суммарный спиновый момент:
 квантовое число полного механического момента: - основное состояние электронной оболочки атома гелия.
квантовое число полного механического момента: - основное состояние электронной оболочки атома гелия.
 Z=4 Be 4 электрона: 3 как у Li, 4 -ый: - электронная конфигурация Суммарный орбитальный момент: Суммарный магнитный момент: Суммарный спиновый момент: - квантовое число полного механического момента - основное состояние электронной оболочки атома бериллия.
Z=4 Be 4 электрона: 3 как у Li, 4 -ый: - электронная конфигурация Суммарный орбитальный момент: Суммарный магнитный момент: Суммарный спиновый момент: - квантовое число полного механического момента - основное состояние электронной оболочки атома бериллия.
 Z=5 B 5 электронов: 4 как у Be, 5 -ый: - электронная конфигурация Суммарный орбитальный момент: Суммарный магнитный момент: Суммарный спиновый момент: - квантовое число полного механического момента - основное состояние электронной оболочки атома бора.
Z=5 B 5 электронов: 4 как у Be, 5 -ый: - электронная конфигурация Суммарный орбитальный момент: Суммарный магнитный момент: Суммарный спиновый момент: - квантовое число полного механического момента - основное состояние электронной оболочки атома бора.
 Z=6 C 6 электронов: 5 как у B, 6 -oй: - электронная конфигурация Суммарный орбитальный момент: Суммарный спиновый момент: - квантовое число полного механического момента - основное состояние электронной оболочки атома углерода.
Z=6 C 6 электронов: 5 как у B, 6 -oй: - электронная конфигурация Суммарный орбитальный момент: Суммарный спиновый момент: - квантовое число полного механического момента - основное состояние электронной оболочки атома углерода.
 Z=7 N 7 электронов: 6 как у C, 7 -oй: - электронная конфигурация - основное состояние электронной оболочки.
Z=7 N 7 электронов: 6 как у C, 7 -oй: - электронная конфигурация - основное состояние электронной оболочки.
 Z=8 O 8 электронов: 7 как у N, 8 -oй: Z=9 F 9 электронов: 8 как у O, 9 -ый:
Z=8 O 8 электронов: 7 как у N, 8 -oй: Z=9 F 9 электронов: 8 как у O, 9 -ый:
 Z=10 Ne 10 электронов: 9 как у F, 10 -ый: - электронная конфигурация Суммарный орбитальный момент: Суммарный спиновый момент: - квантовое число полного механического момента - основное состояние
Z=10 Ne 10 электронов: 9 как у F, 10 -ый: - электронная конфигурация Суммарный орбитальный момент: Суммарный спиновый момент: - квантовое число полного механического момента - основное состояние
 В таблице есть: Щелочные Li, Na, K, Rb, Cs, Fr металлы: Z = 3, 11, 19, 37, 55, 87 После инертных газов в таблице находятся щелочные металлы. У них во внешней электронной оболочке один электрон, он может легко уйти. Они химически агрессивные элементы. Металлы характеризуются электропроводимостью.
В таблице есть: Щелочные Li, Na, K, Rb, Cs, Fr металлы: Z = 3, 11, 19, 37, 55, 87 После инертных газов в таблице находятся щелочные металлы. У них во внешней электронной оболочке один электрон, он может легко уйти. Они химически агрессивные элементы. Металлы характеризуются электропроводимостью.
 F, Cl, Br, J, Z = 9, 17, 35, 53, У них во внешней электронной оболочке не хватает одного электрона, поэтому они берут один электрон. Они химически агрессивны. Инертные He, Ne, Ar, Kr, Xe, Rn газы: Z = 2, 10, 18, 36, 54, 86 Галоиды: У них внешняя электронная оболочка сферически симметрична, то есть полностью заполнена, плотно упакована. Они плохо вступают в реакции, так как не могут отдать или взять электрон.
F, Cl, Br, J, Z = 9, 17, 35, 53, У них во внешней электронной оболочке не хватает одного электрона, поэтому они берут один электрон. Они химически агрессивны. Инертные He, Ne, Ar, Kr, Xe, Rn газы: Z = 2, 10, 18, 36, 54, 86 Галоиды: У них внешняя электронная оболочка сферически симметрична, то есть полностью заполнена, плотно упакована. Они плохо вступают в реакции, так как не могут отдать или взять электрон.
 Вопросы ? В каком состоянии гелий называется ортогелием? ? Чем отличаются щелочные металлы от галогенов и инертных газов?
Вопросы ? В каком состоянии гелий называется ортогелием? ? Чем отличаются щелочные металлы от галогенов и инертных газов?


