6ДЕ_квантовая и атомная физика готовый.ppt
- Количество слайдов: 57
 КВАНТОВАЯ И АТОМНАЯ ФИЗИКА (6 дидактическая единица)
КВАНТОВАЯ И АТОМНАЯ ФИЗИКА (6 дидактическая единица)
 1. Спектр атома водорода (теория Бора) Постулаты Бора: 1. Электрон в атоме может находиться только в определенных стационарных состояниях, удовлетворяющих условию квантования: m – масса электрона, υ – его скорость по n-й орбите радиуса r. При этом атом не испускает и не поглощает энергию. 2. Энергия испускается атомом (или поглощается) при переходе электрона из одного стационарного состояния в другое. Энергия испущенного (или поглощенного) при этом кванта равна разности энергий тех стационарных состояний, между которыми происходит квантовый скачок электрона: – квант излучается – квант поглощается
1. Спектр атома водорода (теория Бора) Постулаты Бора: 1. Электрон в атоме может находиться только в определенных стационарных состояниях, удовлетворяющих условию квантования: m – масса электрона, υ – его скорость по n-й орбите радиуса r. При этом атом не испускает и не поглощает энергию. 2. Энергия испускается атомом (или поглощается) при переходе электрона из одного стационарного состояния в другое. Энергия испущенного (или поглощенного) при этом кванта равна разности энергий тех стационарных состояний, между которыми происходит квантовый скачок электрона: – квант излучается – квант поглощается
 E ∞ 4 энергия электрона на n-ом уровне 3 Серия Пашена скорость (ИК) 2 Серия Бальмера (видимый свет) n=3 n=2 n=1 Серия Лаймана (УФ) радиус орбиты 1 – частота излученного кванта R = 2, 067· 1016 с− 1 – постоянная Ридберга
E ∞ 4 энергия электрона на n-ом уровне 3 Серия Пашена скорость (ИК) 2 Серия Бальмера (видимый свет) n=3 n=2 n=1 Серия Лаймана (УФ) радиус орбиты 1 – частота излученного кванта R = 2, 067· 1016 с− 1 – постоянная Ридберга
 n=1 Серия Лаймана hνmin=E 2 - E 1 =-3. 38 - (-13. 55) =10. 17 n=2 Серия Бальмера hνmax=E∞ - E 2 = 0 - (-3. 38) =3. 38 νmin/ νmax = 10. 17/3. 38 = 3
n=1 Серия Лаймана hνmin=E 2 - E 1 =-3. 38 - (-13. 55) =10. 17 n=2 Серия Бальмера hνmax=E∞ - E 2 = 0 - (-3. 38) =3. 38 νmin/ νmax = 10. 17/3. 38 = 3
 λ – max ν – min ΔE – min
λ – max ν – min ΔE – min
 Укажите, какому переходу соответствует: - поглощение фотона с наибольшей длиной волны 5 - поглощение фотона с наименьшей длиной волны 4 - испускание фотона с наибольшей длиной волны 1 - испускание фотона с наименьшей длиной волны 3 - испускание фотона с максимальной энергией 3 - испускание фотона с минимальной энергией 1
Укажите, какому переходу соответствует: - поглощение фотона с наибольшей длиной волны 5 - поглощение фотона с наименьшей длиной волны 4 - испускание фотона с наибольшей длиной волны 1 - испускание фотона с наименьшей длиной волны 3 - испускание фотона с максимальной энергией 3 - испускание фотона с минимальной энергией 1
 n=2 Серия Бальмера hν – min
n=2 Серия Бальмера hν – min
 n=1 Серия Лаймана
n=1 Серия Лаймана
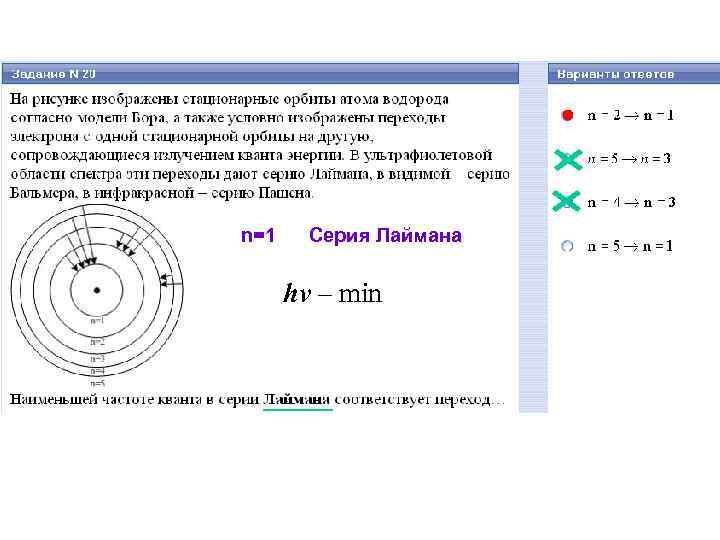 n=1 Серия Лаймана hν – min
n=1 Серия Лаймана hν – min
 n 1=1 n 2=3
n 1=1 n 2=3
 2. Дуализм свойств микрочастиц – длина волны де Бройля – импульс частицы h = 6, 62· 10 -34 Дж·с – постоянная Планка m. V ↑ λ↓ Чем меньше масса частицы, тем более выражены её волновые свойства Волновые и корпускулярные свойства одновременно не проявляются!
2. Дуализм свойств микрочастиц – длина волны де Бройля – импульс частицы h = 6, 62· 10 -34 Дж·с – постоянная Планка m. V ↑ λ↓ Чем меньше масса частицы, тем более выражены её волновые свойства Волновые и корпускулярные свойства одновременно не проявляются!
 – принцип неопределенности Гейзенберга Δx – неопределённость в определении координаты частицы Δpx – неопределённость в определении проекции импульса частицы – принцип неопределенности Гейзенберга ΔE – неопределённость энергии некоторого состояния системы Δt – промежуток времени, в течение которого это состояние существует
– принцип неопределенности Гейзенберга Δx – неопределённость в определении координаты частицы Δpx – неопределённость в определении проекции импульса частицы – принцип неопределенности Гейзенберга ΔE – неопределённость энергии некоторого состояния системы Δt – промежуток времени, в течение которого это состояние существует
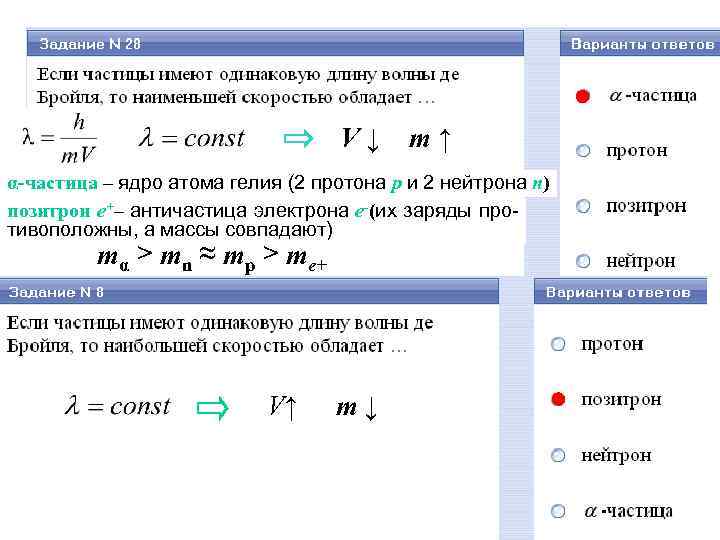 V↓ m↑ α-частица – ядро атома гелия (2 протона p и 2 нейтрона n) позитрон e+– античастица электрона e-(их заряды противоположны, а массы совпадают) mα > mn ≈ mp > me+ V↑ m↓
V↓ m↑ α-частица – ядро атома гелия (2 протона p и 2 нейтрона n) позитрон e+– античастица электрона e-(их заряды противоположны, а массы совпадают) mα > mn ≈ mp > me+ V↑ m↓
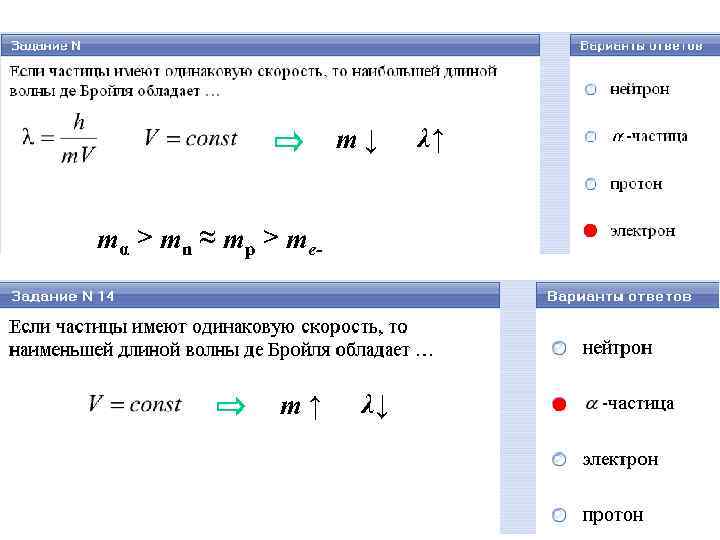 m↓ mα > mn ≈ mp > me- m↑ λ↓ λ↑
m↓ mα > mn ≈ mp > me- m↑ λ↓ λ↑

 λ n= λ α Если протон и нейтрон двигаются с одинаковыми скоростями, то отношения их длин волн де Бройля λp/λn равно… λ n= λ p 4 3
λ n= λ α Если протон и нейтрон двигаются с одинаковыми скоростями, то отношения их длин волн де Бройля λp/λn равно… λ n= λ p 4 3
 1/2 скоростями α-частица – ядро He (2 протона p и 2 нейтрона n) λn= 4λα 4
1/2 скоростями α-частица – ядро He (2 протона p и 2 нейтрона n) λn= 4λα 4


 3. Уравнение Шрёдингера – общее уравнение Шрёдингера – мнимая единица – постоянная Планка – оператор Лапласа
3. Уравнение Шрёдингера – общее уравнение Шрёдингера – мнимая единица – постоянная Планка – оператор Лапласа
 В одномерном случае: U(x, y, z, t) – потенциальная энергия частицы в силовом поле Ψ – волновая функция m – масса частицы – вероятность обнаружить частицу в объеме V
В одномерном случае: U(x, y, z, t) – потенциальная энергия частицы в силовом поле Ψ – волновая функция m – масса частицы – вероятность обнаружить частицу в объеме V
 – общее (временное) уравнение Шрёдингера – стационарное уравнение Шрёдингера E – полная энергия электрона в атоме – стационарное уравнение Шрёдингера для водородоподобных атомов
– общее (временное) уравнение Шрёдингера – стационарное уравнение Шрёдингера E – полная энергия электрона в атоме – стационарное уравнение Шрёдингера для водородоподобных атомов
 – стационарное уравнение Шрёдингера для гармонического осциллятора – стационарное уравнение Шрёдингера для частицы в одномерной потенциальной яме
– стационарное уравнение Шрёдингера для гармонического осциллятора – стационарное уравнение Шрёдингера для частицы в одномерной потенциальной яме

 Установите соответствие между видом потенциальной энергии U и названием уравнения Шредингера Уравнение Шредингера для атома водорода Уравнение Шредингера для линейного гармонического осциллятора Уравнение Шредингера для стационарных состояний (общего вида) Уравнение Шредингера для частицы, находящейся в бесконечно глубокой одномерной потенциальной яме. Временное или общее уравнение Шредингера
Установите соответствие между видом потенциальной энергии U и названием уравнения Шредингера Уравнение Шредингера для атома водорода Уравнение Шредингера для линейного гармонического осциллятора Уравнение Шредингера для стационарных состояний (общего вида) Уравнение Шредингера для частицы, находящейся в бесконечно глубокой одномерной потенциальной яме. Временное или общее уравнение Шредингера

 для водорода Z = 1
для водорода Z = 1


 стационарное для частицы в ? бесконечно глубокой 3 х мерной потенциальной яме
стационарное для частицы в ? бесконечно глубокой 3 х мерной потенциальной яме
 U – не зависит от времени уравнение одномерное U =0
U – не зависит от времени уравнение одномерное U =0
 II U – не зависит от времени уравнение одномерное U =U 0
II U – не зависит от времени уравнение одномерное U =U 0
 3. Частица в одномерной прямоугольной яме с бесконечными внешними «стенками» – стационарное УШ в одномерном случае – волновая функция частицы – энергия частицы n = 1, 2, 3… – главное квантовое число
3. Частица в одномерной прямоугольной яме с бесконечными внешними «стенками» – стационарное УШ в одномерном случае – волновая функция частицы – энергия частицы n = 1, 2, 3… – главное квантовое число
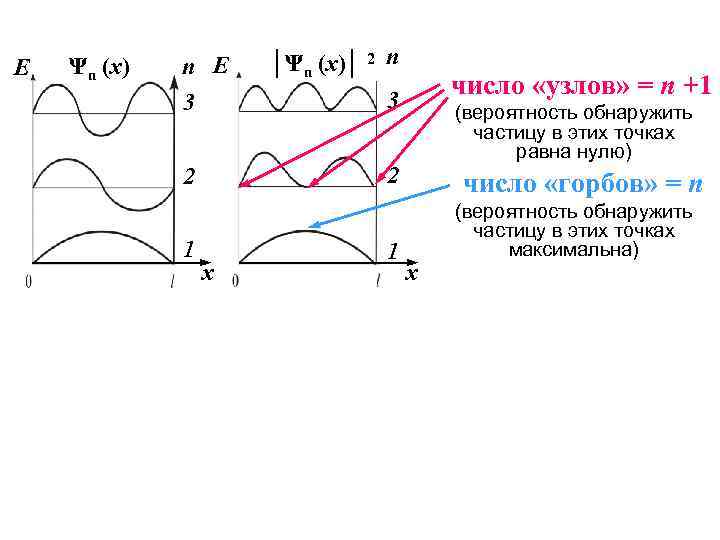 E Ψn (x) n E 3 число «узлов» = n +1 3 (вероятность обнаружить частицу в этих точках равна нулю) 2 2 1 │Ψn (x)│ 2 n x 1 число «горбов» = n x (вероятность обнаружить частицу в этих точках максимальна)
E Ψn (x) n E 3 число «узлов» = n +1 3 (вероятность обнаружить частицу в этих точках равна нулю) 2 2 1 │Ψn (x)│ 2 n x 1 число «горбов» = n x (вероятность обнаружить частицу в этих точках максимальна)
 4 3
4 3
 4 3
4 3

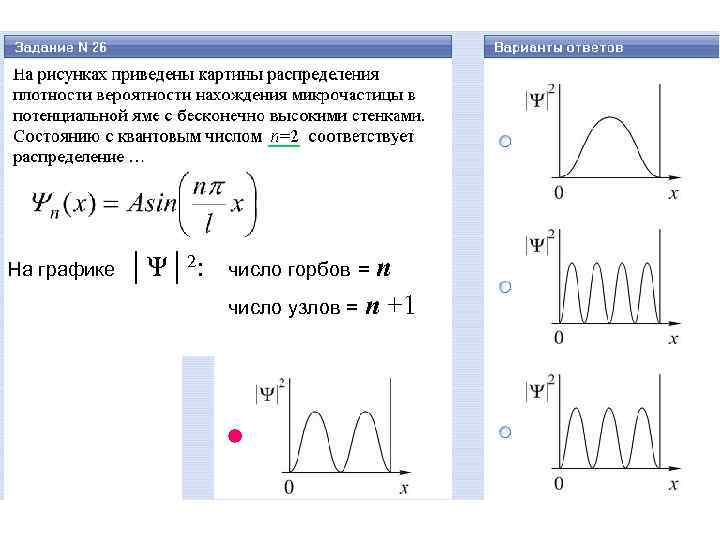 На графике │Ψ│2: n число узлов = n +1 число горбов =
На графике │Ψ│2: n число узлов = n +1 число горбов =
 1 На графике│Ψ│2: n число узлов = n +1 число горбов =
1 На графике│Ψ│2: n число узлов = n +1 число горбов =
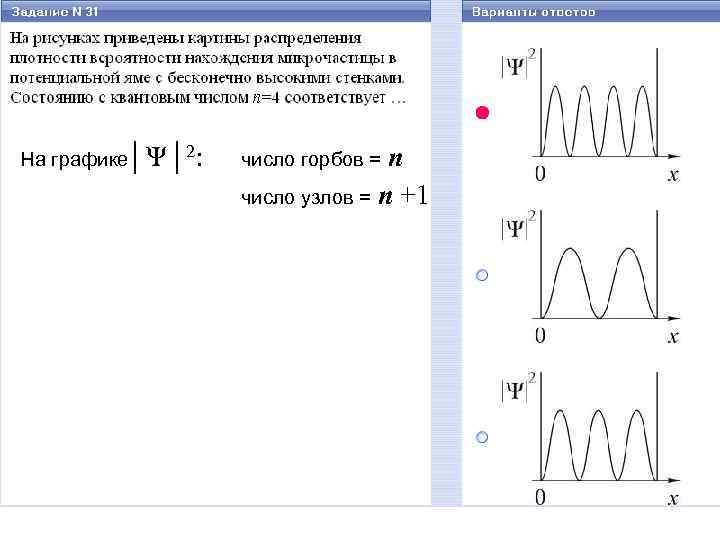 На графике│Ψ│2: n число узлов = n +1 число горбов =
На графике│Ψ│2: n число узлов = n +1 число горбов =
 l/4 3 l/4
l/4 3 l/4
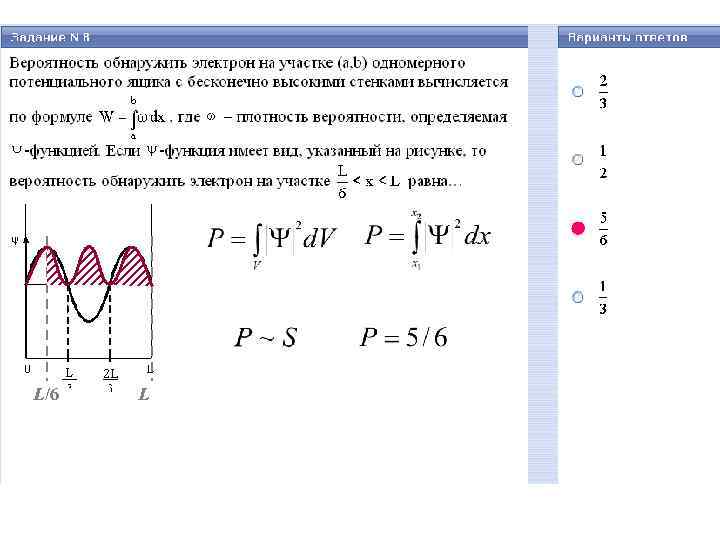 L/6 L
L/6 L
 L/6 L/2
L/6 L/2
 L/8 L/2
L/8 L/2
 3 L/8 L
3 L/8 L
 3. Атом водорода в квантовой механике – потенциальная энергия взаимодействия электрона с ядром Уравнению Шрёдингера в атоме водорода удовлетворяют волновые функции Ψnlm, определяемые тремя квантовыми числами: n, l, m.
3. Атом водорода в квантовой механике – потенциальная энергия взаимодействия электрона с ядром Уравнению Шрёдингера в атоме водорода удовлетворяют волновые функции Ψnlm, определяемые тремя квантовыми числами: n, l, m.
 n – главное квантовое число (определяет энергетические уровни электрона в атоме); n = 1, 2, … Главное квантовое число n характеризует расстояние электрона от ядра – радиус орбиты. 1 n K 2 3 4 L M N обозначения электронных оболочек в атомной физике
n – главное квантовое число (определяет энергетические уровни электрона в атоме); n = 1, 2, … Главное квантовое число n характеризует расстояние электрона от ядра – радиус орбиты. 1 n K 2 3 4 L M N обозначения электронных оболочек в атомной физике
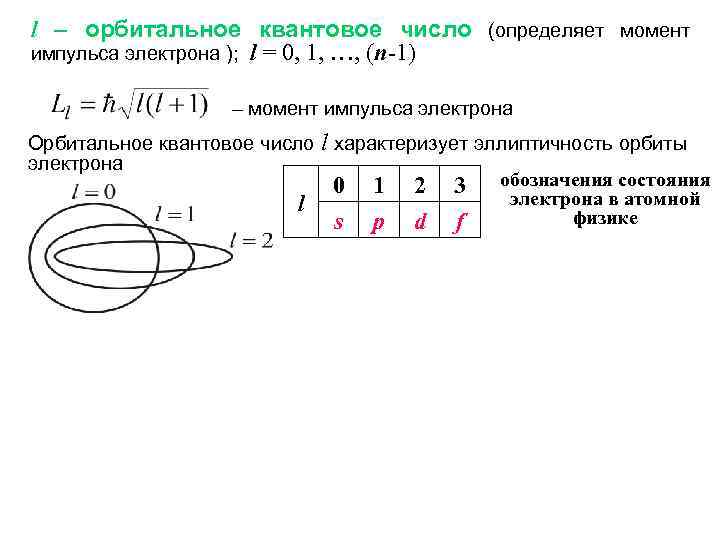 l – орбитальное квантовое число (определяет момент импульса электрона ); l = 0, 1, …, (n-1) – момент импульса электрона Орбитальное квантовое число l характеризует эллиптичность орбиты электрона 0 1 2 3 обозначения состояния электрона в атомной l физике s p d f
l – орбитальное квантовое число (определяет момент импульса электрона ); l = 0, 1, …, (n-1) – момент импульса электрона Орбитальное квантовое число l характеризует эллиптичность орбиты электрона 0 1 2 3 обозначения состояния электрона в атомной l физике s p d f
 m – магнитное квантовое число (определяет проекцию момента импульса электрона на заданное направление); m = 0, ± 1, ± 2, …, ±l – проекция момента импульса на направление внешнего поля Магнитное квантовое число m характеризует ориентацию электронного облака в пространстве Возможные ориентации вектора L в состояниях s, p, d.
m – магнитное квантовое число (определяет проекцию момента импульса электрона на заданное направление); m = 0, ± 1, ± 2, …, ±l – проекция момента импульса на направление внешнего поля Магнитное квантовое число m характеризует ориентацию электронного облака в пространстве Возможные ориентации вектора L в состояниях s, p, d.
 спиновое квантовое число (спин)
спиновое квантовое число (спин)

 На рисунке приведена одна из возможных ориентации момента импульса электрона в р состоянии. Какие еще значения может принимать проекция момента импульса на направление Z внешнего магнитного поля? Lz=ћm – проекция момента импульса электрона на направление внешнего магнитного поля m=0, ± 1, ± 2, …, ±l – магнитное квантовое число • 2ћ • - ћ • 0 На рисунке приведены некоторые из возможных ориентации момента импульса доя электронов в dсостоянии. Какие еще значения может принимать проекция момента импульса на направление Z внешнего магнитного поля? • 3ћ • -2ћ • - ћ
На рисунке приведена одна из возможных ориентации момента импульса электрона в р состоянии. Какие еще значения может принимать проекция момента импульса на направление Z внешнего магнитного поля? Lz=ћm – проекция момента импульса электрона на направление внешнего магнитного поля m=0, ± 1, ± 2, …, ±l – магнитное квантовое число • 2ћ • - ћ • 0 На рисунке приведены некоторые из возможных ориентации момента импульса доя электронов в dсостоянии. Какие еще значения может принимать проекция момента импульса на направление Z внешнего магнитного поля? • 3ћ • -2ћ • - ћ
 K-оболочка n =1 L-оболочка n = 2 Первый n =1 и второй n = уровни полностью заполнены 2 энергетические 8 10 18 Принцип Паули: в пределах одной квантовой системы в данном квантовом состоянии может находиться только один фермион. Состояние электрона числами: n, l, m, s. l = 0, 1, …, (n-1) n=1 l=0 m=0 n=2 l=0 m=0 l=1 m=0 m=+1 m=-1 в атоме определяется квантовыми m = 0, ± 1, ± 2, …, ±l s = ± 1/2 число s= ± 1/2 2 электрона электронов на s= ± 1/2 2 электрона n-ом уровне: s= ± 1/2 2 электрона Z(n)=2 n 2 2 электрона s= ± 1/2 Zобщ=2+2· 22 2 электрона s= ± 1/2
K-оболочка n =1 L-оболочка n = 2 Первый n =1 и второй n = уровни полностью заполнены 2 энергетические 8 10 18 Принцип Паули: в пределах одной квантовой системы в данном квантовом состоянии может находиться только один фермион. Состояние электрона числами: n, l, m, s. l = 0, 1, …, (n-1) n=1 l=0 m=0 n=2 l=0 m=0 l=1 m=0 m=+1 m=-1 в атоме определяется квантовыми m = 0, ± 1, ± 2, …, ±l s = ± 1/2 число s= ± 1/2 2 электрона электронов на s= ± 1/2 2 электрона n-ом уровне: s= ± 1/2 2 электрона Z(n)=2 n 2 2 электрона s= ± 1/2 Zобщ=2+2· 22 2 электрона s= ± 1/2
 главное квантовое число электронов валентный электрон 1 s 2 2 p 6 3 s 1 орбитальное квантовое число В стационарном состоянии электроны находятся на нижних энергетических уровнях. Валентный электрон находится на внешней оболочке атома. n=3 s l=0
главное квантовое число электронов валентный электрон 1 s 2 2 p 6 3 s 1 орбитальное квантовое число В стационарном состоянии электроны находятся на нижних энергетических уровнях. Валентный электрон находится на внешней оболочке атома. n=3 s l=0
 орбитальные квантовые числа l s: l = 0 d: l = 2 p: l = 1 f: l = 3 Правило отбора: Δl = ± 1 главные квантовые числа n
орбитальные квантовые числа l s: l = 0 d: l = 2 p: l = 1 f: l = 3 Правило отбора: Δl = ± 1 главные квантовые числа n
 s: l = 0 d: l = 2 p: l = 1 f: l = 3 Правило отбора: Δl = ± 1
s: l = 0 d: l = 2 p: l = 1 f: l = 3 Правило отбора: Δl = ± 1
 s: l = 0 d: l = 2 p: l = 1 f: l = 3 Правило отбора: Δl = ± 1
s: l = 0 d: l = 2 p: l = 1 f: l = 3 Правило отбора: Δl = ± 1


