Курсовой Рубченков.pptx
- Количество слайдов: 15
 Курсовой проект Тема: Производство серной кислоты нитрозным методом Выполнил: Д. А. Рубченков Группа: ХТ – 11 2014
Курсовой проект Тема: Производство серной кислоты нитрозным методом Выполнил: Д. А. Рубченков Группа: ХТ – 11 2014
 Цель курсового проекта Рассмотрение производства серной кислоты башенным (нитрозным) методом и выполнение расчетов в соответствии с заданием
Цель курсового проекта Рассмотрение производства серной кислоты башенным (нитрозным) методом и выполнение расчетов в соответствии с заданием
 Свойства серной кислоты Сильная двухосновная кислота, высшая степень окисления серы (+6) При о. у. концентрированная серная кислота – тяжёлая маслянистая жидкость без цвета и запаха В технике под серной кислотой подразумевают любые смеси серного ангидрида с водой состава n. S 03 ∙ m. H 2 O Сорта: контактная (улучшенная и техническая), олеум (улучшенный и технический), башенная, регенерированная
Свойства серной кислоты Сильная двухосновная кислота, высшая степень окисления серы (+6) При о. у. концентрированная серная кислота – тяжёлая маслянистая жидкость без цвета и запаха В технике под серной кислотой подразумевают любые смеси серного ангидрида с водой состава n. S 03 ∙ m. H 2 O Сорта: контактная (улучшенная и техническая), олеум (улучшенный и технический), башенная, регенерированная
 Применение Производство минеральных удобрений Электролит в свинцовых аккумуляторах Для получения различных минеральных кислот и солей, химических волокон, красителей, дымообразующих и взрывчатых веществ, В нефтяной, металлообрабатывающей, текстильной, кожевенной и других отраслях промышленности
Применение Производство минеральных удобрений Электролит в свинцовых аккумуляторах Для получения различных минеральных кислот и солей, химических волокон, красителей, дымообразующих и взрывчатых веществ, В нефтяной, металлообрабатывающей, текстильной, кожевенной и других отраслях промышленности
 Сырье для производства серной кислоты Элементарная сера Колчедан Сероводород Отходящие газы Сульфиды, сульфаты
Сырье для производства серной кислоты Элементарная сера Колчедан Сероводород Отходящие газы Сульфиды, сульфаты
 Методы производства серной кислоты Нитрозный, или башенный Контактный Камерный Мокрого катализа
Методы производства серной кислоты Нитрозный, или башенный Контактный Камерный Мокрого катализа
 Нитрозный метод Стадии производства получение SO 2 поглощение SO 2 нитрозой окисление SO 2 нитрозой освобождение нитрозы от окислов азота (денитрация) окисление выделившегося из нитрозы NO кислородом в газовой фазе поглощение оксидов азота серной кислотой
Нитрозный метод Стадии производства получение SO 2 поглощение SO 2 нитрозой окисление SO 2 нитрозой освобождение нитрозы от окислов азота (денитрация) окисление выделившегося из нитрозы NO кислородом в газовой фазе поглощение оксидов азота серной кислотой
 Реакции образования серной кислоты в нитрозном процессе - поглощение газа жидкостью SO 2 + Н 2 O = H 2 SO 3 - реакции в жидкой фазе 2 NO (раств. ) + O 2 = 2 NO 2 (раств. ) HNSO 5 + H 2 O = H 2 SO 4 + HNO 2 выделение оксида азота из жидкой фазы NO + NO 2 + H 2 O = 2 HNO 2 H 2 SO 3 + 2 HNO 2 = 2 H 2 SO 4 + 2 NO + H 2 O 2 HNSO 5 + Н 2 O = 2 H 2 SO 4 + NO 2 NO (раств. ) = NO(газ) Возможность окисления SO 2 в газовой фазе не установлена.
Реакции образования серной кислоты в нитрозном процессе - поглощение газа жидкостью SO 2 + Н 2 O = H 2 SO 3 - реакции в жидкой фазе 2 NO (раств. ) + O 2 = 2 NO 2 (раств. ) HNSO 5 + H 2 O = H 2 SO 4 + HNO 2 выделение оксида азота из жидкой фазы NO + NO 2 + H 2 O = 2 HNO 2 H 2 SO 3 + 2 HNO 2 = 2 H 2 SO 4 + 2 NO + H 2 O 2 HNSO 5 + Н 2 O = 2 H 2 SO 4 + NO 2 NO (раств. ) = NO(газ) Возможность окисления SO 2 в газовой фазе не установлена.
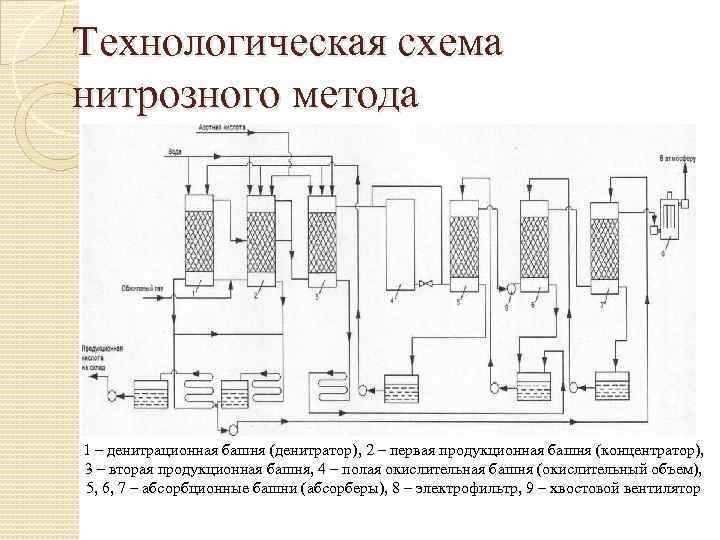 Технологическая схема нитрозного метода 1 – денитрационная башня (денитратор), 2 – первая продукционная башня (концентратор), 3 – вторая продукционная башня, 4 – полая окислительная башня (окислительный объем), 5, 6, 7 – абсорбционные башни (абсорберы), 8 – электрофильтр, 9 – хвостовой вентилятор
Технологическая схема нитрозного метода 1 – денитрационная башня (денитратор), 2 – первая продукционная башня (концентратор), 3 – вторая продукционная башня, 4 – полая окислительная башня (окислительный объем), 5, 6, 7 – абсорбционные башни (абсорберы), 8 – электрофильтр, 9 – хвостовой вентилятор
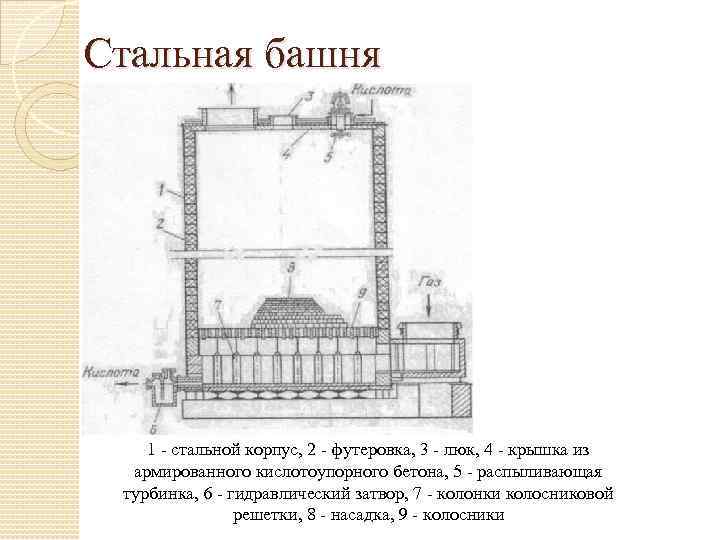 Стальная башня 1 - стальной корпус, 2 - футеровка, 3 - люк, 4 - крышка из армированного кислотоупорного бетона, 5 - распыливающая турбинка, 6 - гидравлический затвор, 7 - колонки колосниковой решетки, 8 - насадка, 9 - колосники
Стальная башня 1 - стальной корпус, 2 - футеровка, 3 - люк, 4 - крышка из армированного кислотоупорного бетона, 5 - распыливающая турбинка, 6 - гидравлический затвор, 7 - колонки колосниковой решетки, 8 - насадка, 9 - колосники
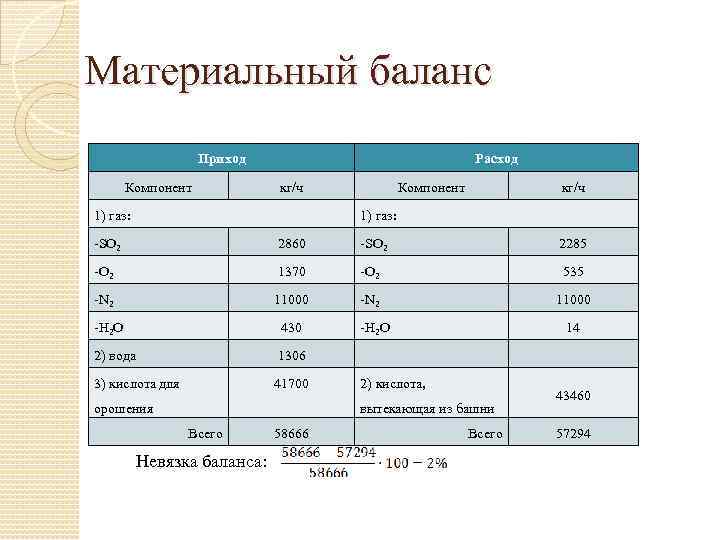 Материальный баланс Приход Компонент Расход кг/ч 1) газ: Компонент кг/ч 1) газ: -SO 2 2860 -SO 2 2285 -O 2 1370 -O 2 535 -N 2 11000 -H 2 O 430 2) вода 1306 3) кислота для 41700 орошения -H 2 O 14 2) кислота, вытекающая из башни Всего Невязка баланса: 58666 Всего 43460 57294
Материальный баланс Приход Компонент Расход кг/ч 1) газ: Компонент кг/ч 1) газ: -SO 2 2860 -SO 2 2285 -O 2 1370 -O 2 535 -N 2 11000 -H 2 O 430 2) вода 1306 3) кислота для 41700 орошения -H 2 O 14 2) кислота, вытекающая из башни Всего Невязка баланса: 58666 Всего 43460 57294
 Тепловой баланс Приход тепла, ккал/ч - с газом 1491600 - с водой 26120 - с орошающей нитрозой - кислотообразование - разбавление моногидрата 972180 484460 Расход тепла, ккал/ч - на денитрацию 406800 - с газом 398475 - с уходящей кислотой 2506320 - потери 174295 80210 - разбавление орошащей 219320 нитрозы - конденсация водяных паров Всего Невязка баланса: 208000 3485890 Всего 3485890
Тепловой баланс Приход тепла, ккал/ч - с газом 1491600 - с водой 26120 - с орошающей нитрозой - кислотообразование - разбавление моногидрата 972180 484460 Расход тепла, ккал/ч - на денитрацию 406800 - с газом 398475 - с уходящей кислотой 2506320 - потери 174295 80210 - разбавление орошащей 219320 нитрозы - конденсация водяных паров Всего Невязка баланса: 208000 3485890 Всего 3485890
 Достоинства и недостатки нитрозного метода Достоинства: 1. Простота аппаратурного оформления 2. Низкая себестоимость 3. 100%-ная переработка SO 2 4. Примеси не влияют на процесс Недостатки: 1. Низкая концентрация кислоты 2. Загрязнение кислоты
Достоинства и недостатки нитрозного метода Достоинства: 1. Простота аппаратурного оформления 2. Низкая себестоимость 3. 100%-ная переработка SO 2 4. Примеси не влияют на процесс Недостатки: 1. Низкая концентрация кислоты 2. Загрязнение кислоты
 Охрана труда и техника безопасности Спецодежда Спецобувь и резиновые перчатки Предохранительные очки Противогаз Серную кислоту вливать в воду, а не наоборот Проверка герметичности аппаратов Порядок и чистота на рабочем месте
Охрана труда и техника безопасности Спецодежда Спецобувь и резиновые перчатки Предохранительные очки Противогаз Серную кислоту вливать в воду, а не наоборот Проверка герметичности аппаратов Порядок и чистота на рабочем месте
 Заключение Нитрозный метод не может быть использован как единственный метод для производства серной кислоты малой концентрации В каждом конкретном случае следует исходить из технико-экономических соображений а также от требуемого качества получаемой продукции
Заключение Нитрозный метод не может быть использован как единственный метод для производства серной кислоты малой концентрации В каждом конкретном случае следует исходить из технико-экономических соображений а также от требуемого качества получаемой продукции


