Лекция 5 Молекулярно-генетические маркеры.ppt
- Количество слайдов: 50

Курс лекций по выбору «ГЕНОМИКА И ПРОТЕОМИКА» Чемерилова Валентина Ивановна, к. б. н. , доцент Молекулярно-генетические маркеры и аннотирование последовательности 1. Революция в картировании 2. Молекулярно-генетические маркеры 3. Картирование с использованием ДНКмаркеров 4. Аннотирование последовательности ДНК
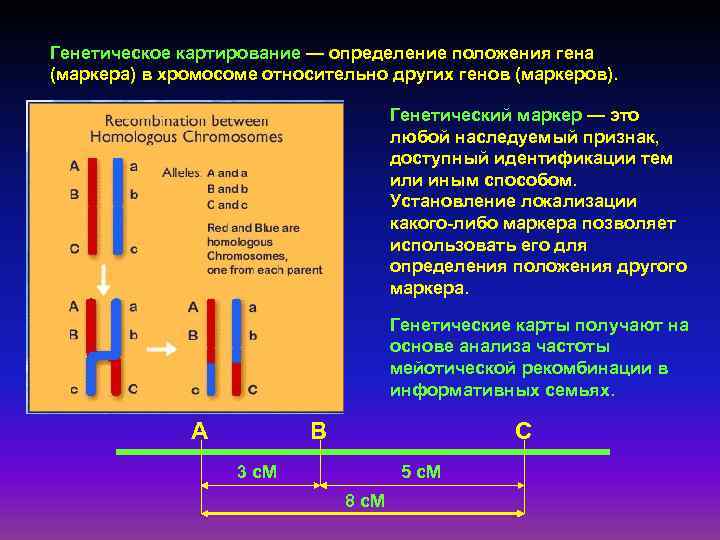
Генетическое картирование — определение положения гена (маркера) в хромосоме относительно других генов (маркеров). Генетический маркер — это любой наследуемый признак, доступный идентификации тем или иным способом. Установление локализации какого-либо маркера позволяет использовать его для определения положения другого маркера. Генетические карты получают на основе анализа частоты мейотической рекомбинации в информативных семьях. А В С 3 с. М 5 с. М 8 с. М
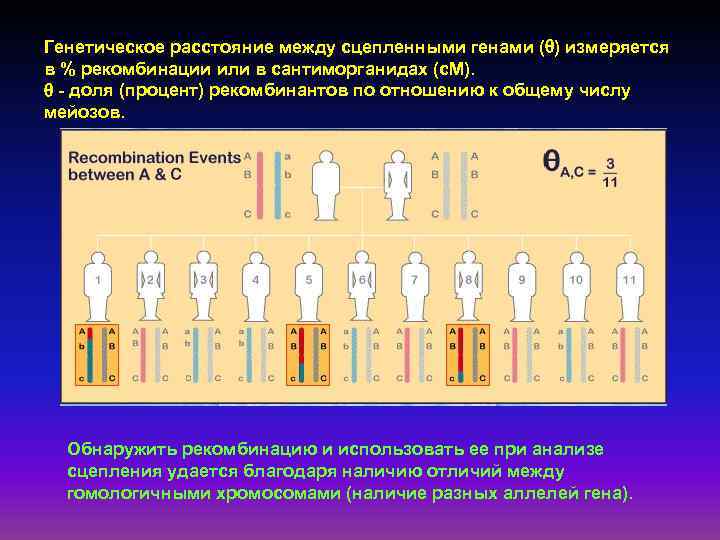
Генетическое расстояние между сцепленными генами ( ) измеряется в % рекомбинации или в сантиморганидах (с. М). - доля (процент) рекомбинантов по отношению к общему числу мейозов. Обнаружить рекомбинацию и использовать ее при анализе сцепления удается благодаря наличию отличий между гомологичными хромосомами (наличие разных аллелей гена).

Динамика картирования генов человека В 1911 г. картирован первый ген цветной слепоты на Х-хромосоме. В 1968 г. картирован первый аутосомный ген. К концу 1973 г. на хромосомах человека было картировано всего 64 гена, значительная часть которых была локализована в Х-хромосоме. Большая часть человеческого генома оставалась недоступной для анализа сцепления из-за недостатка маркеров. Доступные маркеры: гены, кодирующие определенные ферменты, антигены групп крови (белки, которые определяют группу крови) и некоторые другие белки, которые существуют во множестве аллельных вариантов. Это приводит к белковому полиморфизму — различным вариантам белка, кодируемого данным геном; эти различия нередко можно выявить. Было известно всего 25— 30 таких маркерных систем разной степени значимости, и затрагивали они только малые участки нескольких хромосом.

Карта генетического сцепления человека: для мужчин: около 2809 с. М для женщин: 4782 с. М. (Меньший "размер" мужского генома объясняется тем, что частота рекомбинации в сперматогенезе меньше, чем в оогенезе). Средняя длина генома человека в единицах генетического расстояния: – около 3300 с. М. Размер гаплоидного генома человека – 3, 2 млрд. п. н. 1 с. М ≈ 1 млн. п. н. ДНК. Для генетической карты с интервалом в 10% рекомбинации нужно 300 равноудаленных маркеров. Эти маркеры нужны для различения одной хромосомы от другой в данном локусе.
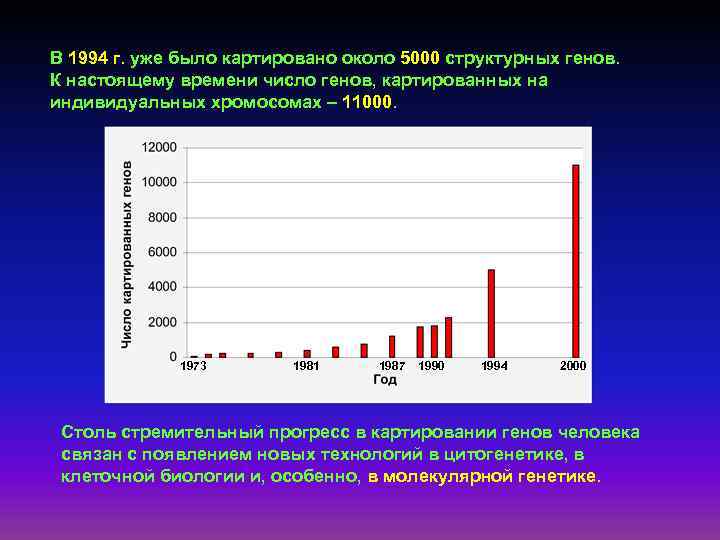
В 1994 г. уже было картировано около 5000 структурных генов. К настоящему времени число генов, картированных на индивидуальных хромосомах – 11000. 1973 1981 1987 1990 1994 2000 Столь стремительный прогресс в картировании генов человека связан с появлением новых технологий в цитогенетике, в клеточной биологии и, особенно, в молекулярной генетике.

Революция в генетическом картировании Апрель 1978 г. - конференция по генетике в Университете шт. Юта Последовательности ДНК сами по себе могут служить многочисленными и легко обнаруживаемыми маркерами. Д. Ботстейн (Массачусетский технологический институт), Р. Дейвис (Станфордский университет), М. Сколник (Университет шт. Юта) В 1980 г. Ботстейн, Уайт, Сколник и Дейвис опубликовали свою первую статью, детализирующую новый подход к анализу сцепления.

Подход оказался эффективен потому, что в последовательностях ДНК в норме наблюдается очень высокий уровень полиморфизма. • ИДЕНТИЧНОСТЬ НЕРОДСТВЕННЫХ ГЕНОМОВ - 99, 9%, т. е. «правильной» последовательности не существует • ИНДИВИДАЛЬНАЯ ВАРИАБЕЛЬНОСТЬ - 0, 1% 3. 2 х109 п. н. – > 3 млн. ~ 1 SNP на 1000 п. н. – представляют наибольший интерес, поскольку делают каждого из нас уникальным. Эти различия вызываются заменой, делецией или инсерцией одной или более нуклеотидных пар. Под генетическим маркером стали понимать любой участок ДНК, наследование, структуру или вариабельность которого изучают в том или ином генетическом исследовании.

Вариабельность генома Вариации последовательности ДНК в геноме довольно условно принято делить на мутации и полиморфизм. Под мутацией понимают изменение, которое возникает редко и которое, как правило, сопровождается изменением фенотипа. Полиморфизм, согласно классическому определению, - это наличие нескольких наследственных вариантов, наиболее редкий из которых встречается с частотой, превышающей частоту обратного мутирования. На практике, признак или маркер считают полиморфным, если наиболее редкий вариант встречается чаще, чем в 1% наблюдений. Генетические мутации, которые вызывают наследственные заболевания, очень редки у населения в целом и, следовательно, составляют лишь небольшую долю вариаций. Подавляющее большинство последних существует в форме полиморфизмов последовательностей ДНК, где несколько различных вариантов аллелей могут быть весьма распространенными.

Типы вариаций последовательности ДНК (мутаций и полиморфизма): 1. Точечные мутации – замены отдельных нуклеотидов. 2. Другое название этого класса генетического полиморфизма - полиморфизм отдельных нуклеотидов (ОНП) - около 95% полиморфных последовательностей. SNP - single nucleotide polymorphism однонуклеотидный полиморфизм Однонуклеотидные замены наиболее часты в интронах и фланкирующих районах генов, а в кодирующей части встречаются реже. ОДНОНУКЛЕОТИДНЫЕ ЗАМЕНЫ (SNP) ВСЕГО – 4, 0 x 10 6 СМЫСЛОВЫЕ – 2, 6 x 10 6

Последовательность участка хромосомы 7 GAAATAATGTTTTCCTTCTCCTATTTTGTCCTTTACTTCAATTTATTTATTATTAATATTATTATTTTTTG AGACGGAGTTTCACTCTTGTTGCCAACCTGGAGTGCAGTGGCGTGATCTCAGCTCACTGCACACTCCGCTTTCC/TGG TTTCAAGCGATTCTCCTGCCTCAGCCTCCTGAGTAGCTGGGACTACAGTCACACACCACCACGCCCGGCTAATTTTTG TATTTTTAGTAGAGTTGGGGTTTCACCATGTTGGCCAGACTGGTCTCGAACTCCTGACCTTGTGATCCGCCAGCCTCT GCCTCCCAAAGAGCTGGGATTACAGGCGTGAGCCACCGCGCTCGGCCCTTTGCATCAATTTCTACAGCTTGTTTTCTT TGCCTGGACTTTACAAGTCTTACCTTGTTCTGCCTTCAGATATTTGTGTGGTCTCATTCTGGTGTGCCAGTAGCTAAAA ATCCATGATTTGCTCTCATCCCACTCCTGTTGTTCATCTCCTCTTATCTGGGGTCACA/CTATCTCTTCGTGATTGCATTC TGATCCCCAGTACTTAGCATGTGCGTAACAACTCTGCTTTCCCAGGCTGTTGATGGGGTGCTGTTCATGCCT CAGAAAAATGCATTGTAAGTTAAATTATTAAAGATTTTAAATATAGGAAAAAAGTAAGCAAACATAAGGAACAAAAAG GAAAGAACATGTATTCTAATCCATTATTATACAATTAAGAAATTTGGAAACTTTAGATTACACTGCTTTTAGAGAT GGAGATGTAGTAAGTCTTTTACTCTTTACAAAATACATGTGTTAGCAATTTTGGGAAGAATAGTAACTCACCCGAACA GTGTAATGTGAATATGTCACTTACTAGAGGAAAGAAGGCACTTGAAAAACATCTCTAAACCGTATAAAAACAATTACA TCATAATGATGAAAACCCAAGGAATTTTTTTAGAAAACATTACCAGGGCTAATAACAAAGTAGAGCCACATGTCATTT ATCTTCCCTTTGTGTCTGTGTGAGAATTCTAGAGTTATATTTGTACATAGCATGGAAAAATGAGAGGCTAGTTTATCAA CTAGTTCATTTTTAAAAGTCTAACACATCCTAGGTATAGGTGAACTGTCCTCCTGCCAATGTATTGCACATTTGTGCCC AGATCCAGCATAGGGTATGTTTGCCATTTACAAACGTTTATGTCTTAAGAGAGGAAATATGAAGAGCAAAACAGTGCA TGCTGGAGAAAGCTGATACAAATATAAATGAAACAATAATTGGAAAAATTGAGAAACTACTCATTTTCTAAATT ACTCATGTATTTTCCTAGAATTTAAGTCTTTTAATTTTTGATAAATCCCAATGTGAGACAAGATAAGTATTAGTGATGGT ATGAGTAATATCTGTTATATAATATTCATTTTCATAGTGGAAGAAATAAAGGTTGTGATGATTGTTGATTA TTTTTTCTAGAGGGGTTGTCAGGGAAATTGCTTTTTTTCATTCTCTCTTTCCACTAAGAAAGTTCAACTATTAATT TAGGCACATACAATAATTACTCCATTCTAAAATGCCAAAAAGGTAATTTAAGAGACTTAAAACTGAAAAGTTTAAGATA GTCACACTGAACTATATTAAAAAATCCACAGGGTGGTTGGAACTAGGCCTTATATTAAAGAGGCTAAAAATTGCAATA AGACCACAGGCTTTAAATATGGCTTTAAACTGTGAAAGGTGAAACTAGAATAAAATCCTATAAATTTAAATCAA AAGAAACAAACTA/GAAATTAAAGTTAATATACAAGAATATGGTGGCCTGGATCTAGTGAACATATAGTAAAGA TAAAACAGAATATTTCTGAAAAATCCTGGAAAATCTTTTGGGCTAACCTGAAAACAGTATATTTGAAACTATTTTTAAA ~ 2000 п. н. - 3 SNP

Динуклеотиды Cp. G - наиболее подвержены вариабельности (p здесь обозначает остаток фосфорной кислоты, связывающий два соседних нуклеотида в цепочке ДНК). CG чаще всего мутируют в динуклеотиды TG или СА. SNP, как правило диаллельны - т. е. встречается 2 варианта. Транзиции – замена нуклеотида на нуклеотид того же класса – т. е. пурина на пурин или пиримидина на пиримидин: Т → С, С → Т, A → G и G → A. Трансверсии – это замены нуклеотида одного класса на нуклеотид другого класса (т. е. пурина на пиримидин и наоборот). Всего возможно восемь различных трансверсий: A → C, A → T, G → C, G → T, C → A, C → G, T → A и T → G. Международный консорциум по SNP дал старт проекту, направленному на систематическое картирование, что позволило к 2001 г. создать карту, содержащую около полутора миллиона SNP.
Полиморфная часть генома
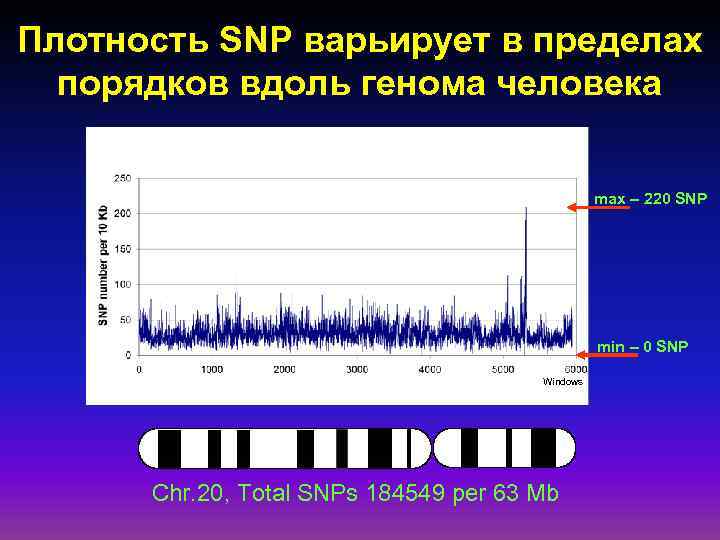
Плотность SNP варьирует в пределах порядков вдоль генома человека max – 220 SNP min – 0 SNP Windows Chr. 20, Total SNPs 184549 per 63 Mb

Группы SNP имеют тенденцию наследоваться совместно в виде гаплотипных блоков с низким уровнем рекомбинации внутри них. Теоретически (8 различных гаплотипов) 1. C/T 2. A/C 3. A/G …C…A…A… …C…A…G… …C…C…A… …C…C…G… …T…A…A… …T…A…G… …T…C…A… …T…C…G… Фактически только 2 гаплотипа …C…A…A… …C…A…G… …C…C…A… …C…C…G… …T…A…A… …T…A…G… …T…C…A… …T…C…G… Гаплотип (сокр. от «гаплоидный генотип» ) — совокупность аллелей на локусах одной хромосомы, обычно наследуемых вместе. Генотип диплоидной особи состоит из двух гаплотипов, расположенных на двух хромосомах, полученных от матери и отца соответственно. 10 млн SNP → 200 тыс. гаплотипов. «Нар. Мар» - 2001 г. .

Типы вариаций последовательности ДНК (мутаций и полиморфизма): - инсерция (вставка) или делеция (выпадение) небольших фрагментов ДНК. -вариабельность по числу тандемных повторов (VNTR - variable number tandem repeat). Минисателлиты - полиморфизм относят к этому типу, если размер повторяющегося элемента находится в пределах от 10 до 100 нуклеотидов. Микросателлиты - вариабельность по числу коротких тандемных повторов STR- short tandem repeat (simple sequence repeat STR polymorphisms, SSRPs). Повторяющийся фрагмент состоит из 2, 3, 4, 5 или 6 нуклеотидов. Это наиболее высокополиморфный тип вариаций. - полиморфизм по наличию или отсутствию мобильных генетических элементов (таких как Alu-повторы, ретротранспозоны семейства LINE, псевдогены).
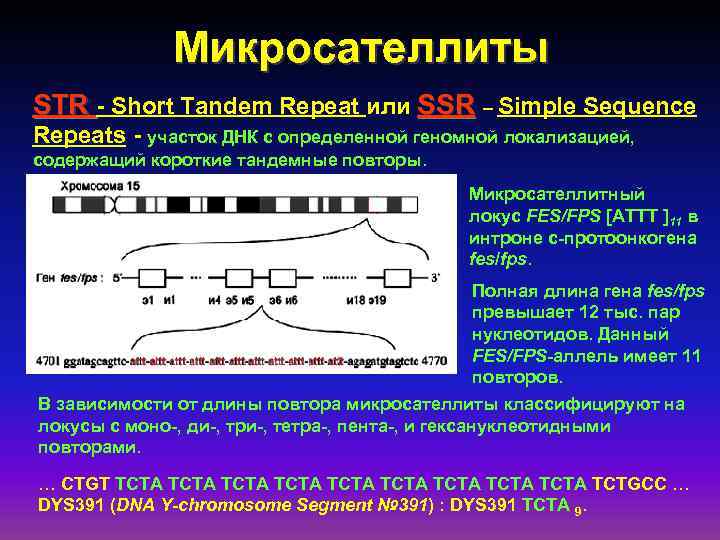
Микросателлиты STR - Short Tandem Repeat или SSR – Simple Sequence Repeats - участок ДНК с определенной геномной локализацией, содержащий короткие тандемные повторы. Микросателлитный локус FES/FPS [ATTT ]11 в интроне с-протоонкогена fes/fps. Полная длина гена fes/fps превышает 12 тыс. пар нуклеотидов. Данный FES/FPS-аллель имеет 11 повторов. В зависимости от длины повтора микросателлиты классифицируют на локусы с моно-, ди-, три-, тетра-, пента-, и гексануклеотидными повторами. … CTGT TCTA TCTA TCTA TCTGCC … DYS 391 (DNA Y-chromosome Segment № 391) : DYS 391 TCTA 9.

Распределение микросателлитных локусов в хромосоме 15 (по данным Marshfield La). Генетическая карта построена по средней частоте рекомбинации у обоих полов. Микросателлиты редко встречаются внутри генов, но если все-таки это происходит, то в результате чаще всего возникает заболевание (например, хорея Гентингтона, вызывающая поражение центральной нервной системы. Поражение обусловлено дисфункцией белка гентингтина вследствие увеличения в нем полиглютаминовой зоны. Это связано с ростом копийности триплетных повторов CAG до 40 -100 в гене, который в норме имеет менее 30 повторов. Другое заболевание – фрагильный Хсиндром – обусловлено возрастанием числа CGGповторов: от нормы, менее 50, до многих сотен копий у больных (Ashley, Warren, 1995).

Темпы возникновения микросателлитных мутаций (μ) гораздо выше, чем частота точковых мутаций у эукариот: точковые – порядка 10– 9– 10– 8 на нуклеотид и порядка 10– 6 на ген, изменение числа повторов: от 10– 6 до 10– 2. Микросателлиты имеют множество аллелей (т. е. могут встречаться варианты с 12 повторами, 22, 31 и т. д. ). К настоящему времени у человека исследовано около десятка тысяч микросателлитных локусов (Dib et al. , 1996; Weber, Broman, 2001; The Mammalian Genotyping Service: http: //research. marshfieldclinic. org/genetics/sets/combo. html). 1992 г. - с помощью микросателлитов была получена генетическая карта с разрешением в 1 с. М (эквивалентно 1 маркеру на каждые 1 Мб ДНК), 1996 г. была опубликована карта с разрешением 0, 5 с. М, включающая дополнительные микросателлитные маркеры. 2002 г. - карта, выпущенная консорциумом de. CODE в Исландии, имела разрешение 0, 2 с. М и включала более 5000 маркеров.
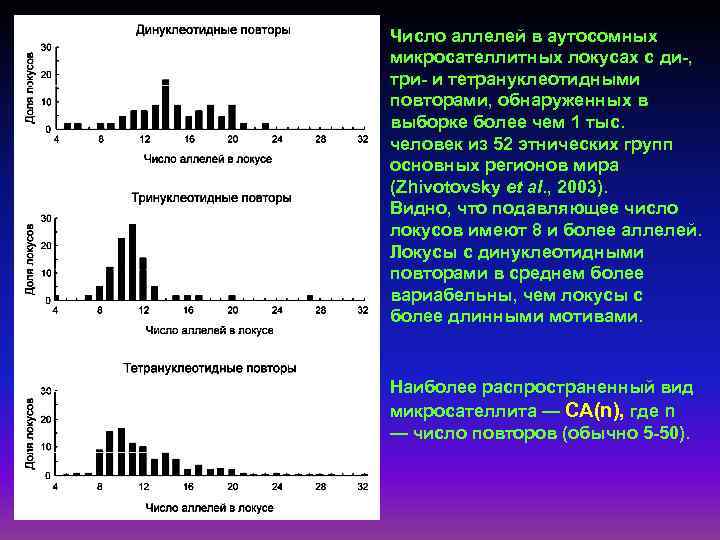
Число аллелей в аутосомных микросателлитных локусах с ди-, три- и тетрануклеотидными повторами, обнаруженных в выборке более чем 1 тыс. человек из 52 этнических групп основных регионов мира (Zhivotovsky et al. , 2003). Видно, что подавляющее число локусов имеют 8 и более аллелей. Локусы с динуклеотидными повторами в среднем более вариабельны, чем локусы с более длинными мотивами. Наиболее распространенный вид микросателлита — СА(n), где n — число повторов (обычно 5 -50).

• STS – сайты, помеченные сиквенсом (Sequence Tagged Site) Существует три основных источника STS-маркеров: 1. Некоторые микросателлитные маркеры были извлечены из генетической карты. Микросателлиты могут использоваться как STS-маркеры лишь в том случае, если помимо повторяющейся последовательности, они содержат какую-нибудь уникальную последовательность. 2. Случайное секвенирование клонов из библиотек к. ДНК дает частичные последовательности к. ДНК, известные как маркеры экспрессируемых последовательностей (ESTs — от англ. Expressed sequence tags). Они могут быть использованы как STS-маркеры в том случае, если соответствуют уникальным генам (а не семействам генов). 3. Остальные STS-маркеры по происхождению являются уникальными последовательностями случайных геномных клонов. • EST - маркеры экспрессируемых последовательностей (Expressed sequence tags).

Молекулярные маркеры, основанные на ПЦР • RAPD-маркеры РАПИД (random RAPD amplified polymorphic DNA = DNA=RAPD-PCR)-случайно амплифицированная полиморфная ДНК • AFLP-маркеры (amplified fragment AFLP length polymorphism) • Микро- и минисателлиты

Вариабельность генома Аллели можно обнаруживать и идентифицировать гибридизацией или ПЦР- анализом и, таким образом, устанавливать, происходила ли рекомбинация в семейной родословной. Допустим локус А в хромосоме может находиться в одном из 10 альтернативных состояний. (Эти состояния, аллели, различимы по их электрофоретической подвижности). Эти состояния различают 10 хромосом или людей с такими хромосомами. Если мы возьмем в анализ еще один локус В (на другой хромосоме) с такими же характеристиками, то по этому локусу мы тоже различим 10 хромосом или людей. А по сочетанию состояний в этих двух локусах различимы 10 х10=102 хромосом. Пять таких локусов позволят различить 105 хромосом. А поскольку хромосом у каждого из нас по паре, то сочетания аллелей этих пяти локусов дают 105 х105 = 1010 вариантов. Это число вариантов больше, чем число людей на земле. На практике при идентификации используют набор аллелей из 13 локусов, хотя и пяти может быть волне достаточно.

Преимущества молекулярных маркеров • Возможность исследования всего генома, а не только последовательностей, кодирующих белки; • Полиморфизм можно выявить на любой стадии развития и в любой части организма; • Многие маркеры имеют кодоминантное стабильное наследование; • Строгая видо- и геноспецифичность.
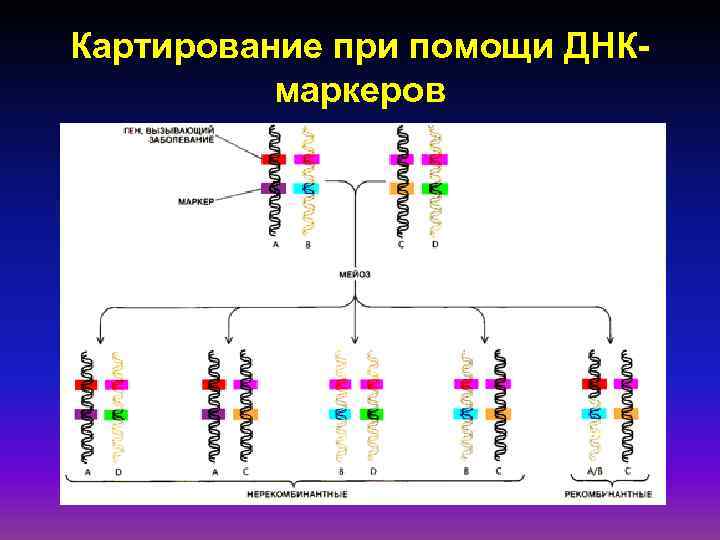
Картирование при помощи ДНКмаркеров
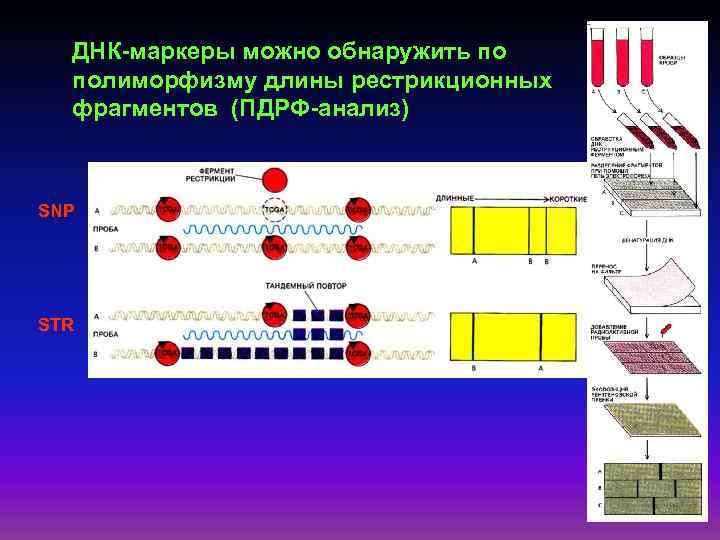
ДНК-маркеры можно обнаружить по полиморфизму длины рестрикционных фрагментов (ПДРФ-анализ) SNP STR
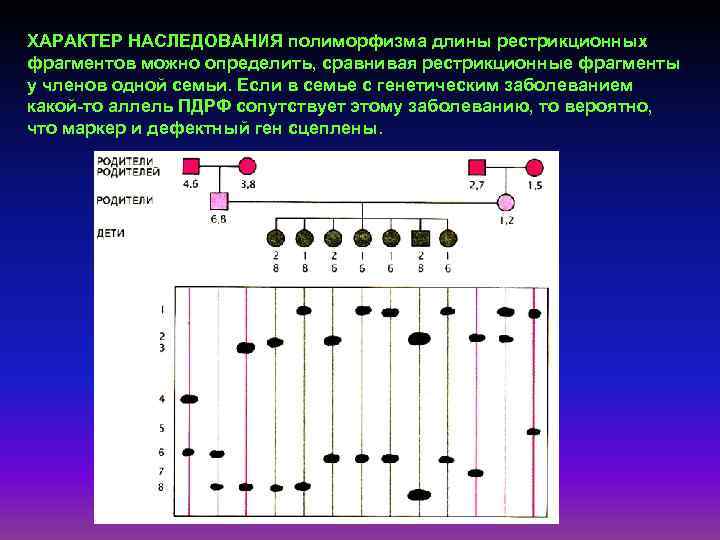
ХАРАКТЕР НАСЛЕДОВАНИЯ полиморфизма длины рестрикционных фрагментов можно определить, сравнивая рестрикционные фрагменты у членов одной семьи. Если в семье с генетическим заболеванием какой-то аллель ПДРФ сопутствует этому заболеванию, то вероятно, что маркер и дефектный ген сцеплены.
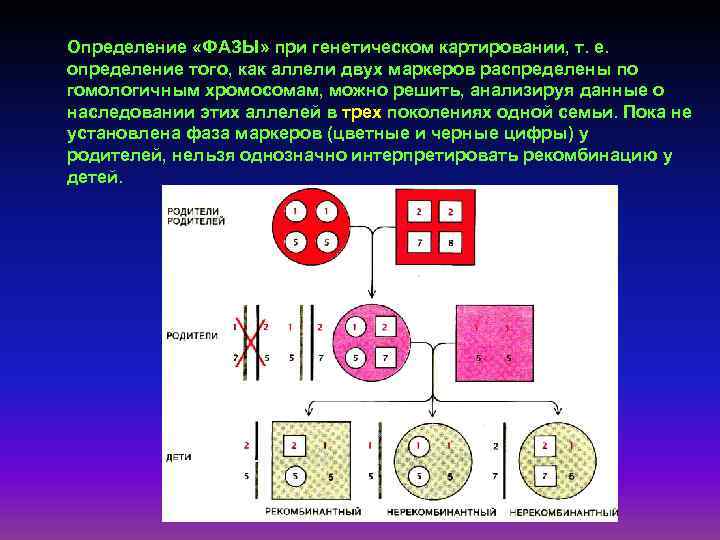
Определение «ФАЗЫ» при генетическом картировании, т. е. определение того, как аллели двух маркеров распределены по гомологичным хромосомам, можно решить, анализируя данные о наследовании этих аллелей в трех поколениях одной семьи. Пока не установлена фаза маркеров (цветные и черные цифры) у родителей, нельзя однозначно интерпретировать рекомбинацию у детей.
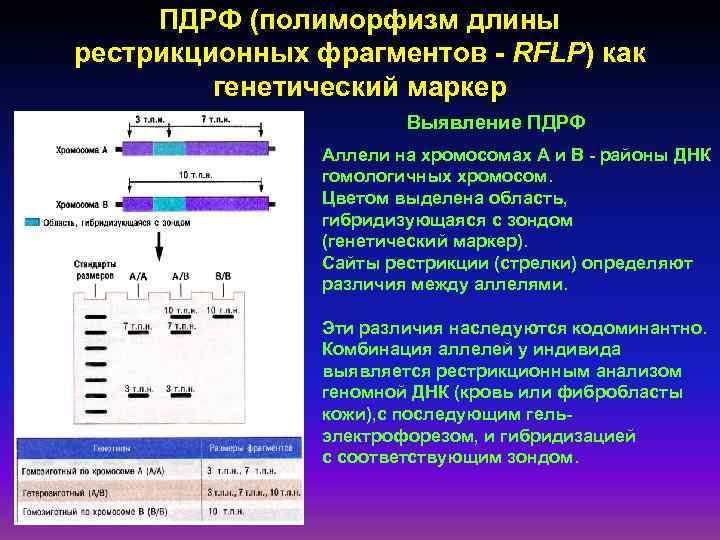
ПДРФ (полиморфизм длины рестрикционных фрагментов - RFLP) как генетический маркер Выявление ПДРФ Аллели на хромосомах А и В - районы ДНК гомологичных хромосом. Цветом выделена область, гибридизующаяся с зондом (генетический маркер). Сайты рестрикции (стрелки) определяют различия между аллелями. Эти различия наследуются кодоминантно. Комбинация аллелей у индивида выявляется рестрикционным анализом геномной ДНК (кровь или фибробласты кожи), с последующим гельэлектрофорезом, и гибридизацией с соответствующим зондом.
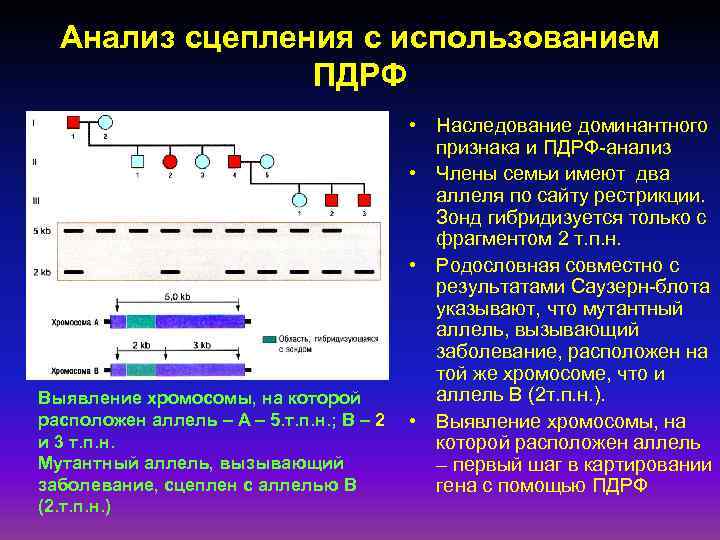
Анализ сцепления с использованием ПДРФ Выявление хромосомы, на которой расположен аллель – А – 5. т. п. н. ; В – 2 и 3 т. п. н. Мутантный аллель, вызывающий заболевание, сцеплен с аллелью В (2. т. п. н. ) • Наследование доминантного признака и ПДРФ-анализ • Члены семьи имеют два аллеля по сайту рестрикции. Зонд гибридизуется только с фрагментом 2 т. п. н. • Родословная совместно с результатами Саузерн-блота указывают, что мутантный аллель, вызывающий заболевание, расположен на той же хромосоме, что и аллель В (2 т. п. н. ). • Выявление хромосомы, на которой расположен аллель – первый шаг в картировании гена с помощью ПДРФ
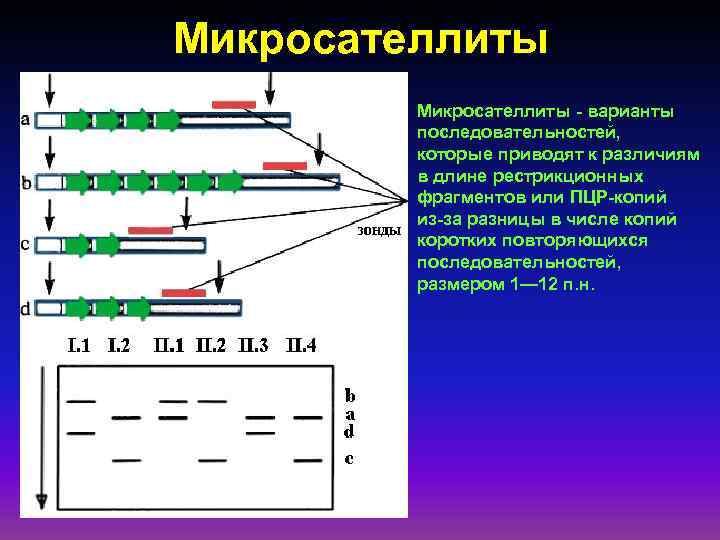
Микросателлиты - варианты последовательностей, которые приводят к различиям в длине рестрикционных фрагментов или ПЦР-копий из-за разницы в числе копий коротких повторяющихся последовательностей, размером 1— 12 п. н.

Использование вариабельности последовательности ДНК - построение генетической карты генома. (STR); - нанесение на генетическую карту новых генов. (муковисцидоз, болезнь Гентингтона, рак груди и многие другие). - Проверка “кандидатных” генов наследственных болезней. Зная о физиологии или биохимии того или иного патологического процесса или состояния можно предположить, что гены, контролирующие этот процесс или биохимический путь являются “кандидатами” на роль генов данной болезни. Проверка того, какие из “кандидатов” действительно являются причиной болезни заключается в выявлении функциональных мутаций у больных: синдром Марфана (ген фибриллина), одна из форм диабета (ген глюкокинаы) и др. - Анализ генетической предрасположенности к мультифакториальным болезням; - ДНК-диагностика наследственных болезней, включая пренатальную диагностику и определение гетерозиготного носительства мутантного гена. -Определение отцовства и идентификация личности в криминалистике; - Исследования происхождения и эволюции популяций человека, генетическая реконструкция расселения человека по земному шару; - и др.

Позиционное клонирование: обратная генетика Сцепленное наследование нейрофиброматоза 1 типа с аллелью ПДРФ, длиной 2, 4 т. п. н. Для всех хромосом человека известен целый набор маркеров ДНК, разбросанных по всей длине хромосомы. И перебирая такие маркеры ДНК и наблюдая, как они наследуются в семьях, вместе с болезнью или без болезни и отдельно не ассоциируя с болезнью, можно наткнуться на такой участок, такой локус генома, где мы действительно увидим, что этот маркер наследуется вместе с болезнью. Гибридизация с зондом р. А 10 -40, соответствующим участку ДНК вблизи центромеры 17 хромосомы Болезнь Альцгеймера (хромосома 14)
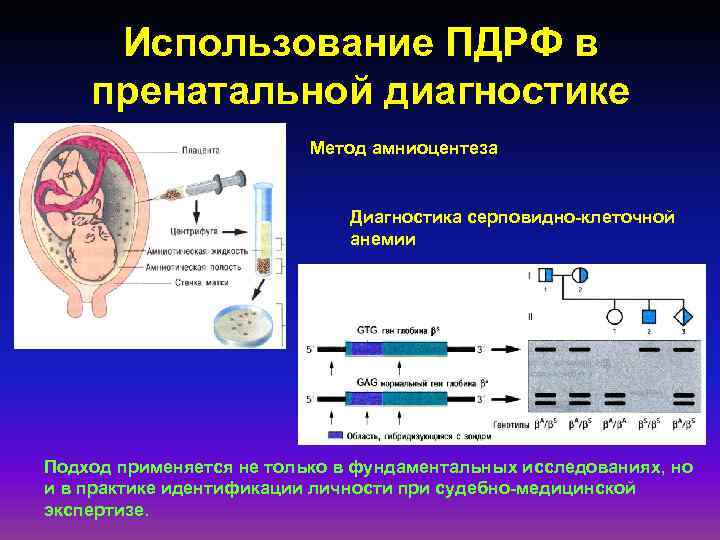
Использование ПДРФ в пренатальной диагностике Метод амниоцентеза Диагностика серповидно-клеточной анемии Подход применяется не только в фундаментальных исследованиях, но и в практике идентификации личности при судебно-медицинской экспертизе.

Определение генотипа с использованием аллель-специфических олигонуклеотидов (ASO) • Ген β-глобина из ДНК, выделенной из клеток крови, амплифицируют ПЦР, гибридизуют с определенным ASO: • А) гибридизация с ASO нормального гена; • Б) гибридизация с ASO к гену мутантного βглобина

Скрининг муковисцидоза (МВ) с использованием аллельспецифических олигонуклеотидов (ASO) Наиболее распространенная мутация CF – трехнуклеотидная делеция Δ 508

Генетический скрининг с использованием ДНК-микрочипов Микрочип содержит зонды одноцепочечной ДНК к нормальному аллелю и мутантным аллелям гена Результат гибридизации выявляется по расположению и окраске флуоресцентных пятен на микрочипе
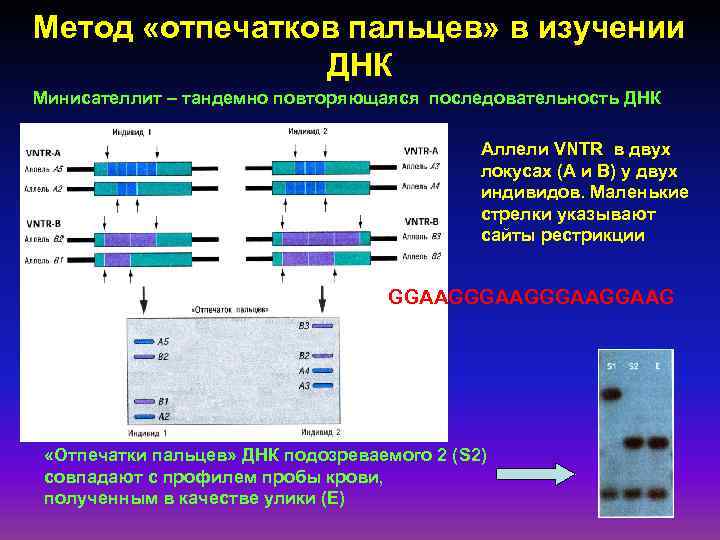
Метод «отпечатков пальцев» в изучении ДНК Минисателлит – тандемно повторяющаяся последовательность ДНК Аллели VNTR в двух локусах (А и В) у двух индивидов. Маленькие стрелки указывают сайты рестрикции GGAAGGGAAG «Отпечатки пальцев» ДНК подозреваемого 2 (S 2) совпадают с профилем пробы крови, полученным в качестве улики (Е)

Аннотирование последовательности • процесс, в котором идентифицируются гены, • их регуляторные области • и функции генов. • также определяют гены, которые не кодируют белки (в частности, гены р. РНК, т. РНК и малой ядерной РНК), • обнаруживают и характеризуют мобильные генетические элементы и • семейства повторов, которые могут также присутствовать в геноме.

Распознавание генов • Поиск открытых рамок считывания • Использование статистики (отличия белоккодирующих и некодирующих областей) • Идентификация начал генов – участки связывания рибосом (прокариоты) • Экзон-интронная структура (эукариоты) • Сравнения с известными генами • Геномные сравнения

Поиск генов, если известен белок: просто
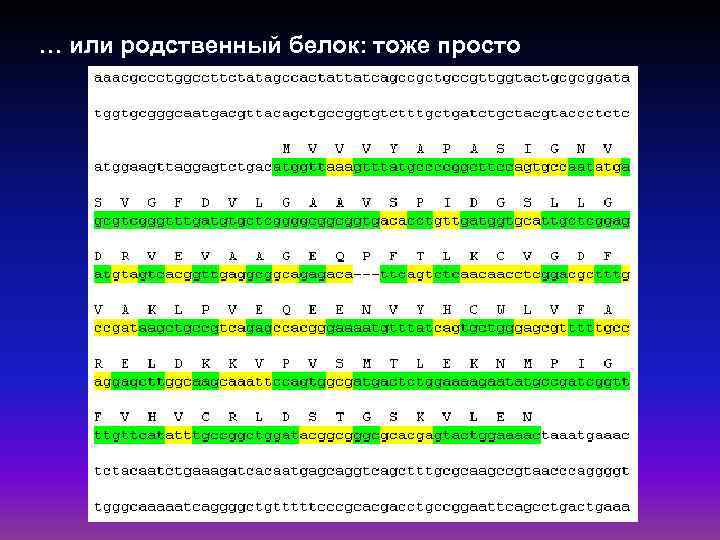
… или родственный белок: тоже просто
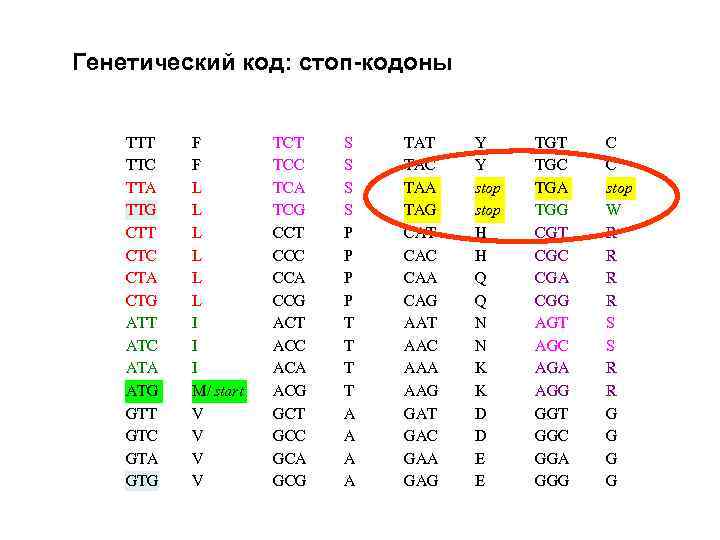
Генетический код: стоп-кодоны TTT TTC TTA TTG CTT CTC CTA CTG ATT ATC ATA ATG GTT GTC GTA GTG F F L L L I I I M/ start V V TCT TCC TCA TCG CCT CCC CCA CCG ACT ACC ACA ACG GCT GCC GCA GCG S S P P T T A A TAT TAC TAA TAG CAT CAC CAA CAG AAT AAC AAA AAG GАT GАC GАA GАG Y Y stop H H Q Q N N K K D D E E TGT TGC TGA TGG CGT CGC CGA CGG AGT AGC AGA AGG GGT GGC GGA GGG C C stop W R R S S R R G G
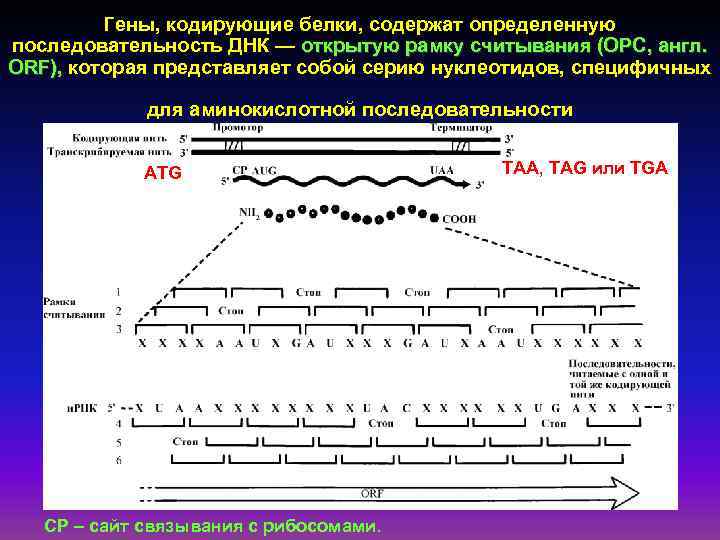
Гены, кодирующие белки, содержат определенную последовательность ДНК — открытую рамку считывания (ОРС, англ. ORF), которая представляет собой серию нуклеотидов, специфичных для аминокислотной последовательности ATG СР – сайт связывания с рибосомами. ТАА, TAG или TGA
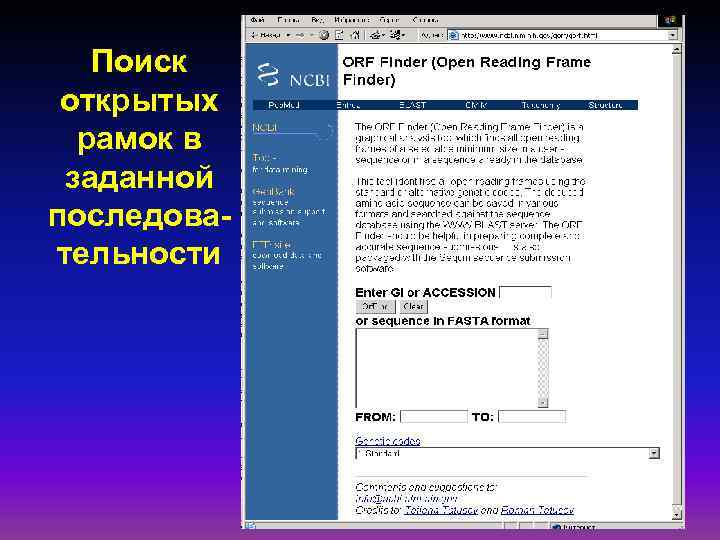
Поиск открытых рамок в заданной последовательности

КЛАССИФИКАЦИЯ ГЕНОВ Pseudomonas aeruginosa Размер генома 6 264 403 п. н. Содержание G+C 66, 6% Кодирующие участки 89, 4% Доверительный ОРС (%) уровень 1 2 372 (6. 7) Гены P. aeruginosa с известной функцией 1059 (19. 0) Строгая гомология генов с известной 3 3 Определение функцией других организмов 1590 (28. 5) Гены с функцией, предполагаемой на основе найденных мотивов или ограниченной гомологии 4 769 (13. 8) 4 1780 (32. 0) 5 Гомологии описанных генов с неизвестной ф-цией Отсутствие гомологии с любым из описанных генов Stover et al. , 2000
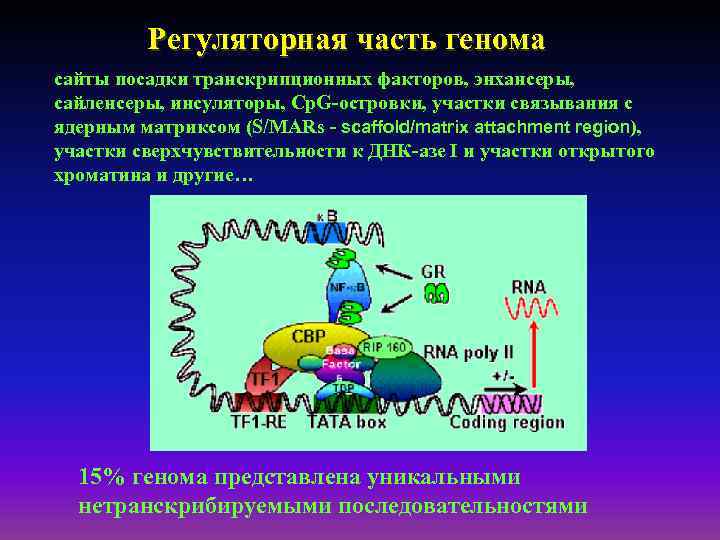
Регуляторная часть генома сайты посадки транскрипционных факторов, энхансеры, сайленсеры, инсуляторы, Cp. G-островки, участки связывания с ядерным матриксом (S/MARs - scaffold/matrix attachment region), участки сверхчувствительности к ДНК-азе I и участки открытого хроматина и другие… 15% генома представлена уникальными нетранскрибируемыми последовательностями

Регуляторные элементы Идентификация и картирование: биоинформатически - крайне ненадежно, в частности, из-за тканеспецифичности этих элементов, и для надежного картирования необходимо применение экспериментальных подходов. экспериментально – • методы селекции S/MARs, • иммунопреципитации хроматина с анализом на микрочипах, технология 3 С (Chromosome Conformation Capture), • подходы с применением метилазы Dam, • методы реконструкции доменной структуры хроматина • и другие методы.

Биоинформатический анализ: TRANSFAC® 7. 0 http: //www. gene-regulation. com Transcription Regulatory Regions Database (TRRD) http: //www. bionet. nsc. ru/t rrd/ Задачи: 1. Статистический анализ последовательностей ДНК; 2. Предсказание функции по последовательности (распознавание генов в последовательности, поиск регуляторных сигналов, предсказание функций белков); 3. Анализ пространственной структуры белков и НК, в том числе предсказание пространственной структуры белка по последовательности; 4. Теория молекулярной эволюции и систематика.
База данных Uni. Gene
Лекция 5 Молекулярно-генетические маркеры.ppt