Лекция 1_чист_мет.pptx
- Количество слайдов: 38
 Курс лекций по дисциплине «Материаловедение» Киприянова Вера Николаевна Доцент кафедры «Материаловедение и автосервис» Куб. ГТУ 1
Курс лекций по дисциплине «Материаловедение» Киприянова Вера Николаевна Доцент кафедры «Материаловедение и автосервис» Куб. ГТУ 1
 Материаловедение – это наука, изучающая строение и свойства материалов и устанавливающая связь между составом, строением и свойствами 2
Материаловедение – это наука, изучающая строение и свойства материалов и устанавливающая связь между составом, строением и свойствами 2
 Основная литература 1. Материаловедение и технология металлов: учеб. для вузов по машиностроит. спец. / [Фетисов Г. П. и др. ]; по ред. Г. П. Фетисова. – Изд. 6 -е, доп. – М. : Высш. шк. , 2008. – 877 с. 2. Материаловедение и технология конструкционных материалов: Учебник/ В. Б. Арзамасов, А. Н. Волчков. – М. : , Академия, 2009. - 448 с. 3. Сильман Г. И. Материаловедение: учеб. пособие для вузов по спец. напр. «Металлургия, машиностроение и материалоперераб. » /. – М. : Академия, 2008. - 335 с. 4. Гуляев А. П. Металловедение. - М. : Металлургия, 1990. - 541 с. 5. Лахтин Ю. М. , Леонтьева В. П. Материаловедение. – М. : Машиностроение, 1990. – 512 с. 3
Основная литература 1. Материаловедение и технология металлов: учеб. для вузов по машиностроит. спец. / [Фетисов Г. П. и др. ]; по ред. Г. П. Фетисова. – Изд. 6 -е, доп. – М. : Высш. шк. , 2008. – 877 с. 2. Материаловедение и технология конструкционных материалов: Учебник/ В. Б. Арзамасов, А. Н. Волчков. – М. : , Академия, 2009. - 448 с. 3. Сильман Г. И. Материаловедение: учеб. пособие для вузов по спец. напр. «Металлургия, машиностроение и материалоперераб. » /. – М. : Академия, 2008. - 335 с. 4. Гуляев А. П. Металловедение. - М. : Металлургия, 1990. - 541 с. 5. Лахтин Ю. М. , Леонтьева В. П. Материаловедение. – М. : Машиностроение, 1990. – 512 с. 3
 Лекция 1 «Строение и свойства чистых металлов» 4
Лекция 1 «Строение и свойства чистых металлов» 4
 Почти 3/4 всех существующих в природе элементов являются металлами. Разумеется не все они находят широкое применение в технике. Некоторые из них встречаются очень редко, они чрезвычайно дороги. Это и редкие - берилий, ванадий, уран, драгоценные – серебро, золото, платина и др. Многие металлы малопригодны к применению , т. к. обладают большой хрупкостью и твердостью ( хром, марганец, сурьма), их используют в качестве добавок к другим металлам. 5
Почти 3/4 всех существующих в природе элементов являются металлами. Разумеется не все они находят широкое применение в технике. Некоторые из них встречаются очень редко, они чрезвычайно дороги. Это и редкие - берилий, ванадий, уран, драгоценные – серебро, золото, платина и др. Многие металлы малопригодны к применению , т. к. обладают большой хрупкостью и твердостью ( хром, марганец, сурьма), их используют в качестве добавок к другим металлам. 5
 Металлы, из которых изготавливают детали машин, приборов, называют конструкционными или машиностроительными. 6
Металлы, из которых изготавливают детали машин, приборов, называют конструкционными или машиностроительными. 6
 Все металлы делятся на 2 большие группы: черные цветные Черные имеют темно-серый цвет, большую плотность, высокую температуру плавления, относительно высокую твердость. Наиболее типичным представителем является железо. Цветные имеют характерную окраску – красную, желтую, белую. Они пластичны, обладают малой твердостью, имеют низкую температуру плавления. Типичным представителем является медь. 7
Все металлы делятся на 2 большие группы: черные цветные Черные имеют темно-серый цвет, большую плотность, высокую температуру плавления, относительно высокую твердость. Наиболее типичным представителем является железо. Цветные имеют характерную окраску – красную, желтую, белую. Они пластичны, обладают малой твердостью, имеют низкую температуру плавления. Типичным представителем является медь. 7
 Черные металлы согласно классификации, предложенной А. П. Гуляевым подразделяются: Железные металлы – железо, кобальт, никель (ферромагнетики) и близкий к ним марганец Тугоплавкие, с температурой плавления больше, чем у железа (1539 о) Урановые ( актиниды) Редкоземельные металлы (РЗМ), лантан, церий и др. Щелочноземельные 8
Черные металлы согласно классификации, предложенной А. П. Гуляевым подразделяются: Железные металлы – железо, кобальт, никель (ферромагнетики) и близкий к ним марганец Тугоплавкие, с температурой плавления больше, чем у железа (1539 о) Урановые ( актиниды) Редкоземельные металлы (РЗМ), лантан, церий и др. Щелочноземельные 8
 Цветные металлы подразделяются: Легкие металлы – берилий, магний, алюминий, с плотностью меньше 5 г/смз Благородные – серебро, золото, платина и и др. к ним может быть отнесена и полу благородная медь, обладающие устойчивостью перед коррозией. Легкоплавкие – цинк, кадмий, ртуть, олово , с температурой плавления меньше 1000 о. 9
Цветные металлы подразделяются: Легкие металлы – берилий, магний, алюминий, с плотностью меньше 5 г/смз Благородные – серебро, золото, платина и и др. к ним может быть отнесена и полу благородная медь, обладающие устойчивостью перед коррозией. Легкоплавкие – цинк, кадмий, ртуть, олово , с температурой плавления меньше 1000 о. 9
 Что такое металл? На этот вопрос М. В. Ломоносов отвечал так: «Металлы суть светлые тела, которые ковать можно» . Это простейшее определение не потеряло своего значения и сегодня. Металлы можно охарактеризовать такими свойствами: • высокая теплопроводность; • электропроводность, которая с понижением температуры повышается, причем некоторые металлы имеют сверхпроводимость; • пластичность (см. «ковать можно» ); • металлический блеск (см. «суть светлые тела» ); • магнитные свойства; • постоянная температура кристаллизации. 10
Что такое металл? На этот вопрос М. В. Ломоносов отвечал так: «Металлы суть светлые тела, которые ковать можно» . Это простейшее определение не потеряло своего значения и сегодня. Металлы можно охарактеризовать такими свойствами: • высокая теплопроводность; • электропроводность, которая с понижением температуры повышается, причем некоторые металлы имеют сверхпроводимость; • пластичность (см. «ковать можно» ); • металлический блеск (см. «суть светлые тела» ); • магнитные свойства; • постоянная температура кристаллизации. 10
 Все металлы – тела кристаллические В природе существует два типа построения твердых тел их атомов – тела могут быть кристаллические и аморфные. Они отличаются по своим свойствам. 11
Все металлы – тела кристаллические В природе существует два типа построения твердых тел их атомов – тела могут быть кристаллические и аморфные. Они отличаются по своим свойствам. 11
 Аморфные тела – это такие тела, в которых атомы расположены беспорядочно, хаотически. В отличие от жидкостей они имеют пониженную подвижность частиц. Примерами аморфных тел могут служить стекло, смолы, воск. 12
Аморфные тела – это такие тела, в которых атомы расположены беспорядочно, хаотически. В отличие от жидкостей они имеют пониженную подвижность частиц. Примерами аморфных тел могут служить стекло, смолы, воск. 12
 Кристаллические тела – это такие тела, в которых атомы расположены в строго определенном порядке, в строго определенной последовательности. Кристаллические тела остаются твердыми, т. е. сохраняют приданную им форму до вполне определенной температуры, при которой он переходит в жидкое состояние. 13
Кристаллические тела – это такие тела, в которых атомы расположены в строго определенном порядке, в строго определенной последовательности. Кристаллические тела остаются твердыми, т. е. сохраняют приданную им форму до вполне определенной температуры, при которой он переходит в жидкое состояние. 13
 Все металлы – тела кристаллические Свойства кристаллов зависят от электронного строения атомов и характера взаимодействия их в кристалле, от пространственного расположения элементарных частиц, химического состава, размера и формы кристаллов. 14
Все металлы – тела кристаллические Свойства кристаллов зависят от электронного строения атомов и характера взаимодействия их в кристалле, от пространственного расположения элементарных частиц, химического состава, размера и формы кристаллов. 14
 Все эти детали строения кристаллов описывает понятие – СТРУКТУРА В зависимости от размеров структурных составляющих и методов их выявления различают: тонкую структуру – описывает расположение частиц в кристалле и электронов в атоме. Изучается дифракционными методами – рентгенографией и т. д. микроструктуру –состоящую из мелких кристалликов, зерен, ее наблюдают с помощь. оптических или электронных микроскопов. макроструктуру – изучаемую невооруженным глазом или при небольших увеличениях. Выявляет изломы, раковины, поры. 15
Все эти детали строения кристаллов описывает понятие – СТРУКТУРА В зависимости от размеров структурных составляющих и методов их выявления различают: тонкую структуру – описывает расположение частиц в кристалле и электронов в атоме. Изучается дифракционными методами – рентгенографией и т. д. микроструктуру –состоящую из мелких кристалликов, зерен, ее наблюдают с помощь. оптических или электронных микроскопов. макроструктуру – изучаемую невооруженным глазом или при небольших увеличениях. Выявляет изломы, раковины, поры. 15
 Под атомно-кристаллической структурой металлов понимают взаимное расположение атомов, существующее в кристалле. 16
Под атомно-кристаллической структурой металлов понимают взаимное расположение атомов, существующее в кристалле. 16
 Кристалл состоит из атомов (ионов), расположенных в определенном порядке, который периодически повторяется в трех измерениях. Для описания атомно-кристаллической структуры пользуются понятием пространственной или кристаллической решетки. Кристаллическая решетка представляет собой воображаемую пространственную сетку, в узлах которой расположены атомы. 17
Кристалл состоит из атомов (ионов), расположенных в определенном порядке, который периодически повторяется в трех измерениях. Для описания атомно-кристаллической структуры пользуются понятием пространственной или кристаллической решетки. Кристаллическая решетка представляет собой воображаемую пространственную сетку, в узлах которой расположены атомы. 17
 Кристаллическую решетку можно построить, выбрав для этого «строительный блок» , многократно повторяя его в трех измерениях. Такая строительная единица в металловедении называется элементарной ячейкой. 18
Кристаллическую решетку можно построить, выбрав для этого «строительный блок» , многократно повторяя его в трех измерениях. Такая строительная единица в металловедении называется элементарной ячейкой. 18
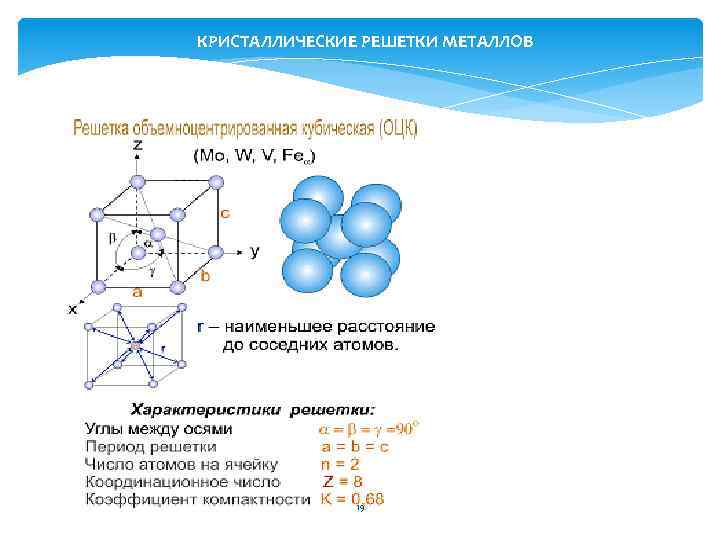 КРИСТАЛЛИЧЕСКИЕ РЕШЕТКИ МЕТАЛЛОВ 19
КРИСТАЛЛИЧЕСКИЕ РЕШЕТКИ МЕТАЛЛОВ 19
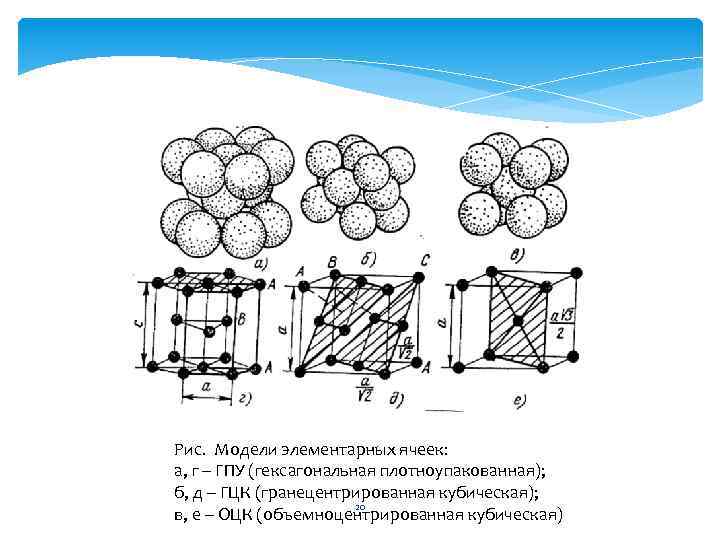 Рис. Модели элементарных ячеек: а, г – ГПУ (гексагональная плотноупакованная); б, д – ГЦК (гранецентрированная кубическая); 20 в, е – ОЦК (объемноцентрированная кубическая)
Рис. Модели элементарных ячеек: а, г – ГПУ (гексагональная плотноупакованная); б, д – ГЦК (гранецентрированная кубическая); 20 в, е – ОЦК (объемноцентрированная кубическая)
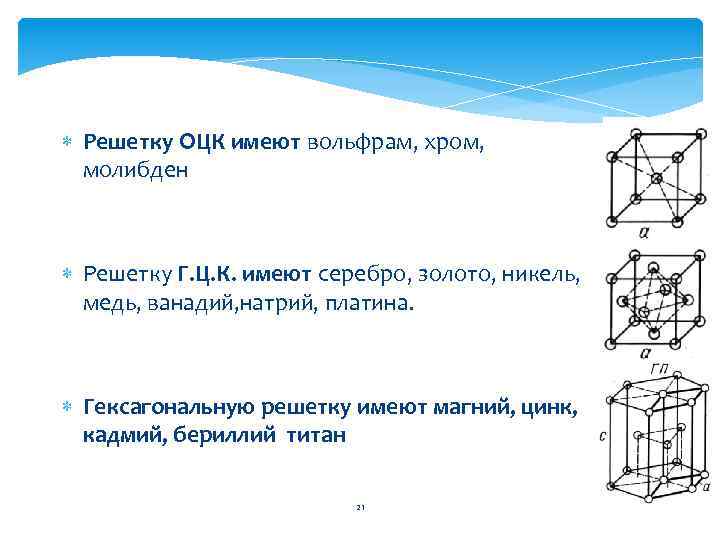 Решетку ОЦК имеют вольфрам, хром, молибден Решетку Г. Ц. К. имеют серебро, золото, никель, медь, ванадий, натрий, платина. Гексагональную решетку имеют магний, цинк, кадмий, бериллий титан 21
Решетку ОЦК имеют вольфрам, хром, молибден Решетку Г. Ц. К. имеют серебро, золото, никель, медь, ванадий, натрий, платина. Гексагональную решетку имеют магний, цинк, кадмий, бериллий титан 21
 Размеры элементарной ячейки кристаллической решетки оценивают отрезки а, в, с. Их называют периодами решетки. Период решетки измеряется в нанометрах (нм) 1 нм = 10 -9 см = 0, 1 А Период решетки металлов находится в пределах от 0, 1 до 0, 7 нм 22
Размеры элементарной ячейки кристаллической решетки оценивают отрезки а, в, с. Их называют периодами решетки. Период решетки измеряется в нанометрах (нм) 1 нм = 10 -9 см = 0, 1 А Период решетки металлов находится в пределах от 0, 1 до 0, 7 нм 22
 Плотность кристаллической решетки- объема, занятого атомами, характеризуется координационным числом – К. К – число атомов, находящихся на равном и наименьшем расстоянии от данного атома. Чем выше К, тем больше плотность упаковки. Для ОЦК К=8 для гцк к=12 для ГПУ К=12 23
Плотность кристаллической решетки- объема, занятого атомами, характеризуется координационным числом – К. К – число атомов, находящихся на равном и наименьшем расстоянии от данного атома. Чем выше К, тем больше плотность упаковки. Для ОЦК К=8 для гцк к=12 для ГПУ К=12 23
 Полиморфизм (аллотропия) – способность металла принимать различные кристаллические формы при разных температурах 24
Полиморфизм (аллотропия) – способность металла принимать различные кристаллические формы при разных температурах 24
 Ряд металлов (железо, марганец, титан и др. ) в зависимости от температуры и давления могут существовать в состояниях с различными кристаллическими решетками – это явление называется – полиморфизмом или аллотропия. 25
Ряд металлов (железо, марганец, титан и др. ) в зависимости от температуры и давления могут существовать в состояниях с различными кристаллическими решетками – это явление называется – полиморфизмом или аллотропия. 25
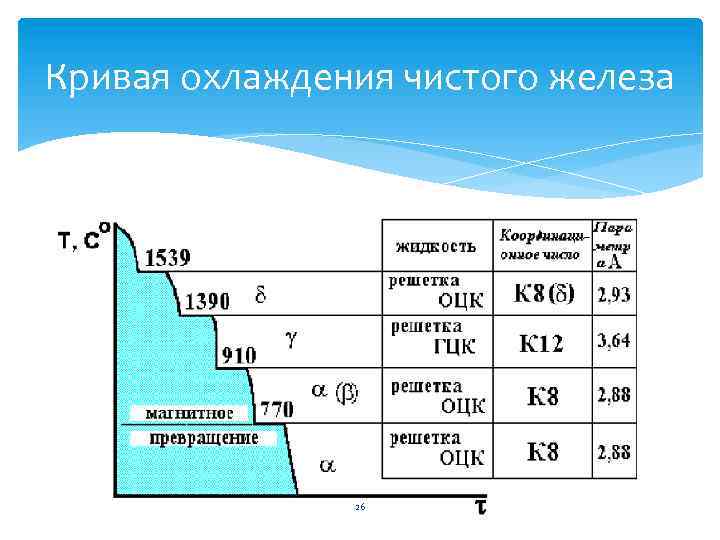 Кривая охлаждения чистого железа 26
Кривая охлаждения чистого железа 26
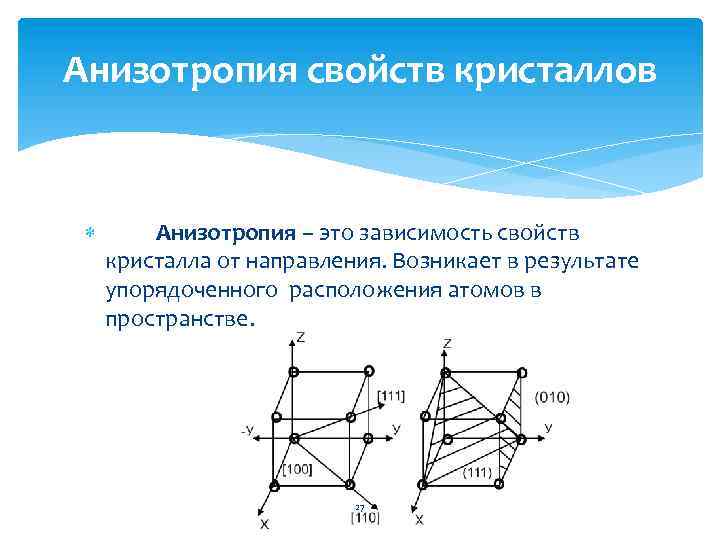 Анизотропия свойств кристаллов Анизотропия – это зависимость свойств кристалла от направления. Возникает в результате упорядоченного расположения атомов в пространстве. 27
Анизотропия свойств кристаллов Анизотропия – это зависимость свойств кристалла от направления. Возникает в результате упорядоченного расположения атомов в пространстве. 27
 Свойства кристаллов определяются взаимодействием атомов В кристалле расстояния между атомами в различных кристаллографических плоскостях различны, поэтому различны и свойства. Например, прочность и пластичность монокристалла меди изменяются в зависимости от направления 180 -350 Мпа, и 10 -50 %. Для поликристалла прочность 250 Мпа, пластичность 40%. 28
Свойства кристаллов определяются взаимодействием атомов В кристалле расстояния между атомами в различных кристаллографических плоскостях различны, поэтому различны и свойства. Например, прочность и пластичность монокристалла меди изменяются в зависимости от направления 180 -350 Мпа, и 10 -50 %. Для поликристалла прочность 250 Мпа, пластичность 40%. 28
 В природе кристаллические тела – поликристаллы, т. е. состоят из множества мелких различно ориентированных кристаллов. В этом случае анизотропии нет, т. к. среднестатистическое расстояние между атомами по всем направлениям оказывается примерно одинаковым. В связи с этим поликристаллические тела считают квазиизотропными (мнимо). Все аморфные тела – изотропны - свойства у них одинаковы во всех направлениях 29
В природе кристаллические тела – поликристаллы, т. е. состоят из множества мелких различно ориентированных кристаллов. В этом случае анизотропии нет, т. к. среднестатистическое расстояние между атомами по всем направлениям оказывается примерно одинаковым. В связи с этим поликристаллические тела считают квазиизотропными (мнимо). Все аморфные тела – изотропны - свойства у них одинаковы во всех направлениях 29
 ДЕФЕКТЫ КРИСТАЛЛОВ Строение реальных кристаллов отличается от идеальных. В реальных кристаллах всегда содержатся дефекты, которые подразделяются на точечные, линейные, поверхностные и объемные. Дефекты имеют различные размеры. У точечных размеры близки к атомным, у линейных длина на несколько порядков больше ширины, объемные дефекты (поры, трещины) могут иметь макроскопические размеры. 30
ДЕФЕКТЫ КРИСТАЛЛОВ Строение реальных кристаллов отличается от идеальных. В реальных кристаллах всегда содержатся дефекты, которые подразделяются на точечные, линейные, поверхностные и объемные. Дефекты имеют различные размеры. У точечных размеры близки к атомным, у линейных длина на несколько порядков больше ширины, объемные дефекты (поры, трещины) могут иметь макроскопические размеры. 30
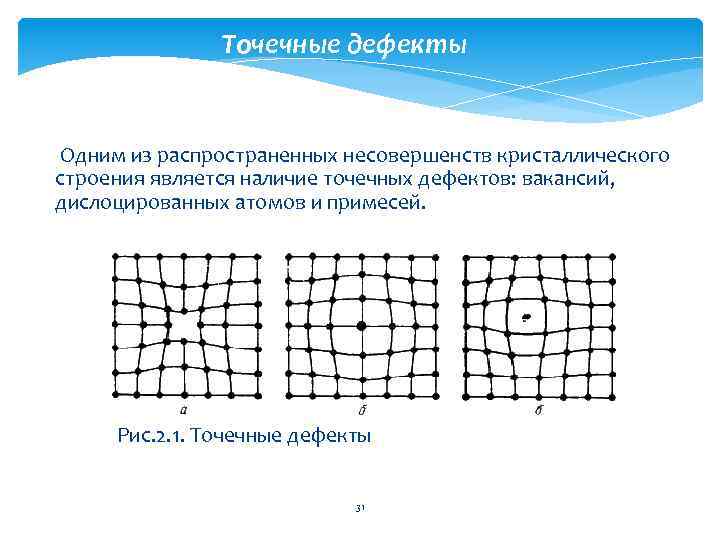 Точечные дефекты Одним из распространенных несовершенств кристаллического строения является наличие точечных дефектов: вакансий, дислоцированных атомов и примесей. Рис. 2. 1. Точечные дефекты 31
Точечные дефекты Одним из распространенных несовершенств кристаллического строения является наличие точечных дефектов: вакансий, дислоцированных атомов и примесей. Рис. 2. 1. Точечные дефекты 31
 Линейные дефекты Основными линейными дефектами являются дислокации. Априорное представление о дислокациях впервые использовано в 1934 году Орованом и Тейлером при исследовании пластической деформации кристаллических материалов, для объяснения большой разницы между практической и теоретической прочностью металла. 32
Линейные дефекты Основными линейными дефектами являются дислокации. Априорное представление о дислокациях впервые использовано в 1934 году Орованом и Тейлером при исследовании пластической деформации кристаллических материалов, для объяснения большой разницы между практической и теоретической прочностью металла. 32
 Дислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей. 33
Дислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей. 33
 Простейшие виды дислокаций – краевые и винтовые. Краевая дислокация представляет собой линию, вдоль которой обрывается внутри кристалла край “лишней“ полуплоскости Рис. 2. 2. Краевая дислокация (а) и механизм ее образования (б) 34
Простейшие виды дислокаций – краевые и винтовые. Краевая дислокация представляет собой линию, вдоль которой обрывается внутри кристалла край “лишней“ полуплоскости Рис. 2. 2. Краевая дислокация (а) и механизм ее образования (б) 34
 Винтовая дислокация Другой тип дислокаций был описан Бюргерсом, и получил название винтовая дислокация 35
Винтовая дислокация Другой тип дислокаций был описан Бюргерсом, и получил название винтовая дислокация 35
 Плотность дислокаций Свойства кристаллов зависят от количества дефектов, которые формируют понятие «плотность дислокаций» . Плотность дислокации – это суммарная длина всех линий дислокации в одном кубическом сантиметре кристалла. 36
Плотность дислокаций Свойства кристаллов зависят от количества дефектов, которые формируют понятие «плотность дислокаций» . Плотность дислокации – это суммарная длина всех линий дислокации в одном кубическом сантиметре кристалла. 36
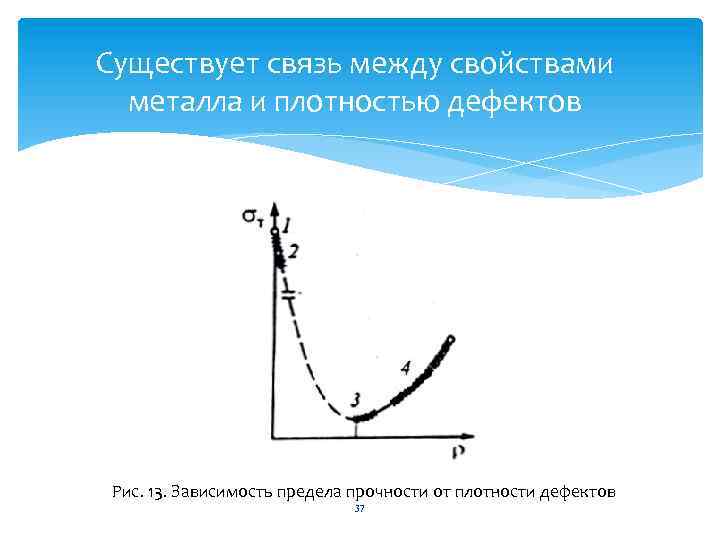 Существует связь между свойствами металла и плотностью дефектов Рис. 13. Зависимость предела прочности от плотности дефектов 37
Существует связь между свойствами металла и плотностью дефектов Рис. 13. Зависимость предела прочности от плотности дефектов 37
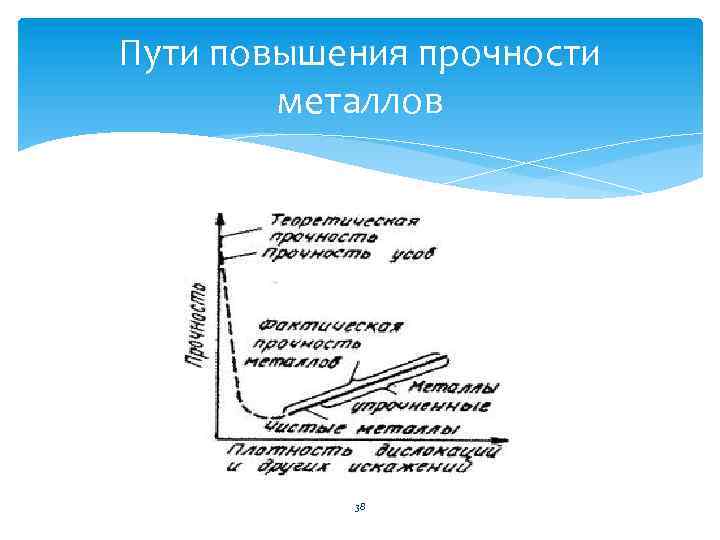 Пути повышения прочности металлов 38
Пути повышения прочности металлов 38


