Кунская Екатерина, Лысковская Мария 10 «Е»
Кунская Екатерина, Лысковская Мария 10 «Е»
 Галоге ны (от греч. ἁλός — соль и γένος — рождение, происхождение) — химические элементы 17 -й группы переодической таблицы химических элементов Д. И. Менделеева, а именно фтор F, хлор Cl, бром Br, йод I и астат As, а также (формально) искусственный элемент унунсептий Uus.
Галоге ны (от греч. ἁλός — соль и γένος — рождение, происхождение) — химические элементы 17 -й группы переодической таблицы химических элементов Д. И. Менделеева, а именно фтор F, хлор Cl, бром Br, йод I и астат As, а также (формально) искусственный элемент унунсептий Uus.
 Все галогены — неметаллы. На внешнем энергетическом уровне 7 электронов, являются сильными окислителями. При взаимодействии с металлами возникает ионная связь, и образуются соли. Галогены, (кроме F) при взаимодействии с более электроотрицательными элементами, могут проявлять и восстановительные свойства вплоть до высшей степени окисления +7.
Все галогены — неметаллы. На внешнем энергетическом уровне 7 электронов, являются сильными окислителями. При взаимодействии с металлами возникает ионная связь, и образуются соли. Галогены, (кроме F) при взаимодействии с более электроотрицательными элементами, могут проявлять и восстановительные свойства вплоть до высшей степени окисления +7.
 Общая электронная конфигурация внешнего энергетического уровня n. S 2 n. P 5.
Общая электронная конфигурация внешнего энергетического уровня n. S 2 n. P 5.
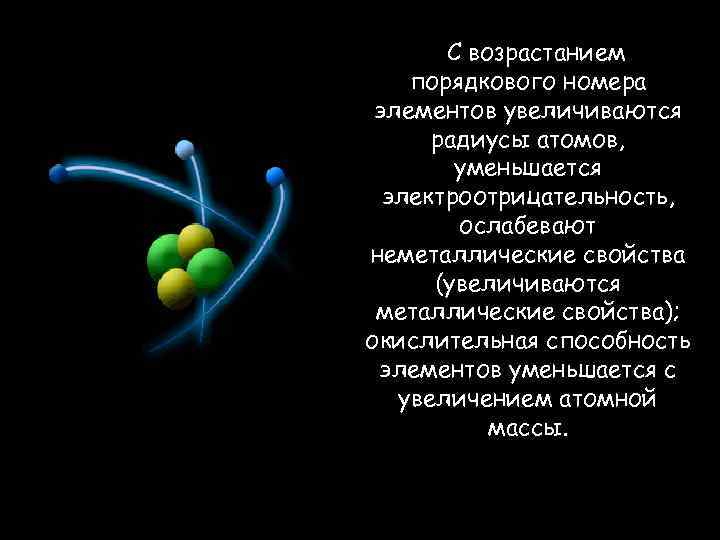 С возрастанием порядкового номера элементов увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства (увеличиваются металлические свойства); окислительная способность элементов уменьшается с увеличением атомной массы.
С возрастанием порядкового номера элементов увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства (увеличиваются металлические свойства); окислительная способность элементов уменьшается с увеличением атомной массы.
 Молекулы галогенов состоят из двух атомов. (F 2, Cl 2, Br 2, I 2 )
Молекулы галогенов состоят из двух атомов. (F 2, Cl 2, Br 2, I 2 )
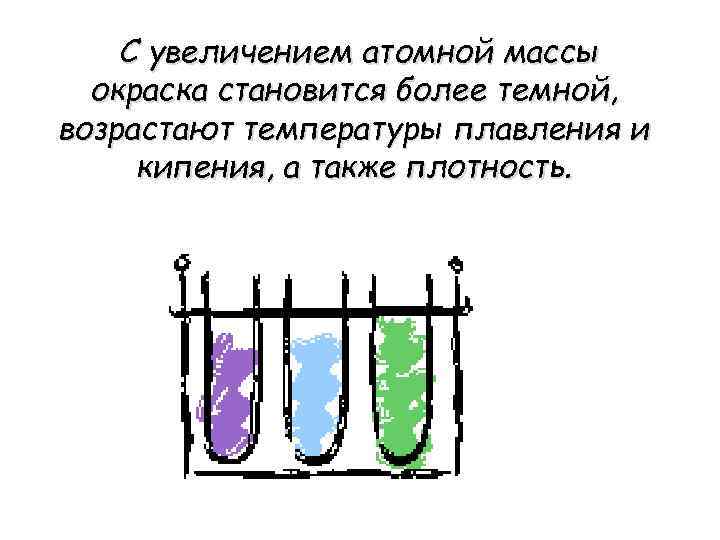 С увеличением атомной массы окраска становится более темной, возрастают температуры плавления и кипения, а также плотность.
С увеличением атомной массы окраска становится более темной, возрастают температуры плавления и кипения, а также плотность.

 Фтор —атомный номер 9. Обозначается символом F. Фтор — чрезвычайно химически активный неметалл и самый сильный окислитель, является самым лёгким элементом из группы галогенов. Простое вещество фтор при нормальных условиях — двухатомный газ (формула F 2) светло – зеленого цвета с резким запахом.
Фтор —атомный номер 9. Обозначается символом F. Фтор — чрезвычайно химически активный неметалл и самый сильный окислитель, является самым лёгким элементом из группы галогенов. Простое вещество фтор при нормальных условиях — двухатомный газ (формула F 2) светло – зеленого цвета с резким запахом.
 Распространение в природе Почва - 0, 02%, Зубы человека - 0, 01%. В природе значимые скопления фтора содержатся в основном в минерале флюорите (Ca. F 2), содержащем по массе 51, 2 % Ca и 48, 8 % F. Содержанием в почве фтор обязан вулканическим газам, за счёт того, что в их состав обычно входит большое количество фтороводорода.
Распространение в природе Почва - 0, 02%, Зубы человека - 0, 01%. В природе значимые скопления фтора содержатся в основном в минерале флюорите (Ca. F 2), содержащем по массе 51, 2 % Ca и 48, 8 % F. Содержанием в почве фтор обязан вулканическим газам, за счёт того, что в их состав обычно входит большое количество фтороводорода.
 Получение Лабораторный метод Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K 2 Mn. F 6 и Sb. F 5 при 150 °C: 2 K 2 Mn. F 6 + 4 Sb. F 5 = 4 KSb. F 6 + 2 Mn. F 3 + F 2 (Этот метод не имеет практического применения)
Получение Лабораторный метод Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K 2 Mn. F 6 и Sb. F 5 при 150 °C: 2 K 2 Mn. F 6 + 4 Sb. F 5 = 4 KSb. F 6 + 2 Mn. F 3 + F 2 (Этот метод не имеет практического применения)
 Также для лабораторного получения фтора можно использовать нагрев фторида кобальта (III) до 300 °С: 2 Со. F 3 = 2 Co. F 2 + F 2
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта (III) до 300 °С: 2 Со. F 3 = 2 Co. F 2 + F 2
 Промышленный метод Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF· 3 HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40— 41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Промышленный метод Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF· 3 HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40— 41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
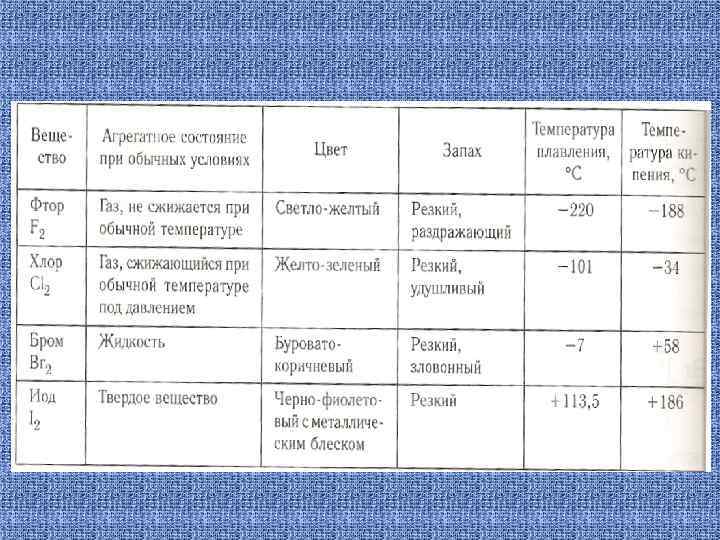
 Физические свойства светло – зеленого цвета газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит. Фтор имеет аномально низкую температуру кипения (плавления): t°пл. (°С)= -219, t°кип. (°С)= -183. Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов.
Физические свойства светло – зеленого цвета газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит. Фтор имеет аномально низкую температуру кипения (плавления): t°пл. (°С)= -219, t°кип. (°С)= -183. Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов.
 Химические свойства • Самый активный неметалл, бурно взаимодействует почти со всеми веществами. • К фтору при комнатной температуре устойчивы некоторые металлы за счет образования плотной плёнки фторида, тормозящей реакцию со фтором — Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до − 252°C). В атмосфере фтора горят даже вода и платина: 2 F 2 + 2 H 2 O = 4 F + O 2 Pt + 2 F 2 =Pt. F 4 • К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например: 2 Co. F 3 = 2 Co. F 2 + F 2 2 Mn. F 4 =2 Mn. F 3 + F 2 • Фтор также способен окислять в электрическом разряде кислород, образуя фторид кислорода OF 2 и диоксидифторид O 2 F 2. • Во всех соединениях фтор проявляет степень окисления − 1.
Химические свойства • Самый активный неметалл, бурно взаимодействует почти со всеми веществами. • К фтору при комнатной температуре устойчивы некоторые металлы за счет образования плотной плёнки фторида, тормозящей реакцию со фтором — Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до − 252°C). В атмосфере фтора горят даже вода и платина: 2 F 2 + 2 H 2 O = 4 F + O 2 Pt + 2 F 2 =Pt. F 4 • К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например: 2 Co. F 3 = 2 Co. F 2 + F 2 2 Mn. F 4 =2 Mn. F 3 + F 2 • Фтор также способен окислять в электрическом разряде кислород, образуя фторид кислорода OF 2 и диоксидифторид O 2 F 2. • Во всех соединениях фтор проявляет степень окисления − 1.
 Применение • Применение в химии: Газообразный фтор используется для получения: гексафторида урана UF 6 из UF 4, применяемого для разделения изотопов урана для ядерной промышленности. трёхфтористого хлора Cl. F 3 — фторирующий агент и мощный окислитель ракетного топлива шестифтористой серы SF 6 — газообразный изолятор в электротехнической промышленности фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами фреонов — хороших хладагентов тефлонов — химически инертных полимеров гексафтороалюмината натрия — для последующего получения алюминия электролизом различных соединений фтора. • Ракетная техника: Соединения фтора и сам фтор применяются в ракетной технике как окислители ракетного топлива. • Применение в медицинe: Фторированные углеводороды (напр. перфтордекалин) применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре (фторотан, фторурацил и др. ).
Применение • Применение в химии: Газообразный фтор используется для получения: гексафторида урана UF 6 из UF 4, применяемого для разделения изотопов урана для ядерной промышленности. трёхфтористого хлора Cl. F 3 — фторирующий агент и мощный окислитель ракетного топлива шестифтористой серы SF 6 — газообразный изолятор в электротехнической промышленности фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами фреонов — хороших хладагентов тефлонов — химически инертных полимеров гексафтороалюмината натрия — для последующего получения алюминия электролизом различных соединений фтора. • Ракетная техника: Соединения фтора и сам фтор применяются в ракетной технике как окислители ракетного топлива. • Применение в медицинe: Фторированные углеводороды (напр. перфтордекалин) применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре (фторотан, фторурацил и др. ).
 Бром —атомный номер 35. Обозначается символом Br. Простое вещество бром при нормальных условиях — тяжёлая жидкость красно-бурого цвета с сильным неприятным запахом. Молекула брома двухатомна (формула Br 2).
Бром —атомный номер 35. Обозначается символом Br. Простое вещество бром при нормальных условиях — тяжёлая жидкость красно-бурого цвета с сильным неприятным запахом. Молекула брома двухатомна (формула Br 2).
 В качестве исходного сырья для производства брома служат: 1. Морская вода (65 мг/л) 2. Рассолы соляных озёр 3. Щёлок калийных производств 4. Подземные воды нефтяных и газовых месторождений Получение: • Бром получают химическим путём из рассола Br−: Cl 2 + 2 Br - = 2 Cl- + Br 2
В качестве исходного сырья для производства брома служат: 1. Морская вода (65 мг/л) 2. Рассолы соляных озёр 3. Щёлок калийных производств 4. Подземные воды нефтяных и газовых месторождений Получение: • Бром получают химическим путём из рассола Br−: Cl 2 + 2 Br - = 2 Cl- + Br 2
 Физические свойства При обычных условиях бром — красно-бурая жидкость с резким неприятным запахом, ядовит, при соприкосновении с кожей образуются ожоги. Бром — одно из двух простых веществ (и единственное из неметаллов), наряду со ртутью, которое при комнатной температуре является жидким. t°пл. (°С)= -8, t°кип. (°С)= 58
Физические свойства При обычных условиях бром — красно-бурая жидкость с резким неприятным запахом, ядовит, при соприкосновении с кожей образуются ожоги. Бром — одно из двух простых веществ (и единственное из неметаллов), наряду со ртутью, которое при комнатной температуре является жидким. t°пл. (°С)= -8, t°кип. (°С)= 58
 Природный бром состоит из двух стабильных изотопов 79 Br (50, 56 %) и 81 Br (49, 44 %). Искусственно получены многочисленные радиоактивные изотопы брома.
Природный бром состоит из двух стабильных изотопов 79 Br (50, 56 %) и 81 Br (49, 44 %). Искусственно получены многочисленные радиоактивные изотопы брома.
 Химические свойства • Бром немного, но лучше других галогенов растворим в воде (3, 58 г в 100 г воды при 20 °C), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот: Br 2 + H 2 O = HBr + HBr. O • По химической активности бром занимает промежуточное положение между хлором и иодом. При реакции брома с растворами иодидов выделяется свободный иод: Br 2 + KI = I 2 + 2 KBr • Напротив, при действии хлора на бромиды, находящиеся в водных растворах, выделяется свободный бром: Cl 2 + 2 KBr = Br 2 + 2 KCl
Химические свойства • Бром немного, но лучше других галогенов растворим в воде (3, 58 г в 100 г воды при 20 °C), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот: Br 2 + H 2 O = HBr + HBr. O • По химической активности бром занимает промежуточное положение между хлором и иодом. При реакции брома с растворами иодидов выделяется свободный иод: Br 2 + KI = I 2 + 2 KBr • Напротив, при действии хлора на бромиды, находящиеся в водных растворах, выделяется свободный бром: Cl 2 + 2 KBr = Br 2 + 2 KCl
 • Реакция брома с водородом протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде — это бромоводородная кислота, по силе близкая к соляной кислоте HCl. Соли бромоводородной кислоты — бромиды (Na. Br, Mg. Br 2, Al. Br 3 и др. ). Br 2 + H 2 = 2 HBr • С кислородом и азотом бром непосредственно не реагирует. Бром образует большое число различных соединений с остальными галогенами. Например, со фтором бром образует неустойчивые Br. F 3 и Br. F 5, с иодом — IBr. При взаимодействии со многими металлами бром образует бромиды, например, Al. Br 3, Cu. Br 2, Mg. Br 2 и др. Устойчивы к действию брома тантал и платина, в меньшей степени — серебро, титан и свинец. • Жидкий бром легко взаимодействует с золотом, образуя трибромид золота Au. Br 3: 2 Au + 3 Br 2 = 2 Au. Br 3
• Реакция брома с водородом протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде — это бромоводородная кислота, по силе близкая к соляной кислоте HCl. Соли бромоводородной кислоты — бромиды (Na. Br, Mg. Br 2, Al. Br 3 и др. ). Br 2 + H 2 = 2 HBr • С кислородом и азотом бром непосредственно не реагирует. Бром образует большое число различных соединений с остальными галогенами. Например, со фтором бром образует неустойчивые Br. F 3 и Br. F 5, с иодом — IBr. При взаимодействии со многими металлами бром образует бромиды, например, Al. Br 3, Cu. Br 2, Mg. Br 2 и др. Устойчивы к действию брома тантал и платина, в меньшей степени — серебро, титан и свинец. • Жидкий бром легко взаимодействует с золотом, образуя трибромид золота Au. Br 3: 2 Au + 3 Br 2 = 2 Au. Br 3
 • Бром — сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион — до нитрата и т. д. • При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные: C 2 H 4 + Br 2 = C 2 H 4 Br 2 • При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C 6 H 5 Br (реакция замещения). C 6 H 6 + Br 2 = C 6 H 5 Br + HBr • При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия или калия образуются соответствующие бромиды и броматы, например: 3 Br 2 + 3 Na 2 CO 3 = 5 Na. Br + Na. Br. O 3 + 3 CO 2
• Бром — сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион — до нитрата и т. д. • При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные: C 2 H 4 + Br 2 = C 2 H 4 Br 2 • При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C 6 H 5 Br (реакция замещения). C 6 H 6 + Br 2 = C 6 H 5 Br + HBr • При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия или калия образуются соответствующие бромиды и броматы, например: 3 Br 2 + 3 Na 2 CO 3 = 5 Na. Br + Na. Br. O 3 + 3 CO 2
 Бромсодержащие кислоты Помимо бескислородной бромоводородной кислоты HBr, бром образует ряд кислородных кислот: бромную HBr. O 4, бромноватую HBr. O 3, бромистую HBr. O 2, бромноватистую HBr. O.
Бромсодержащие кислоты Помимо бескислородной бромоводородной кислоты HBr, бром образует ряд кислородных кислот: бромную HBr. O 4, бромноватую HBr. O 3, бромистую HBr. O 2, бромноватистую HBr. O.
 Применение • В химии: Вещества на основе брома широко применяются в основном органическом синтезе. «Бромная вода» (водный раствор брома) применяется как реагент для качественного определения непредельных органических соединений.
Применение • В химии: Вещества на основе брома широко применяются в основном органическом синтезе. «Бромная вода» (водный раствор брома) применяется как реагент для качественного определения непредельных органических соединений.
 • В технике: Бромид серебра Ag. Br применяется в фотографии как светочувствительное вещество. Используется для создания антипиренов — добавок, придающих пожароустойчивость пластикам, древесине, текстильным материалам. Пентафторид брома иногда используется как очень мощный окислитель ракетного топлива. 1, 2 -дибромэтан в настоящее время применяют как антидетонирующую добавку в моторном топливе, взамен тетраэтилсвинца. Растворы бромидов используются в нефтедобыче. Растворы бромидов тяжёлых металлов используются как «тяжёлые жидкости» при обогащении полезных ископаемых методом флотации. Многие броморганические соединения применяются как инсектициды и пестициды.
• В технике: Бромид серебра Ag. Br применяется в фотографии как светочувствительное вещество. Используется для создания антипиренов — добавок, придающих пожароустойчивость пластикам, древесине, текстильным материалам. Пентафторид брома иногда используется как очень мощный окислитель ракетного топлива. 1, 2 -дибромэтан в настоящее время применяют как антидетонирующую добавку в моторном топливе, взамен тетраэтилсвинца. Растворы бромидов используются в нефтедобыче. Растворы бромидов тяжёлых металлов используются как «тяжёлые жидкости» при обогащении полезных ископаемых методом флотации. Многие броморганические соединения применяются как инсектициды и пестициды.
 • В медицине: В медицине бромид натрия и бромид калия применяют как успокаивающие средства. • В производстве оружия: Со времен Первой мировой войны бром используется для производства боевых отравляющих веществ.
• В медицине: В медицине бромид натрия и бромид калия применяют как успокаивающие средства. • В производстве оружия: Со времен Первой мировой войны бром используется для производства боевых отравляющих веществ.
 Хлор - атомный номер 17. Обозначается символом Cl. Относительная атомная масса равна 35, 5. Молекула хлора двухатомная (формула Cl 2).
Хлор - атомный номер 17. Обозначается символом Cl. Относительная атомная масса равна 35, 5. Молекула хлора двухатомная (формула Cl 2).
 Физические свойства При нормальных условиях хлор — жёлто-зелёный газ с удушающим запахом. Он в 2, 5 раза тяжелее воздуха, ядовит. В одном объеме воды при 20 С растворяется 2, 5 объема хлора. Раствор хлора в воде называется хлорной водой.
Физические свойства При нормальных условиях хлор — жёлто-зелёный газ с удушающим запахом. Он в 2, 5 раза тяжелее воздуха, ядовит. В одном объеме воды при 20 С растворяется 2, 5 объема хлора. Раствор хлора в воде называется хлорной водой.
 Свойство Значение Цвет (газ) Жёлто-зелёный t°кип. (°С) − 34 °C t°пл. (°С) − 100 °C Устойчивые степени окисления − 1, 0, +1, +3, (+4), +5, (+6), +7
Свойство Значение Цвет (газ) Жёлто-зелёный t°кип. (°С) − 34 °C t°пл. (°С) − 100 °C Устойчивые степени окисления − 1, 0, +1, +3, (+4), +5, (+6), +7
 Нахождение в природе В природе встречаются два изотопа хлора 35 Cl(75, 5%) и 37 Cl(24, 5%). В земной коре хлор самый распространённый В природе встречается только в виде соединений в составе минералов: каменная соль(галит) Na. Cl, сильвина KCl, сильвинита KCl · Na. Cl, карналлита KCl · Mg. Cl 2 · 6 Н 2 O, каинита KCl · Mg. SO 4 · 3 Н 2 О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов (содержание в морской воде 19 г/л). На долю хлора приходится 0, 025 % от общего числа атомов земной коры. Человеческий организм содержит 0, 25 % ионов хлора по массе.
Нахождение в природе В природе встречаются два изотопа хлора 35 Cl(75, 5%) и 37 Cl(24, 5%). В земной коре хлор самый распространённый В природе встречается только в виде соединений в составе минералов: каменная соль(галит) Na. Cl, сильвина KCl, сильвинита KCl · Na. Cl, карналлита KCl · Mg. Cl 2 · 6 Н 2 O, каинита KCl · Mg. SO 4 · 3 Н 2 О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов (содержание в морской воде 19 г/л). На долю хлора приходится 0, 025 % от общего числа атомов земной коры. Человеческий организм содержит 0, 25 % ионов хлора по массе.
 Получение • В промышленности: Хлор получают электролизом водного раствора или расплава хлорида натрия: 2 Na. Cl + H 2 O = Cl 2 + H 2 + 2 Na. OH 2 Na. Cl = Cl 2 +2 Na
Получение • В промышленности: Хлор получают электролизом водного раствора или расплава хлорида натрия: 2 Na. Cl + H 2 O = Cl 2 + H 2 + 2 Na. OH 2 Na. Cl = Cl 2 +2 Na
 • В лаборатории: Хлор можно получить действием концентрированно соляной кислоты(при нагревании) на различные окислители, такие как оксид марганца(IV)Mn. O 2, перманганат калия KMn. O 4, бертолетова соль Kcl. O 3 и др. : 4 HСl + Mn. O 2 = Mn. Cl 2 + Cl 2 + 2 H 2 O 2 KMn. O 4 + 16 HCl = 2 KCl + 2 Mn. Cl 2 + 5 Cl 2 + 8 H 2 O KCl. O 3 + 6 HCl = KC + 3 Cl 2 +3 H 2 O
• В лаборатории: Хлор можно получить действием концентрированно соляной кислоты(при нагревании) на различные окислители, такие как оксид марганца(IV)Mn. O 2, перманганат калия KMn. O 4, бертолетова соль Kcl. O 3 и др. : 4 HСl + Mn. O 2 = Mn. Cl 2 + Cl 2 + 2 H 2 O 2 KMn. O 4 + 16 HCl = 2 KCl + 2 Mn. Cl 2 + 5 Cl 2 + 8 H 2 O KCl. O 3 + 6 HCl = KC + 3 Cl 2 +3 H 2 O
 Химические свойства Хлор – химически активное вещество, взаимодействет с простыми и сложными веществами. С кислородом и азотом хлор не взаимодействует. Со сложными веществами : • взаимодействует с водой в 2 стадии. • С кислотами хлор не реагирует. • Взаимодействует с растворами щелочей по-разному в зависимости от уловий протекания реакции. • Взаимодействует с бромидами и иодидами металлов. • С фторидами не реагирует. • Легко взаимодействует со многими органическими веществами.
Химические свойства Хлор – химически активное вещество, взаимодействет с простыми и сложными веществами. С кислородом и азотом хлор не взаимодействует. Со сложными веществами : • взаимодействует с водой в 2 стадии. • С кислотами хлор не реагирует. • Взаимодействует с растворами щелочей по-разному в зависимости от уловий протекания реакции. • Взаимодействует с бромидами и иодидами металлов. • С фторидами не реагирует. • Легко взаимодействует со многими органическими веществами.
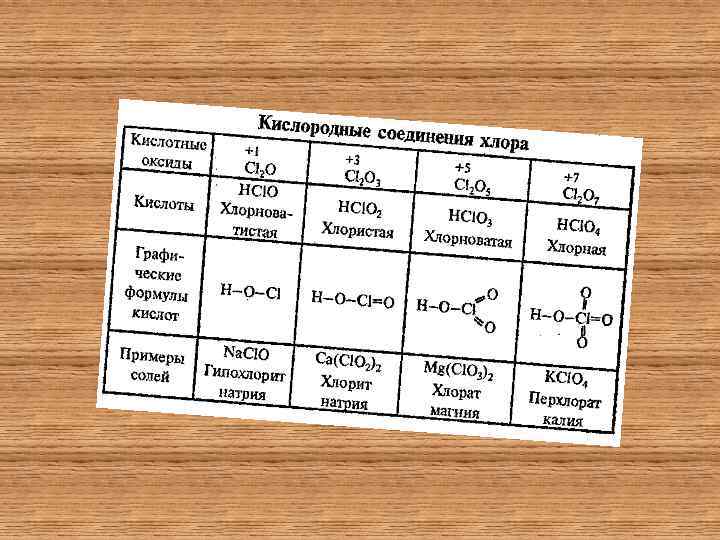
 Хлороводород и соляная кислота Хим. Связь в молекуле HCl – ковалентная полярная. • Хлороводород – бесцветный газ с резким запахом, в воде хорошо растворяется, при 0 С в 1 л воды растворяется около 400 л HCl. Раствор хлороводорода в воде имеет кислую среду и называется хлороводородной или соляной кислотой. Соляная кислота является сильной кислотой, обладает общими свойствами кислот. • Соляная кислота – активный химический реагент, она взаимодействует: с основаниями и амфотерными гидроксидами, с основными и амфотерными оксидами, с металлами, которые находятся в ряду активности до водорода, с солями. Хлороводород можно получить: • 1. прямым синтезом из водорода и хлора. • 2. действием концентрированной серной кислоты на твердые хлориды.
Хлороводород и соляная кислота Хим. Связь в молекуле HCl – ковалентная полярная. • Хлороводород – бесцветный газ с резким запахом, в воде хорошо растворяется, при 0 С в 1 л воды растворяется около 400 л HCl. Раствор хлороводорода в воде имеет кислую среду и называется хлороводородной или соляной кислотой. Соляная кислота является сильной кислотой, обладает общими свойствами кислот. • Соляная кислота – активный химический реагент, она взаимодействует: с основаниями и амфотерными гидроксидами, с основными и амфотерными оксидами, с металлами, которые находятся в ряду активности до водорода, с солями. Хлороводород можно получить: • 1. прямым синтезом из водорода и хлора. • 2. действием концентрированной серной кислоты на твердые хлориды.
 Применение хлора и хлороводорода. • Хлор для отбеливания бумаги и тканей • Производство пластмасс • Для дезинфекции питьевой воды • Получение хлорной извести, фосгена, хлороформ, моющих средств, ядохимикатов, каучуков и т. д. • Для синтеза хлороводорода • В организме человека способствует перевариванию белков и убивает болезнетворные бактерии.
Применение хлора и хлороводорода. • Хлор для отбеливания бумаги и тканей • Производство пластмасс • Для дезинфекции питьевой воды • Получение хлорной извести, фосгена, хлороформ, моющих средств, ядохимикатов, каучуков и т. д. • Для синтеза хлороводорода • В организме человека способствует перевариванию белков и убивает болезнетворные бактерии.
 Йо д —атомный номер 53. Обозначается символом I.
Йо д —атомный номер 53. Обозначается символом I.
 Нахождение в природе Йод — элемент редкий. Йод присутствует практически везде. Находится в виде иодидов в морской воде (20 — 30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях (5 кг на тонну высушенной морской капусты (ламинарии)). Известен в природе также в свободной форме, в качестве минерала. Наиболее известный из минералов иода — лаутарит Ca(IO 3)2. Некоторые другие минералы иода — иодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br), майерсит Cu. I· 4 Ag. I.
Нахождение в природе Йод — элемент редкий. Йод присутствует практически везде. Находится в виде иодидов в морской воде (20 — 30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях (5 кг на тонну высушенной морской капусты (ламинарии)). Известен в природе также в свободной форме, в качестве минерала. Наиболее известный из минералов иода — лаутарит Ca(IO 3)2. Некоторые другие минералы иода — иодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br), майерсит Cu. I· 4 Ag. I.
 Физические свойства Природный Йод состоит только из одного изотопа — иода-127. . В соединениях проявляет степени окисления − 1, 0, +1, +3, +5 и +7 (валентности I, III, V и VII). Иод при обычных условиях — твердое чёрно-серое вещество с металлическим блеском и специфическим запахом. Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях. Йод при комнатной температуре представляет собой темнофиолетовые кристаллы со слабым блеском.
Физические свойства Природный Йод состоит только из одного изотопа — иода-127. . В соединениях проявляет степени окисления − 1, 0, +1, +3, +5 и +7 (валентности I, III, V и VII). Иод при обычных условиях — твердое чёрно-серое вещество с металлическим блеском и специфическим запахом. Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях. Йод при комнатной температуре представляет собой темнофиолетовые кристаллы со слабым блеском.
 • • • Химические свойства Образует ряд кислот: иодоводородную (HI), иодноватистую (HIO), иодистую (HIO 2), иодноватую (HIO 3), иодную (HIO 4). Химически иод довольно активен, хотя и в меньшей степени, чем хлор и бром. • С металлами иод при легком нагревании энергично взаимодействует, образуя иодиды: Hg + I 2 = Hg. I 2 • С водородом иод реагирует только при нагревании и не полностью, образуя иодоводород: H 2 + I 2 = 2 HI Иод является окислителем менее сильным, чем хлор и бром. Сероводород H 2 S , Na 2 S 2 O 3 и другие восстановители восстанавливают его до иона I−: I 2 + H 2 S = S + 2 HI • При растворении в воде иод частично реагирует с ней: I 2 + H 2 O = HI + HIO
• • • Химические свойства Образует ряд кислот: иодоводородную (HI), иодноватистую (HIO), иодистую (HIO 2), иодноватую (HIO 3), иодную (HIO 4). Химически иод довольно активен, хотя и в меньшей степени, чем хлор и бром. • С металлами иод при легком нагревании энергично взаимодействует, образуя иодиды: Hg + I 2 = Hg. I 2 • С водородом иод реагирует только при нагревании и не полностью, образуя иодоводород: H 2 + I 2 = 2 HI Иод является окислителем менее сильным, чем хлор и бром. Сероводород H 2 S , Na 2 S 2 O 3 и другие восстановители восстанавливают его до иона I−: I 2 + H 2 S = S + 2 HI • При растворении в воде иод частично реагирует с ней: I 2 + H 2 O = HI + HIO
 Применение • В медицине 5 -процентный спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците йода в организме. В качестве антисептика применяется всё реже и реже, наряду со спиртовым раствором йода используется Зелёнка, Фукорцин, Пиоктанин, растворы перекиси водорода и др. В рентгенологических и томографических исследованиях широко применяются йодсодержащие контрастные препараты. • Радиоэлектронная промышленность В последние годы резко повысился спрос на иод со стороны производителей жидкокристаллических дисплеев.
Применение • В медицине 5 -процентный спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците йода в организме. В качестве антисептика применяется всё реже и реже, наряду со спиртовым раствором йода используется Зелёнка, Фукорцин, Пиоктанин, растворы перекиси водорода и др. В рентгенологических и томографических исследованиях широко применяются йодсодержащие контрастные препараты. • Радиоэлектронная промышленность В последние годы резко повысился спрос на иод со стороны производителей жидкокристаллических дисплеев.
 • В криминалистике пары йода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например на купюрах. • В технике Источники света: галогеновая лампа металлогалогеновая лампа
• В криминалистике пары йода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например на купюрах. • В технике Источники света: галогеновая лампа металлогалогеновая лампа
 • Производство аккумуляторов Иод используется в качестве компонента положительного электрода (окислителя) в литиево-иодных аккумуляторах для электромобилей. • Лазерный термоядерный синтез Некоторые иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах иода (исследования в области лазерного термоядерного синтеза и промышленность).
• Производство аккумуляторов Иод используется в качестве компонента положительного электрода (окислителя) в литиево-иодных аккумуляторах для электромобилей. • Лазерный термоядерный синтез Некоторые иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах иода (исследования в области лазерного термоядерного синтеза и промышленность).
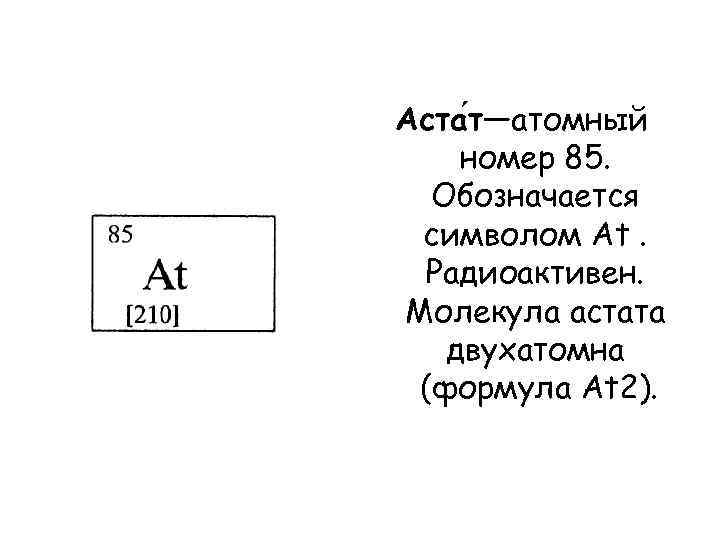 Аста т—атомный номер 85. Обозначается символом At. Радиоактивен. Молекула астата двухатомна (формула At 2).
Аста т—атомный номер 85. Обозначается символом At. Радиоактивен. Молекула астата двухатомна (формула At 2).
 Нахождение в природе Астат является наиболее редким элементом среди всех, обнаруженных в природе. В поверхностном слое земной коры толщиной 1, 6 км содержится всего 70 мг астата.
Нахождение в природе Астат является наиболее редким элементом среди всех, обнаруженных в природе. В поверхностном слое земной коры толщиной 1, 6 км содержится всего 70 мг астата.
 Получение Астат получают только искусственно. В основном изотопы астата получают облучением металлических висмута или тория α-частицами высокой энергии с последующим отделением астата соосаждением, экстракцией, хроматографией или дистилляцией.
Получение Астат получают только искусственно. В основном изотопы астата получают облучением металлических висмута или тория α-частицами высокой энергии с последующим отделением астата соосаждением, экстракцией, хроматографией или дистилляцией.
 Физические свойства Астат — твёрдое вещество сине-чёрного цвета, по внешнему виду похожее на иод. Для него характерно сочетание свойств неметаллов (галогенов) и металлов (полоний, свинец и другие). Как и йод, астат хорошо растворяется в органических растворителях и легко ими экстрагируется. По летучести немного уступает иоду, но также может легко возгоняться. t°пл. (°С)= 302 °C, t°кип. (°С)= 337 °C
Физические свойства Астат — твёрдое вещество сине-чёрного цвета, по внешнему виду похожее на иод. Для него характерно сочетание свойств неметаллов (галогенов) и металлов (полоний, свинец и другие). Как и йод, астат хорошо растворяется в органических растворителях и легко ими экстрагируется. По летучести немного уступает иоду, но также может легко возгоняться. t°пл. (°С)= 302 °C, t°кип. (°С)= 337 °C
 • • Химические свойства Галоген. При действии на водный раствор астата водородом в момент реакции образуется газообразный астатоводород HAt. Астат в водном растворе восстанавливается SO 2 и окисляется Br 2. Астат, как металлы, осаждается из солянокислых растворов сероводородом (H 2 S). Вытесняется из раствора цинком (свойства металла). Известны и межгалогенные соединения астата — иодид астата At. I и бромид астата At. Br. Астатоводород HAt также был получен. Однако ввиду одинаковой электроотрицательности водорода и астата астатоводород крайне неустойчив, а в водных растворах существуют не только протоны, но и ионы At+, чего нет у всех других галогеноводородных кислот. С металлами астат образует соединения, в которых проявляет степень окисления − 1, как и все остальные галогены (Na. At, к примеру, называется астатид натрия). Подобно другим галогенам, астат может замещать водород в молекуле метана до получения тетраастатметана CAt 4. При этом образуются сперва астатметан, диастатметан, астатоформ.
• • Химические свойства Галоген. При действии на водный раствор астата водородом в момент реакции образуется газообразный астатоводород HAt. Астат в водном растворе восстанавливается SO 2 и окисляется Br 2. Астат, как металлы, осаждается из солянокислых растворов сероводородом (H 2 S). Вытесняется из раствора цинком (свойства металла). Известны и межгалогенные соединения астата — иодид астата At. I и бромид астата At. Br. Астатоводород HAt также был получен. Однако ввиду одинаковой электроотрицательности водорода и астата астатоводород крайне неустойчив, а в водных растворах существуют не только протоны, но и ионы At+, чего нет у всех других галогеноводородных кислот. С металлами астат образует соединения, в которых проявляет степень окисления − 1, как и все остальные галогены (Na. At, к примеру, называется астатид натрия). Подобно другим галогенам, астат может замещать водород в молекуле метана до получения тетраастатметана CAt 4. При этом образуются сперва астатметан, диастатметан, астатоформ.
 • Однако ввиду одинаковой электроотрицательности водорода и астата астатоводород крайне неустойчив, а в водных растворах существуют не только протоны, но и ионы At+, чего нет у всех других галогеноводородных кислот. • С металлами астат образует соединения, в которых проявляет степень окисления − 1, как и все остальные галогены (Na. At, к примеру, называется астатид натрия). Подобно другим галогенам, астат может замещать водород в молекуле метана до получения тетраастатметана CAt 4. При этом образуются сперва астатметан, диастатметан, астатоформ.
• Однако ввиду одинаковой электроотрицательности водорода и астата астатоводород крайне неустойчив, а в водных растворах существуют не только протоны, но и ионы At+, чего нет у всех других галогеноводородных кислот. • С металлами астат образует соединения, в которых проявляет степень окисления − 1, как и все остальные галогены (Na. At, к примеру, называется астатид натрия). Подобно другим галогенам, астат может замещать водород в молекуле метана до получения тетраастатметана CAt 4. При этом образуются сперва астатметан, диастатметан, астатоформ.
 Применение Весьма перспективным является 211 At для лечения заболеваний щитовидной железы. Имеются сведения, что радиобиологическое действие α-частиц астата на щитовидную железу в 2, 8 раза сильнее β-частиц иода-131. При этом следует учесть, что с помощью иона роданида можно надёжно вывести астат из организма.
Применение Весьма перспективным является 211 At для лечения заболеваний щитовидной железы. Имеются сведения, что радиобиологическое действие α-частиц астата на щитовидную железу в 2, 8 раза сильнее β-частиц иода-131. При этом следует учесть, что с помощью иона роданида можно надёжно вывести астат из организма.