аналитика.pptx
- Количество слайдов: 20
 Кулонометрический анализ (кулонометрия)
Кулонометрический анализ (кулонометрия)
 План 1. Сущность метода 2. Прямая кулонометрия 3. Кулонометрическое титрование а)Сущность метода б)Условия проведения кулонометрического титрования в)Кривые титрования г)Применение
План 1. Сущность метода 2. Прямая кулонометрия 3. Кулонометрическое титрование а)Сущность метода б)Условия проведения кулонометрического титрования в)Кривые титрования г)Применение
 Принципы метода Кулонометрические методы основаны на измерении количества электричества, затраченного на электропревращение определяемого вещества (прямая кулонометрия) или на получение промежуточного реагента, который количественно реагирует с определяемым веществом (косвенная кулонометрия или кулонометрическое титрование).
Принципы метода Кулонометрические методы основаны на измерении количества электричества, затраченного на электропревращение определяемого вещества (прямая кулонометрия) или на получение промежуточного реагента, который количественно реагирует с определяемым веществом (косвенная кулонометрия или кулонометрическое титрование).
 В основе кулонометрических методов анализа лежат законы электролиза Фарадея: Фарадея Количество (масса) вещества, выделившегося при электролизе, пропорциональна количеству электричества, прошедшего через раствор. При прохождении через раствор одного и того же количества электричества, на электродах выделяется одно и то же количество эквивалента вещества. Где M- молярная масса вещества, прореагировавшего при электролизе n-число электронов, участвующих в электродной реакции (число Фарадея)
В основе кулонометрических методов анализа лежат законы электролиза Фарадея: Фарадея Количество (масса) вещества, выделившегося при электролизе, пропорциональна количеству электричества, прошедшего через раствор. При прохождении через раствор одного и того же количества электричества, на электродах выделяется одно и то же количество эквивалента вещества. Где M- молярная масса вещества, прореагировавшего при электролизе n-число электронов, участвующих в электродной реакции (число Фарадея)
 Главная задача кулонометрических измерений – как можно более точно определить количество электричества. Кулонометрический анализ проводят либо в амперостатическом режиме, либо при контролируемом постоянном потенциале рабочего электрода, когда электрический ток изменяется в процессе электролиза. Различают прямую кулонометрию и косвенную(кулонометрическое титрование).
Главная задача кулонометрических измерений – как можно более точно определить количество электричества. Кулонометрический анализ проводят либо в амперостатическом режиме, либо при контролируемом постоянном потенциале рабочего электрода, когда электрический ток изменяется в процессе электролиза. Различают прямую кулонометрию и косвенную(кулонометрическое титрование).
 Прямая кулонометрия В прямой потенциостатической кулонометрии электролизу подвергают непосредственно определяемое вещество. В процессе электролиза потенциал рабочего электрода поддерживают постоянным, E=const , для чего обычно используют приборы- потенциостаты.
Прямая кулонометрия В прямой потенциостатической кулонометрии электролизу подвергают непосредственно определяемое вещество. В процессе электролиза потенциал рабочего электрода поддерживают постоянным, E=const , для чего обычно используют приборы- потенциостаты.
 Если электролиз проводят при постоянной силе тока (гальваностатическая кулонометрия), то количество электричества (Q) за время электролиза t. Э, при постоянном токе I равно:
Если электролиз проводят при постоянной силе тока (гальваностатическая кулонометрия), то количество электричества (Q) за время электролиза t. Э, при постоянном токе I равно:
 Чаще применяют прямую кулонометрию при постоянном потенциале рабочего электрода. В качестве рабочего электрода чаще всего применяют платиновый электрод, на котором происходит электрохимическое восстановление или окисление определяемого вещества. Кроме рабочего электрода электрохимическая ячейка включает один-другой электрод или чаще два других электрода- электрод сравнения(хлорсеребряный), и вспомогательный(из стали).
Чаще применяют прямую кулонометрию при постоянном потенциале рабочего электрода. В качестве рабочего электрода чаще всего применяют платиновый электрод, на котором происходит электрохимическое восстановление или окисление определяемого вещества. Кроме рабочего электрода электрохимическая ячейка включает один-другой электрод или чаще два других электрода- электрод сравнения(хлорсеребряный), и вспомогательный(из стали).
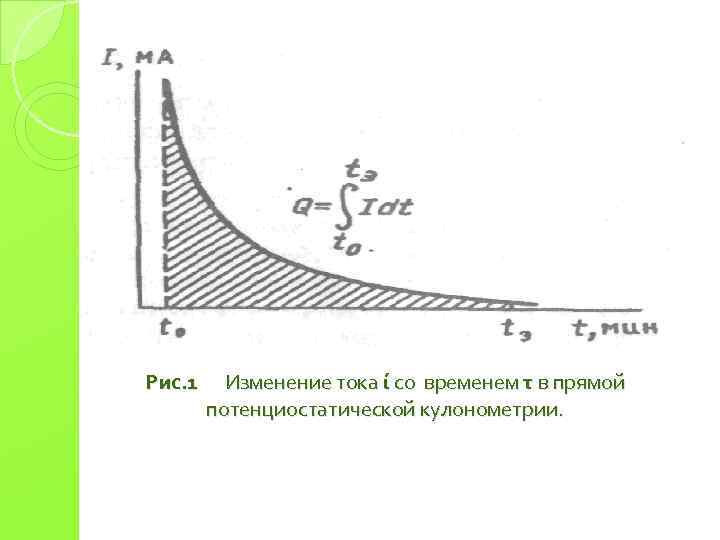 Рис. 1 Изменение тока ί со временем τ в прямой потенциостатической кулонометрии.
Рис. 1 Изменение тока ί со временем τ в прямой потенциостатической кулонометрии.
 Электролиз ведут до достижения остаточного тока It, величина которого определяется требуемой точностью. Так, если допустима погрешность порядка 0. 1%, то электролиз можно считать завершенным при It ~ 0. 001·I 0. Прямая кулонометрия – кулонометрия высокочувствительный и точный метод анализа, легко поддающийся автоматизации. Общая погрешность метода может составлять 0. 5%. При проведении электролиза в течение 103 с при силе тока 1 мк. А принципиально возможно определить до 10‾ 9 г вещества
Электролиз ведут до достижения остаточного тока It, величина которого определяется требуемой точностью. Так, если допустима погрешность порядка 0. 1%, то электролиз можно считать завершенным при It ~ 0. 001·I 0. Прямая кулонометрия – кулонометрия высокочувствительный и точный метод анализа, легко поддающийся автоматизации. Общая погрешность метода может составлять 0. 5%. При проведении электролиза в течение 103 с при силе тока 1 мк. А принципиально возможно определить до 10‾ 9 г вещества
 Кулонометрическое титрование При кулонометрическом титровании титрант не прибавляется из бюретки в титруемый раствор. Роль титранта играет вещество Т, непрерывно генерируемое при электродной реакции на генераторном электроде. Очевидно, имеется аналогия между обычным титрованием, когда титрант вводится извне в титруемый раствор и по мере его прибавления реагирует с определяемым веществом, и генерацией вещества Т, которое по мере своего образования также реагирует с определяемым веществом. Поэтому рассматриваемый метод и получил название «кулонометрическое титрование» .
Кулонометрическое титрование При кулонометрическом титровании титрант не прибавляется из бюретки в титруемый раствор. Роль титранта играет вещество Т, непрерывно генерируемое при электродной реакции на генераторном электроде. Очевидно, имеется аналогия между обычным титрованием, когда титрант вводится извне в титруемый раствор и по мере его прибавления реагирует с определяемым веществом, и генерацией вещества Т, которое по мере своего образования также реагирует с определяемым веществом. Поэтому рассматриваемый метод и получил название «кулонометрическое титрование» .
 Кулонометрическое титрование проводят в амперостатическом (гальваностатическом) режиме. Вместо объема прибавленного титранта в кулонометрическом титровании измеряют время τ и ток ί электролиза. Процесс образования вещества Т в кулонометрической ячейке во время электролиза называется генерацей титранта
Кулонометрическое титрование проводят в амперостатическом (гальваностатическом) режиме. Вместо объема прибавленного титранта в кулонометрическом титровании измеряют время τ и ток ί электролиза. Процесс образования вещества Т в кулонометрической ячейке во время электролиза называется генерацей титранта
 Условия проведения кулонометрического титрования Вспомогательный реагент, из которого на рабочем электроде генерируется титрант, должен присутствовать в растворе в большом избытке по отношению к определяемому веществу. Величина постоянного тока ί=const при проведении электролиза должна быть меньше величины диффузного тока вспомогательного реагента. Необходимо как можно точнее определять количество электричества , израсходованного при проведении электролиза
Условия проведения кулонометрического титрования Вспомогательный реагент, из которого на рабочем электроде генерируется титрант, должен присутствовать в растворе в большом избытке по отношению к определяемому веществу. Величина постоянного тока ί=const при проведении электролиза должна быть меньше величины диффузного тока вспомогательного реагента. Необходимо как можно точнее определять количество электричества , израсходованного при проведении электролиза
 Кривые метода Кривая а) соответствует случаю, когда электроактивно определяемое вещество Х, а генерируемый титрант Т и продукты реакции не являются электроактивными в данных условиях. (титрование железа (2) церием (4), генерируемым из церия (3)на генераторном электроде)
Кривые метода Кривая а) соответствует случаю, когда электроактивно определяемое вещество Х, а генерируемый титрант Т и продукты реакции не являются электроактивными в данных условиях. (титрование железа (2) церием (4), генерируемым из церия (3)на генераторном электроде)
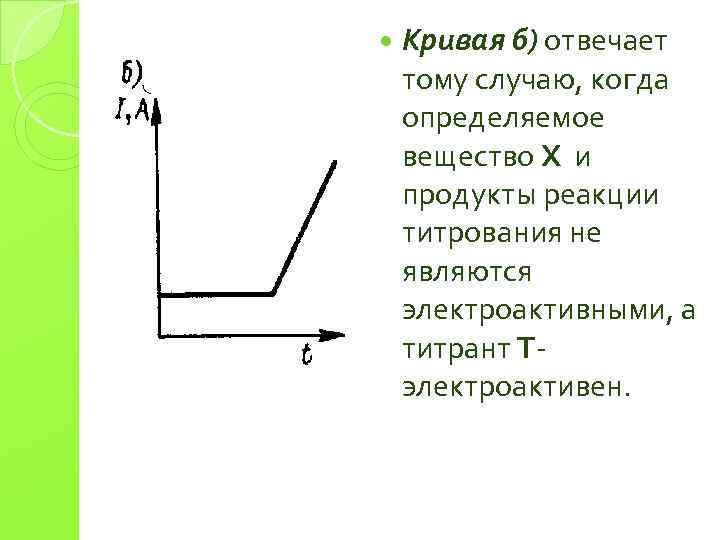 Кривая б) отвечает тому случаю, когда определяемое вещество Х и продукты реакции титрования не являются электроактивными, а титрант Т- электроактивен.
Кривая б) отвечает тому случаю, когда определяемое вещество Х и продукты реакции титрования не являются электроактивными, а титрант Т- электроактивен.
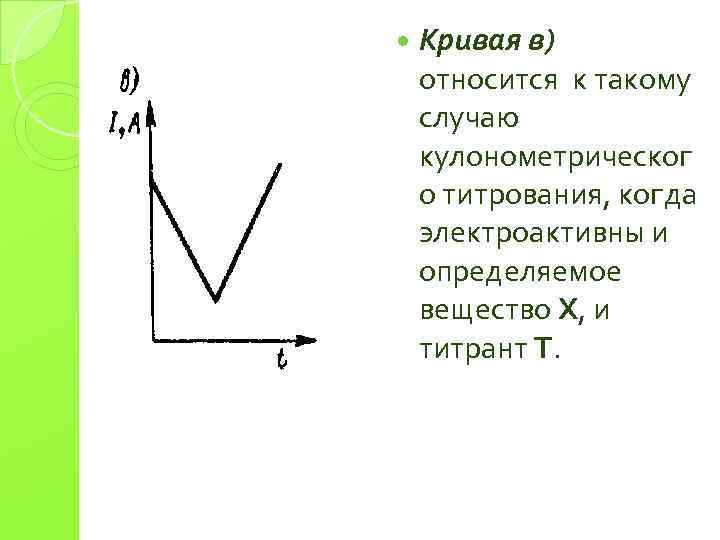 Кривая в) относится к такому случаю кулонометрическог о титрования, когда электроактивны и определяемое вещество Х, и титрант Т.
Кривая в) относится к такому случаю кулонометрическог о титрования, когда электроактивны и определяемое вещество Х, и титрант Т.
 Применение В кулонометрическом титровании можно использовать все типы реакций титриметрического анализа: кислотноосновные, окислительновосстоновительные, осадительные, реакции комплексообразования. Можно определять малые количества кислот Определение галогенид-ионов, органических серосодержащих соединений электрогенериронных катионами серебра, цинка Титрование катионов металлов можно проводить анионами ЭДТА, электрогенерированными на катоде из комплексона ртути(2)
Применение В кулонометрическом титровании можно использовать все типы реакций титриметрического анализа: кислотноосновные, окислительновосстоновительные, осадительные, реакции комплексообразования. Можно определять малые количества кислот Определение галогенид-ионов, органических серосодержащих соединений электрогенериронных катионами серебра, цинка Титрование катионов металлов можно проводить анионами ЭДТА, электрогенерированными на катоде из комплексона ртути(2)
 Преимущества: v Высокая точность. v Обладает широким диапазоном применения в количественном анализе. v Позволяет определить малые количества вещества, малостойкие соединения. v Не требуется приготовление, стандартизация и хранение титранта Недостатком метода можно считать Недостатком необходимость использования сравнительно сложной и дорогостоящей аппаратуры.
Преимущества: v Высокая точность. v Обладает широким диапазоном применения в количественном анализе. v Позволяет определить малые количества вещества, малостойкие соединения. v Не требуется приготовление, стандартизация и хранение титранта Недостатком метода можно считать Недостатком необходимость использования сравнительно сложной и дорогостоящей аппаратуры.
 Выполнили студентки 2 курса 4 а группы Анацкая Дарья Литвин Марина Севко Ольга Ширин Алеся
Выполнили студентки 2 курса 4 а группы Анацкая Дарья Литвин Марина Севко Ольга Ширин Алеся
 А З О ! Б И ИЕ С Н А А П М С И Н В
А З О ! Б И ИЕ С Н А А П М С И Н В


