Коррозия металлов.ppt
- Количество слайдов: 16

Кубанский государственный аграрный университет Кафедра неорганической и аналитической химии Коррозия металлов

План лекции: 1. Коррозия металлов. Виды коррозии. 2. Электрохимичекая коррозия. 3. Атмосферная коррозия 4. Почвенная коррозия 5. Факторы , влияющие на коррозию 6. Методы защиты от коррозии Литература: 1. Глинка Н. Л. Общая химия. М. , ВШ, 2006. 2. Иванов Е. С. Иванов С. С. Коррозия и защита металлов. М. , Знание, 1978. 3. Коровин Н. В. Курс общей химии. М. , ВШ, 2000. 4. Дамаскин Б. Б. , Петрий О. А. , Цирлина Г. А. Электрохимия. М. , Химия, 2001.

Коррозия – это процесс самопроизвольного окисление металлов и сплавов в процессе химического или электрохимического взаимодействия их с окружающей средой. Среда, в которой происходит коррозия металла, называется коррозионной или агрессивной средой. Любой коррозионный процесс является многостадийным: 1. Подвод агрессивной среды или отдельных её компонентов к поверхности металла. 2. Взаимодействие среды с металлом. 3. Полный или частичный отвод продуктов от поверхности металла. Условием возможности самопроизвольного протекания процесса является уменьшение энергии Гиббса системы: ΔG<0. (термодинамическая неустойчивость металлов в заданной среде).

По степени термодинамической нестабильности металлы классифицируют на: 1. Металлы высокой стабильности (благородные): Hg, Pd, Ir, Pt, Au 2. Металлы промежуточной термодинамической стабильности (полублагородные): Bi, Sb, Re, Cu, Tc, Ag, Rh – устойчивы в кислых и нейтральных средах при отсутствии кислорода. 3. Металлы термодинамически нестабильные: Cd, In, Tl, Co, Ni, Mo, Pb, W – устойчивы в нейтральных средах в отсутствии кислорода. 4. Металлы повышенной нестабильности: Li, Rb, Cs, Ba, Sr, Ca, Na, Mg, Al, Ti, Zn, Mn, Cr, Fe – коррозируют даже в нейтральных водных средах.

Виды коррозии По механизму процесса; 1. Химическая коррозия 1. 1 Газовая 1. 2 Жидкостная (в нефтепродуктах). 2. Электрохимическая коррозия Me – nē = Me+n ē O 2 + 2 H 2 O + 4ē = 4 OH- Модель коррозионного микрогальванического элемента
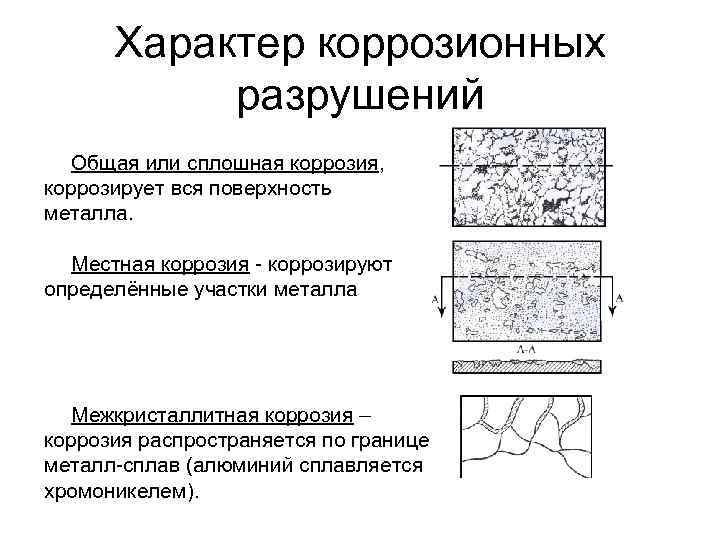
Характер коррозионных разрушений Общая или сплошная коррозия, коррозирует вся поверхность металла. Местная коррозия - коррозируют определённые участки металла Межкристаллитная коррозия – коррозия распространяется по границе металл-сплав (алюминий сплавляется хромоникелем).

Электрохимическая коррозия (гальванокоррозия). Основная причина возникновения гальванокоррозии – тесный контакт металлов с различными потенциалами, находящихся в среде электролита. Металлы, находящиеся в тесном контакте (спай), образуют короткозамкнутый гальванический элемент. Окисляются металлы с меньшим значением электродного потенциала. Например, сплав алюминия с медью. По соотношению потенциалов алюминий является анодом, медь – катодом. Рассмотрим данную гальванопару в кислой среде:

Атмосферная коррозия технического железа. Техническое железо состоит из кристаллов железа и участков цементита. Кристаллы железа играют роль микроанодов, участки цементита – микрокатодов. Рассмотрим данную систему в окружающей среде: воздухе с содержащейся в нём влагой Вторичные процессы е е
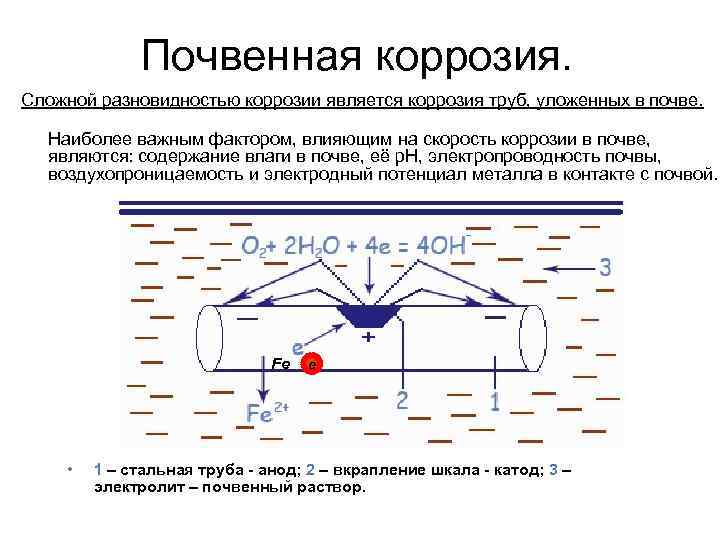
Почвенная коррозия. Сложной разновидностью коррозии является коррозия труб, уложенных в почве. Наиболее важным фактором, влияющим на скорость коррозии в почве, являются: содержание влаги в почве, её p. H, электропроводность почвы, воздухопроницаемость и электродный потенциал металла в контакте с почвой. Fe • е 1 – стальная труба - анод; 2 – вкрапление шкала - катод; 3 – электролит – почвенный раствор.
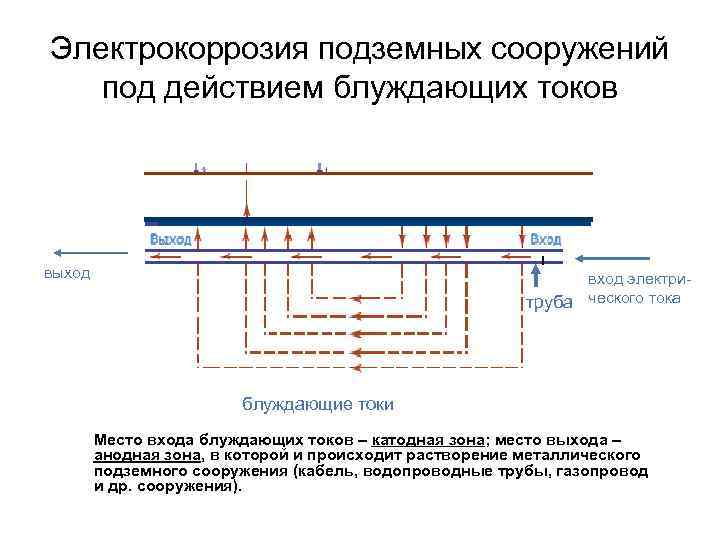
Электрокоррозия подземных сооружений под действием блуждающих токов выход вход электритруба ческого тока блуждающие токи Место входа блуждающих токов – катодная зона; место выхода – анодная зона, в которой и происходит растворение металлического подземного сооружения (кабель, водопроводные трубы, газопровод и др. сооружения).

Факторы, влияющие на коррозию. Внутренние факторы: 1) состав сплава; 2) наличие защитных оксидных плёнок (у Al, Сr, Zn, Sn, Ni, Ti и др. ) 3) состояние поверхности металла (шероховатость). Внешние факторы: 1) состав коррозионной среды 2) влажность (>70% резко ускоряется коррозия); 3) пыль, грязь; 4) контакт разнородных металлов (железный гвоздь вбит в алюминий и др) Ингибиторы - уменьшают скорость коррозии

Методы защиты металлов от коррозии. Покрытия: металлические лакокрасочные; химические (оксидные плёнки, фосфаты, нитриды и др. ). Электрозащита Катодная – на защищаемом объекте создают отрицательный потенциал (катод) за счёт токов катодной станции; Протекторная – анодные электроды имеющие более низкие потенциалы, чем защищаемый металл. Их подключают к объекту (кабелю, трубопроводу, в цистерне и т. д. ).
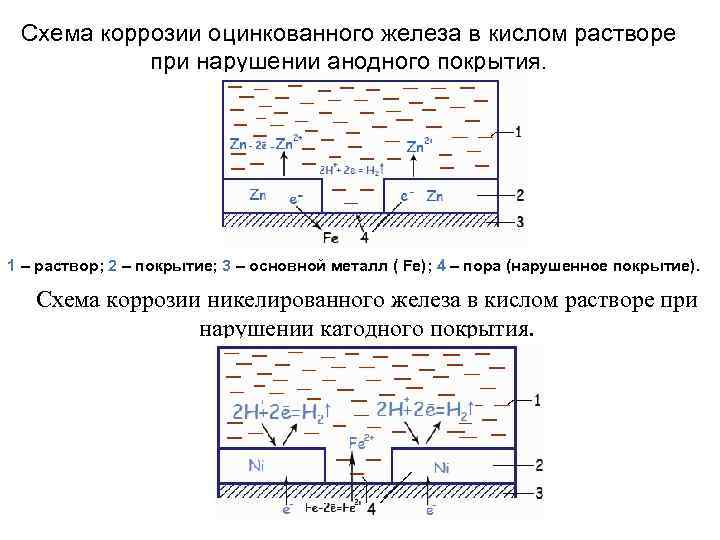
Схема коррозии оцинкованного железа в кислом растворе при нарушении анодного покрытия. 1 – раствор; 2 – покрытие; 3 – основной металл ( Fe); 4 – пора (нарушенное покрытие). Схема коррозии никелированного железа в кислом растворе при нарушении катодного покрытия.
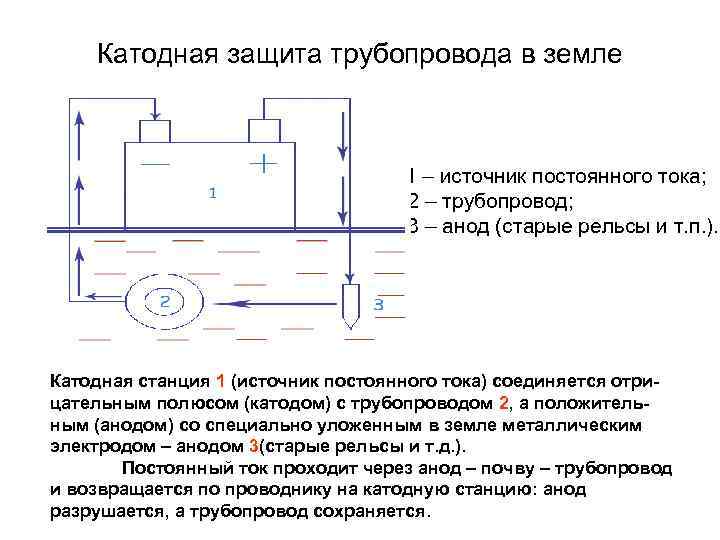
Катодная защита трубопровода в земле 1 – источник постоянного тока; 2 – трубопровод; 3 – анод (старые рельсы и т. п. ). Катодная станция 1 (источник постоянного тока) соединяется отрицательным полюсом (катодом) с трубопроводом 2, а положительным (анодом) со специально уложенным в земле металлическим электродом – анодом 3(старые рельсы и т. д. ). Постоянный ток проходит через анод – почву – трубопровод и возвращается по проводнику на катодную станцию: анод разрушается, а трубопровод сохраняется.
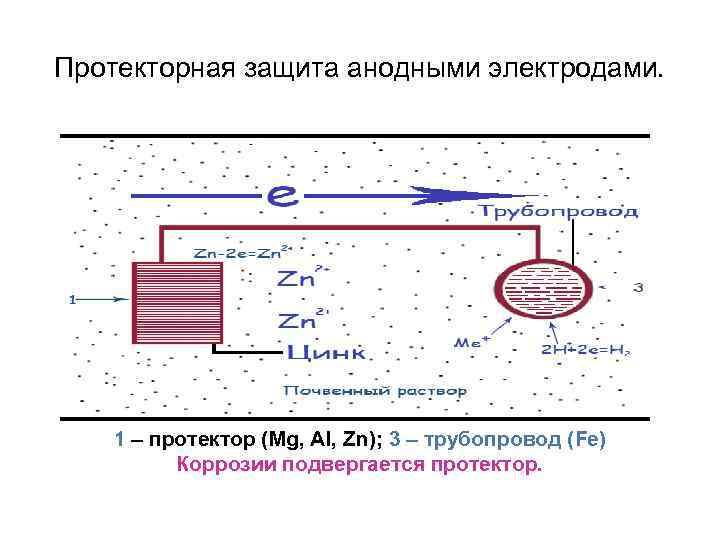
Протекторная защита анодными электродами. 1 – протектор (Mg, Al, Zn); 3 – трубопровод (Fe) Коррозии подвергается протектор.

Стандартные электродные потенциалы, ( φ˚, В) Li K Na Mg Al Zn Cr Fe -3, 04 -2, 92 -2, 71 -2, 36 -1, 66 -0, 74 -0, 44 Cd Co Ni Sn Pb H 2 -0, 40 -0, 28 -0, 25 -0, 14 0, 13 0 Cu Ag Hg Pt +0, 34 +0, 80 +0, 85 +1, 3 Li + K + Na + Mg 2+ Al 3+ Zn 2+ Cr 3+ Fe 2+ Cd 2+ Co 2+ Ni 2+ Sn 2+ Pb 2+ H 22+ Cu 2+ Ag + Hg 2+ Pt 2+
Коррозия металлов.ppt