сера.ppt
- Количество слайдов: 34
 Круговорот серы в природе Выполнил Студент Эи. П-Д-4 Муслихов Р. Р.
Круговорот серы в природе Выполнил Студент Эи. П-Д-4 Муслихов Р. Р.
 • Сера - СЕРА (обозначается S), химический элемент VI группы ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ, неметалл, известный с древности. Встречается в природе как в виде отдельного элемента, так и в виде сульфидных минералов, таких как ГАЛЕНИТ и ПИРИТ, и сульфатных минералов, таких как гипс. В основном промышленным источником серы является встречающаяся в природе самородная сера, добываемая посредством ПРОЦЕССА ФРАША. Используется в ВУЛКАНИЗАЦИИ каучука, а также в производстве СЕРНОЙ КИСЛОТЫ, лекарственных препаратов, спичек, красителей, фунгицидов, инсектицидов и удобрений. Свойства: атомный номер 16, атомная масса 32, 064; плотность 2, 07; темп ература плавления 112, 8 °С, температура кипения 444, 7 °С; наиболее распространенныйизотоп 32 S (95, 1%).
• Сера - СЕРА (обозначается S), химический элемент VI группы ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ, неметалл, известный с древности. Встречается в природе как в виде отдельного элемента, так и в виде сульфидных минералов, таких как ГАЛЕНИТ и ПИРИТ, и сульфатных минералов, таких как гипс. В основном промышленным источником серы является встречающаяся в природе самородная сера, добываемая посредством ПРОЦЕССА ФРАША. Используется в ВУЛКАНИЗАЦИИ каучука, а также в производстве СЕРНОЙ КИСЛОТЫ, лекарственных препаратов, спичек, красителей, фунгицидов, инсектицидов и удобрений. Свойства: атомный номер 16, атомная масса 32, 064; плотность 2, 07; темп ература плавления 112, 8 °С, температура кипения 444, 7 °С; наиболее распространенныйизотоп 32 S (95, 1%).

 • Сера – биогенный элемент, необходимый компонент живой материи. Она содержится в белках в составе аминокислот, содержание серы в белках составляет 0, 8– 2, 4%. Сера также входит в состав витаминов, гликозидов, коферментов, имеется в растительных эфирных маслах. Сера в изобилии присутствует в земной коре, в углях, сланцах, нефти, природных газах.
• Сера – биогенный элемент, необходимый компонент живой материи. Она содержится в белках в составе аминокислот, содержание серы в белках составляет 0, 8– 2, 4%. Сера также входит в состав витаминов, гликозидов, коферментов, имеется в растительных эфирных маслах. Сера в изобилии присутствует в земной коре, в углях, сланцах, нефти, природных газах.
 • Сера относится к элементам с переменной валентностью. Это обеспечивает ее подвижность. В виде неорганических соединений сера бывает в окисленной форме (сульфаты, политионаты), восстановленной форме (сульфиды) и молекулярной, осуществляя активный окислительно-восстановительный цикл. В природе сера претерпевает разнообразные химические и биологические превращения, переходя из неорганических соединений в органические и обратно, меняя валентность в пределах от – 2 до +6.
• Сера относится к элементам с переменной валентностью. Это обеспечивает ее подвижность. В виде неорганических соединений сера бывает в окисленной форме (сульфаты, политионаты), восстановленной форме (сульфиды) и молекулярной, осуществляя активный окислительно-восстановительный цикл. В природе сера претерпевает разнообразные химические и биологические превращения, переходя из неорганических соединений в органические и обратно, меняя валентность в пределах от – 2 до +6.
 • Циклические превращения соединений серы называются круговоротом серы. • Цикл превращения серы включает окислительные и восстановительные звенья, а также превращения серы без изменения ее валентности. Окислительная часть круговорота серы включает стадии, которые могут протекать в зависимости от условий как чисто химически, так и с участием организмов, главным образом микроорганизмов (это организмы, не видимые невооруженным глазом, включающие микроскопические эукариоты: грибы, водоросли, простейшие и все прокариоты). Восстановительная часть круговорота серы осуществляется преимущественно биологическим путем с доминирующей ролью прокариот в этом процессе, при этом осуществляется восстановление атома серы из состояния максимального окисления (+ 6) до максимального восстановления (– 2). Однако не всегда этот процесс происходит до конца, и в среде нередко обнаруживаются не полностью окисленные продукты: элементная сера, политионаты, сульфит.
• Циклические превращения соединений серы называются круговоротом серы. • Цикл превращения серы включает окислительные и восстановительные звенья, а также превращения серы без изменения ее валентности. Окислительная часть круговорота серы включает стадии, которые могут протекать в зависимости от условий как чисто химически, так и с участием организмов, главным образом микроорганизмов (это организмы, не видимые невооруженным глазом, включающие микроскопические эукариоты: грибы, водоросли, простейшие и все прокариоты). Восстановительная часть круговорота серы осуществляется преимущественно биологическим путем с доминирующей ролью прокариот в этом процессе, при этом осуществляется восстановление атома серы из состояния максимального окисления (+ 6) до максимального восстановления (– 2). Однако не всегда этот процесс происходит до конца, и в среде нередко обнаруживаются не полностью окисленные продукты: элементная сера, политионаты, сульфит.
 • Сера — характерный представитель группы активно дегазируемых элементов. В то же время поступление серы в атмосферу по сравнению с инертными газами или СО 2 сильно затруднено. Это связано со следующими обстоятельствами. Среди газообразных соединений серы, выделяющихся с вулканическими газами, наиболее обычными являются диоксид cepы (IV) и сероводород. В процессе активного дегазирования мантии и прохождения через толщи горных пород газы растворяются в подземных водах. При этом H 2 S активно восстанавливает тяжелые металлы, образуя труднорастворимые сульфиды, главным образом дисульфид железа (пирит), a SO 2 частично связывается в составе также плохо растворимых сульфатов кальция, бария, стронция.
• Сера — характерный представитель группы активно дегазируемых элементов. В то же время поступление серы в атмосферу по сравнению с инертными газами или СО 2 сильно затруднено. Это связано со следующими обстоятельствами. Среди газообразных соединений серы, выделяющихся с вулканическими газами, наиболее обычными являются диоксид cepы (IV) и сероводород. В процессе активного дегазирования мантии и прохождения через толщи горных пород газы растворяются в подземных водах. При этом H 2 S активно восстанавливает тяжелые металлы, образуя труднорастворимые сульфиды, главным образом дисульфид железа (пирит), a SO 2 частично связывается в составе также плохо растворимых сульфатов кальция, бария, стронция.
 • В процессе фракционирования элементов при магматическом процессе сера вместе с металлами отщепляется от силикатного расплава и уходит в пневматолитовогидротермальные флюиды, из которых затем выпадает в виде скоплений сульфидов железа, меди, цинка, свинца и некоторых других металлов. Заметим, что месторождения сульфидных руд составляют всего лишь тысячные доли процента от массы сульфидов металлов, рассеянных в верхней части гранитного слоя земной коры континентов мощностью 1 км.
• В процессе фракционирования элементов при магматическом процессе сера вместе с металлами отщепляется от силикатного расплава и уходит в пневматолитовогидротермальные флюиды, из которых затем выпадает в виде скоплений сульфидов железа, меди, цинка, свинца и некоторых других металлов. Заметим, что месторождения сульфидных руд составляют всего лишь тысячные доли процента от массы сульфидов металлов, рассеянных в верхней части гранитного слоя земной коры континентов мощностью 1 км.
 • Часть диффундирующих через земную кору газообразных соединений серы, а также сернистые газы вулканических выбросов и газово -жидких выделений наземных и подводных гидротерм поступает в систему Мирового океана и педосферу. При этом значительная часть газов захватывается бактериями в своеобразный микробиологический круговорот. Таким образом, дегазируемые соединения серы по пути в атмосферу должны преодолеть двойной фильтр: физико-химический в земной коре и биогеохимический на поверхности суши и на дне океана.
• Часть диффундирующих через земную кору газообразных соединений серы, а также сернистые газы вулканических выбросов и газово -жидких выделений наземных и подводных гидротерм поступает в систему Мирового океана и педосферу. При этом значительная часть газов захватывается бактериями в своеобразный микробиологический круговорот. Таким образом, дегазируемые соединения серы по пути в атмосферу должны преодолеть двойной фильтр: физико-химический в земной коре и биогеохимический на поверхности суши и на дне океана.
 • Глобальный массоперенос серы в биосфере не ограничен миграцией газообразных соединений и включает также миграцию водорастворимых соединений этого элемента в поверхностных и грунтовых водах. Образование водорастворимых форм серы связано с гипергенной трансформацией нерастворимых сульфидов, содержащихся в горных породах, в хорошо растворимые сульфаты. Сульфиды металлов в зоне гипергенеза подвергаются гидролизу и окислению, в результате чего образуется серная кислота, нерастворимые гидроксиды железа(Ш), марганца(IV) и легкорастворимые сульфаты. Образование сульфатов также происходит в почвах в результате микробиологических процессов. Водорастворимые сульфаты выщелачиваются из выветривающихся горных пород и выносятся с поверхности суши с речным стоком. Концентрация ионов [SO 4]2 - в морской воде 2, 7 г/л. В системе Мирового океана аккумулировано 3, 7× 1015 [SO 4]2 -, в том числе 1, 2× 1015 т S.
• Глобальный массоперенос серы в биосфере не ограничен миграцией газообразных соединений и включает также миграцию водорастворимых соединений этого элемента в поверхностных и грунтовых водах. Образование водорастворимых форм серы связано с гипергенной трансформацией нерастворимых сульфидов, содержащихся в горных породах, в хорошо растворимые сульфаты. Сульфиды металлов в зоне гипергенеза подвергаются гидролизу и окислению, в результате чего образуется серная кислота, нерастворимые гидроксиды железа(Ш), марганца(IV) и легкорастворимые сульфаты. Образование сульфатов также происходит в почвах в результате микробиологических процессов. Водорастворимые сульфаты выщелачиваются из выветривающихся горных пород и выносятся с поверхности суши с речным стоком. Концентрация ионов [SO 4]2 - в морской воде 2, 7 г/л. В системе Мирового океана аккумулировано 3, 7× 1015 [SO 4]2 -, в том числе 1, 2× 1015 т S.
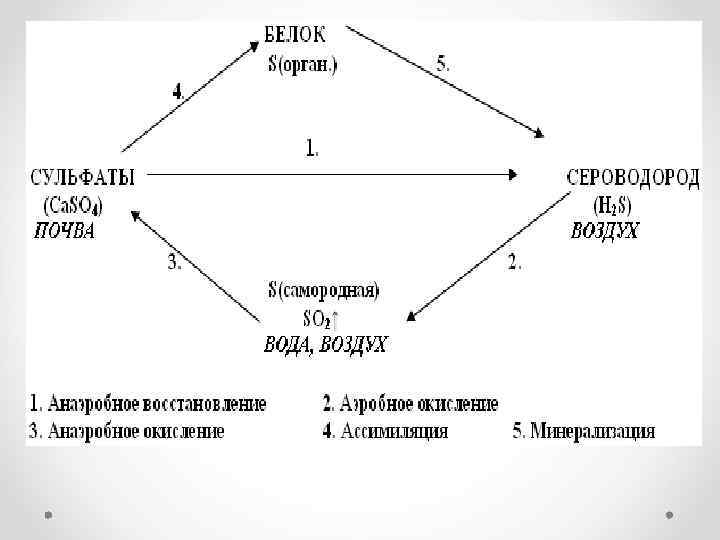
 Ассимиляция сульфата. • Сульфат используется в качестве источника серы почти всеми растениями и микроорганизмами. Сульфат при ассимиляции восстанавливается, чтобы сера могла включиться в органические соединения, так как в живых организмах сера встречается почти исключительно в восстановленной форме в виде сульфгидрильных (-SH) или дисульфидных (-S-S-) групп. В обоих случаях ассимилируется ровно столько питательных веществ, содержащих серу, сколько их необходимо для роста организма, поэтому никакие восстановленные продукты метаболизма серы не выделяются в окружающую среду. В результате биосинтеза сера включается в основном в состав серосодержащих аминокислот: цистин, цистеин, метионин. Вовлечение сульфатов в состав серосодержащих органических веществ носит название ассимиляционной сульфатредукции.
Ассимиляция сульфата. • Сульфат используется в качестве источника серы почти всеми растениями и микроорганизмами. Сульфат при ассимиляции восстанавливается, чтобы сера могла включиться в органические соединения, так как в живых организмах сера встречается почти исключительно в восстановленной форме в виде сульфгидрильных (-SH) или дисульфидных (-S-S-) групп. В обоих случаях ассимилируется ровно столько питательных веществ, содержащих серу, сколько их необходимо для роста организма, поэтому никакие восстановленные продукты метаболизма серы не выделяются в окружающую среду. В результате биосинтеза сера включается в основном в состав серосодержащих аминокислот: цистин, цистеин, метионин. Вовлечение сульфатов в состав серосодержащих органических веществ носит название ассимиляционной сульфатредукции.
 • В ходе круговорота серы может образоваться серная кислота, которая взаимодействует с различными слоями почвы и воды, переводит их в сульфаты: • Ca. CO 3 + H 2 SO 4 = Ca. SO 4 + SO 2 + H 2 O. • Так образуются различные минералы, содержащие серу.
• В ходе круговорота серы может образоваться серная кислота, которая взаимодействует с различными слоями почвы и воды, переводит их в сульфаты: • Ca. CO 3 + H 2 SO 4 = Ca. SO 4 + SO 2 + H 2 O. • Так образуются различные минералы, содержащие серу.
 • Процесс восстановления сульфатов в сероводород протекает в меньшей степени. Залежи сульфатов в результате геологических смещений могут попасть в более глубокие слои земли, где при высокой температуре реагируют с органическими веществами: CH 4 + Ca. SO 4 = Ca. CO 3 + H 2 S + H 2 O.
• Процесс восстановления сульфатов в сероводород протекает в меньшей степени. Залежи сульфатов в результате геологических смещений могут попасть в более глубокие слои земли, где при высокой температуре реагируют с органическими веществами: CH 4 + Ca. SO 4 = Ca. CO 3 + H 2 S + H 2 O.
 • Первичное накопление сероводорода протекало в рамках анаэробных процессов. В атмосфере кислорода сероводород легко окисляется до свободной серы или оксида серы (IV). H 2 S + O 2 S + H 2 O + 527 кдж • В вулканических газах: H 2 S + SO 2 S + H 2 O. • Избытком кислорода воздуха в водоёмах сера переводиться в серную кислоту: S + O 2 + H 2 O H 2 SO 4 + 1051 кдж. • Этот процесс осуществляют специальные микроорганизмы.
• Первичное накопление сероводорода протекало в рамках анаэробных процессов. В атмосфере кислорода сероводород легко окисляется до свободной серы или оксида серы (IV). H 2 S + O 2 S + H 2 O + 527 кдж • В вулканических газах: H 2 S + SO 2 S + H 2 O. • Избытком кислорода воздуха в водоёмах сера переводиться в серную кислоту: S + O 2 + H 2 O H 2 SO 4 + 1051 кдж. • Этот процесс осуществляют специальные микроорганизмы.
 • В воздухе среднее время жизни сероводорода около 2 суток. Cероводород- сильный восстановитель, поэтому он не накапливается в воздухе. Образующийся при окислении оксид серы (VI) H 2 S + O 2 SO 2 + H 2 O, приводит к образованию аэрозолей и кислотных дождей. Время жизни SO 2 в атмосфере составляет 4 суток. Основной вред окружающей среде наносит не столько сам оксид серы (VI), сколько продукт его окисления – оксид серы (IV) SO 3. Он растворяется в капельках воды с образованием серной кислоты: • SO 3 + H 2 O == H 2 SO 4.
• В воздухе среднее время жизни сероводорода около 2 суток. Cероводород- сильный восстановитель, поэтому он не накапливается в воздухе. Образующийся при окислении оксид серы (VI) H 2 S + O 2 SO 2 + H 2 O, приводит к образованию аэрозолей и кислотных дождей. Время жизни SO 2 в атмосфере составляет 4 суток. Основной вред окружающей среде наносит не столько сам оксид серы (VI), сколько продукт его окисления – оксид серы (IV) SO 3. Он растворяется в капельках воды с образованием серной кислоты: • SO 3 + H 2 O == H 2 SO 4.
 • Образование в атмосферной влаге серной кислоты приводит к выпадению кислотных дождей. Из-за этого увеличивается кислотность пресных водоёмов, что приводит к гибели рыб и других водных организмов. Под действием кислотных дождей ускоренно коррозируют металлоконструкции, разрушаются здания и памятники архитектуры.
• Образование в атмосферной влаге серной кислоты приводит к выпадению кислотных дождей. Из-за этого увеличивается кислотность пресных водоёмов, что приводит к гибели рыб и других водных организмов. Под действием кислотных дождей ускоренно коррозируют металлоконструкции, разрушаются здания и памятники архитектуры.
 • В кислой среде возрастает растворимость гидроксида алюминия. Избыток ионов алюминия в воде токсичен для рыб, к тому же алюминий связывает фосфаты, что приводит к снижению питательных запасов в водоёме. Это создаёт опасность токсического загрязнения водных и почвенных экосистем. Кислотные дожди приводят к гибели растений, особенно хвойных пород. При закисление почв происходит выщелачивание кальция, магния и калия, возрастает подвижность токсичных металлов, меняется состав почвенных микроорганизмов.
• В кислой среде возрастает растворимость гидроксида алюминия. Избыток ионов алюминия в воде токсичен для рыб, к тому же алюминий связывает фосфаты, что приводит к снижению питательных запасов в водоёме. Это создаёт опасность токсического загрязнения водных и почвенных экосистем. Кислотные дожди приводят к гибели растений, особенно хвойных пород. При закисление почв происходит выщелачивание кальция, магния и калия, возрастает подвижность токсичных металлов, меняется состав почвенных микроорганизмов.
 • • В отношении оксида серы (VI), -- поглощение газа раствором щёлочи или известковым молоком. Для лабораторных опытов оба метода приемлемы, однако в промышленных масштабах они не рентабельны, так как производство щелочей обходиться достаточно дорого, а в случае использования известкового молока образующийся сульфид кальция идёт в отвал, занимая большие территории и выводя серу из её круговорота. К наиболее эффективным методам утилизации оксида серы (VI) можно отнести: а) аммиачный: SO 2 + 2 NH 3 + H 2 O = (NH 4)2 SO 3; (NH 4)2 SO 3 + SO 2 + H 2 O = 2 NH 4 HSO 3; 2 NH 4 HSO 3 + (NH 4)2 SO 3 = 2( NH 4)2 SO 4 + S + H 2 O. (сульфат аммония – удобрение); б) улавливание оксида серы (VI) сероводородом и получением свободной серы, либо при дальнейшем окислении серной кислоты: 2 H 2 S + SO 2 = 3 S + 2 H 2 O. Этот способ позволяет утилизировать и другой загрязнитель сероводород.
• • В отношении оксида серы (VI), -- поглощение газа раствором щёлочи или известковым молоком. Для лабораторных опытов оба метода приемлемы, однако в промышленных масштабах они не рентабельны, так как производство щелочей обходиться достаточно дорого, а в случае использования известкового молока образующийся сульфид кальция идёт в отвал, занимая большие территории и выводя серу из её круговорота. К наиболее эффективным методам утилизации оксида серы (VI) можно отнести: а) аммиачный: SO 2 + 2 NH 3 + H 2 O = (NH 4)2 SO 3; (NH 4)2 SO 3 + SO 2 + H 2 O = 2 NH 4 HSO 3; 2 NH 4 HSO 3 + (NH 4)2 SO 3 = 2( NH 4)2 SO 4 + S + H 2 O. (сульфат аммония – удобрение); б) улавливание оксида серы (VI) сероводородом и получением свободной серы, либо при дальнейшем окислении серной кислоты: 2 H 2 S + SO 2 = 3 S + 2 H 2 O. Этот способ позволяет утилизировать и другой загрязнитель сероводород.
 • Превращение органических соединений серы с образованием H 2 S. • Для живых организмов сера доступна в основном в форме растворимых сульфатов или восстановленных органических соединений серы. • При минерализации органических серосодержащих соединений сера освобождается в неорганической восстановленной форме в виде H 2 S. В освобождении серы из органических серосодержащих соединений (продукты метаболизма живых существ, отмершие растительные и животные остатки) принимают участие сапрофитные микроорганизмы, способные к аммонификации. При аммонификации серосодержащие белки и нуклеиновые кислоты разлагаются с образованием СО 2, мочевины, органических кислот, аминов и, что важно для цикла серы, H 2 S и меркаптанов (тиоспирты). Меркаптаны в аэробных условиях также окисляются с выделением H 2 S.
• Превращение органических соединений серы с образованием H 2 S. • Для живых организмов сера доступна в основном в форме растворимых сульфатов или восстановленных органических соединений серы. • При минерализации органических серосодержащих соединений сера освобождается в неорганической восстановленной форме в виде H 2 S. В освобождении серы из органических серосодержащих соединений (продукты метаболизма живых существ, отмершие растительные и животные остатки) принимают участие сапрофитные микроорганизмы, способные к аммонификации. При аммонификации серосодержащие белки и нуклеиновые кислоты разлагаются с образованием СО 2, мочевины, органических кислот, аминов и, что важно для цикла серы, H 2 S и меркаптанов (тиоспирты). Меркаптаны в аэробных условиях также окисляются с выделением H 2 S.
 Прямое образование H 2 S из сульфата и элементной серы. • Процессы образования в биосфере сероводорода связывают в основном с деятельностью сульфатредуцирующих бактерий, имеющих большое значение для глобального круговорота серы. Сульфатредуцирующие бактерии осуществляют диссимиляционную сульфатредукцию, представляющую собой анаэробное дыхание, при котором сульфат служит конечным акцептором электронов (вместо кислорода) при окислении органических веществ или молекулярного водорода. Поэтому энергетический тип обмена у сульфатредуцирующих бактерий часто называют сульфатным дыханием. Схематически процесс восстановления сульфатов при диссимиляционной сульфатредукции можно представить следующим образом: SO 42 -→SO 32 -→S 3 O 62 -→S 2 O 32 -→S 2 -.
Прямое образование H 2 S из сульфата и элементной серы. • Процессы образования в биосфере сероводорода связывают в основном с деятельностью сульфатредуцирующих бактерий, имеющих большое значение для глобального круговорота серы. Сульфатредуцирующие бактерии осуществляют диссимиляционную сульфатредукцию, представляющую собой анаэробное дыхание, при котором сульфат служит конечным акцептором электронов (вместо кислорода) при окислении органических веществ или молекулярного водорода. Поэтому энергетический тип обмена у сульфатредуцирующих бактерий часто называют сульфатным дыханием. Схематически процесс восстановления сульфатов при диссимиляционной сульфатредукции можно представить следующим образом: SO 42 -→SO 32 -→S 3 O 62 -→S 2 O 32 -→S 2 -.
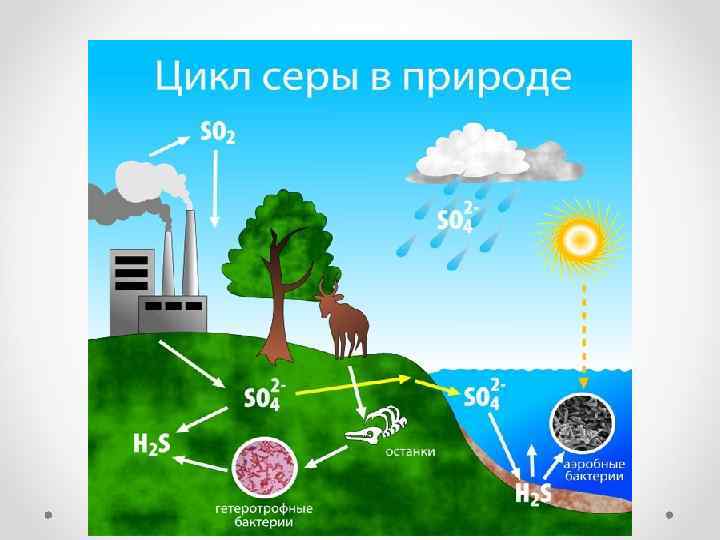
 • Биогеохимический цикл серы состоит из 4 стадий : • усвоение соединений серы живыми организмами (растениями и бактериями) и включение серы в состав белков и аминокислот. • Превращение органической серы живыми организмами (животными и бактериями) в конечный продукт – сероводород. • Окисление минеральной серы живыми организмами (серобактериями, тионовыми бактериями) в процессе сульфатредукции. На этой стадии происходит окисление сероводорода, элементарной серы, ее тио- и тетрасоединений. • Восстановление минеральной серы живыми организмами (бактериями) в процессе десульфофикации до сероводорода. Таким образом, важнейшим звеном всего биогеохимического цикла серы в биосфере является биогенное образование сероводорода.
• Биогеохимический цикл серы состоит из 4 стадий : • усвоение соединений серы живыми организмами (растениями и бактериями) и включение серы в состав белков и аминокислот. • Превращение органической серы живыми организмами (животными и бактериями) в конечный продукт – сероводород. • Окисление минеральной серы живыми организмами (серобактериями, тионовыми бактериями) в процессе сульфатредукции. На этой стадии происходит окисление сероводорода, элементарной серы, ее тио- и тетрасоединений. • Восстановление минеральной серы живыми организмами (бактериями) в процессе десульфофикации до сероводорода. Таким образом, важнейшим звеном всего биогеохимического цикла серы в биосфере является биогенное образование сероводорода.
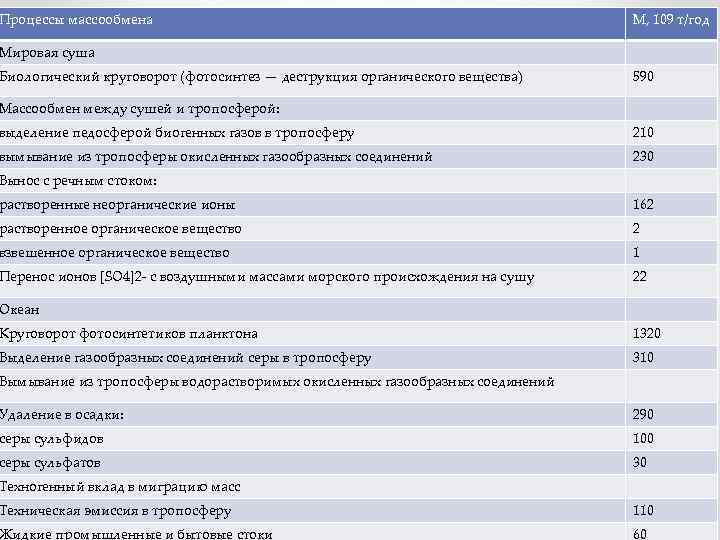 Процессы массообмена М, 109 т/год Мировая суша Биологический круговорот (фотосинтез — деструкция органического вещества) 590 Массообмен между сушей и тропосферой: выделение педосферой биогенных газов в тропосферу 210 вымывание из тропосферы окисленных газообразных соединений 230 Вынос с речным стоком: растворенные неорганические ионы 162 растворенное органическое вещество 2 взвешенное органическое вещество 1 Перенос ионов [SO 4]2 - c воздушными массами морского происхождения на сушу 22 Океан Круговорот фотосинтетиков планктона 1320 Выделение газообразных соединений серы в тропосферу 310 Вымывание из тропосферы водорастворимых окисленных газообразных соединений Удаление в осадки: 290 серы сульфидов 100 серы сульфатов 30 Техногенный вклад в миграцию масс Техническая эмиссия в тропосферу 110 Жидкие промышленные и бытовые стоки 60
Процессы массообмена М, 109 т/год Мировая суша Биологический круговорот (фотосинтез — деструкция органического вещества) 590 Массообмен между сушей и тропосферой: выделение педосферой биогенных газов в тропосферу 210 вымывание из тропосферы окисленных газообразных соединений 230 Вынос с речным стоком: растворенные неорганические ионы 162 растворенное органическое вещество 2 взвешенное органическое вещество 1 Перенос ионов [SO 4]2 - c воздушными массами морского происхождения на сушу 22 Океан Круговорот фотосинтетиков планктона 1320 Выделение газообразных соединений серы в тропосферу 310 Вымывание из тропосферы водорастворимых окисленных газообразных соединений Удаление в осадки: 290 серы сульфидов 100 серы сульфатов 30 Техногенный вклад в миграцию масс Техническая эмиссия в тропосферу 110 Жидкие промышленные и бытовые стоки 60
 • Изъятие серы из биосферного круговорота происходит в результате накопления сульфатных отложений (в основном гипсовых), слои и линзы которых становятся компонентами литосферы. Компенсируются потери во-первых, в процессах вулканизма (поступление H 2 S и SOx в атмосферу, а оттуда, с атмосферными осадками – на поверхность Земли). А во-вторых, в результате деятельности термальных вод, с которыми в верхние горизонты земной коры и на дно Мирового океана поступают сульфидные соединения.
• Изъятие серы из биосферного круговорота происходит в результате накопления сульфатных отложений (в основном гипсовых), слои и линзы которых становятся компонентами литосферы. Компенсируются потери во-первых, в процессах вулканизма (поступление H 2 S и SOx в атмосферу, а оттуда, с атмосферными осадками – на поверхность Земли). А во-вторых, в результате деятельности термальных вод, с которыми в верхние горизонты земной коры и на дно Мирового океана поступают сульфидные соединения.
 • Таким образом, к характерным особенностям круговорота серы можно отнести второстепенную роль процессов атмосферной миграции, а также многообразие форм нахождения, обусловленное переходом её из сульфидных форм в сульфатные и обратно, в зависимости от изменения окислительновосстановительных условий.
• Таким образом, к характерным особенностям круговорота серы можно отнести второстепенную роль процессов атмосферной миграции, а также многообразие форм нахождения, обусловленное переходом её из сульфидных форм в сульфатные и обратно, в зависимости от изменения окислительновосстановительных условий.
 • Промышленные процессы выносят в атмосферу большое количество серы. В отдельных случаях значительная концентрация соединений серы в воздухе служит причиной нарушений в окружающей среде, в том числе, кислотных дождей. Присутствие в воздухе двуокиси серы негативно влияет как на высшие растения, так и на лишайники, причем эпифитные лишайники могут служить индикаторами повышенных содержаний серы в воздухе. Лишайники поглощают влагу из атмосферы всем слоевищем, поэтому концентрация серы в них быстро достигает предельно допустимого уровня, что ведет к гибели организмов.
• Промышленные процессы выносят в атмосферу большое количество серы. В отдельных случаях значительная концентрация соединений серы в воздухе служит причиной нарушений в окружающей среде, в том числе, кислотных дождей. Присутствие в воздухе двуокиси серы негативно влияет как на высшие растения, так и на лишайники, причем эпифитные лишайники могут служить индикаторами повышенных содержаний серы в воздухе. Лишайники поглощают влагу из атмосферы всем слоевищем, поэтому концентрация серы в них быстро достигает предельно допустимого уровня, что ведет к гибели организмов.
 • Поступление серы в общий круговорот по данным Дж. П. Френда (1976) следующее: • При дегазации земной коры – 12 х1012 г/год; при выветривании осадочных пород – 42 х1012 г/год, ; антропогенные поступления в виде сернистого газа – 65 х1012 г/год, что в сумме составляет 119 х1012 г/год. Значительные количества серы ежегодно консервируются в виде сульфидов и сульфатов – 100 х1012 г/год и , таким образом. , временно выводятся из общего биогеохимического круговорота. • Таким образом, антропогенное поступление серы в биосферу существенно изменяет круговорот этого элемента, а приход серы в биосферу превышает ее расход, в результате чего, должно происходить постепенное ее накопление.
• Поступление серы в общий круговорот по данным Дж. П. Френда (1976) следующее: • При дегазации земной коры – 12 х1012 г/год; при выветривании осадочных пород – 42 х1012 г/год, ; антропогенные поступления в виде сернистого газа – 65 х1012 г/год, что в сумме составляет 119 х1012 г/год. Значительные количества серы ежегодно консервируются в виде сульфидов и сульфатов – 100 х1012 г/год и , таким образом. , временно выводятся из общего биогеохимического круговорота. • Таким образом, антропогенное поступление серы в биосферу существенно изменяет круговорот этого элемента, а приход серы в биосферу превышает ее расход, в результате чего, должно происходить постепенное ее накопление.
 • В последние десятилетия природный цикл серы подвергается усиливающемуся антропогенному воздействию, приводя к накоплению токсических соединений серы и нарушению баланса природного цикла серы. В частности, в результате крупномасштабных выбросов серных соединений образуются двуокись серы, выделяемая ТЭЦ при сжигании органического топлива, сероводород и летучие органические сульфиды, выделяемые целлюлозно-бумажными и металлургическими предприятиями, а также при разложении муниципальных и сельскохозяйственных стоков. Эти соединения токсичны уже в микрограммовых концентрациях. Они способны отравлять воздух, влиять на атмосферную химию, вызывать дефицит растворенного в воде кислорода.
• В последние десятилетия природный цикл серы подвергается усиливающемуся антропогенному воздействию, приводя к накоплению токсических соединений серы и нарушению баланса природного цикла серы. В частности, в результате крупномасштабных выбросов серных соединений образуются двуокись серы, выделяемая ТЭЦ при сжигании органического топлива, сероводород и летучие органические сульфиды, выделяемые целлюлозно-бумажными и металлургическими предприятиями, а также при разложении муниципальных и сельскохозяйственных стоков. Эти соединения токсичны уже в микрограммовых концентрациях. Они способны отравлять воздух, влиять на атмосферную химию, вызывать дефицит растворенного в воде кислорода.
 • Как следует из изложенного, своеобразие глобального цикла серы в биосфере обусловлено следующими причинами. Вопервых, способностью этого элемента под влиянием микробиологических процессов образовывать газообразные соединения (SO 2, H 2 S и некоторые другие) и благодаря этому активно участвовать в массообмене между сушей и океаном, с одной стороны, и атмосферой — с другой. Вовторых, трансформацией сернистых газов в хорошо растворимые сульфаты и заменой газовой миграции серы на водную. Это происходит благодаря быстрому окислению восстановленных и недоокисленных сернистых газов кислородом атмосферы и образованием хорошо растворимых сульфатов, легко вымывающихся из атмосферы и включающихся в водную миграцию. В-третьих, широким развитием сульфатредуцирующих бактериальных процессов в водных бассейнах и гидроморфных ландшафтах, куда поступают с водой растворенные сульфаты. Образующийся при разрушении сульфатов сероводород переводит растворенные в воде железо и другие металлы в форму труднорастворимых сульфидов, которые уходят в осадки морей и надолго прочно связывают крупные массы серы.
• Как следует из изложенного, своеобразие глобального цикла серы в биосфере обусловлено следующими причинами. Вопервых, способностью этого элемента под влиянием микробиологических процессов образовывать газообразные соединения (SO 2, H 2 S и некоторые другие) и благодаря этому активно участвовать в массообмене между сушей и океаном, с одной стороны, и атмосферой — с другой. Вовторых, трансформацией сернистых газов в хорошо растворимые сульфаты и заменой газовой миграции серы на водную. Это происходит благодаря быстрому окислению восстановленных и недоокисленных сернистых газов кислородом атмосферы и образованием хорошо растворимых сульфатов, легко вымывающихся из атмосферы и включающихся в водную миграцию. В-третьих, широким развитием сульфатредуцирующих бактериальных процессов в водных бассейнах и гидроморфных ландшафтах, куда поступают с водой растворенные сульфаты. Образующийся при разрушении сульфатов сероводород переводит растворенные в воде железо и другие металлы в форму труднорастворимых сульфидов, которые уходят в осадки морей и надолго прочно связывают крупные массы серы.
 • При ассимиляции часть серы усваивается и фиксируется в организме: 2 - SO 4 S (орган. ). Сера входит в состав трёх аминокислот – метионина, цистеина и цистина; белков, алкалоидов, витамина В 1 (тиамина), гормона инсулина. Она играет основную роль в образовании четвертичной структуры белков. Входит в состав хрящевой ткани, волос, ногтей. При недостатке серы в организме наблюдается хрупкость костей и выпадение волос. Сера необходима для обезвреживания в печени ядовитых веществ, поступающих из толстого кишечника в результате гниения. В сутки человеку необходимо около 1 г серы и это удовлетворяется обычным рационом питания.
• При ассимиляции часть серы усваивается и фиксируется в организме: 2 - SO 4 S (орган. ). Сера входит в состав трёх аминокислот – метионина, цистеина и цистина; белков, алкалоидов, витамина В 1 (тиамина), гормона инсулина. Она играет основную роль в образовании четвертичной структуры белков. Входит в состав хрящевой ткани, волос, ногтей. При недостатке серы в организме наблюдается хрупкость костей и выпадение волос. Сера необходима для обезвреживания в печени ядовитых веществ, поступающих из толстого кишечника в результате гниения. В сутки человеку необходимо около 1 г серы и это удовлетворяется обычным рационом питания.
 • В организме человека сероводород образуется в нижнем отделе кишечника в процессе распада серосодержащих аминокислот при действии микроорганизмов, после смерти организма или в процессе кулинарной обработки. Он имеет характерный запах тухлых яиц. Важно, что человек довольно быстро теряет способность ощущать запах сероводорода; это очень опасно, т. к. сероводород более ядовит, чем цианистый водород. В очень небольших концентрациях — приятный запах свежесваренных яиц; сероводород, действительно, образуется при разложении богатых серой молекул белка яичного альбумина. Другим признаком присутствия сероводорода является светло-жёлтая окраска на границе, разделяющей белок и желток варёного яйца; она обусловлена сульфидом железа(II), образующимся при взаимодействии сероводорода и железосодержащими белками желтка.
• В организме человека сероводород образуется в нижнем отделе кишечника в процессе распада серосодержащих аминокислот при действии микроорганизмов, после смерти организма или в процессе кулинарной обработки. Он имеет характерный запах тухлых яиц. Важно, что человек довольно быстро теряет способность ощущать запах сероводорода; это очень опасно, т. к. сероводород более ядовит, чем цианистый водород. В очень небольших концентрациях — приятный запах свежесваренных яиц; сероводород, действительно, образуется при разложении богатых серой молекул белка яичного альбумина. Другим признаком присутствия сероводорода является светло-жёлтая окраска на границе, разделяющей белок и желток варёного яйца; она обусловлена сульфидом железа(II), образующимся при взаимодействии сероводорода и железосодержащими белками желтка.
 • Причины нарушения круговорота серы в природе: • Сжигание ископаемого топлива и переработка сульфидных руд привели к существенному увеличению содержания оксида серы (VI) в воздухе, что во много раз превышает уровень природного загрязнения биосферы этим оксидом. • Последствия антропогенного воздействия на процессы в окружающей среде • Снижается биологическая продуктивность из-за угнетения процессов фотосинтеза и закисление почвы.
• Причины нарушения круговорота серы в природе: • Сжигание ископаемого топлива и переработка сульфидных руд привели к существенному увеличению содержания оксида серы (VI) в воздухе, что во много раз превышает уровень природного загрязнения биосферы этим оксидом. • Последствия антропогенного воздействия на процессы в окружающей среде • Снижается биологическая продуктивность из-за угнетения процессов фотосинтеза и закисление почвы.
 Спасибо за внимание!!!
Спасибо за внимание!!!


