1.Обзор кроветворения 2013 word 2003.ppt
- Количество слайдов: 116

Кроветворение - это образование и развитие клеток крови

Наработка и гибель клеток крови (фабрика) 5 тонн Каждую минуту в костном мозге производится 300 000 клеток крови

Соблюдение баланса Клетки крови должны быть вовремя наработаны и вовремя умереть. 1. Как обеспечить такую огромную клеточную продукцию? 2. Как обеспечить своевременную гибель клеток?

В основе поддержания системы лежат стволовые кроветворные клетки (СКК) Определение 1. СК способны к дифференцировке во все клеточные линии данной ткани; 2. СК способны к самоподдержанию, то есть к воспроизведению себе подобных.

Точка зрения клеточного биолога

Точка зрения молекулярного биолога

Точка зрения физиолога
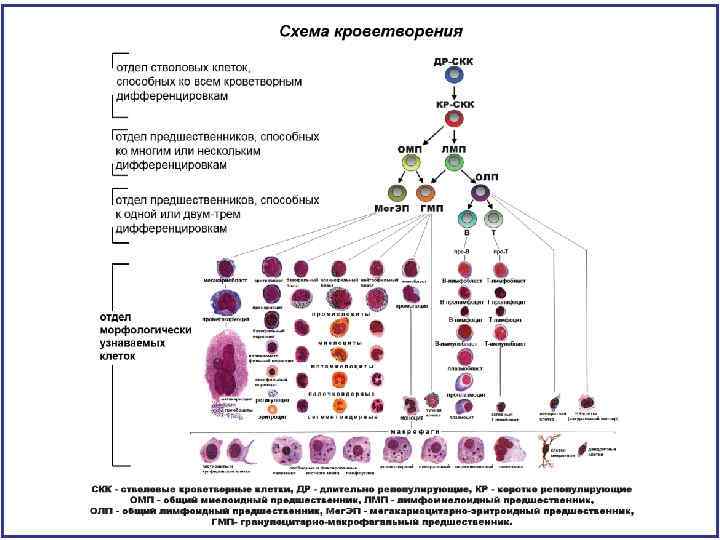

То, что видят морфологи в световой микроскоп в костном мозге

То, что «не видят» , а определяют в костном мозге физиологи, оперирующие функциональными тестами

Функциональные тесты 1. Стволовые кроветворные клетки (СКК) Восстановление кроветворения у летально облученных животных. 2. Полипотентные кроветворные клетки предшественники Колониеобразующие единицы в селезенке (КОЕс-CFU-S). Колониеобразующие единицы в культуре (КОЕк- КОЕ-ГМ, КОЕ-Э, КОЕ-М, БОЕ-Э). (CFU-C-CFU-GM, CFU-E, CFU-M, BFU-E) Клетки образующие области булыжника в культуре (КООБ-CAFC).

Функциональные тесты Восстановление кроветворения у летально облученных животных. 1. Облучение – летальная доза для разных линий животных разная – От 8, 5 до 12 Gy 2. Введение клеток внутривенно 3. Необходимое количество клеток: для мыши – 100000 (вводят 250000) для человека 108 на кг веса (вводят 3 х108 на кг )

А. Восстановление кроветворения у летально облученных животных Метод лимитирующих разведений 1 группа – 100 000 клеток костного мозга 2 группа– 50 000 клеток костного мозга 3 группа – 25 000 клеток костного мозга 4 группа – 12 500 клеток костного мозга

Восстановление кроветворения у летально облученных животных Метод лимитирующих разведений 1. Анализ количества выживших в течение 4 -х месяцев животных 2. Определение количества длительно репопулирующих стволовых клеток (LTR-HSC) по формуле Пуассона Среднее количество LTR-HSC = - ln a/N, где а –количество умерших мышей в данном разведении N – общее количество мышей

Б. Метод конкурентной репопуляции Схема эксперимента. Опытная группа: Контрольная группа: CD 45. 1+ CD 45. 2+ Костный мозг Смеси КМ (группы): 1 часть КМ самца + 1 часть КМ самки 1 часть КМ самца + 3 часть КМ самки 1 часть КМ самца + 19 часть КМ самки + CD 45. 2+ Костный мозг + 10 Гр У восстановленных мышей через 3, 10 и 16 месяцев берут костный мозг и трансплантируют вторичным облученным реципиентам. Изучают, какому полу принадлежат КОЕс. ПЦР анализ Золотой стандарт для определения СКК

То, что «не видят» , а определяют в костном мозге физиологи, оперирующие функциональными тестами

Функциональные тесты Б. Полипотентные кроветворные клетки - предшественницы 1. Колониеобразующие единицы в селезенке (КОЕс-CFU-S). 2. Колониеобразующие единицы в культуре (КОЕк- КОЕ-ГМ, КОЕ-Э, КОЕ-М, БОЕ-Э). (CFU-C-CFU-GM, CFU-E, CFU-M, BFU-E) 3. Клетки образующие области булыжника в культуре (КООБ-CAFC).

James Till, MD, left, and Ernest Mc. Culloch, MD, in 2005.

Колониеобразующие единицы в селезенке (КОЕс) (Till, Mc. Cullock, 1961) Эритроидная Гранулоцитарная Облучение 10 Gy Мегакариоцитарная 7 -14 дней Недифференцированная

Колониеобразующие единицы в селезенке (КОЕс)

Колония в селезенке происходит из 1 клетки Облучение 3 Gy Облучение 10 Gy 7 -14 дней Все клетки колонии несут один и тот же маркер.

Колонии в селезенке происходят из разных предшественников (тестирование в разные сроки после инъекции клеток костного мозга) 8 суток 12 суток

Способность КОЕс к самоподдержанию (пролиферативный потенциал) Облучение 10 Gy Определение числа дочерних колоний

Гетерогенность КОЕс по пролиферативному потенциалу

Гетерогенность КОЕс по пролиферативному потенциалу

Гетерогенность КОЕс по пролиферативному потенциалу

Сочетание работы клеточных биологов и физиологов позволило определить некоторые маркеры кроветворных клеток http: //en. wikipedia. org/wiki/List_of_human_clusters_of_differentiation Type of cell CD markers stem cells CD 34+, CD 31 - all leukocyte groups CD 45+ Granulocyte CD 45+, CD 15+ Monocyte CD 45+, CD 14+ T lymphocyte CD 45+, CD 3+ T helper cell CD 45+, CD 3+, CD 4+ Cytotoxic T cell CD 45+, CD 3+, CD 8+ B lymphocyte CD 45+, CD 19+ or CD 45+, CD 20+ Thrombocyte CD 45+, CD 61+ Natural killer cell CD 16+, CD 56+, CD 3 www. e. Bioscience. com

Гетерогенность СКК Маркеры стволовых клеток CD 34 c-kit • Маркеры стволовых клеток • СD 34 – молекула адгезии • CD 38 – фермент активный в Т и В клетках • c-kit – рецептор фактора роста СКК • Sca 1 - молекула адгезии (stem cell antigen) • Rho low • Ho low • CD 33 – молекула адгезии • CD 150 - SLAMF 1 (Signaling lymphocytic activation molecule) • • CD 135 - fms-like tyrosine kinase receptor-3 (Flt 3), fetal liver kinase-2 (Flk 2) CD 48 - SLAMF 2

Y Y Y Выделение стволовых клеток В Т Б М Эо Y Н Ter 119 и рецептор к трансферину Y Y
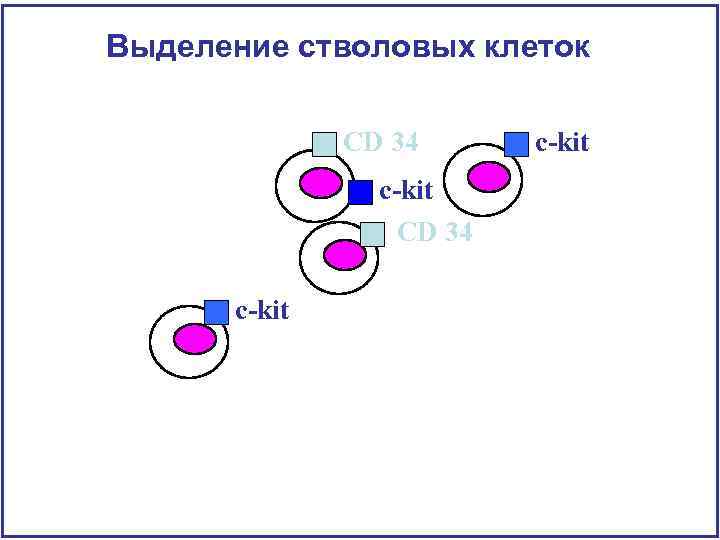
Выделение стволовых клеток CD 34 c-kit


Fillipovich - lecture -2009

Общая информация о кроветворении

Пирамида кроветворных субпопуляций • Кроветворение идет в одном направлении • Пролиферативный потенциал уменьшается • Не происходит смены линейной дифференцировки СКК Коммитированные предшественники Делящиеся и Созревающие клетки

Основные принципы продукции клеток крови • • 1. 2. Клетки крови имеют короткую продолжительность жизни. Клетки крови на поздней стадии дифференцировки и зрелые не делятся. В организме должен быть либо запас стволовых клеток, либо они должны пополняться. Для продукции требуемого количества нормально функционирующих клеток необходимо: пролиферация исходных клеток дифференцировка клеток по мере деления.

Где происходит кроветворение? Места кроветворения: • Эмбрион: желточный мешок, область Аорты-Гонады-Мезонефроса, печень, селезенка. . • Зародыш: печень, селезенка, костный мозг. . • После рождения: костный мозг. . • Молодые особи: длинные и плоские кости. • Взрослые особи: плоские кости и окончания длинных костей.

Развитие зачатка крови Baron 2012

Образование кроветворных клеток в области дорзальной аорты (рыба вьюнок) Kissa, 2010

Образование кроветворных клеток в области дорзальной аорты (рыба вьюнок) Kissa, 2010

Образование кроветворных клеток в области дорзальной аорты (рыба вьюнок) Kissa, 2010

Образование кроветворных клеток в области аорты-гонады-мезонефроса (зародыш мыши) time-lapse confocal imaging new dissection procedure GFP c-kit+ CD 34+ Ly-6 A-GFP Boisset, 2010

Образование кроветворных клеток в области аорты-гонады-мезонефроса (зародыш мыши) GFP c-kit+ CD 34+ Boisset, 2010

Развитие СКК из эндотелия

Образование кроветворных клеток в области дорзальной аорты Вьюнок Мышь/Человек Swiers, 2010

Регуляция образования кроветворных клеток Сhen-2011

Стадии эмбрионального кроветворения у человека
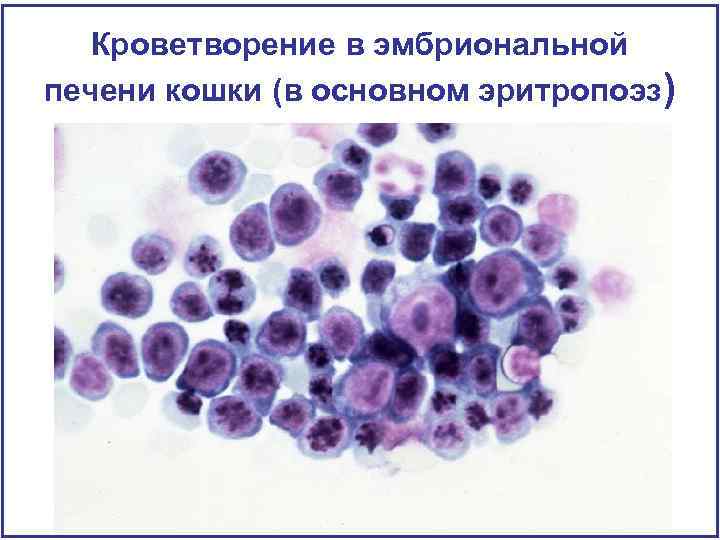
Кроветворение в эмбриональной печени кошки (в основном эритропоэз)

Ядерные эритроциты в крови эмбриона коровы

Места возможного получения аспиратов костного мозга

Места кроветворения у взрослых

Распределение кроветворной ткани в организме мыши Бедра 10% Ребра 8 % Тазовые кости 7% Плечи 5% Голени 4% Череп 11% Другие места 3% Позвоночник 52% Quesenberry P. J.


Вид костного мозга на срезе

Вид костного мозга на отпечатке

Мазок костного мозга с мегакариоцитом

Микрофотография костного мозга на сканирующем электронном микроскопе

Трехмерная архитектура костного мозга воспроизведенная с помощью конфокального микроскопа Takaku-2010

differential interference contrast (DIC) Takaku-2010
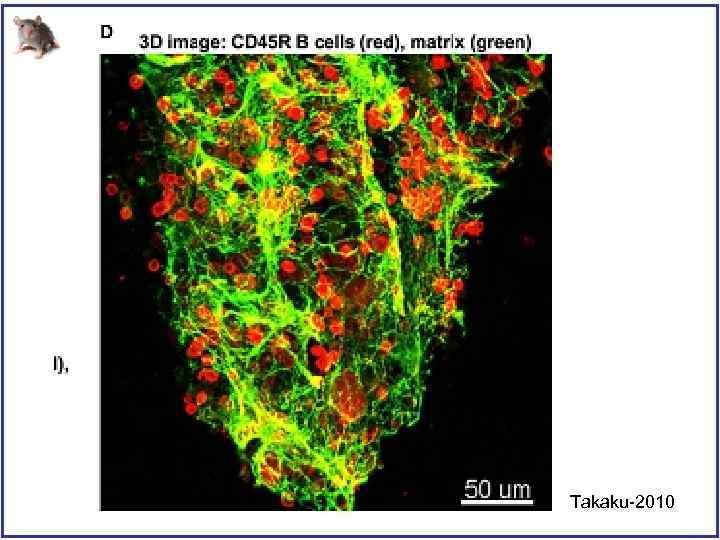
Takaku-2010

Takaku-2010

Takaku-2010

Takaku-2010
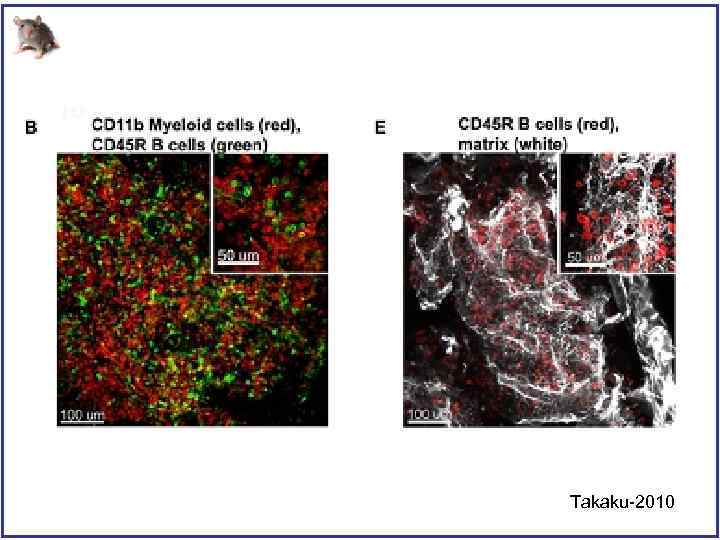
Takaku-2010

Takaku-2010

Трехмерная архитектура костного мозга после трансплантации клеток костного мозга LSC – Lin-, Sca 1+, c-kit+ Takaku-2010

Трехмерная архитектура костного мозга после трансплантации клеток костного мозга Takaku-2010

Трехмерная архитектура костного мозга после трансплантации клеток костного мозга Takaku-2010

Трехмерная архитектура костного мозга после трансплантации клеток костного мозга Takaku-2010

2009

Ткани, участвующие в кроветворении • В костном мозге –продуцируется большинство клеток крови • В лимфатических узлах, тимусе и селезенке – продуцируется большинство лимфоцитов • Печень, селезенка и костный мозг – хранилище железа • Почки – продуцируют эритропоэтин • Эндотелий, клетки воспаления – продуцируют множество стимуляторов кроветворения • Кишечник – источник питания

Резервы кроветворной ткани • При запросе на клетки крови неактивные участки костного мозга, состоящие в основном из жировых клеток, переходят в активное состояние и начинают продуцировать клетки крови. • Аналогично в селезенке и печени возможна продукция кроветворных клеток при экстремальном запросе на клетки крови. Такая активность называется экстамедулярным кроветворением и случается очень редко при отсутствии трансформации.

Продолжительность жизни клеток крови • • Эритроциты 90 -120 дней Тромбоциты 10 -14 дней Гранулоциты 8 -10 часов Лимфоциты от 2 дней до многих лет

Дифференцировка СКК

Дифференцировка СКК • Alexander A. Maximow (18741928) • "Der Lymphozyt als gemeinsame Stammzelle der verschiedenen Blutelemente in der embrionalen Entwicklung und im postfetalen Leben den Saugetiere " ("Fol. Haematology", Vol. VIII) was published in 1909.

Дифференцировка СКК Облучение 10 Gy Клетки: костный мозг периферическая кровь тимус лимфоузлы 3 месяца Восстановлена маркированными клетками костного мозга 1 Продуцент ретровируса 2 4 3

Выбор направления дифференцировки 1. Случайный выбор (стохастическая модель) 2. В зависимости от внутренних факторов 3. В зависимости от внешних факторов

1. Случайный выбор (стохастическая модель)

2. В зависимости от внутренних факторов • Зависимость от эпигенетических факторов (уровня метилирования ДНК) • Метилирование ДНК — это обратимая модификация молекулы ДНК без изменения самой нуклеотидной последовательности ДНК, что можно рассматривать как часть эпигенетической составляющей генома. Метилирование заключается в переносе метильной группы с Sаденозилметионина (SAM) на 5' позицию цитозина. Эту реакцию осуществляет ДНК- метилтрансфераза (DNMT). Для позвоночных характерно метилирование цитозина, когда он находится в составе динуклеотида CG. Не все CG- последовательности метилированы, они формируют специфический паттерн (образ). У человека метилирование осуществляется с помощью ферментов DNMT 1, DNMT 3 a (альфа), DNMT 3 b (бета). Предполагается, что DNMT 3 a и DNMT 3 b функционируют на ранних стадиях развития, когда происходит формирование паттерна метилирования. DNMT 1 поддерживает метилирование ДНК на более поздних стадиях развития организма и отвечает за присоединение метильной группы на комплементарной цепи при репликации ДНК дочерней клетки.

2. В зависимости от внутренних факторов

2. В зависимости от внутренних факторов Неактивный ген соединён с метильной группой. Когда в результате химических реакций метильная группа отделяется от гена, тот активируется. Метильная группа выполняет роль предохранителя. Чем меньше метильных групп, тем более дифференцирована клетка. Чем больше степень метилирования ДНК, тем меньше степень дифференцировки, тем клетка моложе.

Broske, 2009

3. В зависимости от внешних факторов • Могут ли внешние сигналы регулировать дифференцировку клеток крови? До настоящего времени такие сигналы не известны для стволовых клеток, однако, существуют примеры для более зрелых клеток-предшественников, выбор дифференцировки которых зависит от действия специфических ростовых факторов. • Как внешние сигналы влияют на такую дифференцировку? • Необходимы определенные факторы для созревания клеток крови, например, Г-КСФ для гранулоцитов или тромбопоэтин для созревания мегакариоцитов.
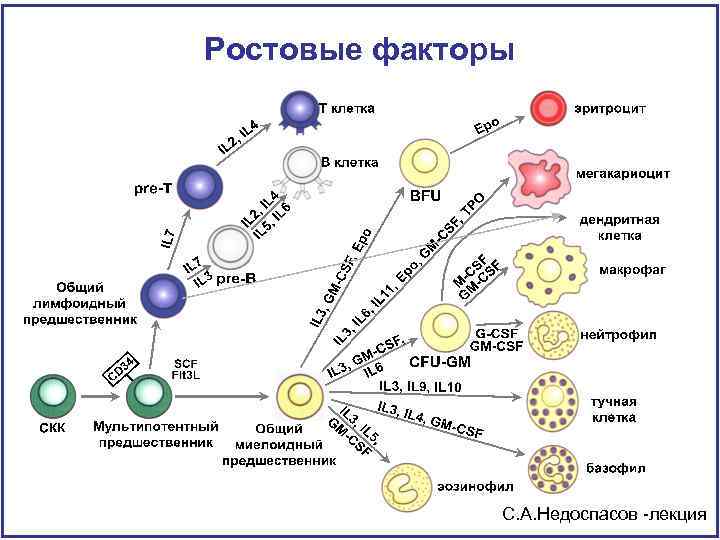
Ростовые факторы C. А. Недоспасов -лекция

Ростовые факторы Три типа действия ростовых факторов : А) действие на 1 линию дифференцировки В) действие на несколько линий (пункитром показано действие фактора только в высокой концентрации) С) последовательное и согласованное действие цитокинов Metcalf D, Blood, 2008

Ростовые факторы Ткани продуцирующие кроветворные ростовые факторы А) ЕРО продуцируется в почках В) GM-CSF продуцируется в различных типах тканей С) M-CSF гуморальный фактор и может продуцироваться локально клетками стромы Metcalf D, Blood, 2008

Ростовые факторы Функциональная стимуляция Выживание Индукция созревания Пролиферация Дифференцировка Коммитирование Ростовые факторы полифункциональны Metcalf D, Blood, 2008

Ростовые факторы Снижение Слабый ответ Ранняя гибель Количества на Нейтрофилов инфекцию Добавление G-CSF Отсутствие G-CSF Metcalf D, Blood, 2008

Плейотропность действия Ростовые факторы Metcalf D, Blood, 2008

Ростовые факторы Функция Гемопоэтины Цитокины Факторы роста Т-лф Факторы роста В-лф IL-2, IL-4, IL-7, IL-9, IL-15 Факторы роста фибр. , эндотелия др. PDGF, b. FGF, a. FGF, VEGF Хемокины Ингибиторы роста Супрессоры Участвующие в апоптозе Провоспалительные Антивирусные IL-8, MCP-1, MIP-1, SLC SCF, Flt-3 -ligand, G-CSF, GM-CSF, LIF, IL-3, IL-4, IL-5, IL-6, IL -9, IL-11, IL-12, TPO, EPO IL-4, IL-5, IL-6, IL-14, CD 40 Oncostatin M, TNF, TGFb IL-4, IL-10, IL-13, TGFb TNF, FAS-ligand, TRAIL IL-1, IL-6, TNF, хемокины Интерфероны

Ростовые факторы Дистальная регуляция кроветворения 1) Позднедействующие линейно специфические факторы. EPO, TPO, IL 5, G-CSF, M-CSF 2) Среднедействующие линейно неспецифические факторы. IL-3, IL-4, GM-CSF 3) Факторы, влияющие на кинетику клеточного цикла дремлющих примитивных предшественников. SCF, Flt-3 ligand, G-CSF, IL-6, IL-11, IL-12, LIF

То, что «не видят» , а определяют в костном мозге физиологи, оперирующие функциональными тестами

Функциональные тесты Б. Полипотентные кроветворные клетки - предшественницы 1. Колониеобразующие единицы в селезенке (КОЕс-CFU-S). 2. Колониеобразующие единицы в культуре (КОЕк- КОЕ-ГМ, КОЕ-Э, КОЕ-М, БОЕ-Э). (CFU-C-CFU-GM, CFU-E, CFU-M, BFU-E) 3. Клетки образующие области булыжника в культуре (КООБ-CAFC).

Donald Metcalf

Колониеобразующие единицы в культуре КОЕк • Выжить кроветворные предшественники в культуре могут только в присутствии соответствующих регуляторных молекул • В отсутствии внешнего регулятора время полу жизни предшественника составляет 22 -24 часа

Ростовые факторы

Колониеобразующие единицы в культуре КОЕк Клетки погибают от: • Подсыхания культур; • Истощения среды; • Накопления продуктов распада (токсичность); • Тесноты
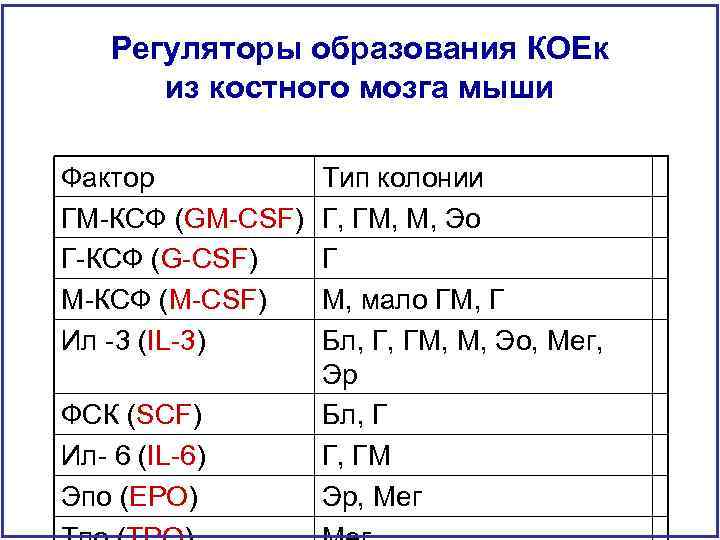
Регуляторы образования КОЕк из костного мозга мыши Фактор ГМ-КСФ (GM-CSF) Г-КСФ (G-CSF) М-КСФ (M-CSF) Ил -3 (IL-3) ФСК (SCF) Ил- 6 (IL-6) Эпо (EPO) Тип колонии Г, ГМ, М, Эо Г М, мало ГМ, Г Бл, Г, ГМ, М, Эо, Мег, Эр Бл, Г Г, ГМ Эр, Мег

Полужидкие среды для клонирования предшественников • Агаровые культуры • Плохо поддерживают рост эритроидных предшественников из тканей взрослого животного • В-лимфоцитарные колонии растут только в агаре • Легко фиксировать и окрашивать колонии • Культуры в метилцеллулозе • Удобно выделять колонии и ретрансплантировать • Образуют монослой на дне чашки, что затрудняет счет колоний

Примерные количества образования колоний Ткань Костный мозг Число клеток на 1 колоний мл 25000 10 -100 Селезенка 50000 0 -30 Перитонеальные клетки Эмбриональная печень 50000 0 -5 10 -25000 10 -100

Приготовление культур • • 1. Клеточные суспензии 2. Поставить клетки на лед 3. Маркирование культуральных чашек 4. Добавление соответствующего КСФ в чашки 5. Приготовление агаровой среды и помещение ее в 37 о 6. Смешивание клеток, агаровой среды и КСФ 7. Дать культурам превратиться в гель 8. Помещение в инкубатор

Приготовление культуральной среды Агар 0, 3% (330 мг агара на 10 мл стерильной воды) кипятить на водяной бане. • • Среда 1: 94, 5 ml a. MEM 2, 5 ml 1 M HEPES 1 ml Pyruvate Na 1 ml Vitamins 1 ml non-Essential aa 0, 8 ml Essential aa • • • Полная среда 30% ЭТС 10% агар 60% среда 1 глютамин 1% антибиотики 0, 5% 2 -МЭ - 10 -5 М (х1000) 100 mkl клеток (4 х105) 200 мкл КСФ (смесь 2 части WEHI 3 B + 1 часть L 929)

Концентрации различных факторов на 1 мл культуры. • • • GM-CSF (10 ng/ml) G-CSF (10 ng/ml) M-CSF (10 ng/ml) IL-3 (10 ng/ml) SCF (100 ng/ml) IL-6 (100 ng/ml) EPO (2 units/ml) TPO (50 ng/ml) Кондиционированная среда 10% от объема. • WEHI 3 B продуцирует GM-CSF, G-CSF, IL-3 • L 929 продуцирует M-CSF Stem cell technologies http: //www. stemcell. com Metocult

Колонии и подсчет 3 дня КОЕэ, 7 дней КОЕ-ГМ, 14 дней БОЕэ

Колонии и подсчет

Колонии и подсчет

Колонии и подсчет
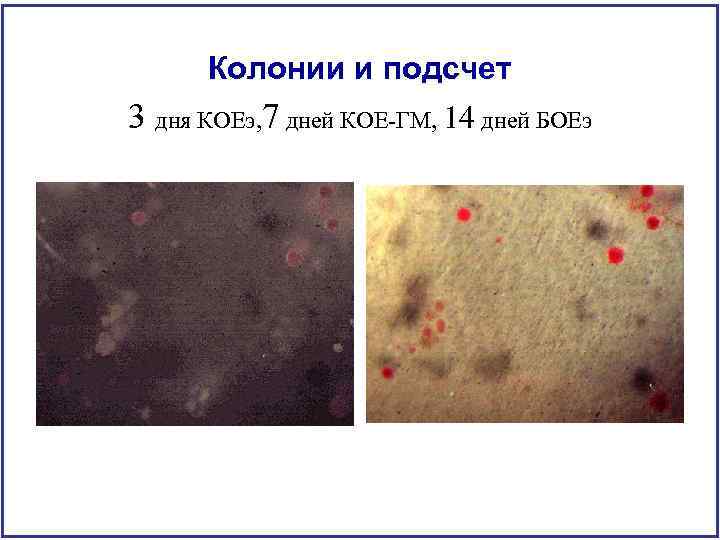
Колонии и подсчет 3 дня КОЕэ, 7 дней КОЕ-ГМ, 14 дней БОЕэ
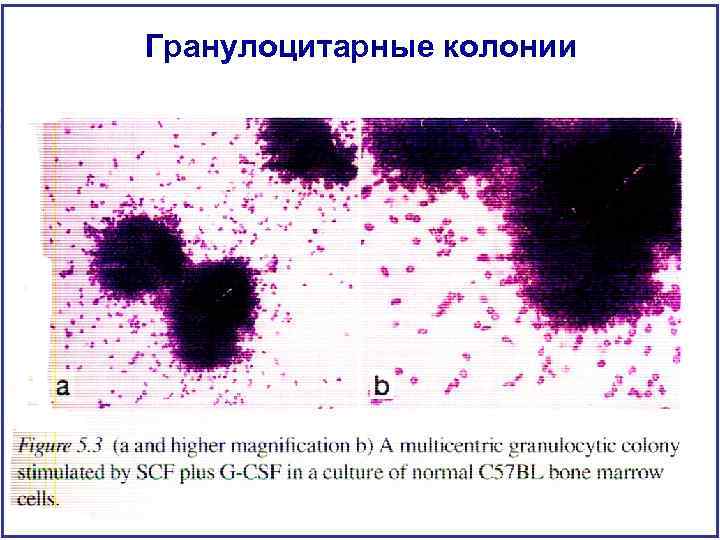
Гранулоцитарные колонии

Гранулоцитарные колонии
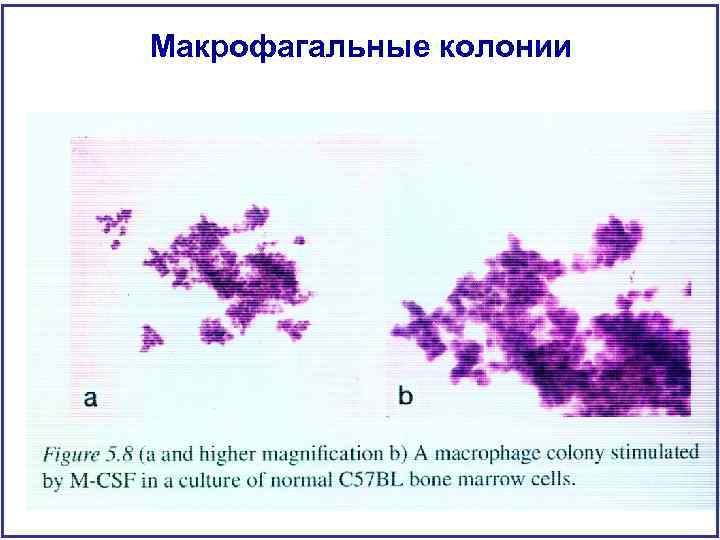
Макрофагальные колонии
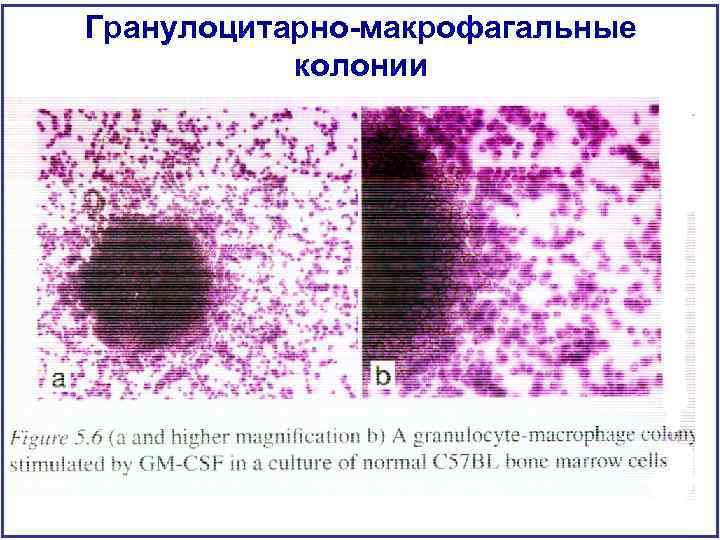
Гранулоцитарно-макрофагальные колонии

Эритроидные бурсты
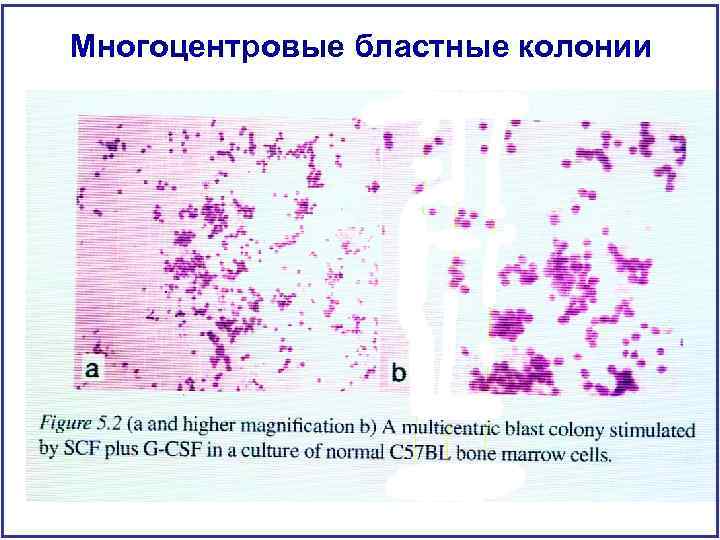
Многоцентровые бластные колонии
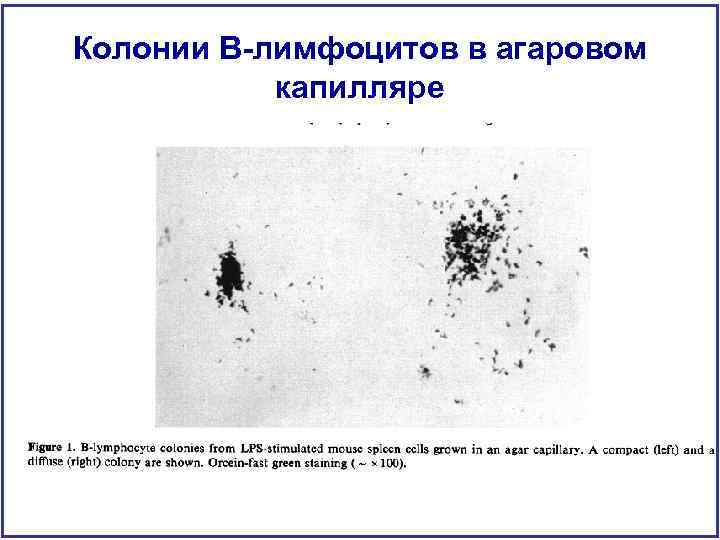
Колонии В-лимфоцитов в агаровом капилляре

Что узнали из этой лекции? • Основные принципы функционирования кроветворной системы. • Методы изучения стволовых клеток и клетокпредшественниц в кроветворной системе. • Основные принципы дифференцировки кроветворных клеток. • Устройство костного мозга. • Роль ростовых факторов в функционировании кроветворной системы.

Что будет на следующей лекции? • Факторы транскрипции в кроветворной системе (схема). • Устройство и функционирование отделов отдельных линий дифференцировки кроветворных клеток. • Хоминг и мобилизация кроветворных клеток. • Пролиферация в отделе стволовых кроветворных клеток. • Гетерогенность отдела стволовых кроветворных клеток. • Регуляция кроветворения в «нише» для стволовых кроветворных клеток. • Старение в кроветворной системе
1.Обзор кроветворения 2013 word 2003.ppt