Кремний.pptx
- Количество слайдов: 22
 КРЕМНИЙ Учитель химии Сташкова А. Э.
КРЕМНИЙ Учитель химии Сташкова А. Э.
 ПОЛУЧЕНИЕ КРЕМНИЯ В чистом виде кремний был выделен в 1811 году французскими учеными Жозеф Луи Гей-Люссак Луи Жаком Тенор Русское название введено в 1834 г. российским химиком Германом Ивановичем Гессом.
ПОЛУЧЕНИЕ КРЕМНИЯ В чистом виде кремний был выделен в 1811 году французскими учеными Жозеф Луи Гей-Люссак Луи Жаком Тенор Русское название введено в 1834 г. российским химиком Германом Ивановичем Гессом.
 1. ПОЛОЖЕНИЕ В ПСХЭ. ОСОБЕННОСТИ СТРОЕНИЯ АТОМА Положение в ПС: период III; группа IV, главная; Относительная атомная масса: Ar (Si)=28 Строение атома: p=14, e=14, n=28 - 14 =14 Электронная формула: +14 Si 2 e; 8 e; 4 e; +14 Si 1 s 2 2 p 6 3 s 2 3 p 2
1. ПОЛОЖЕНИЕ В ПСХЭ. ОСОБЕННОСТИ СТРОЕНИЯ АТОМА Положение в ПС: период III; группа IV, главная; Относительная атомная масса: Ar (Si)=28 Строение атома: p=14, e=14, n=28 - 14 =14 Электронная формула: +14 Si 2 e; 8 e; 4 e; +14 Si 1 s 2 2 p 6 3 s 2 3 p 2
 2. НАХОЖДЕНИЕ В ПРИРОДЕ. § Второй после кислорода § ¼ состава земной коры § Наиболее распространен Si. O 2 кремнезем § Главная часть земной коры – силикатные породы
2. НАХОЖДЕНИЕ В ПРИРОДЕ. § Второй после кислорода § ¼ состава земной коры § Наиболее распространен Si. O 2 кремнезем § Главная часть земной коры – силикатные породы
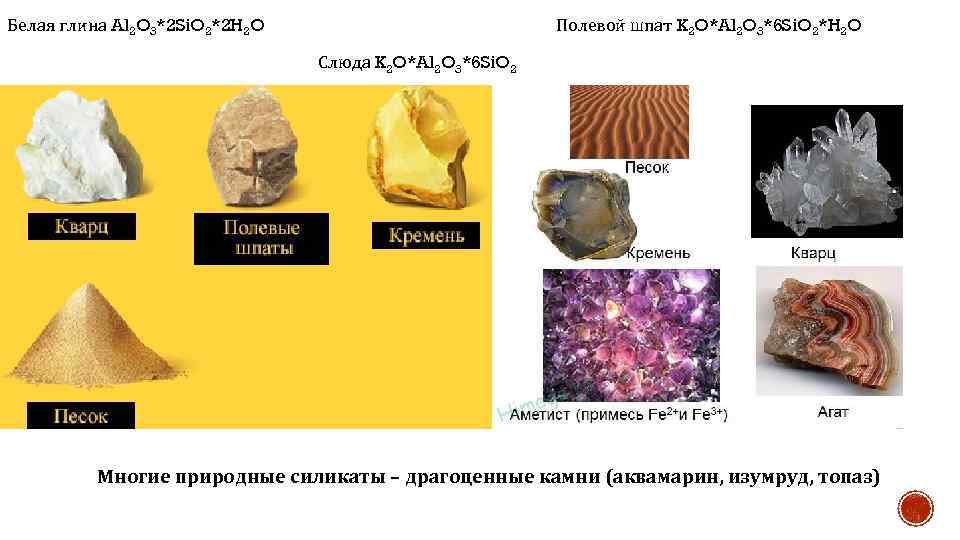 Белая глина Al 2 O 3*2 Si. O 2*2 H 2 O Полевой шпат K 2 O*Al 2 O 3*6 Si. O 2*H 2 O Слюда K 2 O*Al 2 O 3*6 Si. O 2 Многие природные силикаты – драгоценные камни (аквамарин, изумруд, топаз)
Белая глина Al 2 O 3*2 Si. O 2*2 H 2 O Полевой шпат K 2 O*Al 2 O 3*6 Si. O 2*H 2 O Слюда K 2 O*Al 2 O 3*6 Si. O 2 Многие природные силикаты – драгоценные камни (аквамарин, изумруд, топаз)
2 Be 3 Al 2 Si 6 O 18 Al 2[Si. O 4](F, OH)2](https://present5.com/presentation/59811828_437303311/image-6.jpg) Be 3 Al 2 Si 6 O 18 Al 2[Si. O 4](F, OH)2
Be 3 Al 2 Si 6 O 18 Al 2[Si. O 4](F, OH)2

 3. ФИЗИЧЕСКИЕ СВОЙСТВА. Кремний – кристаллическое вещество • темно-серого цвета • с металлическим блеском. • кристаллическая решетка кремния напоминает структуру алмаза • из-за большей длины связи между Si – Si, твердость кремния значительно меньше, чем алмаза. • кремний хрупок, только при нагревании выше 8000 С.
3. ФИЗИЧЕСКИЕ СВОЙСТВА. Кремний – кристаллическое вещество • темно-серого цвета • с металлическим блеском. • кристаллическая решетка кремния напоминает структуру алмаза • из-за большей длины связи между Si – Si, твердость кремния значительно меньше, чем алмаза. • кремний хрупок, только при нагревании выше 8000 С.
 4. ПОЛУЧЕНИЕ. üВ промышленности кремний получают восстановлением кремнезема Si. O 2 коксом в электрических печах при 1500 -17000 С: Si. O 2 + 2 C Si + 2 CO üВ лаборатории: Si. O 2 + 2 Mg Si + 2 Mg. O 3 Si. O 2 + 4 Al 3 Si + 2 Al 2 O 3 üЧистый кремний получают: Si. Cl 4 + 2 Zn↑ Si + Zn. Cl 2
4. ПОЛУЧЕНИЕ. üВ промышленности кремний получают восстановлением кремнезема Si. O 2 коксом в электрических печах при 1500 -17000 С: Si. O 2 + 2 C Si + 2 CO üВ лаборатории: Si. O 2 + 2 Mg Si + 2 Mg. O 3 Si. O 2 + 4 Al 3 Si + 2 Al 2 O 3 üЧистый кремний получают: Si. Cl 4 + 2 Zn↑ Si + Zn. Cl 2
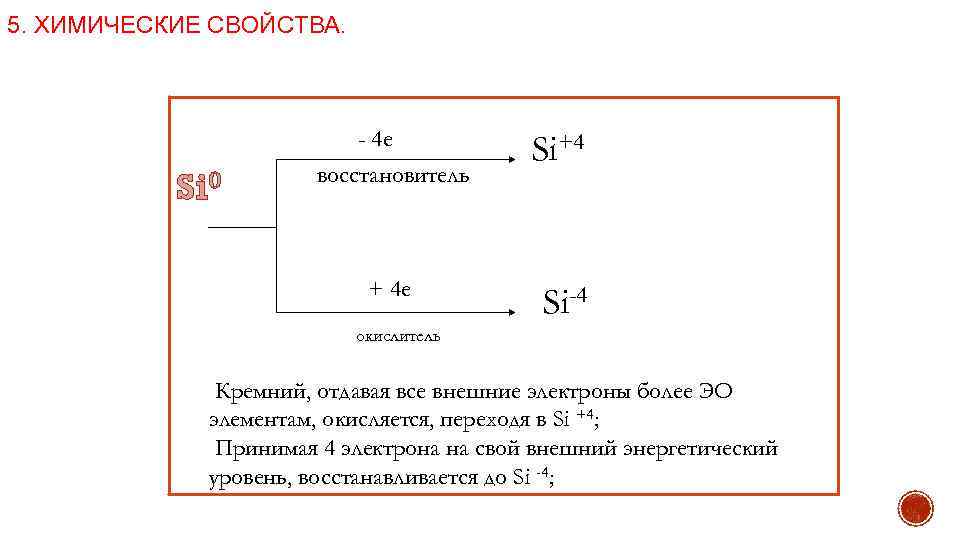 5. ХИМИЧЕСКИЕ СВОЙСТВА. - 4 е Si 0 восстановитель + 4 е Si+4 Si-4 окислитель Кремний, отдавая все внешние электроны более ЭО элементам, окисляется, переходя в Si +4; Принимая 4 электрона на свой внешний энергетический уровень, восстанавливается до Si -4;
5. ХИМИЧЕСКИЕ СВОЙСТВА. - 4 е Si 0 восстановитель + 4 е Si+4 Si-4 окислитель Кремний, отдавая все внешние электроны более ЭО элементам, окисляется, переходя в Si +4; Принимая 4 электрона на свой внешний энергетический уровень, восстанавливается до Si -4;
 5. ХИМИЧЕСКИЕ СВОЙСТВА. Восстановительные 1) Si + O 2 =Si. O 2 2) Si + 2 CL 2 = Si. CL 4 3) Si + S = Si. S 2 4)Si + 2 H 2 O (пар) = Si. O 2 + H 2 5)Si + C = Si. C (карборунд) 6)Si +2 Na. OH(конц) + H 2 O = Na 2 Si. O 3 + H 2 Окислительные Si + 2 Ca = Ca 2 Si
5. ХИМИЧЕСКИЕ СВОЙСТВА. Восстановительные 1) Si + O 2 =Si. O 2 2) Si + 2 CL 2 = Si. CL 4 3) Si + S = Si. S 2 4)Si + 2 H 2 O (пар) = Si. O 2 + H 2 5)Si + C = Si. C (карборунд) 6)Si +2 Na. OH(конц) + H 2 O = Na 2 Si. O 3 + H 2 Окислительные Si + 2 Ca = Ca 2 Si
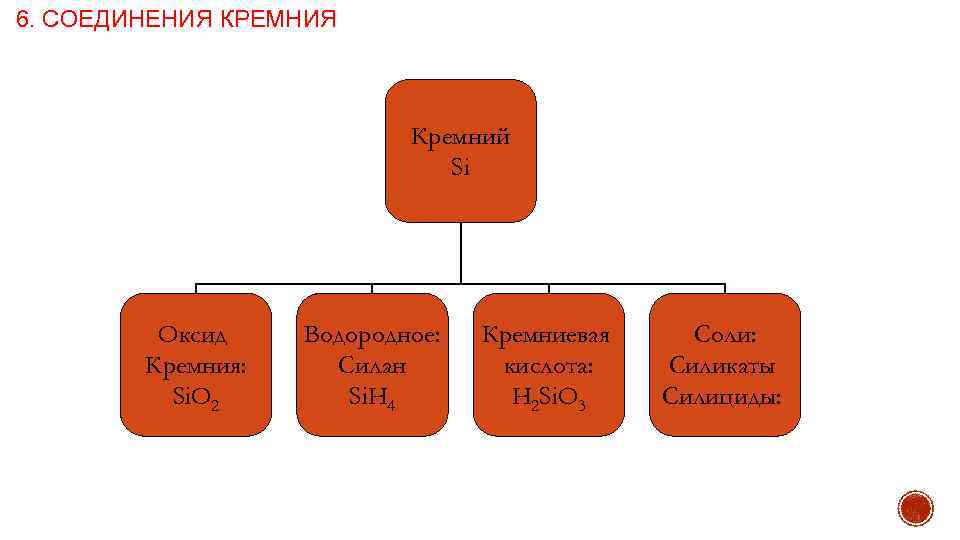 6. СОЕДИНЕНИЯ КРЕМНИЯ Кремний Si Оксид Кремния: Si. O 2 Водородное: Силан Si. H 4 Кремниевая кислота: H 2 Si. O 3 Соли: Силикаты Силициды:
6. СОЕДИНЕНИЯ КРЕМНИЯ Кремний Si Оксид Кремния: Si. O 2 Водородное: Силан Si. H 4 Кремниевая кислота: H 2 Si. O 3 Соли: Силикаты Силициды:
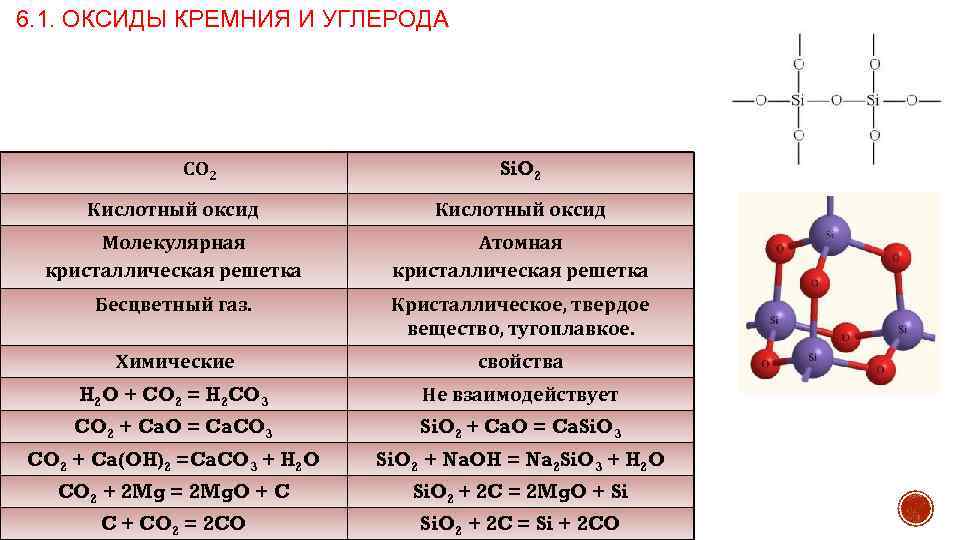 6. 1. ОКСИДЫ КРЕМНИЯ И УГЛЕРОДА СО 2 Si. O 2 Кислотный оксид Молекулярная кристаллическая решетка Атомная кристаллическая решетка Бесцветный газ. Кристаллическое, твердое вещество, тугоплавкое. Химические свойства H 2 O + CO 2 = H 2 CO 3 Не взаимодействует CO 2 + Ca. O = Ca. CO 3 Si. O 2 + Ca. O = Ca. Si. O 3 CO 2 + Ca(OH)2 =Ca. CO 3 + H 2 O Si. O 2 + Na. OH = Na 2 Si. O 3 + H 2 O CO 2 + 2 Mg = 2 Mg. O + C Si. O 2 + 2 C = 2 Mg. O + Si C + CO 2 = 2 CO Si. O 2 + 2 C = Si + 2 CO
6. 1. ОКСИДЫ КРЕМНИЯ И УГЛЕРОДА СО 2 Si. O 2 Кислотный оксид Молекулярная кристаллическая решетка Атомная кристаллическая решетка Бесцветный газ. Кристаллическое, твердое вещество, тугоплавкое. Химические свойства H 2 O + CO 2 = H 2 CO 3 Не взаимодействует CO 2 + Ca. O = Ca. CO 3 Si. O 2 + Ca. O = Ca. Si. O 3 CO 2 + Ca(OH)2 =Ca. CO 3 + H 2 O Si. O 2 + Na. OH = Na 2 Si. O 3 + H 2 O CO 2 + 2 Mg = 2 Mg. O + C Si. O 2 + 2 C = 2 Mg. O + Si C + CO 2 = 2 CO Si. O 2 + 2 C = Si + 2 CO
 6. 2. КИСЛОТЫ H 2 CO 3 H 2 Si. O 3 Двухосновная, кислородсодержащая, слабая, непрочная, т. к. летучая. Двухосновная, кислородсодержащая, слабая, нерастворимая в воде. Получение: СО 2 + Н 2 О = Н 2 СО 3 Получение: Si. O 2 + H 2 O = нельзя Нестойкая, непрочная, при стоянии или нагревании разлагается: Н 2 СО 3 = СО 2 + Н 2 О Выделить в чистом виде нельзя, т. к. при нагревании разлагается: H 2 Si. O 3 = Si. O 2 + H 2 O Zn + H 2 CO 3 = Zn. CO 3 + H 2
6. 2. КИСЛОТЫ H 2 CO 3 H 2 Si. O 3 Двухосновная, кислородсодержащая, слабая, непрочная, т. к. летучая. Двухосновная, кислородсодержащая, слабая, нерастворимая в воде. Получение: СО 2 + Н 2 О = Н 2 СО 3 Получение: Si. O 2 + H 2 O = нельзя Нестойкая, непрочная, при стоянии или нагревании разлагается: Н 2 СО 3 = СО 2 + Н 2 О Выделить в чистом виде нельзя, т. к. при нагревании разлагается: H 2 Si. O 3 = Si. O 2 + H 2 O Zn + H 2 CO 3 = Zn. CO 3 + H 2
![6. 3. СОЛИ A 3 B 2[Si. O 4]3 , где A – кальций, 6. 3. СОЛИ A 3 B 2[Si. O 4]3 , где A – кальций,](https://present5.com/presentation/59811828_437303311/image-15.jpg) 6. 3. СОЛИ A 3 B 2[Si. O 4]3 , где A – кальций, магний, железо(II) ; B – алюминий, хром, железо(III) Топаз Al 2[Si. O 4] (F, OH)2 Угольной кислоты - карбонаты; - гидрокарбонаты; Карбонаты обладают всеми свойствами солей, являются сильными электролитами, полностью диссоциируют на ионы(растворимых в воде). Кремниевой кислоты - силикаты; Растворимыми являются только соли щелочных металлов, остальные образуют нерастворимые или вообще не образуют солей(Al+3, Cr+3, Ag+).
6. 3. СОЛИ A 3 B 2[Si. O 4]3 , где A – кальций, магний, железо(II) ; B – алюминий, хром, железо(III) Топаз Al 2[Si. O 4] (F, OH)2 Угольной кислоты - карбонаты; - гидрокарбонаты; Карбонаты обладают всеми свойствами солей, являются сильными электролитами, полностью диссоциируют на ионы(растворимых в воде). Кремниевой кислоты - силикаты; Растворимыми являются только соли щелочных металлов, остальные образуют нерастворимые или вообще не образуют солей(Al+3, Cr+3, Ag+).
 7. ПРИМЕНЕНИЕ. В БЫТУ. Стекло Фаянс Фарфор Кирпич Цемент Клей Асбест Силикон Керамика Гранит
7. ПРИМЕНЕНИЕ. В БЫТУ. Стекло Фаянс Фарфор Кирпич Цемент Клей Асбест Силикон Керамика Гранит
 7. ПРИМЕНЕНИЕ. КРЕМНИЙ - ПОЛУПРОВОДНИК
7. ПРИМЕНЕНИЕ. КРЕМНИЙ - ПОЛУПРОВОДНИК
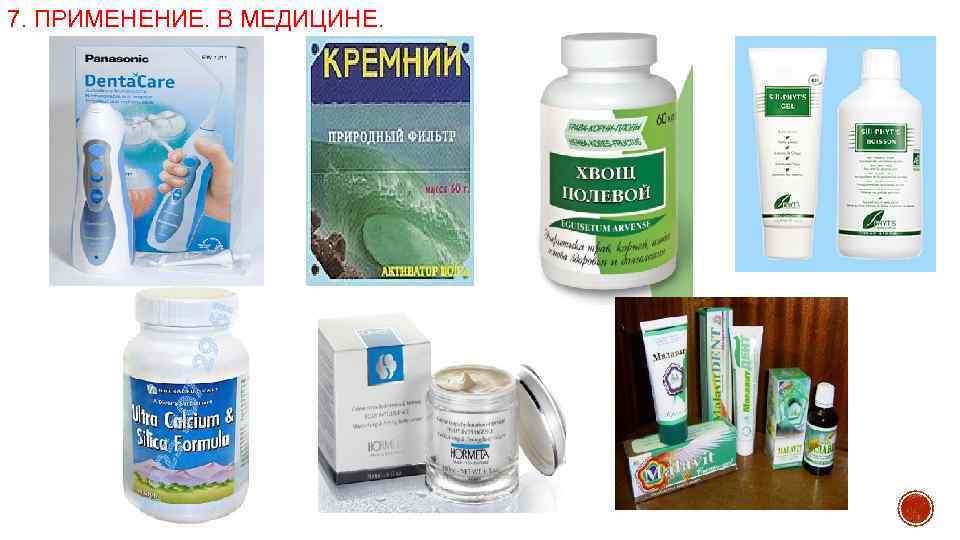 7. ПРИМЕНЕНИЕ. В МЕДИЦИНЕ.
7. ПРИМЕНЕНИЕ. В МЕДИЦИНЕ.
 КРЕМНИЙ И ПРИРОДА. Важнейшее соединение кремния – Si. O 2 необходим для жизни растений и животных. Благодаря ему тростники, камыши и хвощи стоят крепко, как штыки. Острые листья осоки режут, как ножи, стерня на скошенном поле колет, как иголки, а стебли злаков настолько крепки, что не позволяют ниве на полях ложиться от дождя и ветра
КРЕМНИЙ И ПРИРОДА. Важнейшее соединение кремния – Si. O 2 необходим для жизни растений и животных. Благодаря ему тростники, камыши и хвощи стоят крепко, как штыки. Острые листья осоки режут, как ножи, стерня на скошенном поле колет, как иголки, а стебли злаков настолько крепки, что не позволяют ниве на полях ложиться от дождя и ветра
 Чешуя рыб, панцири насекомых, крылья бабочек, перья птиц и шерсть животных прочны, так как содержат кремнезем.
Чешуя рыб, панцири насекомых, крылья бабочек, перья птиц и шерсть животных прочны, так как содержат кремнезем.
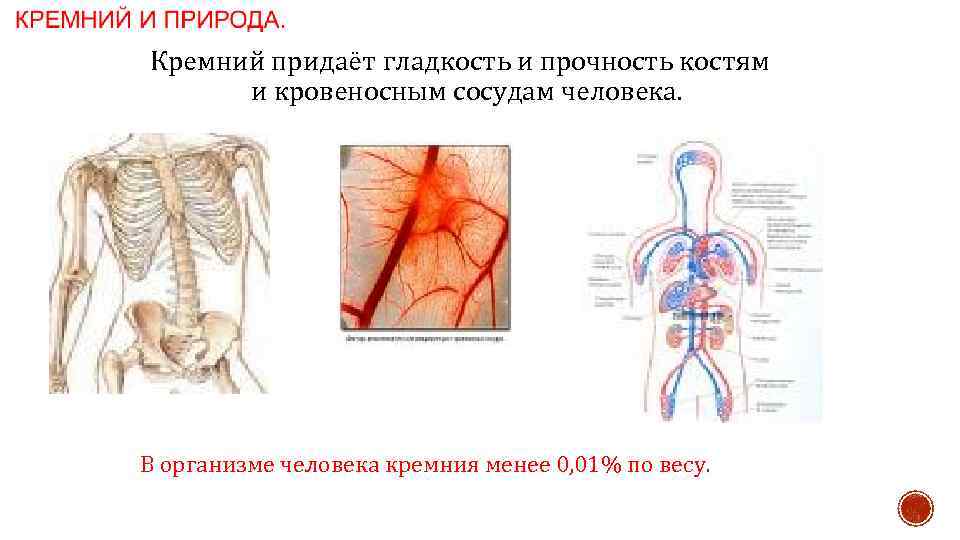 Кремний придаёт гладкость и прочность костям и кровеносным сосудам человека. В организме человека кремния менее 0, 01% по весу.
Кремний придаёт гладкость и прочность костям и кровеносным сосудам человека. В организме человека кремния менее 0, 01% по весу.
 ЗАКРЕПЛЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА. Осуществите цепочки превращений, укажите названия продуктов и реагентов. Si. О 2 - Si – Mg 2 Si – Si. H 4 – Na 2 Si. O 3 – H 2 Si. O 3 Si. Cl 4 – Si – K 2 Si. O 3 – H 2 Si. O 3 – Si. O 2 Si – Si. O 2 – Ca. Si. O 3 – H 2 Si. O 3 – Si. O 2 – Si. F 4
ЗАКРЕПЛЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА. Осуществите цепочки превращений, укажите названия продуктов и реагентов. Si. О 2 - Si – Mg 2 Si – Si. H 4 – Na 2 Si. O 3 – H 2 Si. O 3 Si. Cl 4 – Si – K 2 Si. O 3 – H 2 Si. O 3 – Si. O 2 Si – Si. O 2 – Ca. Si. O 3 – H 2 Si. O 3 – Si. O 2 – Si. F 4


